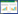文章信息
- 赵少莉, 王文红, 冯玲玲, 赵雨蒙, 孙际伟, 王欢
- ZHAO Shaoli, WANG Wenhong, FENG Lingling, ZHAO Yumeng, SUN Jiwei, WANG Huan
- 多模态超声技术评估活血化瘀法逆转大鼠早期肝硬化的实验研究
- Experimental study on reversal of early liver cirrhosis by promoting blood circulation and removing blood stasis by multimodal ultrasound
- 天津中医药大学学报, 2020, 39(2): 203-208
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(2): 203-208
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.02.19
-
文章历史
收稿日期: 2019-12-23
2. 天津市人民医院放射科, 天津 300121
2. Department of Radiology, Tianjin Union Medical Center, Tianjin 300121, China
早期肝硬化是中国常见的肝病类型, 多因肝炎不能及时治疗逐渐发展而成, 严重者将转变为肝硬化甚至肝癌[1-3]。病理学检查为诊断早期肝硬化的金标准, 但存在创伤性, 患者依从性差[4-5]。超声检查作为腹部实质脏器的检查技术具有便捷、便宜且无创的优势, 且有研究显示超声造影检查可以提供早期肝硬化诊断的定量依据, 对诊断早期肝硬化具有重要临床意义[6-8]。众多中医药研究显示活血化瘀法对早期肝硬化的治疗具有独特疗效[9-12]。本研究以活血化瘀法(扶正化瘀胶囊、血府逐瘀胶囊)干预早期肝硬化为例, 通过超声影像学的变化评估治疗效果, 为肝硬化无创可视化评估提供依据。
1 材料与方法 1.1 实验动物SPF级雄性Wistar大鼠39只, 体质量180~220 g, 来自北京华阜康生物科技股份有限公司, 许可证号SCXK(京)2014-0004, 饲养于天津市人民医院动物房, 恒温恒湿环境, 自由饮水、饮食, 适应性饲养一周后用于实验。
1.2 主要药物、试剂、仪器扶正化瘀胶囊, 上海黄海制药有限责任公司生产, 规格300 mg/粒, 批号181205。血府逐瘀胶囊, 天津宏仁堂药业有限公司, 规格400 mg/粒, 批号H03173。二甲基亚硝胺, 梯希爱(上海)化成工业发展有限公司, 批号Lot.RUUHB-HI。超声造影剂SonoVue, 意大利Bracco公司。
Rat-HA ELISA Kit(HA), LOT:B34238;Rat-Laminin ELISA Kit(LN), Lot:B39506;Rat-PCⅢ ELISA Kit(PCⅢ), Lot:B57201;Rat-CollagenⅣELISA Kit(C-Ⅳ), Lot:B21417均采自天津安诺瑞康生物技术有限公司。
采用VINNO8彩色超声诊断仪, 配有超声造影成像技术, 选用X4-12L线阵探头, 频率6~12 MHz。
1.3 方法 1.3.1 造模、分组及给药选用Wistar雄性大鼠39只, 按照平均体质量随机分组, 正常组8只, 31只大鼠腹腔注射0.5%的二甲基亚硝胺, 每周3天, 连续4周, 每次剂量为2 μL/g制备早期肝硬化模型[13-14]。正常组大鼠同时间同部位腹腔注射等剂量的0.9%生理盐水, 共4周。造模成功后于第5周初称取大鼠体质量, 按照平均体质量随机分为模型组10只、FZ组7只、XF组7只、FZ+XF组7只。以蒸馏水稀释扶正化瘀胶囊及血府逐瘀胶囊, 根据体质量及临床用量折算, FZ组大鼠灌胃扶正化瘀胶囊473 mg/kg、XF组大鼠灌胃血府逐瘀胶囊504 mg/kg、FZ+XF组大鼠同时灌胃扶正化瘀胶囊及血府逐瘀胶囊977 mg/kg(相当于60 kg成人体质量用量的6.3倍量), 按照每100 g大鼠体质量灌胃不超过1 mL, 各组分别灌胃相应的药物, 每天灌胃1次, 共4周。正常组及模型组灌胃同体积的蒸馏水。
1.3.2 超声检查各组大鼠均在第8周行超声检查。所有大鼠检查前禁食禁水8 h, 5%水合氯醛按照6 mL/kg腹腔注射进行麻醉, 麻醉后取仰卧位固定于平板上, 脱去肝区体毛。在二维超声模式下观察肝脏形态变化; 测量门静脉内径、流速、脾脏厚度、长度, 至少测量3次, 取平均值。用26 G留置针经鼠尾静脉建立静脉通道, 在同时显示门静脉、腹主动脉、下腔静脉的切面切换至造影模式, 造影检查时增益、深度等预设置始终保持一致, 机械指数(MI)固定为0.6。造影剂采用SonoVue, 经大鼠尾静脉以团注方式按0.1 mL剂量团注造影剂, 而后推注1.0 mL生理盐水。动态造影数据采集5 min。选择大鼠肝中叶的肝实质为感兴趣区获取相应的时间-强度曲线, 得到达峰时间、峰值强度、曲线下面积等定量参数。
1.4 样本采集与处理超声检查后处死大鼠, 经腹主动脉取血, 静置30 min后3 000 r/min离心10 min, 分离血清。血清透明质酸(HA)、层粘连蛋白(LN)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(CⅣ)测定使用ELISA试剂盒检测。取大鼠肝组织固定于4%多聚甲醛溶液中, 固定48 h后取肝组织行苏木精-伊红染色(HE染色)、Masson染色行病理学检查, 显微镜下观察肝脏形态改变。
1.5 统计方法应用SPSS25.0软件对研究的数据进行统计学分析, 计量资料采用均值±标准差(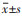
正常组大鼠生长情况良好, 饮食尚佳, 活跃度积极, 毛色洁白光滑, 体质量呈上升趋势。造模后, 大鼠随时间延长生长状况较差, 饮食不佳, 体型偏瘦, 毛发发黄蓬松, 体重呈下降趋势, 生长情况明显抑制。在第4~8周灌胃治疗期间, 3组治疗组大鼠体质量均有明显上升。
2.2 各组大鼠的血清学检查结果与正常组比较, 模型组大鼠血清HA、LN、Ⅲ型前胶原、Ⅳ型胶原水平显著上升(P < 0.01)。与模型组比较, FZ组及FZ+XF组大鼠的血清HA、LN、Ⅲ型前胶原、Ⅳ型胶原水平显著下降(P < 0.05或P < 0.01);XF组大鼠血清LN、Ⅲ型前胶原、Ⅳ型胶原水平显著下降(P < 0.01)。见表 1。
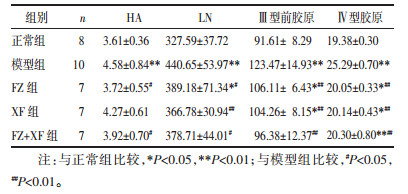
与正常组比较, 模型组大鼠的门静脉内径水平显著增宽、门静脉流速水平显著减慢(P < 0.01)。与模型组比较, FZ组、XF组大鼠的门静脉内径显著减短、脾脏长度水平显著增加(P < 0.01或P < 0.05);FZ+XF组大鼠的门静脉内径水平显著减短(P < 0.01), 门静脉流速水平显著增快(P < 0.05)。与FZ组比较, FZ+XF组大鼠的门静脉内径水平显著减短(P < 0.05)。见表 2。
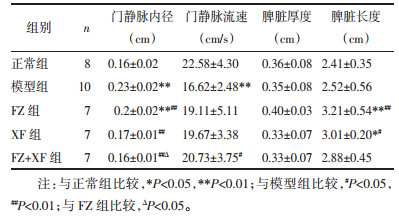
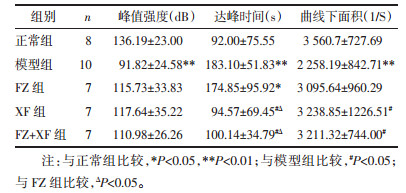
与正常组比较, 模型组大鼠肝实质灌注的峰值强度、曲线下面积水平显著降低, 达峰时间水平显著上升(P < 0.01);与模型组比较, FZ组达峰时间水平显著降低(P < 0.05)。XF组及FZ+XF组大鼠肝实质灌注的达峰时间水平显著降低, 曲线下面积水平显著上升(P < 0.05);与FZ组比较, XF组及FZ+XF组肝实质灌注的达峰时间水平显著下降(P < 0.05);见表 3。各组大鼠肝实质灌注时间-强度曲线见图 1。
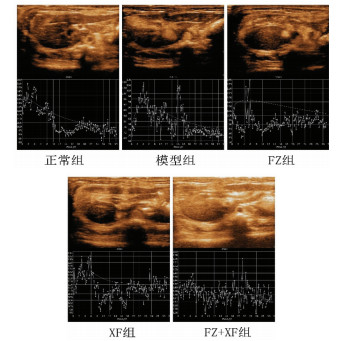
|
| 图 1 各组大鼠肝实质灌注时间-强度曲线 |
光学显微镜下观察, 正常组大鼠的肝小叶结构完整、清晰, 肝细胞形态正常, 肝细胞无变性坏死, 肝窦清晰, 肝细胞索排列整齐, 由中央向四周放射状排列; 模型组大鼠的肝小叶结构紊乱, 肝细胞形态变形, 出现坏死, 肝窦狭窄, 肝细胞索排列混乱, 汇管区、中央静脉等出现不同程度的纤维增生及形成不完全纤维间隔, 甚至形成假小叶。经药物治疗干预后, 3组治疗组的大体形态镜下观察总结归纳为肝小叶结构欠规则, 肝细胞坏死情况改善, 肝窦狭窄缓解, 肝细胞索排列欠规则, 汇管区、中央静脉存在不完全纤维间隔。虽然肝纤维化程度仍存在, 与模型组的肝脏病变形态相比较, 3组治疗组的肝脏病变形态均有不同程度的缓解, 说明活血化瘀疗法对于大鼠早期肝硬化具有治疗作用。结果见图 2-3。

|
| 图 2 各组肝组织HE染色(×100) |
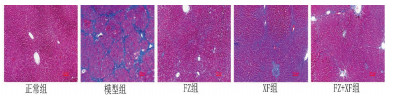
|
| 图 3 各组肝组织Masson染色(×100) |
据文献报道, 中国肝病患病人数众多, 在1987-2016年间死于肝脏疾病的人数达1 354万, 其中慢性肝病及肝硬化是主要原因之一, 而肝癌则是肝硬化发展至晚期肝硬化的严重并发症之一, 病死率占恶性肿瘤的第4位[15]。因各种损伤因素引起的肝组织内细胞外基质的生成与降解失衡, 会使肝脏内纤维结缔组织过度增生与沉积, 导致肝纤维化, 即为肝硬化发生的早期可逆阶段[16-17]。因此, 有效治疗早期肝硬化即肝纤维化是阻止其向肝硬化甚至肝癌发展的重要环节之一。
中药复方因其具有多成分、多靶点、多环节的特点以及药物间的相互配伍能够起到增加疗效的作用[18-20]。《肝纤维化中西医结合诊疗指南》指出:肝纤维化的基本病机是正虚血瘀。血瘀则为瘀血阻络, 提示活血化瘀有助于肝纤维化的治疗。周洁等[21]总结归纳各医家观点亦认为血瘀是肝纤维化的主要病机, 且贯穿该病发展的全过程。扶正化瘀方为治疗肝纤维化的经典用药[22], 而血府逐瘀方对肝纤维化的治疗也有一定的临床应用价值[23-26]。两方均能活血化瘀, 扶正化瘀方侧重于益精养肝, 固护后天之源以化瘀; 血府逐瘀方则侧重于行气止痛, 气行则血行以化瘀。扶正化瘀方治疗肝纤维化针对的病机是肝肾不足瘀血阻络。《难经·八难》曰:"气者, 人之根本也。"《类经·摄生类》曰:"人之有生, 全赖此气。"所以无论在任何疾病发展过程中, 若气机瘀滞, 治法均为行气。血府逐瘀方治疗肝纤维化针对的病机是气机瘀滞瘀血阻络。两方的中药组成不同, 故化瘀功效侧重不同, 但对于肝纤维化的治疗均能发挥重要作用, 通过中药配伍联合应用有增效作用的启发, 得出两方联合用药, 配伍得当也可达到增效减毒的作用, 故本研究旨在验证扶正化瘀、血府逐瘀联合应用治疗效果。本研究显示联合用药治疗效果优于单药组, 可以逆转早期肝硬化。
超声检查技术具有无创性、重复性好、简便快捷, 患者依从性高等优势, 在腹部实质性脏器病变的诊断中具有重要临床价值, 且随着超声造影技术的日趋成熟, 其在早期肝硬化的诊断方面具有广阔的应用前景[27-28]。超声的彩色多普勒模式既有二维超声结构图像的优点, 又同时提供了血流动力学的动态信息。超声造影检查是通过静脉注入造影剂增强人体血流信号, 实时动态观察组织微血管灌注信息, 从而提高病变诊断水平的检查技术。本研究通过监测早期肝硬化大鼠在中药治疗前后, 其肝脏、脾脏等实质脏器的形态学改变以及门静脉血管管径及血流变化, 结合肝脏灌注后所测得肝实质峰值强度、达峰时间、曲线下面积等指标, 量化评估大鼠肝损伤及修复的程度。结果显示模型组门静脉内径增宽, 流速减慢, 而与模型组比较, FZ组、XF组、FZ+XF组呈现相反趋势, 这与肝脏为门静脉及肝动脉双重血供, 肝细胞纤维化加重的同时形成纤维间隔, 血管间形成吻合支, 压力较高的肝动脉血流向门静脉, 门静脉压力升高, 同时门静脉阻力增加, 导致门静脉内径增宽有关。当血液流经门静脉、肝窦、下腔静脉时压力依次递减, 压力的梯度差是供血的主动力。肝纤维化时, 由于汇管区及肝小叶内结缔组织及肝细胞外基质沉积, 肝窦内皮细胞窗孔消失, 肝窦内皮毛细血管化引起肝窦血流阻力增高, 压力梯度差降低, 故门静脉血流速度减慢。门静脉高压时, 脾脏可有不同程度的增大。与FZ组和XF组相比, FZ+XF组大鼠的门静脉流速、脾脏长度与正常组数值更接近, 说明联合用药的效果更优。此外, FZ组、XF组、FZ+XF组肝实质灌注明显优于模型组, 模型组肝实质峰值强度降低、曲线下面积减少, 达峰时间延长, 3组治疗组则呈相反的趋势。这可能与肝纤维化时, 肝窦毛细血管化, 肝血窦容积变小, 从而微泡造影剂通过毛细血管网受阻, 影响微泡造影剂的数量及速度, 进而峰值强度会降低, 又因纤维间隔及结缔组织增生, 肝血窦容积变小, 造影剂微泡通过总量减少, 从而曲线下面积减小有关[29-30]。达峰时间延长可能是由于肝小叶结构改变, 肝血窦血流量受限导致整个灌注时间延长, 微泡到达峰值速度减慢所致。
综上所述, 本研究利用多模态超声检查技术通过定量评估肝组织微血管灌注及门静脉形态学、血流动力学指标在扶正化瘀胶囊、血府逐瘀胶囊以及两者联合用药前后的改变, 为多模态超声检查技术广泛应用于临床奠定了实验基础。但是本研究样本量较少, 治疗时间较短, 有待于今后进一步完善并在临床治疗过程中加以考证。
| [1] |
AHN J M, PAIK Y H, KIM S H, et al. Relationship of liver stiffness and controlled attenuation parameter measured by transient elastography with diabetes mellitus in patients with chronic liver disease[J]. Journal of Korean Medical Science, 2014, 29(8): 1113-1119. DOI:10.3346/jkms.2014.29.8.1113 |
| [2] |
胡潇, 胡光荣, 刘思达, 等. 肝纤维化治疗进展[J]. 肝脏, 2018, 23(10): 85-87. HU X, HU G R, LIU S D, et al. Progress of liver fibrosis treatment[J]. Chinese Hepatology, 2018, 23(10): 85-87. |
| [3] |
中华医学会肝病学分会. 肝硬化诊治指南[J]. 临床肝胆病杂志, 2019, 35(11): 2408-2425. Chinese Society of Hepatology Chinese Medical Association. Chinese guidelines on the management of liver cirrhosis[J]. J Clin Hepatol, 2019, 35(11): 2408-2425. |
| [4] |
郑少秋, 王启之. 无创肝纤维化诊断研究现状与前景[J]. 临床肝胆病杂志, 2019, 35(1): 197-200. ZHENG SQ, WANG QZ. Current status and prospects of research on noninvasive diagnosis of liver fibrosis[J]. J Clin Hepatol, 2019, 35(1): 197-200. DOI:10.3969/j.issn.1001-5256.2019.01.043 |
| [5] |
于吉广, 邹志强, 丁玉平. 无创肝纤维化检测与肝脏穿刺病理诊断的对照研究进展[J]. 实用临床医药杂志, 2011, 15(3): 118-121. YU J G, ZOU Z Q, DING Y P. Comparative study of non-invasive liver fibrosis detection and pathological diagnosis of liver puncture[J]. Journal of Clinical Medicine in Practice, 2011, 15(3): 118-121. |
| [6] |
MARUYAMA H, KATO N. Advances in ultrasound diagnosis in chronic liver diseases[J]. Clinical and Molecular Hepatology, 2019, 25(2): 160-167. DOI:10.3350/cmh.2018.1013 |
| [7] |
YE L, ZHAO Y Z. Discussion on Noninvasive Diagnosis of Liver Fibrosis[J]. World Latest Medicine Information, 2019, 19(61): 94-95, 97. |
| [8] |
王晶晶, 陈国凤. 无创肝纤维化诊断研究进展[J]. 肝脏, 2018, 23(1): 72-76. WANG J J, CHEN G F. Research advances in non-invasive liver fibrosis diagnosis[J]. Chiness Hepatology, 2018, 23(1): 72-76. |
| [9] |
雷金艳, 贾建伟. 血府逐瘀胶囊治疗慢性乙肝后肝纤维化临床观察[J]. 北京中医药, 2010, 29(2): 126-127. LIE J Y, JIA J W. Clinical observation of Xuefu Zhuyu Capsule in treating liver fibrosis after chronic hepatitis B[J]. Beijing Journal of Traditional Chinese Medicine, 2010, 29(2): 126-127. |
| [10] |
刘成海, 赵志敏, 吕靖. 中医对肝纤维化逆转的认识与治疗[J]. 临床肝胆病杂志, 2019, 35(4): 728-733. LIU C H, ZHAO Z M, LV J. Advances in the understanding and treatment of liver fibrosis in traditional Chinese medicine[J]. Journal of Clinical Hepatobiliary Disease, 2019, 35(4): 728-733. |
| [11] |
周春燕. 血府逐瘀胶囊联合恩替卡韦治疗慢性乙肝肝纤维化临床观察[J]. 中国医药导报, 2011, 8(14): 103-104. ZHOU C Y. Clinical observation of Xuefu Zhuyu capsule combined with entecavir in the treatment of chronic hepatitis B fibrosis[J]. China Medicine Guide, 2011, 8(14): 103-104. DOI:10.3969/j.issn.1673-7210.2011.14.049 |
| [12] |
谢正兰, 李铁强. 早期肝硬化的中医研究进展[J]. 现代中西医结合杂志, 2012, 21(32): 3646-3648. XIE ZL, LI TQ. Research Progress of Traditional Chinese Medicine in Early Liver Cirrhosis[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2012, 21(32): 3646-3648. DOI:10.3969/j.issn.1008-8849.2012.32.064 |
| [13] |
ZHANG X, ZHANG J, JIA L, et al. Dicliptera Chinensis polysaccharides target TGF-β/Smad pathway and inhibit stellate cells activation in rats with dimethylnitrosamine-induced hepatic fibrosis[J]. Cellular and molecular biology (Noisy-le-Grand, France), 2016, 62(1): 99-103. |
| [14] |
姜娜, 平键, 陈高峰, 等. 八宝丹对二甲基亚硝胺诱导的大鼠肝纤维化干预作用研究[J]. 上海中医药杂志, 2016, 50(12): 76-81. JIANG N, PING J, CHEN G F, et al. Intervention of Babaodan capsule on liver fibrosis induced by dimethylnitrosamine in rats[J]. Shanghai Journal of Traditional Chinese Medicine, 2016, 50(12): 76-81. |
| [15] |
SUN Y, CHANG J, LIU X, et al. Mortality trends of liver diseases in mainland China over three decades:an age-period-cohort analysis[J]. BMJ open, 2019, 9(11): e029793. DOI:10.1136/bmjopen-2019-029793 |
| [16] |
ZHAO J, CHENG J. Research progress of signaling pathways in liver fibrosis[J]. Chinese journal of hepatology, 2019, 27(6): 403-406. |
| [17] |
WALLACE M C, FRIEDMAN S L, MANN D A. Emerging and disease-specific mechanisms of hepatic stellate cell activation[J]. Seminars in Liver Disease, 2015, 35(2): 107-118. DOI:10.1055/s-0035-1550060 |
| [18] |
SHAN L, LIU Z, CI L, et al. Research progress on the anti-hepatic fibrosis action and mechanism of natural products[J]. International Immunopharmacology, 2019, 75(10): 105765. |
| [19] |
QIN D M, ZHANG Y, LI L, et al. Progress in research of Chinese herbal medicines with anti-hepatic fibrosis activity[J]. World Chinese Journal of Digestology, 2017, 25(11): 958-965. DOI:10.11569/wcjd.v25.i11.958 |
| [20] |
杜燕, 梁爽, 周波, 等. 肝纤维化中医证治研究进展[J]. 中医药临床杂志, 2019, 31(3): 22-25. DU Y, LIANG S, ZHOU B, et al. Research progress of traditional Chinese medicine syndrome differentiation of liver fibrosis[J]. Clinical Journal of Traditional Chinese Medicine, 2019, 31(3): 22-25. |
| [21] |
周洁, 赵峻, 陈拥军, 等. 中医活血法治疗肝纤维化进展[J]. 河南中医, 2017, 37(2): 254-256. ZHOU J, ZHAO J, CHEN Y J, et al. The progress of liver fibrosis treated with traditional Chinese medicin method of activating blood circulation[J]. Henan Tradtional Chinese Medicine, 2017, 37(2): 254-256. |
| [22] |
LIU P. Fuzheng huayu capsule in the treatment of liver fibrosis:clinical evidence and mechanism of action[J]. Chinese Journal of Integrative Medicine, 2012, 18(5): 398-400. DOI:10.1007/s11655-012-1030-1 |
| [23] |
胡谷冰. 血府逐瘀汤治疗慢性乙型肝炎肝纤维化疗效观察[J]. 中华医院感染学杂志, 2012, 22(19): 4279-4281. HU GB. Clinical efficacy of therapeutic soup in treatment of hepatitis B liver fibrosis[J]. Chin J Nosocomiol, 2012, 22(19): 4279-4281. |
| [24] |
李苗, 周诗澜, 黄古叶. 柴胡类方治疗早期肝硬化研究进展[J]. 亚太传统医药, 2018, 14(10): 82-84. LI M, ZHOU SL, HUANG GY. Research Progress of Chaihu Decoction in Treatment of Early Stage Cirrhosis[J]. Asia-Pacific Traditional Medicine, 2018, 14(10): 82-84. |
| [25] |
杜秀萍, 薛建华, 孙莲娜, 等. 血府逐瘀汤治疗代偿期乙肝肝硬化疗效观察[J]. 山东中医杂志, 2014, 33(7): 561-562. DU XP, XUE JH, SUN LN, et al. Observation on the efficacy of Xuefu Zhuyu Decoction in the treatment of compensatory hepatitis B liver cirrhosis[J]. Shandong Journal of Traditional Chinese Medicine, 2014, 33(7): 561-562. |
| [26] |
赵海明. 血府逐瘀汤治疗乙肝后肝硬化疗效观察[J]. 实用中医内科杂志, 2011, 25(7): 65-66. ZHAO H M. Effective Observation on Treating Hepatitic Cirrhosis with Xuefu Zhuyu Decoction[J]. Journal of Practical Traditional Chinese Internal Medicine, 2011, 25(7): 65-66. DOI:10.3969/j.issn.1671-7813.2011.07.037 |
| [27] |
吴晓梅. 彩色多普勒超声检查在慢性乙型肝炎肝纤维化诊断中应用价值分析[J]. 影像研究与医学应用, 2018, 2(22): 185-186. WU X M. Color Doppler ultrasound in the diagnosis of liver fibrosis in chronic hepatitis B Applied value analysis[J]. Journal of Imaging Research and Medical Applications, 2018, 2(22): 185-186. |
| [28] |
郑悠, 许永生, 张旭霞, 等. 肝纤维化的影像学诊断现状[J]. 临床肝胆病杂志, 2019, 35(8): 1838-1841. ZHENG Y, XU Y S, ZHANG X X, et al. Current status of the imaging diagnosis of liver fibrosis[J]. Journal of Clinical Hepatobiliary Disease, 2019, 35(8): 1838-1841. DOI:10.3969/j.issn.1001-5256.2019.08.042 |
| [29] |
武永萍, 魏占芳, 杨文帅, 等. 彩色多普勒超声对慢性乙型肝炎肝纤维化的价[J]. 中国继续医学教育, 2019, 11(14): 96-98. WU Y P, WEI Z F, YANG W S, et al. The value of doppler ultrasound of liver fibrosis in chronic hepatitis B[J]. China Continuing Medical Education, 2019, 11(14): 96-98. DOI:10.3969/j.issn.1674-9308.2019.14.041 |
| [30] |
杨敬恩, 李若攀, 梁清. 彩色多普勒超声检查对慢性乙型肝炎肝纤维化的诊断价值[J]. 海南医学, 2017, 28(8): 1293-1295. YANG J E, LI R P, LIANG Q. Application of color Doppler ultrasound in the diagnosis of liver fibrosis of chronic hepatitis B[J]. Hainan Medicine Journal, 2017, 28(8): 1293-1295. DOI:10.3969/j.issn.1003-6350.2017.08.031 |
 2020, Vol. 39
2020, Vol. 39