文章信息
- 庞赓, 李沙, 唐新月, 赵娜
- PANG Geng, LI Sha, TANG Xinyue, ZHAO Na
- 推拿疗法对骨骼肌纤维化大鼠MMP-1和TIMP-1表达的影响
- Effect of massage therapy on the expression of MMP-1 and TIMP-1 in rats with skeletal muscle fibrosis
- 天津中医药大学学报, 2020, 39(2): 209-214
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(2): 209-214
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.02.20
-
文章历史
收稿日期: 2019-12-25
2. 天津体育学院, 天津 301617;
3. 天津中医药大学第一附属医院, 天津 300193
2. Tianjin University of Sport, Tianjin 301617, China;
3. First Affiliated Hospital of Tianjin University of TCM, Tianjin 300193, China
急性骨骼肌损伤作为运动性损伤的一种类型, 一直呈高发态势, 其致病原因多为钝挫伤或牵拉伤。虽然已有研究证实骨骼肌损伤后具有再生修复的能力, 但严重的钝挫伤可导致骨骼肌纤维断裂、肌膜遭到破坏、肌核死亡, 使其丧失再生功能, 这时结缔组织增生, 瘀痕修复占据主导, 骨骼肌出现纤维化[1]。骨骼肌纤维化可导致肌肉弹性不同程度的消退、功能受损、运动能力下降, 且具有不可逆性, 因此抗纤维化的治疗手段一直都是运动医学领域研究的热点。研究显示, 由于致炎细胞的持续浸润, 成肌细胞可转型为肌成纤维细胞, 其过度活化增殖产生大量细胞外基质, 导致的大量胶原纤维持续聚集, 是骨骼肌纤维化的重要环节[2]。研究发现基质金属蛋白酶(MMPs)/金属蛋白酶组织抑制因子(TIMPs)的动态平衡对细胞外基的合成与降解具有调节作用[3]。
推拿作为一种绿色、无化学毒副作用的治疗方法, 针对骨骼肌的各种损伤具有明显的临床疗效[4], 本研究通过复制大鼠急性骨骼肌钝挫伤模型, 选用临床推拿核心手法——按揉法为干预手段进行治疗, 观察其对骨骼肌纤维化的干预效果, 并阐明其机制是否与调控基质金属蛋白酶-1(MMP-1)/金属蛋白酶组织抑制因子-1(TIMP-1)平衡相关。
1 材料与方法 1.1 实验材料 1.1.1 实验动物健康成年雄性Sprague-Dawley(SD)大鼠20只, 体质量(200±20) g, 由北京华阜康生物科技股份有限公司提供, 许可证编号SCKY(京)20140004饲养于天津中医药大学清洁级动物房。
1.1.2 实验仪器和主要试剂TPA-Ⅱ推拿手法测定仪(上海益联医学仪器发展有限公司); Veriti PCR热循环仪、荧光定量PCR仪(美国ABI公司); PowerPac Basic基础电泳仪、凝胶成像系统(美国Bio-Rad公司); cDNA第一链合成试剂盒、SYBR Green试剂盒(天津彬彤生物科技有限公司); 兔抗大鼠多克隆抗体(美国Santa Cruz公司); BCA蛋白检测试剂盒(美国Thermo公司); 低速离心机, 型号LDZ5-2(北京京立离心机有限公司)。
1.2 骨骼肌钝挫伤模型的复制和分组本研究效仿经典钝挫伤造模法[5], 自制造模装置, 选取SD大鼠腓肠肌部位为造模区域, 以重物垂直下落方式击打造模, 具体操作如下:动物入笼适应性喂养一周后, 调配10%水合氯醛(0.4 mL/100 g), 一次性腹腔注射麻醉; 选取大鼠右后肢内侧面, 距根骨1.5 cm处为造模区域, 标注, 备皮; 将大鼠仰卧位固定于操作台上, 右后肢外展, 伸膝、踝背屈90°, 充分暴露标记部位; 将面积为1 cm2的圆形接触装置紧贴大鼠标记部位, 固定; 220 g重物由81 cm高度下落垂直击打接触装置, 动能2.62 J; 将创面无破损、无骨折, 击打部位为标记区大鼠入组, 完成造模。参阅文献, 该造模方式制备纤维化大鼠模型达100%。成模大鼠观察3 d后, 依体质量遵数字随机法分为模型组和推拿干预组(n=10)。
1.3 干预措施选用TPA-Ⅱ推拿手法测定仪采集并储存推拿名家王金贵教授手法参数, 建立量化标准; 实操人员依标准进行模拟训练, 后经测定仪评定, 实操人员在力度、频率与量化标准一致后方可进入实验组干预。成模后3日后, 依量化标准实施干预, 具体操作流程如下:缚成模大鼠于自制固定装置, 仰卧位, 暴露患肢; 定位大鼠患处及周边, 依标准按揉施术; 固定时间、每天10 min/次、25 d连续施术。
模型组:参照推拿组相同方式予以固定, 不施加干预, 10 min/次/d, 连续25 d。
1.4 标本采集与处理经25 d干预后, 大鼠称质量后调配10%水合氯醛(0.4 mL/100 g), 一次性腹腔注射麻醉, 立即解剖并分离大鼠腓肠肌中段, 均分为2份, 一份用于苏木精-伊红(HE)染色; 另一份用锡纸包裹后置于-80℃冰箱保存, 用于后续qPCR及Western Blot检测。
1.5 HE染色操作步骤:将腓肠肌组织置于4%甲醛固定72 h, 改刀, 石蜡包埋, 4 μm切片, 常规脱蜡至水, 置于苏木精液中染色5 min, 流水冲洗5min, 1%盐酸乙醇分化3 s, 稍后流水浸泡10 min, 置入蒸馏水中5 min, 经伊红染色2 min, 梯度酒精脱水, 放入二甲苯中透明, 最后用中性树胶予以封固。镜下观察各组大鼠腓肠肌形态结构变化。
1.6 实时荧光定量核酸扩增(qPCR)检测大鼠腓肠肌MMP-1、TIMP-1mRNA表达情况取大鼠造模区域腓肠肌组织样品, 加入1 mL Trizol试剂与氯仿分离, 经4℃以下7 000 rpm转速震荡离心后取出上清液; 加入异丙醇经振荡离心后去除上清液, 经75%乙醇洗涤后再次去除上清液, 常温干燥, 加入DEPC, 随即测量RNA的浓度与纯度。从Genbank数据库查找出MMP-1及TIMP-1的mRNA序列, 参照说明书逆转录反应合成cDNA, 用SYBR Green法冰上配制20 μL反应液进行扩增, 具体反应条件如下:95℃ 15 min, 预变性及热启动→95℃ 10 s, 变性→60℃ 30 s, 退火→72℃ 1 min, 延伸→40个循环。所得数据用2-ΔΔCT法计算各基因的相对表达量。具体的引物序列如:MMP1引物设计, 上游引物5'-TACCATC-CTGCGACTCTTGC-3', 下游引物为:5'-TTCACCCA-CATCAGGCACTC-3'。TMIP1引物设计, 上游引物:5'-ACACCCCAGTCATGGAAAGC-3', 下游引物:5-'AAGAA GCTGCAGGCACTGAT-3';GAPDH引物设计, 上游引物:5'-AAGAAGGTGGTGA AGCAGG-3', 下游引物:5'-GAAGGTGGAAGAGTGGGAGT-3'。
1.7 蛋白免疫印迹(Western Blot)法检测大鼠腓肠肌MMP-1、TIMP-1的蛋白表达情况取大鼠损伤区域腓肠肌组织, 迅速加入液氮1 h后研磨, 加入蛋白裂解液和蛋白酶抑制剂配平, 经离心震荡后取上清液测定蛋白浓度。蛋白经95℃煮10 min, 用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)恒压电泳, 转膜至聚偏氟乙烯(PVDF), 5%脱脂奶粉常温封闭1 h, 加入经三羟甲基氨基甲烷盐酸(Tris-HCl)缓冲盐溶液和吐温(Tween)-20稀释的一抗, 4℃摇床过夜。TBST洗膜3次后加入5%脱脂奶粉的二抗, 室温反应2 h, TBST洗膜, 加ECL显色3 min, 成像系统显影成像。以GDPH为内参照蛋白, 运用image J软件进行定量分析。
1.8 统计学分析运用SPSS24.0软件进行采集数据的整理分析。数据呈正态分布, 实验数据用均数±标准差(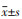
对照组大鼠肌纤维排列整齐, 形态结构完整, 肌细胞核呈卵圆形, 多个核细胞位于肌细胞边缘。模型组大鼠肌纤维排列紊乱, 部分肌纤维出现断裂情况, 并伴有炎症细胞侵袭, 肉眼可见形成大量结缔组织给予推拿治疗后, 治疗组大鼠肌纤维排列较为整齐, 伴有轻微肿胀, 结构大小均一, 结缔组织生成较少, 纤维化程度明显降低, 表明推拿治疗可有效修复大鼠急性骨骼肌钝挫伤后的肌肉损伤。
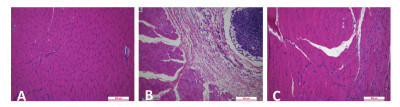
|
| A为对照组;B为模型组;C为治疗组 图 1 大鼠腓肠肌HE染色(100×) |
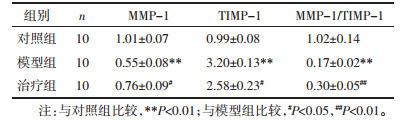
对比对照组, 造模28 d后模型组大鼠造模区域腓肠肌MMP-1的mRNA相对表达量及MMP-1/TIMP-1的比值明显降低(P < 0.05), TIMP-1的mRNA相对表达量明显升高(P < 0.05), 说明模型大鼠致纤维化的进程与MMP-1的转录下调、TIMP-1的激活及MMP-1/TIMP-1比值下降有关。经25 d的推拿干预治疗后MMP-1的mRNA相对表达量及MMP-1/TIMP-1的比值较模型组明显升高(P < 0.05, P < 0.01), TIMP-1的转录水平明显降低(P < 0.05), 说明推拿干预可能通过提升MMP-1的转录水平、升高MMP-1/TIMP-1的比值及降低TIMP-1转录水平来逆转大鼠钝挫伤导致的骨骼肌纤维化程度。
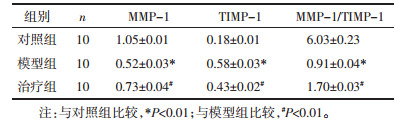
如表 2所示, 模型组大鼠造模区域腓肠肌组织中MMP-1的蛋白相对表达量及MMP-1/TIMP-1比值相比对照组均明显下调(P < 0.01);TIMP-1的蛋白相对表达量明显上调。而经推拿干预治疗后, 其MMP-1的蛋白相对表达量及MMP-1/TIMP-1比值相比模型组均明显提升(P < 0.01), TIMP-1的蛋白相对表达量明显下调, 进一步说明推拿干预治疗可能通过提升MMP-1的蛋白水平、下调TIMP-1的蛋白水平及提升MMP-1/TIMP-1比值弱化大鼠钝挫伤导致的骨骼肌纤维化程度。
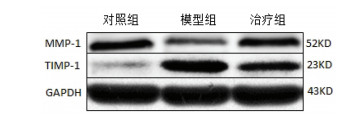
|
| 图 2 各组大鼠腓肠肌MMP-1、TIMP-1相关蛋白印迹图 |
骨骼肌纤维化是一个多细胞因子参与调控的复杂病例变化过程, 是骨骼肌纤维损伤重构后发生的病理表现形式[6-7]。
由外部原因造成的骨骼肌钝挫伤, 会导致部分通路暂时激活或限制, 并通过精确协调, 来完成肌肉成分的重建, 如损伤严重, 会造成受伤组织动态平衡重建受阻, 使正常肌纤维被不具备功能性的结缔组织替代。肌束膜是结缔组织的重要组成部分, 其主要成分是I型、III型胶原, 而I型胶原的过度沉积标志着受伤机体结缔组织大量合成, 而这也会导致受损部位ECM的增多[8]。从目前的研究结果中可以推断, 严重钝挫伤的肌肉组织在其后续修复过程中会引起I型、III型胶原的过度合成, 进而导致瘢痕产生, 严重影响肌肉的物理特性。研究发现, 经受严重钝挫伤后, 受损部位III型胶原蛋白水平迅速上升, 并于14 d时达到峰值, 而I型胶原蛋白水平于损伤后21 d时达到峰值, 因此可以推断, 钝挫伤后骨骼肌前期主要以III型胶原合成为主, 而后期则以I型胶原合成为主[9]。
MMPs, 即基质金属蛋白酶, 作为主要的基质降解酶, 可降低多种细胞外基质, 截至目前, MMPs大家族已发现26个具备相似结构的成员[10-13]。MMPs表达水平升高有助于损伤部位形成新的肌纤维。MMP1作为家族成员之一, 属于间质胶原酶, 经研究表明, MMP1作为降解I型和III型胶原的特异性酶, 具备缓解骨骼肌纤维化的作用, 并能促进骨骼肌结构与功能的恢复。TIMPs(即基质金属蛋白酶抑制物), 作为MMPs的特异性抑制剂, 以共价键的形式结合MMPs并抑制其活性[13]。目前, TIMPs家族已发现4名成员, 其中TIMP-1为MMP-1的内源性抑制物, 其以1:1的方式与MMP-1结合并形成复合体, 最终使MMP-1失去活性。MMP-1/TIMP-1的动态平衡, 极大的影响着MMP-1降解细胞外基质的功效。而本实验的研究结果表明, 经严重钝挫伤后的腓肠肌组织其MMP-1的蛋白相对表达量的明显下调及其内源性抑制物TIMP-1的显著上调, 必然导致MMP-1/TIMP-1比值下调, 而MMP-1与TIMP-1动态平衡的破坏将会引起I型、III型胶原合成降解的稳态失衡, 使I型、III型胶原合成增多, 弱化MMP-1对细胞外基质(ECM)的降解作用, 而ECM作为一种大分子物质, 当骨骼肌纤维受损时, 可由细胞内分泌到细胞外间质中, 在骨骼肌纤维的连接中承担桥梁作用。ECM的大量外溢、增生、取代正常骨骼肌细胞可视为骨骼肌纤维化的重要标志[14], 因此可以推断, 严重钝挫伤造成的受损部位肌肉组织中MMP-1/TIMP-1比值下调, 是造成本实验模型组大鼠腓肠肌组织纤维化的重要因素。在其他学者的研究中, 也发现了类似趋势[15]。杨宁等[16]研究发现, 拉伤诱导骨骼肌纤维化模型大鼠腓肠肌组织的MMP-1/TIMP-1蛋白比值较正常组明显下降; Lv S研究发现, 主动脉狭窄诱导心肌纤维化模型大鼠心肌组织的MMP-1/TIMP-1平衡受到破坏[17]; 李洁等研究发现在肝纤维化小鼠肝组织MMP-1显著降低, TIMP-1显著升高[18]。由此可见, MMP-1/TIMP-1的失衡是引起骨骼肌纤维化的重要分子基础。
推拿治疗直接作用于受损骨骼肌, 可活血化瘀、理筋复脉、调理经络, 对于急性骨骼肌损伤后再生具有明显的效果[19-21], 而按摩时机与力度的选择也是影响干预效果的重要因素, 在急性损伤期由于损伤的肌纤维破裂、坏死、和炎症细胞的浸润, 不宜立即施术, 故本实验按摩干预选择在大鼠成模3 d后, 为急性损伤中期, 此时期受损腓肠肌炎症反应加剧, 成纤维细胞增多, 新生的毛细血管与肉芽组织正在形成, 推拿可有效改善局部血液循环, 促进淤血的吸收与坏死组织的清除, 并可避免损伤组织的肌肉粘连, 能有效的促进损伤肌肉的修复。而在推拿力度的选择上, 本实验通过推拿手法测定仪的前期手法训练, 对王金贵教授手法进行复刻, 通过按揉法降低受损部位淤结、肿胀, 垂直用力, 对受损肌纤维施以垂直按压, 在早期施以小强度按摩, 于后期加大按摩力度, 从实验结果来看取得了较好的效果。在本实验中, 通过HE染色观察发现, 经按揉法干预, 治疗组大鼠腓肠肌纤维排列较整齐且间隙小、胶原纤维沉积降低、ECM增生减少、纤维化程度明显降低。而qPCR和Western Blot结果显示经按揉法干预后大鼠腓肠肌MMP-1的表达及MMP-1/TIMP-1比值明显上调, TIMP-1的表达明显下调从而抑制了骨骼肌纤维化的形成。而其他学者的研究也表明推拿可促进肌纤维再生及肌卫星细胞增殖, 改善损伤区血液循环等加速骨骼肌损伤后修复[22-24]。由此推论, 推拿可能是因为使腓肠肌损伤部位发热、促进其血液循环、增加血管容积、改善了腓肠肌受损部位微循环, 使受损部位修复所需要的氧和营养物质得到大量补充, 并降低与周围组织的粘连, 使慢性炎症反应得到缓解, 在提升MMP-1表达的同时, 降低TIMP-1的表达, 使MMP-1/TIMP-1比值提升, 进一步提升了MMP-1降解I型和III型胶原的效果, 进而抑制纤维化的发生。
4 小结结合HE染色形态学观察, 本研究所采用的钝挫伤造模方式明显引起了部分肌纤维断裂, 肉眼可见形成大量结缔组织。而通过qPCR及Western Blot结果分析, MMP-1mRNA及蛋白表达下调, TIMP-1mRNA及蛋白表达上调, MMP-1/TIMP-1比值下降, 并引起受损部位腓肠肌出现明显纤维化症状。而经过推拿干预后, 治疗组大鼠受损部位腓肠肌肌纤维结构、大小均一, 结缔组织生成降低, 纤维化程度明显降低。MMP-1mRNA及蛋白表达明显上调, TIMP-1mRNA及蛋白表达明显下调, 提升了MMP-1/TIMP-1比值, 推测推拿治疗可能通过改变MMP-1与TIMP-1动态平衡, 进而, 有效降低I型和III型胶原纤维的增生, 促进肌肉的修复, 降低受损肌肉纤维化程度。
综上所述, 推测按摩通过提升MMP-1/TIMP-1比值, 有效缩短肌纤维修复过程, 这可能为推拿促进骨骼肌损伤修复, 降低纤维化的机制之一。
| [1] |
TIDBALL J G. Mechanisms of muscle injury, repair, and regeneration[J]. Comprehen-sive Physiology, 2011, 1(4): 2029-2062. |
| [2] |
邓修元, 吴志彬, 杨忠. 骨骼肌纤维化的细胞与分子机制研究进展[J]. 中国康复理论与实践, 2014, 20(2): 142-147. DENG X Y, WU Z B, YANG Z. Fibrosis in skeletal muscle:celluar and molecular mechanism[J]. Chinese Journal of Rehabilitation and Practice, 2014, 20(2): 142-147. DOI:10.3969/j.issn.1006-9771.2014.02.011 |
| [3] |
ZHANG L, LI X, BI L J. Alterations of collagen-I, MMP-1 and TIMP-1 in the periodontal ligament of diabetic rats under mechanical stress[J]. Journal of Periodontal Research, 46(4): 448-455. |
| [4] |
谢娇, 邓多喜, 陈英, 等. 推拿手法对骨骼肌损伤干预研究的进展[J]. 湖南中医杂志, 2018, 34(4): 199-201. XIE J, DENG D X, CHEN Y, et al. Research progress on the intervention of massage manipulation on skeletal muscle injury[J]. Hunan Journal of Traditional Chinese Medicine, 2018, 34(4): 199-201. |
| [5] |
KAMI K, MASUHARA M, KASHIBA H, et al. Changes of vinculin and extracellular matrix components following blunt trauma to rat skeletal muscle[J]. Medicine&Science in Sports&Exercise, 1993, 25(7): 832-840. |
| [6] |
于新凯, 石鹏超, 左群. 转化生长因子β与骨骼肌损伤修复的研究进展[J]. 解剖科学进展, 2014, 20(2): 158-161. YU X K, SHI P C, ZUO Q, et al. The role of TGF-β in the injury and regeneration of skeletal muscle[J]. Progress of Anatomical Sciences, 2014, 20(2): 158-161. |
| [7] |
姚鸿恩.体育保健学高级教程[M].广西: 广西师范大学出版社.2003. YAO H E. Advanced Course in health fitness education[M]. Guangxi: Guangxi Normal University Press.2003. |
| [8] |
于亮. MMP-1在骨骼肌损伤去纤维化中的作用[C].中国生理学会运动生理学专业委员会(CSEP).2011年中国生理学会运动生理学专业委员会会议暨"运动与骨骼肌"学术研讨会论文集.中国生理学会运动生理学专业委员会(CSEP): 北京体育大学运动生理教研室, 2011. YU L. Role of MMP-1 in defibrosis of skeletal muscle injury[C]. Chinese Society Of Exercise Physiology (CSEP). Proceedings of the 2011 meeting of the sports physiology committee of the Chinese Society Of Exercise Physiology (CSEP): department of sports physiology, Beijing sport university, 2011. |
| [9] |
朱文辉, 陈世益, 任惠民, 等. 活血生肌类中药对大鼠急性钝挫伤后骨骼肌Ⅱb型MHC及Ⅰ、Ⅲ型胶原蛋白表达的影响[J]. 中国运动医学志, 2005(2): 182-186. ZHU W H, CHEN S Y, REN H M, et al. Effects of Chinese medicine Huoxue Shengji on the protein expression of MHC-Ⅱb, collagen-Ⅰ and collagen-Ⅲ in Rat's skeletal muscle with acute contusion[J]. Chinese Journal of Sports Medicine, 2005(2): 182-186. |
| [10] |
丁洁, 常煜胤, 李文杰, 等. γ-分泌酶抑制剂干预对鼠心脏成纤维细胞平滑肌肌动蛋白-α及MMP-1/TIMP-1表达的影响[J]. 临床心血管病杂志, 2016, 32(7): 735-738. DING J, CHANG Y Y, LI W J, et al. The effects of DAPT intervention on the expression of α-SMA and MMP-1/TIMP-1 in rats cardiac fibroblasts[J]. Journal of Clinical Cardiology, 2016, 32(7): 735-738. |
| [11] |
王世强, 常芸, 马晓雯, 等. 不同强度耐力运动对大鼠心肌胶原蛋白的影响及MMP-1/TIMP-1的调节作用[J]. 中国体育科技, 2015, 51(5): 60-66. WANG S Q, CHANG Y, MA X W, et al. Effects of endurence exercise of different intensity on cardiac collagen of rats and regulation of MMP-1/TIMP-1[J]. China Sport Science and Technology, 2015, 51(5): 60-66. |
| [12] |
王乾宇, 王文佳, 奚锦, 等. 杜仲多糖对肝纤维化模型大鼠Ⅰ, Ⅲ型胶原蛋白, MMP-1, TIMP-1及TGF-β1 mRNA表达的影响[J]. 中国实验方剂学杂志, 2018, 24(23): 153-158. WANG Q Y, WANG W J, XI J, et al. Effect of polysaccharides from eucommiae cortex on expressions of genes of Ⅰ, Ⅲ collagen, MMP-1, TIM MP-1 and TGF-β1 from hepatic fibrosis in rat models[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2018, 24(23): 153-158. |
| [13] |
SPINALE F G. Myocardial matrix remodeling and the matrix metalloproteinases:influence on cardiac form and function[J]. Physiological Reviews, 2007, 87(4): 1285-1342. DOI:10.1152/physrev.00012.2007 |
| [14] |
杨长青, 胡国龄, 谭德明, 等. 实验性肝纤维化时MMP-1、TIMP-1的表达与Ⅰ、Ⅲ型胶原含量变化的关系[J]. 临床肝胆病杂志, 2000(4): 222-224. YANG C Q, HU G L, TAN D M, et al. Relativity of Expression of MMP-1, TIMP-1 and Variability of Type Ⅰ, Ⅲ Collagen During Experimental Liver Fibrosis[J]. Chinese Journal of Clinical Hepatology, 2000(4): 222-224. DOI:10.3969/j.issn.1001-5256.2000.04.015 |
| [15] |
张岩伟. MMP-1、TIMP-1在主动脉缩窄大鼠心肌细胞外基质重塑中的作用[D].郑州: 郑州大学, 2007. ZHANG Y W. Effects of MMP-1 and TIMP-1 on myocardial extracellular matrix remodeling in hypertrophic rat hearts induced by aortic coarctation[D]. Zhengzhou: Zhengzhou University, 2007. |
| [16] |
杨宁, 周越, 王瑞元, 等. 针刺对骨骼肌拉伤恢复进程中纤维化因子的影响[J]. 北京体育大学学报, 2018, 41(9): 75-79, 87. YANG N, ZHOU Y, WANG R Y, et al. Influence of acupuncture on fibrosis factors during recovery of skeletal muscle strain[J]. Journal of Beijing Sport University, 2018, 41(9): 75-79, 87. |
| [17] |
SHICHAO L, MEIFANG W, MENG L, et al. Effect of Qishen Yiqi Pill on myocardial collagen metabolism in rats with partial abdominal aortic coarctation[J]. Evidence-Based Complementary and Alternative Medicine, 2015, 126(25): 1-10. |
| [18] |
李洁, 徐玉莲, 罗书. 加味茵陈四逆汤对实验性肝纤维化小鼠MMP1和TIMPs表达的影响[J]. 辽宁中医杂志, 2016(43): 1317. LI J, XU Y L, LUO S. Jiawei Yinchen Sini Decoction on MMP1 and TIMPs in carbon tetrachloride-induced hepatic fibrosis mice[J]. Liaoning Journal of Traditional Chinese Medicine, 2016(43): 1317. |
| [19] |
田源, 唐成林, 黄思琴, 等. 按摩对大鼠骨骼肌急性钝挫伤后膜修复蛋白dysferlin和annexin A1表达的影响[J]. 中国康复医学杂志, 2016, 31(8): 841-846. TIAN Y, TANG C L, HUANG S Q, et al. Effects of massage on expressions of membrane repair proteins dysferlin and annexin A1 in rats with skeletal muscle acute contusion[J]. Chinese Journal of Rehabilitation Medicine, 2016, 31(8): 841-846. DOI:10.3969/j.issn.1001-1242.2016.08.003 |
| [20] |
宋济昊. 按摩手法和穴位注射对骨骼肌拉伤治疗的临床观察[J]. 武汉体育学院学报, 2000(4): 52-57. SONG J H. Clinic observation of the treatment of skeletal muscular strain with massage and tempt injection[J]. Journal of Wuhan Institute of Physical Education, 2000(4): 52-57. |
| [21] |
吴安林, 叶平, 谢娇, 等. 推拿对骨骼肌损伤修复相关生长因子影响研究进展[J]. 世界中医药, 2019, 14(3): 548-552. WU A L, YE P, XIE J, et al. Research progress on the effects of massage on growth factors related to skeletal muscle injury repair[J]. World Chinese Medicine, 2019, 14(3): 548-552. DOI:10.3969/j.issn.1673-7202.2019.03.007 |
| [22] |
谢辉, 唐成林, 陈晓琳, 等. 按摩通过改善VEGF活性及血供促进兔骨骼肌损伤修复[J]. 中国老年学杂志, 34(24): 6984-6986. XIE H, TANG C L, CHEN X L, et al. Massage promotes the repairing of rabbit skeletal muscle injury by improving the activity of VEGF an d blood supply[J]. Chinese Journal of Gerontology, 34(24): 684-6996. |
| [23] |
赵娜, 张玮, 庞赓, 等. 基于TGF-β1/CTGF作用途径探讨推拿干预骨骼肌纤维化的作用机制[J]. 辽宁中医杂志, 2016(12): 2539-2541. ZHAN N, ZHANG W, PANG G, et al. Based on the TGF-β1/CTGF action pathway to explore the mechanism of massage intervention for skeletal muscle fibrosis[J]. Liaoning Journal of Traditional Chinese Medicine, 2016(12): 2539-2541. |
| [24] |
李应志, 张吉, 王春林. 家兔骨骼肌急性钝挫伤早期推拿干预的实验研究[J]. 云南中医学院学报, 2018(5): 1-5. LI Y Z, ZHANG J, WANG C L. Experimental study on early massage intervention on acute blunt contusion of skeletal muscle in rabbits[J]. Journal of Yunnan University of Traditional Chinese Medicine, 2018(5): 1-5. |
 2020, Vol. 39
2020, Vol. 39