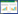文章信息
- 张怡, 赵鑫, 周梦楠, 商利娜, 赵海宁, 王亚静
- ZHANG Yi, ZHAO Xin, ZHOU Mengnan, SHANG Lina, ZHAO Haining, WANG Yajing
- 黄芩与葡萄糖酸锌联用对痤疮致病菌的抑菌实验研究
- Study on antibacterial activity of combined application of Scutellaria baicalensis and zinc gluconate against pathogenic bacteria of acne
- 天津中医药大学学报, 2020, 39(2): 215-220
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(2): 215-220
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.02.21
-
文章历史
收稿日期: 2019-11-20
2. 天津中医药大学方剂学教育部重点实验室, 天津 301617
2. Key Research Laboratory of Prescription Compatibility among Components, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
痤疮是一种临床常见的慢性毛囊皮脂腺炎症性皮肤病, 是全球第二大皮肤病[1]。它通常发生在面部, 颈部、前胸后背等皮脂丰富的部位, 临床表现多为粉刺、丘疹和脓包, 严重时伴有结节、囊肿及疤痕等, 对患者的身心健康产生严重影响[2]。痤疮的发病机制比较复杂, 除与雄激素分泌过多, 皮脂分泌旺盛, 毛囊角化过度等因素有关外, 还与痤疮致病菌的增殖密切相关[3]。病原学研究表明痤疮丙酸杆菌和金黄色葡萄球菌是痤疮的主要致病菌[4], 痤疮丙酸杆菌能够促进皮脂分泌[5-6], 其代谢产物不仅可以加重毛囊皮脂腺导管增生[7], 还能刺激不同的炎症调控因子诱发局部炎症[8-9]; 金黄色葡萄球菌可引起局部化脓感染, 能够在痤疮病灶上加重感染发炎[10], 因此, 抑制痤疮致病菌的增殖对有效治疗痤疮尤为重要。目前临床上常口服或局部使用抗生素类药物治疗痤疮, 但细菌耐药性、治疗周期长、不良反应等问题也日趋严重[11]。
锌是生理学上重要的微量元素, 参与机体各种生物过程, 具有一定的抑菌活性[12], 研究表明补充葡萄糖酸锌能够有效治疗痤疮[13-14]。青春期机体由于生长发育的需要常伴有锌的相对不足, 低浓度的锌对维持细胞正常功能是必需的, 但高水平锌的应用会引发细菌耐药性及机体毒性反应[15-16]。黄芩为常用的清热解毒类中药, 研究显示[17], 其醇提物有一定的抑菌活性, 在痤疮治疗上具有较大的开发潜力。临床上中西药联合应用较为广泛, 中药和化学药联合应用可取长补短从而有利于疾病治疗、减少细菌耐药性、降低毒副作用[18]。本文以痤疮丙酸杆菌和金黄色葡萄球菌为试验菌株, 考察黄芩与葡萄糖酸锌联用对痤疮主要致病菌的抑菌活性, 现报道如下。
1 主要试剂与仪器痤疮丙酸杆菌(Propionibacterium acnes, P. acnes, BNCC 336649)购自北纳创联生物技术有限公司; 金黄色葡萄球菌(Staphylococcus aureus, S. aureus, ATCC 25923)购自广东省微生物菌种保藏中心; 黄芩片(批号190102)购自河北安国市誉林药业有限公司; 葡萄糖酸锌(纯度99%批号20170412)购自河南雅辉化工产品有限公司; 硫酸庆大霉素注射液(批号20170710)购自天津金耀药业有限公司; 头孢氨苄(批号170301)购自天津市中央药业有限公司; LB肉汤购自北京索莱宝科技有限公司; 改良GAM培养基、营养琼脂培养基均购自山东拓普生物工程有限公司; 厌氧产气袋、厌氧培养袋(日本三菱瓦斯化学株式会社); HCB-900V垂直层流洁净工作台(青岛海尔特种电器有限公司); 生化培养箱(上海一恒科学仪器有限公司); ZWY-240恒温培养振荡器(上海智诚分析仪器制造有限公司); LS-B50L立式压力蒸汽灭菌器(上海医用核子仪器厂); infinite200全波长酶标仪(美国帝肯TECAN公司)。
2 方法 2.1 培养基制备分别配制硫乙醇酸盐培养基、改良GAM培养基、LB肉汤和营养琼脂培养基, 将配制好的培养基置锥形瓶中密封, 放入灭菌锅中于121℃下灭菌30 min, 待冷却后, 置于4℃冰箱中保存备用。
2.2 菌悬液制备取100 μL金黄色葡萄球菌甘油冻存液于10 mL LB肉汤中, 在37℃、150 r/min的条件下置于恒温振荡器中培养16 h进行活化, 随后采用平板计数法进行菌落计数, 使用前用LB肉汤稀释; 取100 μL痤疮丙酸杆菌甘油冻存液于5 mL硫乙醇酸盐培养基中, 在37℃条件下厌氧培养48 h进行活化, 随后采用平板计数法进行菌落计数, 使用前用改良GAM肉汤稀释。
2.3 供试药液制备参考文献[19]称取定量黄芩于烧杯中, 加10倍量60%乙醇于60℃条件下提取两次, 每次1 h, 趁热抽滤后合并滤液, 回收溶剂至0.5 g/mL(以生药计算), 存放于4℃备用; 称取葡萄糖酸锌0.5 g定容至10 mL, 即得浓度为50 mg/mL的葡萄糖酸锌溶液。
2.4 药物抑菌活性考察采用牛津杯法测定药物的抑菌圈直径来考察药物的抑菌活性。在无菌条件下, 取100 μL金黄色葡萄球菌菌悬液(1×105CFU/mL)于营养琼脂培养基上均匀涂布, 每板放5枚牛津杯, 于孔内分别加入黄芩、葡萄糖酸锌以及两种药物等体积混合均匀的药液各100 μL, 阳性对照为硫酸庆大霉素溶液(0.4 mg/mL) 20 μL, 阴性对照为无菌水100 μL, 将平板放于37℃生化培养箱中培养24 h。
取100 μL痤疮丙酸杆菌菌悬液(1×106 CFU/mL)于改良GAM培养基上均匀涂布, 每板放5枚牛津杯, 于孔内分别加入黄芩、葡萄糖酸锌以及两种药物等体积混合均匀的药液各100 μL, 阳性对照为头孢氨苄溶液(0.1 mg/mL) 50 μL, 阴性对照为无菌水100 μL。将平板与厌氧产气袋一同放入厌氧培养袋中, 在37℃生化培养箱中培养48 h。
结果采用十字交叉法测量抑菌圈直径, 实验平行测定3次。
2.5 药物最小抑菌浓度(MIC)和最小杀菌浓度(MBC)测定采用微量2倍稀释法测定药物的MIC和MBC, 考察黄芩、葡萄糖酸锌对金黄色葡萄球菌、痤疮丙酸杆菌的体外抑菌效果。首先对药物进行2倍稀释, 稀释后黄芩提取液浓度为500.00、250.00、125.00、62.50、31.25、15.63、7.81、3.91、1.95、0.98 mg/mL; 葡萄糖酸锌溶液浓度为50.00、25.00、12.50、6.25、3.13、1.56、0.78、0.39、0.20、0.10 mg/mL。于96孔细菌培养板内分别加入各浓度药液100 μL, 再加入菌悬液100 μL, 同时设置阳性对照(空白菌液), 阴性对照(空白药液)和培养基对照, 孔内终体积不足200 μL用相应肉汤补齐, 培养条件同2.4项, 测定A值, 测量前用枪头反复吸打混匀, 以抑制率≥ 80%的药物浓度为其MIC[20]。取≥ MIC浓度的孔内培养液100 μL于平板上涂布, 按照相应条件继续培养, 取菌落数≤ 5个的药物浓度为其MBC, 实验平行测定3次。
抑制率计算公式:

|
(1) |
采用棋盘法评价黄芩与葡萄糖酸锌联用对痤疮致病菌的体外联合抑菌效果。设置孔内药物终浓度为2 MIC、MIC、1/2 MIC、1/4 MIC、1/8 MIC, 分别沿着无菌的96孔细菌培养板的横轴、纵轴添加不同浓度的两种药物各50 μL, 再加入菌悬液100 μL, 同时设置阳性对照(空白菌液), 阴性对照(空白药液)和培养基对照, 孔内终体积不足200 μL用相应肉汤补齐, 培养条件同2.4项, 采用测定MIC的方法对联合用药时细菌的生长情况进行检测, 实验平行测定3次。并计算FICI [21], 判断联合用药效果, 计算方法为:FICI=MICA药联用/MICA药单用+MICB药联用/MICB药单用
当FICI ≤ 0.5时, 为协同作用; 当0.5 < FICI ≤ 0.75时, 为部分协同作用; 当0.75 < FICI ≤ 2时, 为无关作用; 当FICI > 2时, 为拮抗作用。
2.7 时间-生长曲线以棋盘法试验结果为依据, 进一步考察黄芩与葡萄糖酸锌较优组合下的联合抑菌效果, 于孔板内分别加入含有黄芩和葡萄糖酸锌的混合药液以及联合作用时两药各自浓度下的药液, 培养及测量条件同2.5项, 金黄色葡萄球菌每隔2 h测定一次A值, 痤疮丙酸杆菌分别于0、2、4、6、8、10、24、36、48 h测定A值, 以时间为横坐标, 活菌率为纵坐标绘制时间-生长曲线。
活菌率计算公式:
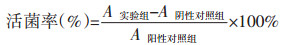
|
(2) |
数据使用SPSS 22.0和Origin 8.5.1软件进行分析和绘图, 计量资料用均数±标准差(
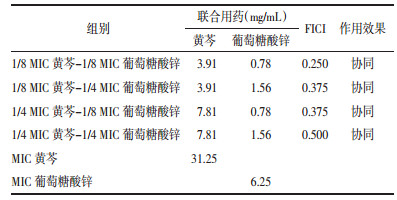
通过牛津杯法考察药物的抑菌活性, 结果见表 1。黄芩与葡萄糖酸锌联用后对金黄色葡萄球菌的抑菌活性与黄芩单用相比显著增强(P < 0.01), 而与葡萄糖酸锌单用相比无明显差异(P>0.05);联合用药对痤疮丙酸杆菌的抑菌活性与两药单独使用相比均显著增强(P < 0.01)。
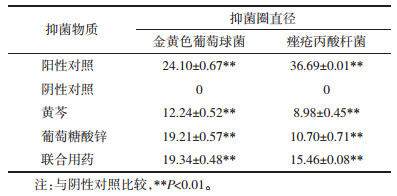
通过微量二倍稀释法和菌落计数法考察黄芩与葡萄糖酸锌的MIC和MBC, 结果见表 2。
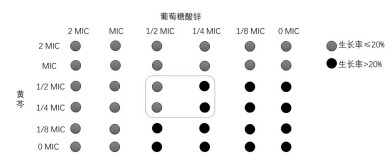
黄芩与葡萄糖酸锌联用对金黄色葡萄球菌的抑菌活性测定结果如图 1所示, 生长率>20%标记为黑色, 生长率≤ 20%标记为灰色, 结果显示, 在1/4 MIC黄芩-1/2 MIC葡萄糖酸锌作用下, 联合用药开始表现明显的抑菌作用。
|
| 图 1 黄芩与葡萄糖酸锌联用对金黄色葡萄球菌的抑菌作用结果示意图 |
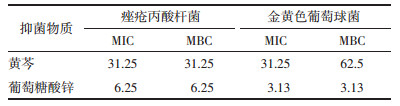
基于黄芩和葡萄糖酸锌联合应用时的最低抑菌浓度计算相应的FICI, 并对两者联合作用进行评价。由表 3中FICI可知, 黄芩与葡萄糖酸锌联用对金黄色葡萄球菌的抑制具有部分协同作用。
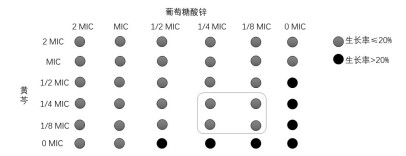
黄芩与葡萄糖酸锌联用对痤疮丙酸杆菌的抑菌活性测定结果如图 2所示, 生长率>20%标记为黑色, 生长率≤ 20%标记为灰色, 结果显示在1/8 MIC黄芩-1/8 MIC葡萄糖酸锌、1/4 MIC黄芩-1/8 MIC葡萄糖酸锌、1/8 MIC黄芩-1/4 MIC葡萄糖酸锌、1/4 MIC黄芩-1/4 MIC葡萄糖酸锌作用下, 联合用药开始表现明显的抑菌作用。
|
| 图 2 黄芩与葡萄糖酸锌联用对痤疮丙酸杆菌的抑菌作用结果示意图 |
基于黄芩和葡萄糖酸锌联合应用时的最低抑菌浓度计算相应的FICI, 并对两者联合作用进行评价。由表 4中FICI可知, 黄芩与葡萄糖酸锌联用对痤疮丙酸杆菌的抑制具有协同作用。
基于棋盘法测得的联合用药时的最低抑菌浓度绘制时间-生长曲线, 由图 3可知, 与细菌正常生长和同浓度下药物单用组相比, 联合用药作用下金黄色葡萄球菌的生长更为缓慢, 迟缓期的持续时间更长, 明显抑制了细菌进入对数生长期的进程, 且在对数生长期活性低, 持续时间短, 最高活菌率仅为20%。作用20 h后, 联合用药组活菌率开始减少, 进入衰亡期, 而阳性对照组细菌处于稳定期, 单独用药组的活菌率仍呈上升趋势。综上所述, 黄芩与葡萄糖酸锌联用对金黄色葡萄球菌抑制作用更强。
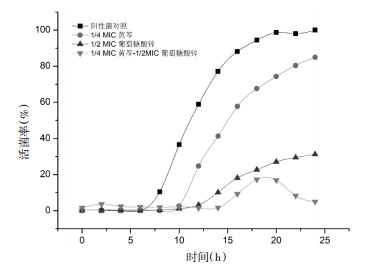
|
| 图 3 黄芩与葡萄糖酸锌联用下金黄色葡萄球菌的时间-生长曲线 |
由图 4可知, 1/8 MIC浓度黄芩对痤疮丙酸杆菌无抑菌活性, 1/8 MIC浓度葡萄糖酸锌与细菌作用24 h后活菌率高达70%, 但当1/8 MIC浓度黄芩与1/8 MIC浓度葡萄糖酸锌联用时, 细菌在48 h内均处于迟缓期, 表明联合用药完全抑制了痤疮丙酸杆菌的生长, 抑菌强度和速度远高于同浓度下的任一药物, 两者联用具有显著协同抑菌作用。
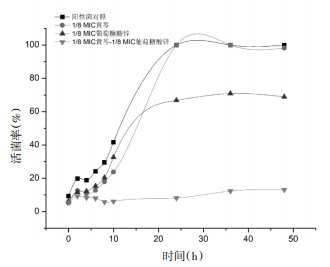
|
| 图 4 黄芩与葡萄糖酸锌联用下痤疮丙酸杆菌的时间-生长曲线 |
在青春期, 雄性激素水平升高导致皮脂分泌增加和痤疮丙酸杆菌的高度定植, 痤疮丙酸杆菌数量的增加是痤疮病理生理学的重要因素[22]。痤疮丙酸杆菌可直接刺激皮脂腺和角质形成细胞[23], 并通过分泌各种蛋白质包括裂解性外酶和趋化因子诱发和维持局部炎症[24]。除痤疮丙酸杆菌外, 金黄色葡萄球菌在痤疮病灶上加重感染发炎, 是炎症过程的间接贡献者[10]。
本实验以痤疮丙酸杆菌和金黄色葡萄球菌为实验菌株考察黄芩和葡萄糖酸锌的联合抑菌效果, 研究显示, 两者联用对痤疮致病菌的抑菌活性显著增强, MIC均下降, 对金黄色葡萄球菌的FICI为0.75, 表现为部分协同作用, 对痤疮丙酸杆菌的FICI为0.25, 表现为协同作用。联合用药降低了两者单用时的药物浓度, 有助于提高用药的安全性, 对临床治疗痤疮具有重要的现实意义和经济意义。
黄芩及其有效成分作为天然产物, 其抑菌机制通常是通过影响细菌细胞膜的形成及通透性, 干扰菌体内蛋白质合成, 抑制细菌代谢和DNA拓扑异构酶等多条途径[25-26]。锌主要通过破坏细菌细胞膜导致细胞内容物的溶出, 从而使细菌丧失生物学活性, 其作用机制较为单一, 长期或过量使用会引发毒性和细菌耐药性[27]。两者联用的增效机制可能是两种药物各自抑菌机制的结合, 也有可能与黄芩所含有效成分与葡萄糖酸锌生成的配合物抑菌效果更强有关[28]。有关联合用药的抑菌机理、增效机制以及是否对其他致病环节有调控作用等还需继续深入探讨和研究。
| [1] |
Taleb M, Abdeltawab N, Shamma R, et al. Origanum vulgare L.Essential Oil as a Potential Anti-Acne Topical Nanoemulsion-In Vitro and In Vivo Study[J]. Molecules, 2018, 23(9): 2164. DOI:10.3390/molecules23092164 |
| [2] |
曲韵.火针疗法治疗痤疮疗效的Meta分析及临床疗效观察与兔耳模型病理研究[D].北京: 中国中医科学院, 2016. QU Y. Meta Analysis of Efficacy of Acne Treatment with Fire-needle Therapy and the Clinical Efficacy Observation and Rabbit Ear Acne Model's Pathological Study[D]. Bingjing: China Academy of Chinese Medical Sciences. 2016. |
| [3] |
BOJAR R, HOLLAND K T. Acne and propioni bacterium acnes[J]. Clinics in Dermatology, 2004, 22(5): 375-379. DOI:10.1016/j.clindermatol.2004.03.005 |
| [4] |
纪薇, 沈德凯. 痤疮的病因病机研究进展[J]. 中国美容医学, 2012, 21(3): 528-530. JI W, SHEN D K. Research progress on etiology and pathogenesis of acne[J]. Chinese Journal of Aesthetic Medicine, 2012, 21(3): 528-530. DOI:10.3969/j.issn.1008-6455.2012.03.083 |
| [5] |
Ganceviciene R, Graziene V, Fimmel S, et al. Involvement of the corticotropin-releasing hormone system in the pathogenesis of acne vulgaris[J]. British Journal of Dermatology, 2010, 160(2): 345-352. |
| [6] |
Isard O, Knol A C, Ariès, Marie F, et al. Propionibacterium acnes Activates the IGF-1/IGF-1R System in the Epidermis and Induces Keratinocyte Proliferation[J]. Journal of Investigative dermatology, 2010, 131(1): 59-66. |
| [7] |
许德田, 刘玮. 痤疮丙酸杆菌和痤疮:进展与悖论[J]. 临床皮肤科杂志, 2016(03): 234-237. XU D T, LIU W. Propionibacterium acnes and acne:progress and paradoxes[J]. Journal of Clinical Dermatology, 2016(3): 234-237. |
| [8] |
Sandeep Varma R, Shamsia S, Thiyagarajan O S, et al. Yashadabhasma (Zinc calx) and Tankana (Borax) inhibit Propionibacterium acne and suppresses acne induced inflammation in vitro[J]. International Journal of Cosmetic Science, 2014, 36(4): 361-368. DOI:10.1111/ics.12134 |
| [9] |
Araviiskaia E, Dréno, B. The role of topical dermocosmetics in acne vulgaris[J]. Journal of the European Academy of Dermatology and Venereology, 2016, 30(6): 926-935. |
| [10] |
贺改英, 陈迪, 沈丽. 中草药祛痘复方对痤疮致病菌和外泌酶的影响[J]. 日用化学工业, 2018, 48(7): 403-407. HE G Y, CHEN D, SHEN L. The effect of Chinese herbal anti-acne formula on pathogenic bacteria and exocrine enzyme of acne vulgaris[J]. China Surfactant Detergent&Cosmetics, 2018, 48(7): 403-407. |
| [11] |
单孔荣, 王红丽, 姚乃捷, 等. 薰衣草精油与罗勒精油对痤疮致病菌的体外抑菌作用研究[J]. 广东药科大学学报, 2017, 33(5): 677-680. SHAN K R, WANG H L, YAO N J, et al. Antibacterial activity of lavender essential oil and basil essential oil against pathogenic bacteria of acne in vitro[J]. Journal of Guangdong Pharmaceutical University, 2017, 33(5): 677-680. |
| [12] |
WANG X, LIU S, LI M, et al. The synergistic antibacterial activity and mechanism of multicomponent metal ions-containing aqueous solutions against staphylococcus aureus[J]. Journal of Inorganic Biochemistry, 2016, 163: 214-220. |
| [13] |
杜金锋, 裴广德, 甄希, 等. 甘草锌颗粒联合异维A酸红霉素凝胶治疗轻、中度寻常性痤疮72例临床观察[J]. 中国皮肤性病学杂志, 2013, 27(9): 900-902. DU J F, PEI G D, ZHEN X, et al. Clinical effect of licorzine granules united lsotretinoin erythromycin gel for 72 cases of acne vulgaris[J]. The Chinese Journal of Dermatovenereology, 2013, 27(9): 900-902. |
| [14] |
何莉萍, 郝俊, 于开封, 等. 痤疮患者血清锌水平及加锌治疗效果[J]. 广东微量元素科学, 2001(4): 46-48. HE L P, HAO J, YU K F, et al. Concentration of Zn in serum of sufferers with acne and the effects by treatment with zinc[J]. Guangdong Trace Elements Science, 2001(4): 46-48. DOI:10.3969/j.issn.1006-446X.2001.04.012 |
| [15] |
LI L, WANG H, JIN C, et al. Antibacterial activity and cytotoxicity of L-phenylalanine-oxidized starch-coordinated zinc (II)[J]. International Journal of Biological Macromolecules, 2019, 123: 133-139. DOI:10.1016/j.ijbiomac.2018.11.057 |
| [16] |
Poole K. At the nexus of antibiotics and metals:the impact of Cu and Zn on antibiotic activity and resistance[J]. Trends in Microbiology, 2017, 25(10): 820-832. DOI:10.1016/j.tim.2017.04.010 |
| [17] |
石浩, 王仁才, 王琰, 等. 黄芩抑菌物的提取工艺及抑菌稳定性[J]. 湖南农业大学学报(自然科学版), 2019, 45(2): 199-204. SHI H, WANG R C, WANG Y, et al. Extraction of antibacterial active substances from Scutellaria baicalensis and antimicrobial stability of the extract[J]. Journal of Hunan Agricultural University (Natural Sciences), 2019, 45(2): 199-204. |
| [18] |
陈四玉, 杨明川, 杨孜生, 等. 7种常用抗生素与清开灵配伍前后体外抑菌作用比较[J]. 时珍国医国药, 2017, 28(2): 280-282. CHEN S Y, YANG M C, YANG Z S, et al. Comparison of bacteriostasis of 7 kinds of antibiotica and the Qingkailing injection on staphylococcus aureus after the combination therapy in vitro[J]. Lishizhen Medicine and Materia Medica Research, 2017, 28(2): 280-282. |
| [19] |
叶晓林, 唐诗韵, 陈思敏, 等. 黄芩的最佳提取工艺及黄芩苷的细胞保护作用[J]. 华西药学杂志, 2017, 32(2): 186-188. YE X L, TANG S Y, CHEN S M, et al. Study of the optimal extraction process for extraction solution of Scutellaria baicalensis and cytoprotection of baicalin[J]. West China Journal of Pharmaceutical Sciences, 2017, 32(2): 186-188. |
| [20] |
陈佳, 江雅琴, 李伟, 等. 3种中药活性成分对耐多药鲍曼不动杆菌的体外抑菌作用[J]. 中国药业, 2018, 27(8): 12-14. CHEN J, JIANG Y Q, LI W, et al. Bacteriostasis effects of active ingrediens of 3 kinds of traditional Chinese medicine on multidrug resistant acinetobacter baumannii in vitro[J]. China Pharmaceuticals, 2018, 27(8): 12-14. DOI:10.3969/j.issn.1006-4931.2018.08.004 |
| [21] |
LIU H, PEI H, HAN Z, et al. The antimicrobial effects and synergistic antibacterial mechanism of the combination of ε-Polylysine and nisin against Bacillus subtilis[J]. Food Control, 2015, 47: 444-450. DOI:10.1016/j.foodcont.2014.07.050 |
| [22] |
FINDLEY K, GRICE E A. The skin microbiome:a focus on pathogens and their association with skin disease[J]. Plos Pathogens, 2014, 10(11): e1004436. DOI:10.1371/journal.ppat.1004436 |
| [23] |
SULZBERGER M, LSTER H, SATTLER M, et al. Inhibition of propionibacterium acnes associated biofilm formation by decanediol[J]. Journal of Dermatological Science, 2016, 83(2): 159-161. DOI:10.1016/j.jdermsci.2016.05.003 |
| [24] |
ROCHA M A, BAGATIN E. Skin barrier and microbiome in acne[J]. Archives of Dermatological Research, 2017, 310(3): 181-185. |
| [25] |
云宝仪, 周磊, 谢鲲鹏, 等. 黄芩素抑菌活性及其机制的初步研究[J]. 药学学报, 2012, 47(12): 1587-1592. YUN B Y, ZHOU L, XIE K P, et al. Antibacterial activity and mechanism of baicalein[J]. Acta Pharmaceutica Sinica, 2012, 47(12): 1587-1592. |
| [26] |
杜仲业.黄芩苷、黄芩素对金黄色葡萄球菌生物膜抑制作用的体外研究[D].南宁: 广西医科大学, 2012. DU Z Y. Inhibition of baicalin, baicalein on staphylococcus aureus biofilm in vitro[D]. Naning: Guangxi Medical University, 2012. |
| [27] |
VIMALAJ S, SUMANTRAN V N, CHATTERJEE S. MicroRNAs:Impaired vasculogenesis in metal induced teratogenicity[J]. Reproductive Toxicology, 2017, 70: 30-48. DOI:10.1016/j.reprotox.2017.02.014 |
| [28] |
SELVARAJ S, KRISHNASWAMY S, DEVASHYA V, et al. Flavonoid-metal ion complexes:a novel class of therapeutic agents[J]. Medicinal Research Reviews, 2014, 34(4): 677-702. DOI:10.1002/med.21301 |
 2020, Vol. 39
2020, Vol. 39