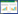文章信息
- 郭泰麟, 康廷国, 张慧
- GUO Tailin, KANG Tingguo, ZHANG hui
- 不同产地南北柴胡中柴胡皂苷的含量测定
- Content determination of saikosaponins in Bupleuri Radix from different habitats
- 天津中医药大学学报, 2020, 39(2): 221-225
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(2): 221-225
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.02.22
-
文章历史
收稿日期: 2019-12-02
柴胡为伞形科植物柴胡(Bupleurum chinense DC.)或狭叶柴胡(Bupleurum scorzonerifolium Willd.)的干燥根[1]。原名茈胡, 始载于《神农本草经》, 列为上品。具有疏散退热, 疏肝解郁, 升阳举气的功效。柴胡(B. chinense DC.)又名北柴胡, 狭叶柴胡(B. scorzonerifolium Willd.)又名南柴胡, 市场上两种柴胡均以商品名出现。柴胡皂苷为柴胡中的有效成分[2-7], 目前对于柴胡皂苷a和柴胡皂苷d的研究较多[8-13], 但是对于同时测定柴胡皂苷a、d、c、f 4种成分进行含量测定的报道很少。不同产地柴胡中其含量相差较大, 为了评价不同产地的南北柴胡质量的优劣, 文章采用紫外可见分光光度法测定不同产地南北柴胡中的总皂苷的含量, 同时使用HPLC-ELSD(高效液相色谱法和蒸发光检测器连用法)测定柴胡中柴胡皂苷a、d、c、f的含量, 旨在为柴胡的质量评价提供科学依据。
1 实验仪器和材料 1.1 仪器Agilent1260高效液相色谱仪, 安捷伦G6240B蒸发光散射检测器; 岛津UV-1750紫外检测器; KQ-250DE型数控超声波清洗器(昆山市超声仪器有限公司); LFP-800T高速多功能粉碎机; JD200-3千分之一天平(沈阳龙腾电子有限公司); Sartourius CP225D十万分之一天平。
1.2 材料 1.2.1 试剂和药品甲醇, 乙醇为色谱纯(Merck KGaA, Germany), 娃哈哈纯净水, 硫酸、乙醇、磷酸(购自天津市科密欧化学试剂有限公司)等均为分析纯; 对二甲氨基苯甲醛; 对照品柴胡皂苷a(批号:P03M9F50593)购自上海源叶生物科技有限公司, 柴胡皂苷d(批号:PS101397)、柴胡皂苷c(批号:PS000193)、柴胡皂苷f(批号:PS000195)均购自成都普斯生物科技股份有限公司。
1.2.2 样品的收集北柴胡共24批(编号1-24), 南柴胡共5批(编号25-29)。购自河北安国药材市场。经辽宁中医药大学中药鉴定教研室张慧教授鉴定为伞形科植物柴胡(Bupleurum chinense DC.)及狭叶柴胡(B.scorzonerifolium Willd.)的根, 样品信息见表 1-2。
取柴胡皂苷a、柴胡皂苷d、柴胡皂苷c、柴胡皂苷f适量, 精密称定, 分别置于5 mL棕色容量瓶中, 用甲醇溶解并定容。制成柴胡皂苷a 0.401 mg/mL、柴胡皂苷d 0.415 mg/mL、柴胡皂苷c 0.419 mg/mL、柴胡皂苷f 0.451 mg/mL的对照品溶液。
2.2 供试品的制备取本品粉末(过65目筛)0.5 g, 精密称定, 置具塞锥形瓶中, 向内加入含10%浓氨试液的甲醇液25 mL, 密塞, 30℃水温超声处理(功率250 W, 频率40 kHz)40 min, 滤过, 使用甲醇20 mL分2次洗涤容器及药渣, 洗液和滤液合并, 在60℃回收溶剂至干。残渣加甲醇溶解, 转移至25 mL容量瓶, 使用甲醇定容至容量瓶刻度线, 摇匀, 得供试品溶液。
2.3 总皂苷检测波长的确定精密吸取对照品柴胡皂苷d溶液500 μL置于10 mL具塞试管中, 向内加入浓度为1%的对二甲氨基苯甲醛乙醇溶液0.5 mL。在70℃的水浴中反应10 min, 放置至室温。再加入磷酸4 mL并在70℃的水浴中反应30 min。放置至室温。将甲醇为作为空白对照。对溶液进行扫描(400~800 nm), 溶液在536 nm处有最大的吸收峰, 所以将536 nm作为柴胡总皂苷的检测波长。
2.4 总皂苷的含量测定精密吸取6号样品500 μL置于10 mL具塞试管中, 向内加入浓度为1%的对二甲氨基苯甲醛乙醇溶液0.5 mL。在70℃的水浴中反应10 min, 放置至室温。再加入磷酸4 mL并在70℃的水浴中反应30 min。放置至室温。在536 nm下检测吸光度。
2.5 方法学考察 2.5.1 专属性实验取"2.2"项供试品溶液, 按"2.4"项方法操作, 同时以不加供试品的平行样为空白。在紫外可见分光光度计上进行扫描(400~800 nm), 结果显示, 阴性液在536 nm处无紫外吸收, 证明阴性液无干扰, 方法专属性良好。
2.5.2 线性范围考察精密吸取本节"2.1"项对照品溶液200、400、600、800、1 000 μL, 分别置于10 mL具塞试管中, 使用甲醇将试管内溶液定容至1 mL, 加入1%对二甲氨基苯甲醛的乙醇溶液0.5 mL, 在70℃的水浴中反应10 min, 放置至室温。再加入磷酸4 mL并在70℃的水浴中反应30 min。将甲醇为作为空白对照, 按紫外-可见分光光度测定法, 在536 nm处测定吸光度, 以吸光度值为纵坐标Y, 以质量(mg)为横坐标X, 绘制标准曲线。标准曲线Y=2.51X-0.048 6, r=0.999, 在质量为0.08~0.40 mg范围内呈良好的线性关系。
2.5.3 稳定性实验精密称取柴胡6号样品0.5 g, 按"2.2"项下方法制成供试品溶液, 按"2.4"项下方法分别于0、2、4、6、8、12 h间隔, 对柴胡总皂苷吸光度进行测定。柴胡总皂苷吸光度的RSD为1.10%, 结果显示, 在12 h内总皂苷的化学性质稳定。
2.5.4 精密度实验精密称取柴胡6号样品0.5 g, 按"2.2"项下方法制成供试品溶液, 按"2.4"项下方法, 测定柴胡总皂苷的吸光度, 连续测定6次, 计算吸光度的RSD值。RSD为1.01%, 结果说明仪器精密度良好。
2.5.5 重复性实验精密称取6份同样的柴胡6号样品各0.5 g, 分别按"2.2"项下方法制成供试品溶液, 按"2.4"项下方法, 测定柴胡总皂苷的吸光度, 计算总皂苷吸光度的平均值, 总皂苷吸光度平均值为0.522, RSD为1.50%, 说明该方法重复性良好。
2.5.6 回收率实验分别精密称取6份同样的柴胡6号样品各0.25 g, 分别加入柴胡皂苷d对照品, 按"2.2"项下方法制成供试品溶液, 按"2.4"项下方法, 测定吸光度, 计算回收率, 该方法总皂苷的回收率在99.2%~103%之间, RSD=1.42%, 符合相关规定。
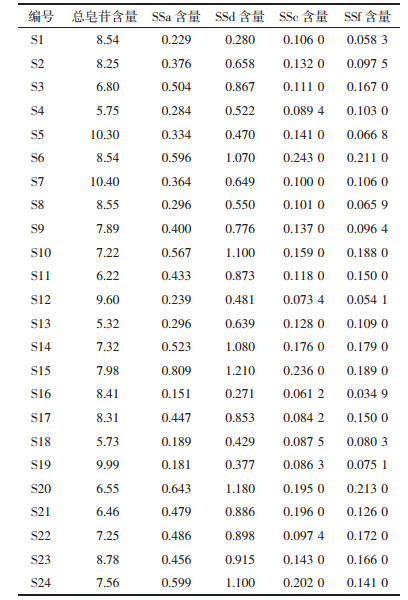
2.5.7 样品溶液的测定取24批北柴胡、5批南柴胡样品, 每个批次0.5 g, 按"2.2"项下方法制成供试品溶液, 按"2.4"项下方法, 计算各个批次南北柴胡中总皂苷的含量。结果见表 3、表 4。
TOSOH TSKgel ODS-100V色谱柱(4.6 mm×150 cm, 5 μm); 乙腈(A)和水(B)为流动相进行梯度洗脱:0~15 min:20%~30% A, 15 min~20 min:30%~35%A, 20 min~35min:35%~40% A, 35 min~45 min:40%~50% A. VWD检测波长为254 nm, 流速:1 mL/min, 柱温:25℃, 进样量:20 μL。蒸发器温度:30℃; 雾化器温度:40℃; 气体流速:1.6 mL/min。
3.2 样品溶液的制备取本品粉末(过65目筛)0.5 g, 精密称定, 置具塞锥形瓶中, 向内加入含10%浓氨试液的甲醇液25 mL, 密塞, 30℃水温超声处理(功率250 W, 频率40 kHz)40 min, 滤过, 使用甲醇20 mL分2次洗涤容器及药渣, 洗液和滤液合并, 在60℃旋蒸, 回收溶剂至干。残渣加甲醇溶解, 转移至5 mL棕色容量瓶, 使用甲醇定容至容量瓶刻度线, 摇匀, 过0.45 μm滤膜, 得供试品溶液。
3.3 方法学考察 3.3.1 专属性实验精密吸取20 μL的供试品溶液, 对照品溶液, 阴性溶液, 按照"3.1"项下方法, 进样测定。从图 1可知, 对照品和供试品溶液分离度均大于1.5, 互不干扰, 且阴性无干扰, 方法专属性良好。
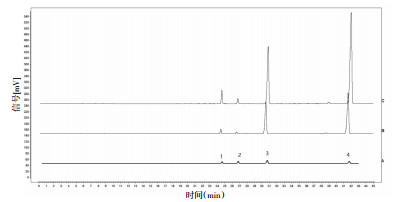
|
| A混合标准品溶液;B北柴胡样品溶液;C南柴胡样品溶液;柴胡皂苷c;2.柴胡皂苷f;3.柴胡皂苷a;4.柴胡皂苷d 图 1 典型色谱图 |
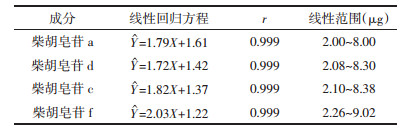
分别精密吸取柴胡皂苷a、柴胡皂苷d、柴胡皂苷c、柴胡皂苷f对照品溶液0.1、0.25、0.5、0.75、1 mL, 置于1 mL容量瓶中, 甲醇定容到刻度线, 精密吸取各个稀释之后的对照品溶液各20 μL, 注入液相中, 检测, 以对照品的进样量(μg)的自然对数值为横坐标X, 峰面积的自然对数值为纵坐标Y, 进行线性回归。结果见表 2。
3.3.3 稳定性实验精密称取柴胡6号样品0.5 g, 按"3.2"项下方法制成供试品溶液, 按"3.1"项下方法分别于0、2、4、6、8、12 h间隔, 对柴胡皂苷a、d、c、f含量进行测定。测得含量的RSD为1.04%、2.07%, 0.981%、2.61%, 结果显示, 在12 h内供试品的化学性质稳定。
3.3.4 精密度实验精密称取柴胡6号样品0.5 g, 按"3.2"项下方法制成供试品溶液, 按"3.1"项下方法, 测定柴胡皂苷a、d、c、f含量, 连续测定6次, 计算RSD值分别为0.993%、1.93%、0.722%、1.65%, 结果说明仪器精密度良好。
3.3.5 重复性实验精密称取6份同样的柴胡6号样品各0.5 g, 分别按"3.2"项下方法制成供试品溶液, 按"3.1"项下方法, 计算柴胡皂苷a、d、c、f含量, 计算出RSD分别为1.70%、2.10%、0.863%、2.14%, 说明该方法重复性良好。
3.3.6 回收率实验分别精密称取6份同样的柴胡6号样品各0.25 g, 分别加入适量柴胡皂苷a、d、c、f对照品, 按"3.2"项下方法制成供试品溶液, 按"3.1"项下方法, 测定柴胡皂苷a、d、c、f的含量, 计算回收率, 该方法计算出柴胡皂苷a、d、c、f含量的平均回收率分别为100%、100%、101%、101%, RSD分别为1.32%、1.19%、0.952%、0.851%, 符合相关规定。
3.4 样品的含量测定取24批北柴胡、5批南柴胡每个批次0.5g, 按"3.2"项下方法制成供试品溶液, 按照"3.1"项下方法测定, 计算各个批次南北柴胡中柴胡皂苷a、d、c、f的含量。结果见表 3、表 4。
3.5 相关性分析分别将南、北柴胡中总皂苷和4种单体成分输入进SPSS 24.0, 进行相关性分析。采用偏相关性分析方法, 观察P值。当P < 0.05时, 说明二者之间存在线性相关的关系; 当P>0.05时, 说明二者之间无线性相关的关系。
总皂苷与柴胡皂苷a、d、c、f含量之间P值分别为0.394、0.178、0.519、0.117。从结果中可以得知, 柴胡总皂苷的含量与4中单体皂苷之间不具有相关性, 所以不仅要测定总皂苷的含量, 还需要对柴胡皂苷a、d、c、f的含量进行测定, 才能对柴胡的质量进行评价。
4 讨论 4.1 指标成分的选择在2015版《中华人民共和国药典》一部中, 柴胡的含量测定指标性成分为柴胡皂苷a、柴胡皂苷d两种成分, 但是通过前期对不同产地南北柴胡指纹图谱的建立的研究中, 笔者发现柴胡皂苷c、柴胡皂苷f这两种成分含量也较高, 可以作为柴胡的指标性成分, 加之对照品易得且价格合理, 所以本实验选取这4种成分作为指标性成分进行含量测定。
4.2 含量测定的分析2015版《中华人民共和国药典》中要求指标性成分柴胡皂苷a、柴胡皂苷d的总量不得少于0.30%, 本实验中24批北柴胡和5批南柴胡中的两种柴胡皂苷总含量均远高于此, 其中北柴胡中含量最高的是来自四川阿坝州的北柴胡(S15), 柴胡皂苷a、d总含量达到了2.02%, 南柴胡中来自山东临沂产的南柴胡(S27)含量最高, 达到了2.29%。同时通过对不同产地的南北柴胡中柴胡皂苷a、d、c、f的含量进行检测发现, 4种成分含量均有明显差异, 表明多组分成分的测定对药材的质量评价是可行且有必要的。
| [1] |
国家药典委员会.中华人民共和国药典[S].北京: 中国医药科技出版社.2015: 280. Chinese Pharmacopoeia Commission. Chinese Pharmacopoeia[S]. Part 1, Beijing: China Medical Science Press, 2015: 280. |
| [2] |
高丽萍. 柴胡有效成分与药理作用探究[J]. 临床医药文献电子杂志, 2017, 4(4): 13853-13854. GAO L P. Study on the effective components and pharmacological activity of Bupleurum chinense DC[J]. Journal of Clinical Medical, 2017, 4(70): 13853-13854. |
| [3] |
陈文彬, 史毅, 马亚男, 等. 基于UPLC/Q-TOF-MS/MS分析鳖血柴胡皂苷类化学成分[J]. 现代食品科技, 2019, 35(7): 1-8. CHEN W B, SHI Y, MA Y N, et al. Analysis of the chemical constituents of Bupleurum Saponins in Bupleuri radix with Turtle Blood by UPLC/Q-TOF-MS/MS[J]. Modern Food Science and Technology, 2019, 35(7): 247-253. |
| [4] |
罗燕, 蒋益兰, 李勇敏, 等. 柴胡皂苷D对乳腺癌MDA-MB-231细胞增殖、周期及周期相关调控因子表达的影响[J]. 中国中西医结合杂志, 2019, 39(5): 572-576. LUO Y, JIANG Y L, LI Y M, et al. Effects of Saikosaponin D on the proliferation, cell cycle and the expressions of cyclins in breast cancer MDA-MB-231 cells[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2019, 39(5): 572-576. |
| [5] |
宋登鹏, 王雪芹, 王永慧, 等. 柴胡皂苷类化合物体内代谢途径及其代谢产物的研究进展[J]. 药物评价研究, 2019, 42(7): 1460-1465. SONG D P, WANG X Q, WANG Y H, et al. Research progress on metabolic pathways in vivo and their metabolites of saikosaponin[J]. Drug Evaluation Research, 2019, 42(7): 1460-1465. |
| [6] |
万方, 郭景珍, 李忻, 等. 柴胡皂苷D对肝纤维化大鼠TPA、PAI、MDA及NO影响的研究[J]. 中国药房, 2007, 18: 1847-1849. WAN F, GUO J Z, LI X, et al. Study on effects of Saikosaponin D on TPA, PAI, MDA and NO in rats with liver fibrosis[J]. China Pharmacy, 2007, 18(24): 1847-1849. |
| [7] |
张程亮, 兰露露, 任秀华, 等. 柴胡黄芩药对的基础研究探析[J]. 世界科学技术-中医药现代化, 2019, 21(1): 33-37. ZHANG C L, LAN L L, REN X H, et al. Discussion on herb pair "Radix Bupleuri and Radix Scutellariae"[J]. World Science and Technology/Modernization of Traditional Chinese Medicine and Materia Medica, 2019, 21(1): 33-37. |
| [8] |
吴福祥, 赵磊, 陶兰萍, 等. 高效液相色谱法测定定西市栽培北柴胡中柴胡皂苷a的含量[J]. 中国药房, 2007, 18: 440-441. WU F X, ZHAO L, TAO L P, et al. Determination of Saikoponin a in cultivated Bupleurum chinense DC. from Dingxi City by HPLC[J]. China Pharmacy, 2007, 18(6): 440-441. |
| [9] |
李卫斌, 胡宝平, 项炫萌. HPLC法测定不同产地柴胡中柴胡皂苷a、c、d的含量[J]. 甘肃医药, 2019, 38(1): 66-67, 86. LI W B, HU B P, XIANG X M. Content determination of Saikosaponin a、c、d in Bupleurum chinense DC. from different habitats by HPLC[J]. Gansu Medical Journal, 2019, 38(1): 66-67, 86. |
| [10] |
邵金鑫, 林龙飞, 刘宇灵, 等. 采用一测多评法同时测定人参-柴胡药对及其制剂中5种皂苷成分[J]. 中草药, 2018, 49(12): 2873-2877. SHAO J X, LIN L F, LIU Y L, et al. Determination of five saponins in Ginseng Radix et Rhizoma-Bupleuri Radix herb pair and its preparations by QAMS method[J]. Chinese Traditional and Herbal Drugs, 2018, 49(12): 2873-2877. |
| [11] |
蔡林, 吴雪, 石姗平. HPLC法同时测定柴葛清热颗粒中柴胡皂苷a、d和葛根素的含量[J]. 中国药房, 2012, 23: 2949-2950. CAI L, WU X, SHI S P. Content determination of Saikosaponin a, d and Puerarin in Chaige Qingre Granules by HPLC[J]. China Pharmacy, 2012, 23(31): 2949-2950. |
| [12] |
王瑞, 闫玺镁, 巨博雅, 等. 山西野生柴胡不同部位柴胡皂苷a、c、d的含量测定[J]. 中国医药科学, 2018, 27(10): 703-710. WANG R, YAN X M, JU B Y, et al. Simultaneous determination of Saikosaponin a, c and d in different parts of wild bupleurum from Shanxi Province[J]. Journal of Chinese Pharmaceutical Sciences, 2018, 27(10): 703-710. |
| [13] |
黄炜忠, 张清民. 一测多评分析方法下柴胡药材中柴胡皂苷a、c、d含量测定研究[J]. 四川中医, 2018, 36(1): 71-74. HUANG W Z, ZHANG Q M. Study on the determination of Saponin a, c and d in bupleurum by multi-evaluation method[J]. Journal of Sichuan of Traditional Chinese Medicine, 2018, 36(1): 7. |
 2020, Vol. 39
2020, Vol. 39