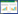文章信息
- 孙媛, 丁江生, 万近福
- SUN Yuan, DING Jiangsheng, WAN Jinfu
- 重黄温敏凝胶中重楼皂苷Ⅵ含量测定及体外释放研究
- Determination and release in vitro of polyphyllin VI in ChongHuang thermosensitive in situ gel
- 天津中医药大学学报, 2020, 39(2): 226-230
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(2): 226-230
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.02.23
-
文章历史
收稿日期: 2019-12-20
2. 云南白药集团创新研发中心, 昆明 650111;
3. 云南省中药和民族药新药创制企业重点实验室, 昆明 650111
2. Yunnan Baiyao Group Innovation and R&D Center, Kunming 650111, China;
3. Yunnan Province Company Key Laboratory for Traditional Chinese Medicine and Ethnic Drug of New Drug Creation, Kunming 650111, China
重楼为百合科植物云南重楼Paris polyphylla Smith var. yunnanensis(Franch.) Hand.-M.azz.或七叶一枝花Paris polyphylla Smith var. chinensis(Franch.) Hara的干燥根茎, 性凉, 味苦, 微寒, 有小毒, 归肝经。具有清热解毒、消炎消肿、凉肝熄风、利胆退黄、除风定痉、止血止痛、攻坚化积、截疟等功效。可补水、气、血, 通气血。现代药理研究表明, 重楼具有抗肿瘤、止血止痛、抗病毒, 抑菌消炎和免疫调节及肝脏保护等作用。现已分离并鉴定出50余种化合物, 主要为皂苷类成分, 约占化合物总含量的80%。重楼皂苷具有抗肿瘤、清热解毒、消炎止痛、止血等功效,是宫血宁等中成药的主要成分之一[1-6]。
重楼皂苷主要活性成分是甾体皂苷及苷元, 其中又分为薯蓣皂苷类化合物和偏诺皂苷类化合物。《中华人民共和国药典》规定了薯蓣皂苷类化合物重楼皂苷Ⅰ、Ⅱ和偏诺皂苷类化合物重楼皂苷Ⅵ、Ⅶ作为衡量重楼植物药用价值的指标。近年来的研究进一步表明偏诺类皂苷在药理活性上更具优势, 特别是其中的重楼皂苷Ⅵ有止血、祛痰、抑菌、镇静镇痛、抗早孕杀灭精子、抗肿细胞等作用, 临床用于治疗功能性子宫出血等。因此, 采用主要含偏诺类皂苷的重楼提取物进行组方, 制备重黄温敏凝胶。同时, 鉴于偏诺皂苷类化合物的4个主要指标成分中重楼皂苷Ⅵ含量最低, 也最易被干扰出现检测误差而影响重黄温敏凝胶的质量判断。因此, 本实验选择重楼皂苷Ⅵ作为检测指标, 采用高效液相色谱-蒸发光散射检测法(HPLC-ELSD)对重黄温敏凝胶的质量情况和体外溶蚀释放情况进行考察, 为该药制剂成型和体内释药研究提供理论依据[7-10]。
1 材料 1.1 仪器Agilent1100高效液相色谱仪(美国安捷伦); 2000ES ELSD检测器(美国奥泰公司); XWK-Ⅲ型空气发生器(天津市津分分析仪器制造有限公司); ZRS-8G智能溶出实验仪(天津大学无线电厂); THZ-82恒温振荡器(金坛市富华仪器有限公司); ETS——4fuzzy磁力搅拌器(德国IKA); AR2130型电子天平(美国Capintec公司); Delta320 PH计(梅特勒托利多); KH3200E黏度测定仪(昆山禾创超声有限公司); KH3200E超声波清洗仪(昆山禾创超声有限公司); DZKW-S-6电热恒温水浴锅(北京市永光明医疗)。
1.2 试剂和药品重楼皂苷Ⅵ对照品(中国食品药品检定研究院, 批号111592-201203);重黄温敏凝胶(自制); 泊洛沙姆407(Poloxamer 407, 德国BASF公司); 泊洛沙姆188(Poloxamer 188, 德国BASF公司); 丙二醇(国药试剂集团); 乙腈(色谱纯, 默克股份); 超纯水; 其他试剂为分析醇。
2 方法与结果 2.1 重黄温敏凝胶的制备精密称取处方量的重楼等提取物, 加入丙二醇分散, 再在连续搅拌下依次加入水、苯扎溴铵和泊洛沙姆407、泊洛沙姆188, 搅拌直至完全溶解, 加水定重, 放置4℃冷藏24 h, 即得。
2.2 含量测定 2.2.1 色谱条件CAPCELL PAK C8色谱柱(5 μm, 4.6 mm×250 mm, 资生堂), 乙腈(A)-水(B)为流动相, 梯度洗脱(0~15 min, 25%~35% A; 15~35 min, 35%~40% A; 35~40 min, 40%~60% A), 柱温25℃, 流速1.0 mL/min, 进样量10 μL, 漂移管温度92℃, 载气流速2.9 L/min, 增益2, 撞击器关。
2.2.2 对照品溶液制备精密称取重楼皂苷Ⅵ对照品21.5 mg, 置50 mL容量瓶中, 加甲醇溶解并定容至刻度, 超声(150 W, 40 kHz)5 min, 摇匀, 即得。
2.2.3 样品溶液制备精密称取2.0 g重黄温敏凝胶, 置于10 mL容量瓶中, 加甲醇8mL, 超声20 min, 放冷, 甲醇定容至刻度, 0.45 μm微孔滤膜过滤, 即得。
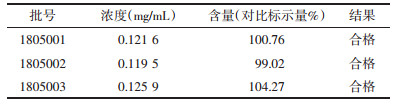
2.2.4 专属性实验分别将重楼皂苷Ⅵ对照品溶液、样品溶液、空白溶液以及样品加对照品溶液按上述色谱条件进行测定, 记录色谱图。此条件下重楼皂苷Ⅵ分离良好, 无干扰。见图 1。
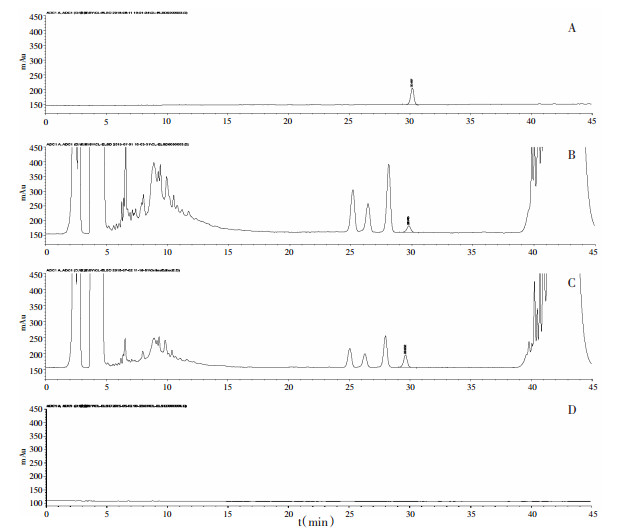
|
| A:对照品溶液B:样品溶液C:对照及样品混合溶液D:空白溶液 图 1 专属性实验HPLC图 |
分别精密量取2.2.2项下重楼皂苷Ⅵ对照品溶液1.0、2.0、4.0、6.0、8.0、10.0 mL置于10 mL容量瓶中, 加甲醇定容, 摇匀, 0.45 μm滤膜过滤, 按2.2.1项下色谱条件测定, 记录峰面积。以峰面积的常数对数值(lgA)对浓度的常数对数值(lgC)进行线性回归, 得回归方程为:lgA=1.796 9 lgC+4.398 9(r2=0.999 9), 0.430 0~4.300 0 mg范围内, 线性关系良好。以信噪比(S/N)约为10的重楼皂苷Ⅵ对照品溶液为定量限:0.054 0 mg。
2.2.6 精密度实验精密量取2.2.5项下对照品溶液, 按上述色谱条件连续进样6次, 记录峰面积, 计算重楼皂苷Ⅵ的峰面积的RSD为1.51%(n=6), 表明精密度良好。
2.2.7 稳定性实验取同一份样品溶液, 分别于0、2、4、8、12、24 h按上述色谱条件测定, 记录峰面积, 计算重楼皂苷Ⅵ的峰面积的RSD为3.08%(n=6), 表明样品溶液在24 h内稳定。
2.2.8 重复性实验精密称取2.0 g重黄温敏凝胶6份, 按2.2.3项下要求, 配制样品溶液, 按上述色谱条件测定, 记录峰面积, 计算重楼皂苷Ⅵ的含量, RSD为2.70%(n=6), 表明重复性良好。
2.2.9 回收率实验精密称取已知含量的重黄温敏凝胶, 分别按含量的50%、100%、150%精密加入重楼皂苷Ⅵ对照品, 按2.2.3项制备样品溶液, 每个浓度平行制备3份, 按上述色谱条件测定, 记录峰面积, 计算回收率。见表 1。
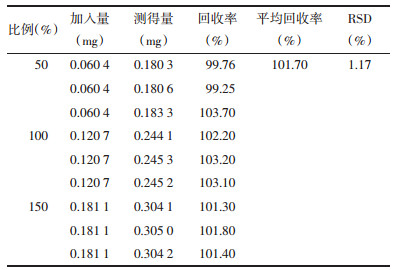
分别精密称取3批重黄温敏凝胶, 按2.2.3项制备样品溶液, 每个样品平行制备2份, 按上述色谱条件测定, 记录峰面积, 计算含量, 为标示量的90%~110%。见表 2。
采用试管倒置法来判断凝胶的相变温度:平行称取6份重黄温敏凝胶于试管中, 将试管置于水浴中缓慢升温, 于分别于(31.0±0.1)℃、(32.0±0.1)℃、(35.0±0.1)℃、(37.0±0.1)℃、(39.0±0.1)℃、(41.0±0.1)℃、(43.0±0.1)℃和(45.0±0.1)℃测定胶凝时间, 每间隔30 s倾斜一次试管, 直至凝固, 记录时间。见图 2。
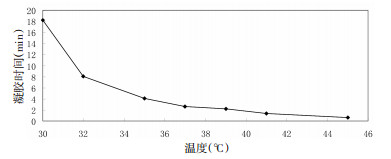
|
| 图 2 胶凝曲线图(n=6) |
证明此温敏凝胶从(35.0±0.1)℃起, 胶凝时间明显加快, 在体温时(37±0.1)℃仅需(2.90±0.58) min即可成胶。
2.4 体外释放考察取25 mL具塞试管, 精密称取5.0 g重黄温敏凝胶于试管内, 置于(37±0.1)℃恒温水浴振荡器中, 待完全凝胶后, 缓缓加入已脱气的pH4.0的磷酸盐缓冲液5.0 mL, 平行制备6份样品, 放入(37.0±0.1)℃恒温水浴振荡器中, 振荡频率为120 r/min, 于0.5、1、2、3、4、6、8、12、24、30、36、48 h取样, 取出全部溶蚀介质, 称重后将试管放回恒温水浴振荡器中胶凝, 缓慢补加相同温度的空白溶蚀介质5.0 mL, 重复操作, 直至剩余凝胶质量不足初始重量的10%。相邻时间点间质量差异即为重黄温敏凝胶溶蚀量。每个时间点取样后, 按相应比例加入甲醇稀释至规定体积, 0.45 μm微孔滤膜过滤, 采用上述色谱条件进行检测, 记录峰面积, 计算重楼皂苷Ⅵ的累积释放量。并对各时间点的药物累积释放率进行探讨。见表 3和图 3。
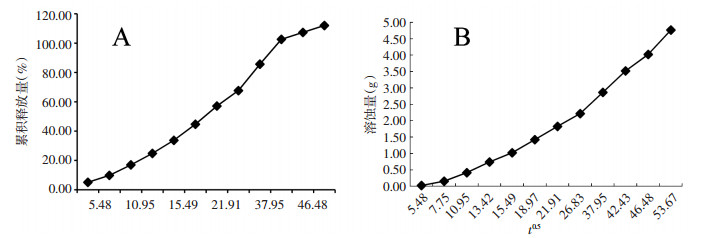
|
| 图 3 重黄温敏凝胶pH4.0缓冲液中溶蚀释放情况 |
结果显示, 重黄温敏凝胶溶蚀量和重楼皂苷Ⅵ体外释放均符合Higuchi方程, 12 h释放67.63%, 24 h释放85.65%。表明重黄温敏凝胶在人体阴道微环境中释药, 基质溶蚀是限速条件。
3 讨论2015版《中华人民共和国药典》重楼项下的紫外检测波长为203 nm, 重黄温敏凝胶在该波长下测定时重楼皂苷Ⅵ干扰明显, 无法达到预期检测效果。本研究采用HPLC-ELSD检测, 不仅药典项下的4种重楼皂苷实现良好的分离检测, 还将偏诺重楼皂苷Ⅵ、重楼皂苷Ⅶ、重楼皂苷PA和重楼皂苷H进行了较好的分离, 为进一步研究重楼偏诺皂苷提供了技术支持。
重黄温敏凝胶的体外溶蚀释放符合Higuchi方程, 且在12 h释放可达67.63%, 不仅满足用药需求, 还能减少药物给药次数, 保证药效的同时, 增加患者的用药顺应性, 为重黄温敏凝胶制剂推广提供依据。
本实验主要对药物从重黄温敏凝胶制剂中释放的情况进行了研究, 对于释放后在人体阴道中的吸收利用情况还需进一步探讨。
重黄温敏凝胶需在体内以半固体形态存在, 且随着处方中黏性物质比例的增加, 凝胶强度进一步加大, 药物释放较低温时的液体形态发生明显改变。因此, 体外溶蚀释放研究对药物的利用和疗效有指导意义。
| [1] |
何含杰, 章怀云, 陈丽莉, 等. 重楼皂苷的药理作用和临床应用研究进展[J]. 中药材, 2014, 37(3): 527-530. HE H J, ZHANG H Y, CHEN L L, et al. Research progress on pharmacological action and clinical application of Paris Polyphylla saponins[J]. Journal of Chinese Medicinal Materials, 2014, 37(3): 527-530. |
| [2] |
王跃虎, 牛红梅, 张兆云, 等. 重楼属植物的药用价值及其化学物质基础[J]. 中国中药杂志, 2015, 40(5): 833-839. WANG Y H, NIU H M, ZHANG Z Y, et al. Medicinal value and chemical basis of Paris[J]. China Journal of Chinese Materia Medica, 2015, 40(5): 833-839. |
| [3] |
何明生, 李秀. 重楼药理作用的研究进展[J]. 世界中医药, 2012, 7(6): 579-582. HE M S, LI X. Research progress on pharmacological action of Paris Polyphylla[J]. World Chinese Medicine, 2012, 7(6): 579-582. |
| [4] |
Yong C S, OH Y K, JUNG S H, et al. Preparation of ibuprofen-loaded liquid suppository using eutecticmixture system with menthol[J]. Eur J Pharm Sci, 2004, 23(51): 347-350. |
| [5] |
熊伟, 陈思如, 修光辉, 等. 中药重楼的抗炎作用机制研究进展[J]. 云南中医中药杂志, 2018, 39(1): 92-94. XIONG W, CHEN S R, XIU G H, et al. Research progress on anti-inflammatory mechanism of Rhizoma Paridis[J]. Yunnan Journal of Traditional Chinese Medicine and Materia Medica, 2018, 39(1): 92-94. DOI:10.3969/j.issn.1007-2349.2018.01.044 |
| [6] |
涂渝娇, 蒋蕾, 杨亚玲. 超临界CO2萃取重楼偏诺皂苷的工艺研究[J]. 昆明理工大学学报(自然科学), 2018, 43(4): 98-104. TU Y J, JIANG L, YANG Y L. Study on supercritical CO2 extraction of vinoside from Rhizoma Paridis[J]. Journal of the Kunming University of Science and Technology, 2018, 43(4): 98-104. |
| [7] |
国家药典委员会.中华人民共和国药典[M].北京: 中国医药科技出版社, 2015: 260. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[M]. Beijing: China Medical Science and Technology Publishing House, 2015: 260. |
| [8] |
陈锡琨. HPLC测定宫血宁胶囊中重楼皂苷Ⅰ、Ⅱ、Ⅵ及Ⅶ的含量[J]. 中国现代应用药学, 2013, 30(12): 1346-1349. CHEN X K. Determination of Paris Polyphylla Saponin Ⅰ, Ⅱ, Ⅵ and Ⅶ in gongxuening capsule by HPLC[J]. Chinese Journal of Modern Applied Pharmacy, 2013, 30(12): 1346-1349. |
| [9] |
刘佳, 杨亚利, 张鹏, 等. 4种重楼不同部位4种重楼皂苷含量的分析[J]. 中国实验方剂学杂志, 2016, 22(16): 44-48. LIU J, YANG Y L, ZHANG P, et al. Analysis of Saponin contents in different parts of 4 Paris species[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2016, 22(16): 44-48. |
| [10] |
许愫云, 杨欣怡, 贾梅琳, 等. 近5年宫血宁胶囊在妇科疾病的应用概况[J]. 世界最新医学信息文摘, 2017, 17(54): 77-79. XU S Y, YANG X Y, JIA M L, et al. Application of gongxuening capsule in gynecological diseases in recent 5 years[J]. Dkgest of the World Latest Medical Information, 2017, 17(54): 77-79. |
 2020, Vol. 39
2020, Vol. 39