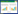文章信息
- 何冰, 高雁鸿, 孙华, 王俊玲
- HE Bing, GAO Yanhong, SUN Hua, WANG Junling
- 荷叶碱对非酒精性脂肪肝模型小鼠肝组织中SREBP信号通路的影响
- Effects of nuciferine on non alcoholic fatty liver disease and the relative mechanisms based on SREBP signaling pathway
- 天津中医药大学学报, 2020, 39(3): 320-323
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(3): 320-323
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.03.16
-
文章历史
收稿日期: 2020-01-29
非酒精性脂肪肝(NAFLD)是一种以肝脏中脂肪过度堆积引发肝细胞变性为特征的慢性肝病, 且患者无过量饮酒史[1]。NAFLD可引发许多疾病如肝硬化[2]、冠心病[3]、糖尿病[4]等。近些年, NAFLD在中国的发病率持续增高[5]。荷叶碱是中药荷叶中的主要成分, 对肥胖及胰岛素抵抗有一定的疗效[6-7]。本实验通过蛋氨酸和胱氨酸联合缺乏饲料建立NAFLD小鼠模型, 考察荷叶碱对NAFLD的治疗作用, 并检测小鼠肝组织中胆固醇调节元件结合蛋白(SREBP)相关通路mRNA表达, 进一步探讨荷叶碱对NAFLD的作用机制。
1 材料与方法 1.1 实验动物成年雄性C57BL/6小鼠60只, 体质量(20±2) g, 由北京华阜康生物科技有限公司提供。动物合格证号:1103221800000880。小鼠饲养于SPF级清洁环境中, 标准饲料喂养, 自由进食, 室温(22±2)℃。
1.2 主要试剂及仪器荷叶碱标准品(C19H21NO2, 纯度≥98%)购自维克奇生物科技有限公司; 二甲双胍、油红O染色试剂盒购自索莱宝生物科技有限公司; 蛋氨酸和胱氨酸联合缺乏饲料购自斯贝福生物技术有限公司; 血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆固醇(TC)试剂盒、三酰甘油(TG)试剂盒购自南京建成生物科技有限公司; 核糖核酸(RNA)提取、反转录、扩增试剂盒购自天根生物科技有限公司; 多功能读扳机(Thermo); 光学显微镜(Nikon ECLIPSE TS100);荧光定量聚合酶链式反应(PCR)仪(Bio-RAD iQTM5)。
1.3 NAFLD模型建立及分组NAFLD模型建立采用蛋氨酸和胱氨酸联合缺乏饲料喂养12周[7]。将60只小鼠随机分为6组:正常组、模型组、二甲双胍组、荷叶碱低剂量组、荷叶碱中剂量组和荷叶碱高剂量组, 每组10只。除正常组每天灌胃生理盐水外, 其余各组均建立NAFLD模型。造模4周后, 模型组及荷叶碱低、中、高剂量组每天分别灌胃生理盐水、荷叶碱7.5、15、30 mg/kg, 连续灌胃8周, 二甲双胍组每天灌胃二甲双胍90 mg/kg, 连续灌胃8周。
1.4 观察指标及检测方法 1.4.1 小鼠血脂及肝功能造模给药后收集各组小鼠血清, 检测各组小鼠血清中ALT、AST、TC及TG含量。
1.4.2 小鼠肝组织染色造模给药后, 收集各组小鼠肝组织, 用福尔马林溶液固定, 对各组小鼠肝组织进行苏木精-伊红(HE)染色观察肝组织病理学变化。同时对各组小鼠肝组织进行油红O染色观察肝组织中脂质含量。
1.4.3 荧光定量PCR检测造模给药后, 提取各组小鼠肝组织中总RNA, 反转录合成cDNA, 采用SYBR Green Real Time RT-PCR试剂盒进行扩增, 检测各组小鼠肝组织中SREBP通路相关基因SREBF-1、乙酰CoA羧化酶(ACC)、ATP-柠檬酸裂解酶(ACLY)及脂肪酸合酶(FASN)基因表达, 采用β-肌动蛋白(β-actin)为内参, 具体引物序列见表 1。
采用SPSS 23.0统计软件进行统计分析, 计量资料用均数±标准差(x±s)表示, 多组间比较采用单因素方差分析, 组间两两比较采用LSD法, P < 0.05为差异有统计学意义。
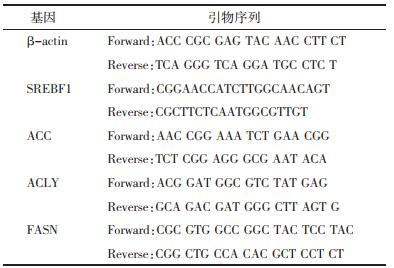
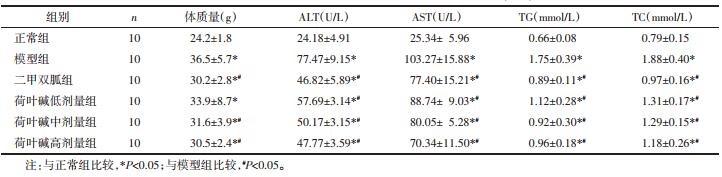
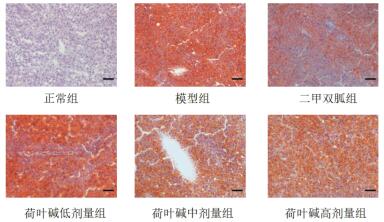
2 结果 2.1 荷叶碱对NAFLD模型小鼠的治疗作用造模给药结束后, 与正常组相比, 模型组、二甲双胍组、荷叶碱低、中、高剂量组小鼠体质量显著增高(P < 0.05), 血清中ALT、AST、TG及TC水平显著升高(P < 0.05);与模型组相比, 二甲双胍组、荷叶碱中、高剂量组小鼠体质量显著降低(P < 0.05);此外与模型组相比, 二甲双胍组、荷叶碱低、中、高剂量组血清中ALT、AST、TG及TC水平显著降低(P < 0.05), 见表 2。通过HE染色结果发现, 模型组小鼠肝组织中肝细胞出现明显脂肪变性, 二甲双胍及荷叶碱各剂量组对NAFLD模型小鼠肝组织中脂肪变性都有所缓解, 见图 1。此外油红O染色同样表明与正常组相比, 模型组小鼠肝组织中脂质增多, 与模型组相比, 二甲双胍及荷叶碱各剂量组小鼠肝脏中脂质有所减少, 见图 2。
|
| 图 1 造模给药后各组小鼠肝组织HE染色(n=6,200×) |
|
| 图 2 造模给药后各组小鼠肝组织油红O染色(n=6,200×) |
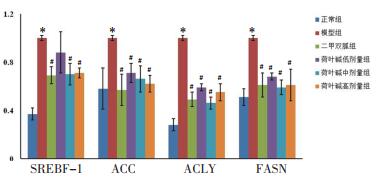
与正常组相比, 模型组小鼠肝组织中SREBF-1、ACC、ACLY及FASN mRNA表达显著上调(P < 0.05);与模型组相比, 二甲双胍组、荷叶碱中、高剂量组小鼠肝脏中SREBF-1、ACC、ACLY及FASN mRNA表达显著下调(P < 0.05);此外与模型组相比, 荷叶碱低剂量组小鼠肝组织中ACC、ACLY及FASN mRNA表达显著下调(P < 0.05), 见图 3。
|
| 注:与正常组相比, *P < 0.05;与模型组相比, #P<0.05。 图 3 造模给药后各组小鼠肝组织中SREBP通路相关mRNA表达水平(x±s,n=6) |
本研究通过蛋氨酸和胱氨酸联合缺乏饲料建立NAFLD小鼠模型, 蛋氨酸和胱氨酸联合缺乏饲料是一种常用的建立NAFLD模型的饲料, 经过12周的蛋氨酸和胱氨酸联合缺乏饲料饲养, 模型组小鼠体质量、血脂及血清肝功能相关生化指标显著升高, 模型组小鼠肝细胞中出现明显的脂肪变性及脂质过度堆积, 这些结果与NAFLD的模型判定标准一致, 提示造模成功[8]。荷叶苦、平, 归肝、脾、胃经, 始载于唐朝孟诜《食疗本草》, 历版《中国药典》亦均有收载, 具有清热解暑、升发清阳、凉血止血之功效。作为一味传统中药, 荷叶在减肥降脂方面的保健和治疗效果突出[9-10], 现代研究证明其主要成分荷叶碱能通过调节能量代谢紊乱及机体脂质代谢, 并缓解脂质过氧化损伤和氧化应激, 从而抑制脂肪细胞分化和胰脂肪酶活性, 其中抑制作用最强的是苄基异喹啉生物碱, 在抑制脂肪积累的同时, 还能有效减少机体对脂肪吸收[11-12]。本实验结果显示, 荷叶碱可显著降低NAFLD模型小鼠体质量、血脂及肝组织中脂肪变性及脂质堆积, 此外荷叶碱还可显著缓解NAFLD小鼠血清肝生化指标水平, 这些结果表明荷叶碱对NAFLD具有良好的治疗作用。
SREBP是调控细胞脂肪合成的重要转录因子[13-14]。当细胞摄入脂质增多时, SREBP发生裂解活化进入细胞核, 调控脂肪代谢相关酶如ACLY、ACC及FASN表达, 促进细胞脂质合成[15]。其中ACLY可将细胞中的柠檬酸转化为乙酰辅酶A, 乙酰辅酶A在ACC催化下进行羧化, 进而形成丙二酰辅酶A, 丙二酰辅酶A在FASN作用下最终转化为脂肪酸。NAFLD小鼠肝细胞中SREBP及其下游因子表达显著升高[16], 降低SREBP相关通路因子表达可缓解NAFLD[17]。本研究结果表明荷叶碱能显著下调NAFLD模型小鼠SREBP相关通路mRNA表达, 提示荷叶碱可能是通过抑制肝组织中SREBP信号通路激活发挥治疗NAFLD的作用机制。
此外, 本研究选用二甲双胍作为阳性对照, 且荷叶碱中剂量及高剂量组中相关NAFLD疗效指标与二甲双胍组无明显差异, 但是荷叶碱是否可以在治疗NAFLD中作为二甲双胍的替代药物尚需要临床进行验证。
| [1] |
CHALASANI N, YOUNOSSI Z, LAVINE J E, et al. The diagnosis and management of non-alcoholic fatty liver disease:practice guideline by the American Gastroenterological Association, American Association for the study of Liver Diseases, and American College of Gastroenterology[J]. Gastroenterology, 2012, 142(7): 1592-1609. DOI:10.1053/j.gastro.2012.04.001 |
| [2] |
POWELL E E, JONSSON J R, CLOUSTON A D. Metabolic factors and non-alcoholic fatty liver disease as co-factors in other liver diseases[J]. Digestive Diseases, 2010, 28(1): 186-191. DOI:10.1159/000282084 |
| [3] |
BNATIA L S, CURZEN N P, CALDER P C, et al. Non-alcoholic fatty liver disease:a new and important cardiovascular risk factor[J]. European Heart Journal, 2012, 33(10): 1190-1200. DOI:10.1093/eurheartj/ehr453 |
| [4] |
SAMUEL V T, LIU Z X, QU X, et al. Mechanism of hepatic insulin resistance in non-alcoholic fatty liver disease[J]. Journal of Biological Chemistry, 2004, 279(31): 32345-32353. DOI:10.1074/jbc.M313478200 |
| [5] |
Araújo A R, ROSSO N, BEDOGNI G, et al. Global epidemiology of non-alcoholic fatty liver disease/non-alcoholic steatohepatitis:What we need in the future[J]. Liver International, 2018, 38(S1): 47-51. |
| [6] |
蒲鹏, 张丽静, 雷森. 荷叶碱对胰岛素抵抗小鼠的干预研究[J]. 职业与健康, 2015, 31(10): 1317-1320. PU P, ZHANG L J, LEI S. Intervention study of nuciferine on mice with insulin resistance[J]. Occup and Health, 2015, 31(10): 1317-1320. |
| [7] |
范婷婷, 法鲁克, 方芳, 等. 荷叶总生物碱降脂减肥作用的体内外试验[J]. 浙江大学学报, 2013, 39(2): 141-148. FAN T T, FAROUK, FANG F, et al. Lotus leaf total alkaloid lipid-lowering effect reducing weight of test in vivo and in vitro[J]. Journal of Zhejiang University, 2013, 39(2): 141-148. DOI:10.3785/j.issn.1008-9292.2013.02.003 |
| [8] |
欧强, 杨华, 赵亚娟, 等. 蛋氨酸-胆碱缺乏饮食诱导的大、小鼠非酒精性脂肪性肝病模型的特点及差异[J]. 肝脏, 2017, 22(10): 933-937. OU Q, YANG H, ZHAO Y J, et al. Characteristics and differences of non-alcoholic fatty liver disease models induced by methionine-choline deficiency diet in rats and mice[J]. Chinese Hepatology, 2017, 22(10): 933-937. DOI:10.3969/j.issn.1008-1704.2017.10.022 |
| [9] |
王福刚, 曹娟, 刘斌, 等. 荷叶的化学成分及其药理作用研究进展[J]. 时珍国医国药, 2010, 21(9): 2339-2340. WANG F G, CAO J, LIU B, et al. Research progress on chemical constituents and pharmacological effects of lotus leaves[J]. Li shizhen Medicine and Materia Medica Research, 2010, 21(9): 2339-2340. DOI:10.3969/j.issn.1008-0805.2010.09.099 |
| [10] |
胡榴燕. 荷叶的功能成分提取测定及药用研究进展[J]. 浙江中医杂志, 2006, 41(11): 678-679. HU L Y. Advances in extraction and determination of functional ingredients from lotus leaves and its medicinal research[J]. Zhejiang Journal of Traditional Chinese Medicine, 2006, 41(11): 678-679. DOI:10.3969/j.issn.0411-8421.2006.11.042 |
| [11] |
JONG H A, EUN S K, CHUL L, et al. Chemical constituents from Nelumbo nucifera leaves and their anti-obesity effects[J]. Bioorg Med Chem Lett, 2013, 23(12): 3604-3608. DOI:10.1016/j.bmcl.2013.04.013 |
| [12] |
程婷婷, 原新博, 惠小涵, 等. 荷叶生物碱成分及其调脂机制研究进展[J]. 中草药, 2019, 50(8): 1998-2003. CHENG T T, YUAN X B, HUI X H, et al. Research progress of alkaloids from lotus leaf and its lipid regulating mechanism[J]. Chinese Herbal Medicine, 2019, 50(8): 1998-2003. |
| [13] |
GOLDSTEIN J L, BROWN M S. A century of cholesterol and coronaries:from plaques to genes to statins[J]. Cell, 2015, 161(1): 161-172. DOI:10.1016/j.cell.2015.01.036 |
| [14] |
GOLDSTEIN J L L, DEBOSE-BOYD R A, BROWN M S. Protein sensors for membrane sterols[J]. Cell, 2006, 124(1): 35-46. DOI:10.1016/j.cell.2005.12.022 |
| [15] |
HAO J, ZHU L, ZHAO S, et al. PTEN ameliorates high glucose-induced lipid deposits through regulating SREBP-1/FASN/ACC pathway in renal proximal tubular cells[J]. Experimental Cell Research, 2011, 317(11): 1629-1639. DOI:10.1016/j.yexcr.2011.02.003 |
| [16] |
艾正琳, 陈东风. SREBP-1c在大鼠非酒精性脂肪性肝病中的表达及意义[J]. 第三军医大学学报, 2006, 28(10): 1063-1065. AI Z L, CHEN D F. Expression and significance of sterol regulatory elementbinding protein-1c in nonal-coholic fatty liver disease in rats[J]. Journal of Third Military Medical University, 2006, 28(10): 1063-1065. DOI:10.3321/j.issn:1000-5404.2006.10.022 |
| [17] |
黄凯文, 吴菲, 李常青, 等. 鸡骨草对非酒精性脂肪肝大鼠肝组织SREBP-1c表达的影响[J]. 中药材, 2015, 38(11): 2368-2371. HUANG K W, WU F, LI C Q, et al. Effects of cortex chinensis on SREBP-1c expression in liver tissues of rats with nonalcoholic fatty liver disease[J]. Journal of Chinese Medicinal Materials, 2015, 38(11): 2368-2371. |
 2020, Vol. 39
2020, Vol. 39