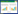文章信息
- 杨洋, 王志强, 任丽丽, 许秋双, 曹丽娟, 李天祥
- YANG Yang, WANG Zhiqiang, REN Lili, XU Qiushuang, CAO Lijuan, LI Tianxiang
- 不同产地黄芩药材中主要药效成分含量变化规律研究
- Study on the change law of major pharmacological components in Scutellariae Radix membranaceus from different habitats
- 天津中医药大学学报, 2020, 39(3): 324-329
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(3): 324-329
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.03.17
-
文章历史
收稿日期: 2020-01-25
2. 天津盛实百草药业有限公司, 天津 300301
2. Tianjin Shengshibai Herbal Medicine Co. Ltd., Tianjin 300301, China
黄芩为唇形科黄芩属植物黄芩(Scutellaria baicalensis Georgi)的干燥根, 始载于《神农本草经》, 味苦、性寒, 具有清热燥湿、泻火解毒、止血、安胎的功效, 为常用大宗中药[1]。多用于治疗湿瘟、暑湿等证[2]。现代研究表明, 黄芩中黄酮类物质具有广谱生物活性, 在抗肿瘤、抗氧化、抗病毒等方面疗效确切[3-6]。
目前, 黄芩野生品和栽培品广泛流通于市场, 产地不同、规格不同, 药材质量各异。因此, 以黄芩药材《中华人民共和国药典》(简称药典)指标成分黄芩苷、浸出物[7]及其他主要药效成分汉黄芩苷、黄芩素为考察指标[8-10], 进行系统质量评价, 拟阐明不同产地黄芩药效成分整体质量特征, 为其临床运用提供参考。
1 材料与仪器试剂 1.1 材料共收集7个产区13个产地及样地黄芩药材样品(样品信息见表 1), 经天津中医药大学李天祥教授鉴定为唇形科黄芩属植物黄芩Scutel-laria baicalensis Georgi的干燥根, 55℃烘干至恒重, 粉碎, 过4号筛, 备用。
高效液相色谱仪(配置B05型高压梯度泵、UV 1000型全波段可编程紫外可见检测器、CSChromPlus色谱工作站、美国Alltech科技有限公司), UV-6100PCS型紫外可见分光光度计(上海美普达有限公司), YHG-600-BS-II型远红外快速干燥箱(上海贺德实验设备有限公司), DFZ-6050型真空干燥箱(上海新苗医疗器械制造有限公司), 旋转蒸发仪(郑州长城科工贸有限公司), SB25-12DT超声波清洗机(宁波新芝生物科技股份有限公司), 调温电热套(山东省鄄城永兴仪器厂), 二列四孔智能水浴锅(河南省巩义市仪器有限责任公司), FA 2104电子天平(上海舜宇恒平科技仪器有限公司), 移液枪(赛默飞世尔科技有限公司)。
对照品黄芩苷(MUST-11101403, 北京鼎国昌盛技术有限公司), 黄芩素(MUST-16031618, 北京鼎国昌盛技术有限公司), 汉黄芩苷(MUST-16111611, 北京鼎国昌盛技术有限公司), 甲酸、磷酸(色谱纯, 天津市光复精细化工研究所), 甲醇、乙腈(色谱纯, 天津市康科德科技有限公司), 95%乙醇、无水乙醇(分析纯, 天津市江天化工技术有限公司), 娃哈哈纯净水(天津娃哈哈食品有限公司)。
2 实验方法 2.1 黄芩浸出物的提取与测定精密称取供试品2 g, 精密加入稀乙醇50 mL, 密塞, 称质量, 静置1 h后, 加热回流1 h, 待冷却后, 称质量, 补质量, 摇匀, 过滤。精密量取滤液25 mL, 烘至恒重, 称质量。以干燥品计算供试品中醇溶性浸出物的含量(%)。
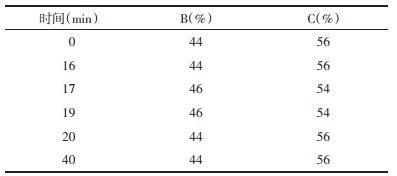
2.2 黄芩苷的提取与含量测定 2.2.1 色谱条件采用Agilent Zorbax SB-C18色谱柱; 甲醇(B):0.2%的磷酸水(C)为流动相; 检测波长为280 nm, 流速1.0 mL/min; 柱温25℃; 进样量为10 μL。梯度洗脱顺序见表 2。
精密称取黄芩苷对照品1.5 mg于25 mL容量瓶中, 甲醇溶解并定容, 得0.06 mg/mL的黄芩苷对照品储备溶液。
2.2.3 供试品溶液的制备取本品粉末约0.3 g, 加70%乙醇40 mL, 加热回流3 h, 待冷却后, 过滤, 滤液置100 mL容量瓶中, 70%乙醇定容。精密量取1 mL, 置10 mL容量瓶中, 甲醇定容, 即得供试品溶液。
2.2.4 线性关系考察精密移取对照品溶液适量, 分别制备含黄芩苷浓度为15、30、45、75、90 μg/mL的对照品溶液, 按"2.2.1 "项下进行分析。以对照品进样浓度(X)为横坐标, 峰面积积分值(Y)为纵坐标, 得回归方程Y=17 162X+15 391, R2=0.999 5, 线性范围为15~90 μg/mL。
2.2.5 方法学考察精密度实验:精密量取同一供试品溶液, 按照" 2.2.1"项下色谱条件, 连续测定6次, 测定黄芩苷峰面积, 结果黄芩苷峰面积RSD=0.73%。
稳定性实验:精密量取同一供试品溶液, 按照2.2.1 "项下色谱条件, 分别在2、4、6、8、10、12 h间隔进样, 测定黄芩苷峰面积, 结果黄芩苷峰面积积分值的RSD=2.92%。
重复性实验:精密称取黄芩样品粉末6份, 按照" 2.2.3 "项下方法制备供试品溶液, 再按" 2.2.1 "项下色谱条件测定峰面积, 结果黄芩苷峰面积RSD=2.41%。
加样回收率实验:精密称量已知含量样品6份, 分别加入对照品储备液适量, 依据" 2.2.3 "项下方法制备供试品溶液, 按照" 2.2.1 "项下色谱条件测定, 结果黄芩苷平均回收率为100.82%, RSD=2.91%。
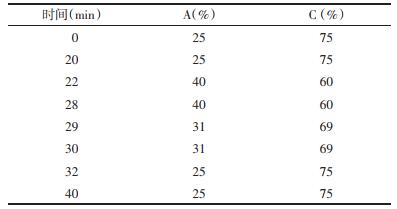
2.3 黄芩素、汉黄芩苷的含量测定 2.3.1 色谱条件采用Agilent Zorbax SB-C18色谱柱; 乙腈(A):0.1%甲酸水溶液(C)为流动相; 检测波长为78 nm; 流速1.0 mL/min; 柱温20℃; 进样量为10 μL。梯度洗脱顺序见表 3。
分别精密称取汉黄芩苷对照品2.4 mg、黄芩素对照品2.6 mg置于10 mL容量瓶中, 70%甲醇溶解并定容, 得浓度分别为0.24 mg/mL和0.26 mg/mL的汉黄芩苷和黄芩素对照品溶液。
2.3.3 供试品溶液的制备精密称取黄芩药材粉末(过65目筛)0.2 g, 置于25 mL容量瓶中, 加入70%甲醇20 mL, 超声提取30 min, 待冷却后, 定容, 摇匀, 静置, 取上清液1 mL, 置于10 mL容量瓶中, 70%甲醇定容, 即得供试品溶液。
2.3.4 线性关系考察分别精密吸取" 2.3.2 "项下制备的汉黄芩苷、黄芩素对照品储备液适量制备汉黄芩苷浓度为0.024 mg/mL和黄芩素浓度为0.013 mg/mL的混合对照品溶液, 摇匀。分别吸取上述对照品溶液1、2、6、10、14、18、20、25 μL注入液相色谱仪, 按" 2.3.1 "项下色谱条件进行分析。分别以黄芩素和汉黄芩苷对照品进样量为横坐标(X), 峰面积积分值为纵坐标(Y), 绘制标准曲线, 得汉黄芩苷回归方程为Y=2×109X-9 788, R2=1, 线性范围为0.024~0.6 μg; 黄芩素回归方程为Y=2×109X-11 095, R2=0.999 8, 线性范围为0.013~0.325 μg。
2.3.5 方法学考察精密度实验:精密吸取同一供试品溶液, 按" 2.3.1 "项下色谱条件重复进样6次, 测定汉黄芩苷和黄芩素的峰面积, 结果黄芩素峰面积RSD=1.10%, 汉黄芩苷RSD=0.26%。
重复性实验:精密称取同一药材粉末6份, 各0.2 g, 分别按" 2.3.3"项下方法制备供试品溶液, 按2.3.1"项下色谱条件进行分析, 测定汉黄芩苷和黄芩素的峰面积, 结果黄芩素峰面积RSD=2.90%, 汉黄芩苷峰面积RSD=2.60%。
稳定性实验:精密吸取同一供试品溶液, 按照2.3.1"项下色谱条件, 分别在2、4、6、8、10、12 h间隔进样, 测定汉黄芩苷和黄芩素色谱峰面积, 结果汉黄芩苷峰面积积分值的RSD=0.67%, 黄芩素峰面积积分值RSD=1.91%。
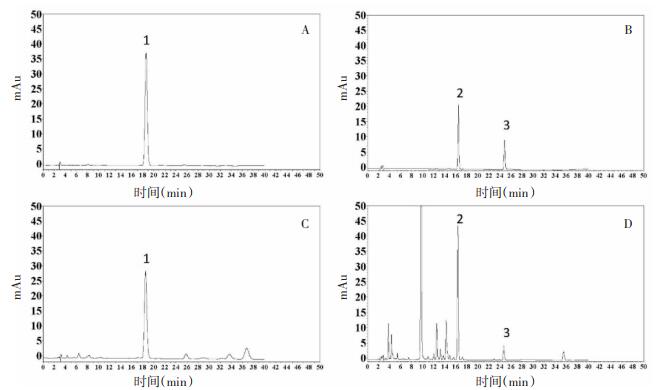
加样回收率实验:取已知含量的供试品6份, 分别精密加入一定量汉黄芩苷、黄芩素对照品, 按2.3.3 "项下方法制备供试品溶液, 按" 2.3.1"项下色谱条件测定, 计算加样回收率。结果黄芩素平均加样回收率为100.50%, RSD=2.44%, 汉黄芩苷平均加样回收率为96.08%, RSD=1.41%。对照品及样品色谱分离图见图 1。
|
| 注:1:黄芩苷; 2:汉黄芩苷; 3:黄芩素。 图 1 对照品(A、B)和黄芩样品(C、D)高效液相色谱图 |
每份样品重复测定3次, 结果取算数平均值, 结果用Excel 2007和SPSS 23.0软件分析统计。
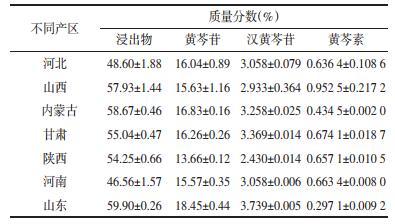
3 实验结果 3.1 不同产区黄芩药效成分含量测定结果基于药典限量指标成分黄芩苷含量(≥ 9%)和浸出物含量(≥40%), 各产地样品黄芩均高于药典限量标准, 不存在不合格药材, 尤以山东临沂、内蒙古赤峰栽培品含量总体水平最高, 但所有野生品(三产区)均最低。汉黄芩苷含量于2.28%~3.74%, 仍以山东临沂栽培品含量最高, 内蒙古赤峰野生最低。黄芩素的含量于0.3%~1.18%, 山西栽培品总体水平较高, 但山东临沂栽培品含量最低, 为0.3%。见表 4。
当前, 黄芩栽培品为市场流通商品的主要货源, 占有较大份额。由表 5结果可知, 山东、内蒙古、山西、甘肃4个产区栽培品各药效物质累积丰富, 但道地产区河北样品各药效物质含量处于较低水平, 并且与其他产区相比差异较大。因此, 各药效物质含量多少并不能完全反映黄芩的道地本质, 同时, 还发现各产地野生品黄芩药效物质含量远远低于栽培品, 故根据指标成分含量的高低去评价药材质量的优劣并不完全科学合理。
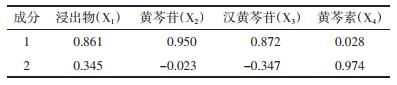
中药是多组分的复合体, 以多成分、多靶点、多层次发挥治疗作用。为了客观反映不同产地黄芩样品的整体质量特征, 对黄芩药效成分含量进行主成分分析, 结果见表 6。
用SPSS 23.0进行主成分分析, 一、二主成分(浸出物、黄芩苷)特征值均大于1, 累计贡献率达到了89.833%, 基本可以代表黄芩中4种指标成分的累积情况。由表 6可知浸出物、黄芩苷、汉黄芩苷在第一主分中有较高载荷量, 因此, 第一主成分反映了黄芩中总代谢产物及苷类药效成分的含量; 黄芩素在第二主成分有较高载荷量, 第二主成分也反映了黄芩中苷元的质量特征, 故选取两个主成分对不同产地黄芩进行综合评价分析。
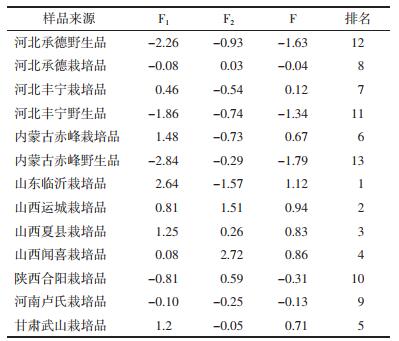
由表 7结果可知, 基于第一主成分得分, 山东临沂栽培品黄芩各药效成分累积量最为丰富, 其次为山西运城、山西闻喜、山西夏县栽培品。基于第二主成分, 山西闻喜栽培品各药效成分累积量丰富。由综合主成分分析结果可知, 山西各产地药材中各药效成分最为丰富, 整体质量较优, 说明当前市场山西部分地区黄芩广泛流通, 具有一定合理性; 河北丰宁、河北承德、内蒙古赤峰野生居于最后3位, 说明各产地野生药材各药效成分累积量低于栽培品药材, 此现象应引起人们关注。
黄芩苷含量测定色谱条件的优化:参照2015版药典(一部)黄芩中黄芩苷的含量测定方法, 基于黄芩苷色谱峰分离度, 由于不同产地黄芩样品比较多, 生长环境存在差异, 部分产地样品中黄芩苷色谱峰分离不完全, 故对色谱条件进行了优化, 即采用Agilent Zorbax SB-C18色谱柱; 甲醇(B):0.2%磷酸水(C)为流动相; 检测波长为280 nm, 流速1.0 mL/min; 柱温25℃; 进样量为10 μL, 进行梯度洗脱, 达到了较佳的分离效果。
道地药材是指经过中医长期临床应用, 产于特定地域, 与其他地区所产同种中药材相比品质和疗效更好, 且质量稳定, 具有较高知名度的中药材。从《本草纲目》记载的产地来看, 黄芩主产于甘肃、山西、陕西、山东, 近现代研究记载, 河北、内蒙古、辽宁等地广泛分布、质量较优[11-13]。纵观黄芩分布变迁, 整体呈现由南往北的趋势, 这可能与历史上不同时期自然环境的渐变和人为活动有关, 也进一步说明药材质量形成与产地的密切相关性。现代研究表明黄芩适宜分布在温带大陆性季风气候和山地气候区, 河北北部、内蒙古东部、辽宁西部及陕西汉中地区的气候类型适宜黄芩生长, 现今多把河北北部、内蒙古东部、辽宁西部及陕西等地列为黄芩药材的道地产区, 尤以燕山-阴山一带地区所产热河黄芩质量最优[14], 并公认河北作为黄芩主要道地产区。本研究结果表明, 河北道地产区与其他非道地产区黄芩活性成分含量存在差异, 样品中黄芩苷、汉黄芩苷、黄芩素累积含量均居于中等水平, 远不如非道地产区(山东), 产生原因有待进一步研究。
基于药典指标成分黄芩苷含量, 栽培品黄芩均高于野生黄芩。此外, 对比其他各药效成分的含量, 野生黄芩远不如栽培黄芩含量。但在市场上, 野生黄芩的价格高于栽培黄芩, 且认为野生黄芩药材品质优良。因此, 药材代谢产物累积量的多少并不能完全代表药材品质的优劣, 野生黄芩与栽培品就是典型代表, 两者在药效组分量比特征是不同的, 所以, 如何科学阐明道地性药效组分特征的内涵是非常重要的。
5 结论基于药典指标, 各主产区黄芩药材中黄芩苷含量和浸出物含量均高于药典规定限量, 市场黄芩药材整体质量较优。基于各药效成分的含量和主成分分析结果可知, 山东、山西、内蒙古、甘肃所产的栽培黄芩质量较好, 可作为黄芩栽培主要产地, 山西各产区样品含量较高, 为优质产区; 河北、河南, 陕西所产栽培黄芩质量一般, 但各产地野生药材各药效成分的含量远远低于栽培品药材, 此应引起人们关注。
| [1] |
林慧彬, 路宁, 王臣臣, 等. 黄芩的本草考证[J]. 四川中医, 2007, 26(12): 48-51. LIN H B, LU N, WANG C C, et al. Textual research on scutellaria[J]. Journal of Sichuan of Traditional Chinese Medicine, 2007, 26(12): 48-51. DOI:10.3969/j.issn.1000-3649.2007.12.026 |
| [2] |
张晓娟, 吕勃川. 黄芩研究新进展[J]. 中医药学报, 2017, 45(1): 96-99. ZHANG X J, LYU B C. New advances in research of Scutellaria baicalensis[J]. Acta Chinese Medicine and Pharmacology, 2017, 45(1): 96-99. DOI:10.3969/j.issn.1002-2392.2017.01.028 |
| [3] |
王孟华, 曲玮, 梁敬钰. 黄芩的研究进展[J]. 海峡药学, 2013, 25(9): 6-13. WANG M H, QU W, LIANG J Y. Research progress of Scutellaria baicalensis[J]. Strait Pharmaceutical Journal, 2013, 25(9): 6-13. DOI:10.3969/j.issn.1006-3765.2013.09.002 |
| [4] |
EDWARD K, MARCIN K, JAN N, et al. Pharmacological effects of flavonoids from Scutellaria baicalensis[J]. Przeglad Lekarski, 2006, 63(2): 95-96. |
| [5] |
王雅芳, 李婷, 唐正海, 等. 中药黄芩的化学成分及药理研究进展[J]. 中华中医药学刊, 2015, 33(1): 206-211. WANG Y F, LI T, TANG Z H, et al. Progress on chemical composition and pharmacological activities of scutellariae radix[J]. Chinese Archives of Traditional Chinese Medicine, 2015, 33(1): 206-211. |
| [6] |
陈涛.中药黄芩及其主要成分抗炎活性的研究[D].吉林: 吉林大学, 2017. CHEN T. Anti-inflammatory activity of traditional Chinese medicine radix scutellariae and its main components[D]. Jilin: Jilin University, 2017. |
| [7] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2015. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[M]. Beijing: China Medical Science and Technology Publishing House, 2015. |
| [8] |
郑勇凤, 王佳婧, 傅超美, 等. 黄芩的化学成分与药理作用研究进展[J]. 中成药, 2016, 38(1): 141-147. ZHENG Y F, WANG J J, FU C M, et al. Advances in research on chemical constituents and pharmacological effects of Scutellaria baicalensis[J]. Chinese Traditional Patent Medicine, 2016, 38(1): 141-147. |
| [9] |
田硕, 洪涛, 张多, 等. 黄芩素的药理作用及分子机制的最新研究进展[J]. 黑龙江医药, 2015, 28(6): 1195-1199. TIAN S, HONG T, ZHANG D, et al. Recent advances in pharmacological effects and molecular mechanisms of baicalein[J]. Heilongjiang Medicine Journal, 2015, 28(6): 1195-1199. |
| [10] |
申云富, 范小青. 汉黄芩苷的药理活性研究进展[J]. 上海中医药大学学报, 2016, 30(4): 98-101. SHEN Y F, FAN X Q. Progress on pharmacological research of wogonoside[J]. Academic Journal of Shanghai University of Traditional Chinese Medicine, 2016, 30(4): 98-101. |
| [11] |
白吉庆. 陕西道地药材——黄芩[J]. 现代中医药, 2019, 39(4): 147. BAI J Q. Authentic medicine of Shaanxi-Scutellaria baicalensis[J]. Modern Traditional Chinese Medicine, 2019, 39(4): 147. |
| [12] |
崔萌萌, 张贵君.黄芩的本草考证[A].第二届全国中药商品学术大会论文集[C]. 2010: 216-221. CUI M M, ZHANG G J. Textual research on scutellaria[A]. Proceedings of the Second National Conference on Chinese Medicine Commodities[C]. 2010: 216-221. |
| [13] |
陈仁山, 等.药物出产辨[M].广州:广东中医药专科学校, 1930. CHEN R S, JIANG M, CHEN S, et al. Drug production identification[M]. Guangzhou:Guangdong College of Traditional Chinese Medicine, 1930. |
| [14] |
李子.黄芩的本草考证及道地产区分布与变迁的研究[D].北京: 中国中医科学院, 2010. LI Z. Study on herbal textual research and distribution and change of authentic region of Huang Qin[D]. Beijing: China Academy of Chinese Medical Sciences, 2010. |
 2020, Vol. 39
2020, Vol. 39