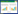文章信息
- 王春燕, 隆红艳
- WANG Chunyan, LONG Hongyan
- 黄龙止咳口服液对咳嗽变异性哮喘模型小鼠的作用机制研究
- Study on the mechanism of Huanglong Zhike Oral Liquid on mouse with cough variant asthma model
- 天津中医药大学学报, 2020, 39(3): 330-335
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(3): 330-335
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.03.18
-
文章历史
收稿日期: 2020-02-02
2. 南京中医药大学附属南京中医院, 南京 210023
2. Department of Pediatrics, Nanjing Hospital of Chinese Medicine, Nanjing 210023, China
咳嗽变异性哮喘(CVA)又称变异性哮喘、隐匿性哮喘, 是引起中国儿童尤其是学龄前和学龄期儿童慢性咳嗽的最常见原因, 临床以咳嗽为唯一或主要表现[1]。CVA的发病机制尚不明确, 目前认为是由多因素共同作用引起气道慢性炎症、气道高反应性和气道重构的结果, 报道称有超过30%的CVA患儿最终发展成典型哮喘[2]。目前的临床诊治方法与哮喘相似, 多以吸入性糖皮质激素、支气管扩张剂和白三烯受体拮抗剂为主, 虽见效快, 但长期服用不良反应大, 停药后易复发, 加上低龄儿童对于吸入疗法依从性差, 导致治疗效果不甚理想。本病中医属于"风咳"范畴[3], 黄龙止咳口服液(HLOL)作为南京中医药大学附属南京中医院治疗儿童CVA的有效验方, 多年来在临床取得显著的疗效。前期的临床研究已经证实, 在使用黄龙合剂1个疗程(2周)后, 患儿第1秒用力呼气量(FEV1)、最大呼气流量(PEF)有明显改善, 血中嗜酸性粒细胞计数和T淋巴细胞亚群CD4+、白细胞介素(IL)-4均显著降低, 进而使支气管痉挛得到有效缓解, 减轻气道炎症, 降低气道高反应性, 显著改善持续性咳嗽等临床症状[4-5]。动物实验研究也表明黄龙合剂可以有效降低气道周围炎性细胞浸润程度, 减少气道壁和血管周围胶原沉积, 抑制细胞炎症因子的释放, 最终改善肺功能障碍和气道重塑[6]。本研究观察HLOL对CVA模型小鼠气道炎症及Toll样受体(TLR)4/髓样分化因子(MyD88)/核转录因子-κB (NF-κB)通路的影响, 从而探讨HLOL治疗CVA的可能作用机制。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级雌性BALB/c小鼠(18~22 g), 由南京中医药大学实验动物中心提供, 实验前在标准实验室条件下饲养1周[许可证号:SYXK (苏)2016-0018]。动物的处理遵守国家健康协会制定的实验动物护理和使用指南[7]。
1.1.2 药物HLOL由麻黄、地龙、苦杏仁、前胡、桑白皮、蝉蜕、紫苏子、旋覆花共8味药组成, 其中前胡、桑白皮、紫苏子使用醇提, 其药渣与剩余5味合并水煎。水煎液和醇提液混合并浓缩, 得到生药量1.5 g/mL, 调整pH值, 加防腐剂, 静置后取上清即得。地塞米松(Dex)(生产批号:CD170417b)。
1.1.3 主要试剂及仪器卵蛋白(OVA)(批号:1002638270)、氢氧化铝(批号:21645-51-2)、乙酰甲胆碱(Mch)购于美国Sigma-Aldrich公司, 白细胞介素(IL)-4、IL-5、IL-13酶联免疫吸附(ELISA)试剂盒购于Elabscience公司, TLR2、TLR4、MyD88、NF-κB p65抗体购于美国Cell Signaling公司。
O2AI超声雾化器(江苏鱼跃医疗设备有限公司), 超纯水系统(美国Thermo公司LabTower), 正置荧光显微镜(日本Olympus公司BX43), 全波长酶标仪(美国Bio-Tek Epoch), 全自动洗板机(美国Bio-Tek ELX50), 蛋白成像系统(美国Bio-Rad ChemiDoc XRS+), 小鼠无创肺功能仪(Buxco American)。
1.2 方法 1.2.1 实验动物分组将50只雌性BALB/c小鼠随机分为5组, 分别为正常组、OVA组、Dex组、HLOL低剂量组、HLOL高剂量组, 每组10只。
1.2.2 动物模型建立参照文献方法建立模型[8-9], 采用OVA和氢氧化铝激发致敏, 并用OVA雾化激发来建立CVA模型小鼠。所有小鼠饲养1周, 于第1、7、14天, 正常组小鼠每只腹腔注射200 μL生理盐水, 其他各组小鼠每只腹腔注射200 μL致敏液(含OVA 100 μg, 氢氧化铝20 μg, 溶解于生理盐水溶液中)致敏。末次注射1周后, 除正常组外其余各组均以1.5% OVA溶液进行超声雾化, 每日30 min, 连续激发14 d。每次激发前1 h, Dex组以Dex片配制成溶液后以2 mg/kg灌胃, HLOL低剂量组0.75 g/kg、高剂量组1.5 g/kg等剂量灌胃, 正常组和模型组以等剂量生理盐水灌胃。
1.2.3 标本收集在最后1次给药激发后24 h测定部分小鼠的气道反应性, 处死小鼠, 摘眼球取血, 12 000 r/min离心, 离心半径为21 cm, 离心后取上层血清, 置于-80℃冻存。打开小鼠胸腔, 取左侧肺组织置于4%多聚甲醛溶液中固定, 经石蜡包埋、切片、染色, 其余肺组织于-80℃冻存。
1.2.4 小鼠气道反应性测定末次激发24 h后, Buxco无创肺功能仪检测小鼠增强的呼吸间歇(Penh), 首先测定小鼠基础Penh值1 min, 随后测定倍增浓度Mch雾化激发后Penh的变化, 每次雾化2 min, 记录3 min。Mch激发浓度由低到高, 记录各浓度Mch激发下的Penh值。
1.2.5 ELISA法测定小鼠血清中总免疫球蛋白E (IgE)及IL-4、IL-5、IL-13的含量根据ELISA试剂盒说明书的步骤, 依次检测血清中总IgE、IL-4、IL-5和IL-13的含量, 并进行分析。
1.2.6 肺组织学检查将固定后的左肺依次进行脱水、浸蜡、包埋等步骤, 并进行苏木精-伊红(HE)染色。
1.2.7 免疫组化检测石蜡切片常规脱蜡、脱水, 并置于100℃的抗体修复液中修复30 min, 根据说明书按比例制备兔抗鼠TLR4和磷酸化(p)-NF-κB p65抗体(1:1 000), 4℃孵育过夜, 孵育二抗, 二氨基联苯胺(DAB)显色、苏木精复染, 封片后观察并拍照。
1.2.8 蛋白免疫印迹(Western blot)检测收集肺组织并裂解, 二喹啉甲酸(BCA)法测定样品蛋白浓度。每个泳道加等量的蛋白样品分离后, 转移到PVDF膜上, 封闭后分别加入一抗(TLR4、MyD88、NF-κB p65、p-NF-κB p65)4℃过夜。二抗孵育后加入ECL荧光试剂, 进行图像采集和数据分析。
1.3 统计学分析实验结果均以SPSS 23.0软件进行统计学分析, 实验数据以均数±标准差(x±s)表示, 多组间比较采用单因素方差分析(One-Way ANOVA), 组间两两比较采用LSD法, P < 0.05为差异具有统计学意义。
2 结果 2.1 HLOL对各组小鼠肺组织病理学改变比较相较于正常组, OVA组小鼠肺组织切片可见气道平滑肌增厚, 支气管及血管周围有大量炎性细胞浸润。经Dex治疗后仍有炎性细胞浸润, HLOL各组肺组织炎性细胞浸润明显减少, 支气管壁结构相对完整, 减轻了OVA诱导的气道炎症。见图 1。
|
| 图 1 各组小鼠肺组织病理切片(HE染色,200×) |
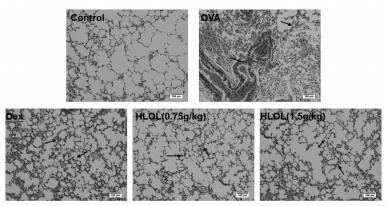
除正常组外, 其余各组Penh值都有随Mch升高而增加的趋势。与正常组相比, OVA组的AHR显著增加(P < 0.01), 用药治疗后均能降低气道Penh值(P < 0.01), 因此, HLOL能有效降低CVA模型小鼠的AHR。见图 2。
|
| 注:与正常组比较,#P < 0.01;与OVA组比较,*P < 0.01。 图 2 各组小鼠AHR(x±s,n=10) |
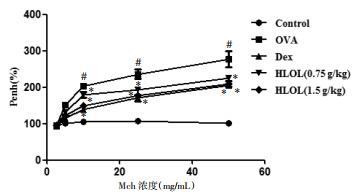
与正常组相比, OVA组小鼠血清中总细胞数与嗜酸性粒细胞(EOS)、淋巴细胞(LYM)和中性粒细胞(NEU)的细胞数较正常组明显升高(P < 0.01)。与OVA组相比, HLOL各组的总细胞数与EOS、LYM、NEU均明显减少(P < 0.01), Dex组减少更为明显。见图 3。
|
| 注:与正常组比较,#P < 0.01;与OVA组比较,*P < 0.01。 图 3 各组小鼠血清总细胞和各炎症细胞计数(x±s,n=10) |
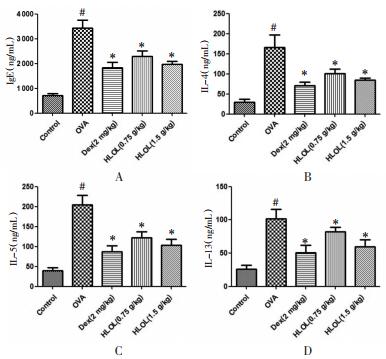
与正常组比较, OVA组血清中IgE和IL-4、IL-5、IL-13含量明显增高(P < 0.01);与OVA组比较, 各治疗组IgE和炎症因子均明显降低(P < 0.01), 提示各治疗组均对CVA有一定的治疗作用。相较于HLOL低剂量组, 高剂量组的作用更明显。见图 4。
|
| 注:与正常组比较,#P < 0.01;与OVA组比较,*P < 0.01。 图 4 ELISA法测定各组小鼠总IgE和IL-4、IL-5、IL-13水平(x±s,n=10) |
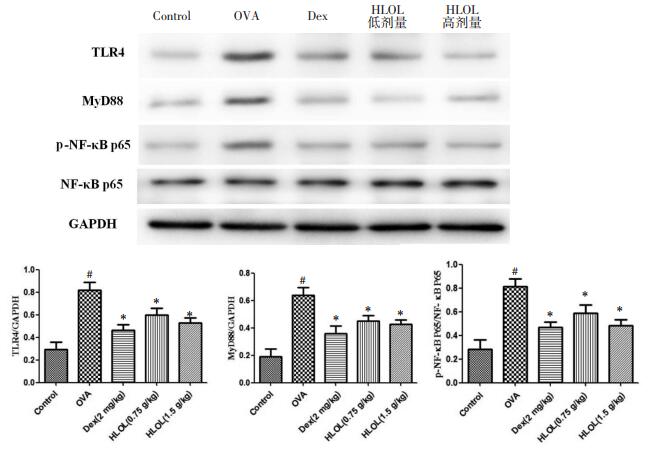
OVA组小鼠肺组织中TLR4、MyD88和p-NF-κB p65的蛋白表达明显高于正常组(P < 0.01), 经治疗后各蛋白含量明显降低(P < 0.01), 表明HLOL可以抑制TLR4、MyD88和p-NF-κB p65蛋白的表达。见图 5。
|
| 注:与正常组比较,#P < 0.01;与OVA组比较,*P < 0.01。 图 5 各组小鼠肺组织TLR4、MyD88、NF-κB p65表达的影响(x±s,n=10) |
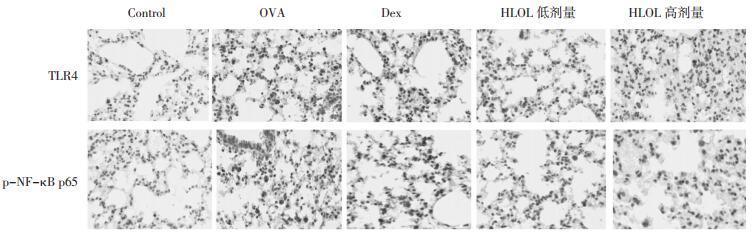
免疫组化可见经OVA刺激后气道周围TLR4和p-NF-κB P65蛋白明显聚集, 而HLOL各组较OVA组蛋白水平均有不同程度的减弱。见图 6。由此可见, HLOL减弱OVA诱导的过敏气道炎症可能与TLR4/NF-κB信号通路有关。
|
| 图 6 各组小鼠肺组织TLR4和p-NF-κB p65免疫组化染色(400×) |
CVA是一种过敏性气道炎症性疾病, 以气道炎症、气道高反应性和气道重塑为主要病理基础, 涉及多种炎症介质和细胞因子。儿童CVA的发病机制尚不明确, 大多数研究认为是由环境、遗传、感染及免疫等因素相互作用所致。
现代研究普遍认为Th1/Th2细胞亚群的失衡是CVA的重要发病机制之一[10], Th2细胞刺激的2型免疫应答与过敏和哮喘有关, 其特征在于高抗体滴度和EOS增多。CVA发病过程中Th0过多向Th2转化, 从而使Th1细胞激活受抑制[11]。Th2细胞主要分泌炎症细胞因子IL-4、IL-5和IL-13, 能介导气道黏膜的炎症, 加重CVA并促使其向哮喘发展。其中IL-4、IL-5能诱导IgE的产生, 趋化EOS[12]; IL-13刺激EOS, 引起AHR、黏液产生和胶原沉积[13], 三者共同作用, 促使CVA气道炎症形成和发展。因此抑制这3种炎症因子的生成是治疗CVA的有效途径。
TLR4作为参与非特异性免疫的重要蛋白, 能够识别外源性病原体并调控免疫, 从而调节机体Th1和Th2两种细胞的平衡。NF-κB在多种细胞中广泛表达, 正常情况下, NF-κB与其抑制剂IκB结合而失活。然而, 在异常状态下, 当上皮细胞受到刺激和损伤(如过敏性疾病)时, 由于某些因子的激活, IκB与NF-κB分离, 导致NF-κB活化, 进而引起大量炎症因子基因表达[14]。TLR4能通过激活NF-κB信号通路, 引起多种炎症因子如IL-4、IL-5、IL-13基因的表达, 这些表达的炎症因子又重新激活了NF-κB通路, 形成滚雪球式的正反馈调节[15]。
HLOL是由8味中草药组成的混合物, 其中麻黄作为止咳平喘的代表药物, 被证实能抑制细胞免疫和体液免疫, 有抗哮喘作用, 可缓解气道平滑肌的收缩[16-17]; 地龙具有松弛平滑肌、抗炎杀菌、平喘和免疫调节作用, 研究发现地龙可有效抑制NF-κB的活化, 降低IL-4、IL-5和IL-13的水平, 减少体内EOS炎症[18]; 苦杏仁可平喘镇咳, 亦有抗炎作用; 紫苏子能一定程度上抑制过敏反应; 桑白皮、前胡均能镇咳祛痰; 蝉蜕、旋覆花能缓解气道高敏反应状态, 解除支气管平滑肌痉挛。
本次研究发现, HLOL能抑制CVA小鼠血清NEU的增多, 减少CVA小鼠肺组织炎性细胞的浸润, 降低AHR。HLOL通过抑制上游TLR4与MyD88结合, 从而抑制TLR介导的MyD88依赖信号转导途径, 进一步降低或延迟下游NF-κB信号通路的活化, 减少促炎细胞因子IL-4、IL-5和IL-13的释放, 从而缓解临床症状。总而言之, HLOL能够有效改善CVA模型小鼠的气道炎症及AHR, 也为临床诊治小儿CVA提供新的治疗思路, 有望成为专病新药应用于临床中。
| [1] |
中华医学会儿科学分会呼吸学组. 儿童支气管哮喘诊断与防治指南(2016年版)[J]. 中华儿科杂志, 2016, 54(3): 167-181. Respiration Section of Pediatrics Branch of Chinese Medical Association. Guidelines for the diagnosis and treatment of bronchial asthma in children (2016 edition)[J]. Chinese Journal of Pediatrics, 2016, 54(3): 167-181. DOI:10.3760/cma.j.issn.0578-1310.2016.03.003 |
| [2] |
陈树煜, 方泽葵, 方思, 等. 典型哮喘与咳嗽变异性哮喘的小气道功能差异分析[J]. 南方医科大学学报, 2017, 37(3): 330-336. CHEN S Y, FANG Z K, FANG S, et al. Comparison of functional parameters of small airways between patients with typical asthma and cough-variant asthma[J]. Journal of Southern Medical University, 2017, 37(3): 330-336. |
| [3] |
许先科. 俞景茂教授治疗儿童咳嗽变异性哮喘经验[J]. 中华中医药杂志, 2014, 29(7): 2229-2231. XU X K. Professor YU Jingmao's experience in treating pediatric cough variant asthma[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2014, 29(7): 2229-2231. |
| [4] |
隆红艳, 张骠, 司振阳, 等. 黄龙合剂治疗小儿咳嗽变异性哮喘风热夹痰证的临床疗效及其对肺功能和T淋巴细胞亚群的影响[J]. 中医儿科杂志, 2015, 11(6): 27-31. LONG H Y, ZHANG B, SI Z Y, et al. The clinic observation of Huanglong Mixture on infantile cough variant asthma with wind-heat phlegm syndrome and its influence on the lung function and T cell subsets[J]. Journal of Pediatrics of Traditional Chinese Medicine, 2015, 11(6): 27-31. |
| [5] |
陶迪, 司振阳, 隆红艳, 等. 黄龙止咳口服液对咳嗽变异性哮喘模型大鼠白细胞介素4和γ干扰素的影响[J]. 中国医药导报, 2015, 12(2): 8-11, 15. TAO D, SI Z Y, LONG H Y, et al. Effect of Huanglong Cough Liquid on interleukin-4 and interferon-γ of cough variant asthma of model rats[J]. China Medical Herald, 2015, 12(2): 8-11, 15. |
| [6] |
朱维娜, 隆红艳, 李红燕, 等. 黄龙止咳口服液对咳嗽变异性哮喘模型大鼠抗气道炎症的影响[J]. 中成药, 2016, 38(9): 2030-2035. ZHU W N, LONG H Y, LI H Y, et al. Effect of Huanglong Zhike oral liquid on anti airway inflammation in cough variant asthma model rats[J]. Chinese Traditional Patent Medicine, 2016, 38(9): 2030-2035. |
| [7] |
王建飞. 实验动物饲养管理和使用指南[M]. 上海: 上海科学技术出版社, 2012. WANG J F. Guide for feeding management and use of laboratory animals[M]. Shanghai: Shanghai Scientific and Technical Publishers, 2012. |
| [8] |
HUA S, LIU F G, WANG M M. Emodin alleviates the airway inflammation of cough variant asthma in mice by regulating the notch pathway[J]. Medical Science Monitor:International Medical Journal of Experimental and Clinical Research, 2019(25): 5621-5629. |
| [9] |
马风桐, 李江全. 咳敏合剂对咳嗽变异性哮喘小鼠IFN-γ及IL-13含量的影响[J]. 上海中医药杂志, 2013, 47(7): 90-92. MA F T, LI J Q. Effect of "Kemin Mixture" on IFN-γ and IL-13 in mice with cough variant asthma[J]. Shanghai Journal of Traditional Chinese Medicine, 2013, 47(7): 90-92. |
| [10] |
MEI F, XING X F, TANG Q F, et al. Antipyretic and anti-asthmatic activities of traditional Chinese herb-pairs, ephedra and eypsum[J]. Chinese Journal of Integrative Medicine, 2016, 22(6): 445-450. DOI:10.1007/s11655-014-1952-x |
| [11] |
YSSEL H, GROUX H. Characterization of T cell subpopulations involved in the pathogenesis of asthma and allergic diseases[J]. International Archives of Allergy and Immunology, 2000, 121(1): 10-18. DOI:10.1159/000024292 |
| [12] |
FAHY J V. Type 2 inflammation in asthma-present in most, absent in many[J]. Nature Reviews Immunology, 2015, 15(1): 57. DOI:10.1038/nri3786 |
| [13] |
KUPERMAN D A, HUANG X, KOTH L L, et al. Direct effects of interleukin-13 on epithelial cells cause airway hyperreactivity and mucus overproduction in asthma[J]. Nature Medicine, 2002, 8(8): 885-889. DOI:10.1038/nm734 |
| [14] |
JIANG W, LI M, HE F, et al. Protective effects of asiatic acid against spinal cord injury-induced acute lung injury in rats[J]. Inflammation, 2016, 39(6): 1853-1861. DOI:10.1007/s10753-016-0414-3 |
| [15] |
YANG S, YU Z, YUAN T, et al. Therapeutic effect of methyl salicylate 2-O-β-d-lactoside on LPS-induced acute lung injury by inhibiting TAK1/NF-kappaB phosphorylation and NLRP3 expression[J]. International Immunopharmacology, 2016(40): 219-228. |
| [16] |
MEI F, XING X F, TANG Q F, et al. Antipyretic and anti-asthmatic activities of traditional Chinese herb-pairs, Ephedra and Gypsum[J]. Chinese Journal of Integrative Medicine, 2016, 22(6): 445-450. DOI:10.1007/s11655-014-1952-x |
| [17] |
Bilcíková L, BAUER V, KOLENA J. The effects of methylxanthines, ethymizol, ephedrine and papaverine on guinea pig and dog trachea[J]. General Physiology & Biophysics, 1987, 6(2): 137-148. |
| [18] |
HUANG C Q, LI W, WU B, et al. Pheretima aspergillum decoction suppresses inflammation and relieves asthma in a mouse model of bronchial asthma by NF-κB inhibition[J]. Journal of Ethnopharmacology, 2016(189): 22-30. |
 2020, Vol. 39
2020, Vol. 39