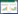文章信息
- 全宏娟
- QUAN Hongjuan
- 丹参川芎嗪注射液改善缺血性卒中大鼠Th17/Treg平衡减轻神经缺血损伤的研究
- Effect of Danshen and Ligustrazine Injection on Th17/Treg balance in rats with ischemic stroke
- 天津中医药大学学报, 2020, 39(4): 446-452
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(4): 446-452
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.04.18
-
文章历史
收稿日期: 2020-01-10
脑缺血诱发的中枢免疫炎症反应是卒中重要的病理特征之一。研究显示,T淋巴细胞是脑内持续炎症反应发生的核心[1]。脑缺血后,外周淋巴细胞等免疫细胞受趋化因子募集,穿过损伤的血脑屏障浸润至脑组织,引起脑内的特异性免疫应答;并和脑内固有的免疫细胞如小胶质细胞一起产生更多的炎性介质,恶化神经缺血损伤[2]。Th17与Treg细胞为功能相反的CD4+T淋巴细胞亚群,Th17促进炎症反应,而Treg抑制炎症反应,二者数量与功能的平衡是维持自身免疫稳态的关键因素[3]。已有一些证据提示Th17和Treg参与了缺血后的脑内免疫炎症反应过程[4-6],那些具有抑制Th17而增强Treg细胞数量及功能的治疗策略,则有助于炎症环境下神经细胞的保护。
丹参川芎嗪注射液(DCZ)是临床治疗缺血性卒中的常用药,主要成分为丹参素与盐酸川芎嗪,二者协同起效,具有降低血黏度、扩张脑局部血管,改善脑组织改善微循环、减轻脑组织水肿、抑制神经细胞凋亡的作用[7]。目前对丹参川芎嗪注射液对卒中后脑内免疫炎症反应的调节作用关注甚少,且多集中于对炎症因子水平的改善。因此,本研究拟观察丹参川芎嗪注射液对卒中后大鼠脑内Th17/Treg的影响,以阐明Th17/Treg在卒中后的变化规律,为临床使用丹参川芎嗪注射液治疗卒中提供更多实验依据。
1 材料与方法 1.1 材料 1.1.1 试剂红细胞裂红液、Percoll细胞分离液购自北京索莱宝科技有限公司;RPMI Medium 1640培养液购自上海立菲生物技术有限公司;APC Mouse Anti-Rat CD3、FITC Mouse Anti-Rat CD4、PE Mouse Anti-Rat CD25、PE Mouse Anti-Rat CD8a、Transcription Factor Buffer Set、4×Fix/Perm Buffer、Leukocyte Activation Cocktail with BD GolgiPlug购自美国BD公司;APC Foxp3、Anti-Rat IL-17A APC购自美国eBio science;IL-6、TNF-α、IL-4、IL-10的ELISA试剂盒购自德国IBL公司。
1.1.2 主要仪器台式高速离心机为德国Eppendorf公司(Centrifuge 5430 R);流式细胞仪为美国BD公司(FACS Calibur);多功能酶标仪为美国Molecular Devices公司(SpectraMax i3)。
1.2 动物分组、造模动物分组:健康雄性Wistar大鼠,体质量190~210 g,适应性喂养一周。将大鼠随机分为假手术组和大脑中动脉阻塞(MCAO)组。除假手术组为10只动物,MCAO组在手术后根据神经功能缺损评分(NSS评分)剔除NSS < 2分的大鼠,剩余大鼠随机分为模型组和参芎组,每组有24 h、3 d、7 d、14 d共4个时相,每时相各10只动物。
造模方法:采用Zea Longa腔内线栓法阻滞大鼠右侧大脑中动脉,制作MCAO模型。尼龙线直径为0.205mm。见参考文献(Longa ZE.Stroke,1989,20(1):84-91)。假手术组仅钝性分离血管但不结扎,亦不插线,余处理同MCAO组。
1.3 给药方法根据Meeh-rubner体表面积公式及相关文献计算大鼠用药量[8]:大鼠剂量(mL)=成人日剂量(10 mL)×0.018/0.2 kg=0.9 mL/kg。参芎组于造模后按体质量腹腔注射0.9 mL/kg的丹参川芎嗪注射液,每日1次;假手术组和模型组给予等量生理盐水。
1.4 实验方法 1.4.1 神经功能缺损检测根据NSS评分标准,对各组动物的神经功能进行评分[9]。NSS评分是一种针对运动、感觉、反射和平衡功能的综合性评价指标,分值为0~18分,分值越高表示损伤程度越重。
1.4.2 TTC染色法检测梗死体积百分比各组大鼠麻醉后采用0.01M PBS和4%多聚甲醛常规方法经心灌注固定;取脑,-20 ℃冰冻脑组织20 min后,行冠状连续切片,片厚2 mm,共切6片。将切片置于2%的TTC(氯化三苯基四氮唑)溶液中,37 ℃避光孵育20 min,后用4%多聚甲醛固定24 h。拍照,以Image Pro-plus 6.0软件计算脑片总面积及梗死面积,将面积之和乘以厚度(2 mm),得出脑片总体积和梗死体积,由此计算出梗死体积百分比。
1.4.3 流式细胞术分析Th17、Treg细胞的比例治疗结束后,将大鼠麻醉,分离大脑中动脉供血区的脑组织。将脑组织置于RMPI 1640培养液中,300目不锈钢筛网上机械法制成单细胞悬液。悬液中依次加入3 mL 37%和70%的Percoll溶液,500×g离心20 min,分离中间层(单个核细胞层),洗涤并重悬细胞。
Treg细胞抗体标记:取脑单细胞悬液,加入2倍体积的红细胞裂解液,4℃孵育15 min,450×g离心10 min,1×PBS洗涤并重悬细胞。加入1.5 μL CD4和2.5 μL CD25,4℃避光孵育20 min。1×PBS洗涤并重悬细胞。涡旋加入1 ml 1×Fix/Perm Working Solution破膜,4℃避光孵育40 min,1× Perm/Wash洗涤并重悬细胞。加入2.5 μL FoxP3抗体,4 ℃避光孵育50 min。1×Perm/Wash洗涤并重悬细胞。加入500 μL 1×PBS溶液重悬细胞,过300目筛,流式细胞仪检测。
Th17细胞抗体标记:取200 μL脑单细胞悬液,加入4 μL刺激液、200 μL RMPI 1640培养液,37 ℃孵育4 h。加入各5 μL CD8a、CD3、CD4抗体,室温避光孵育20 min。加入2倍体积的红细胞裂解液,4 ℃孵育15 min,450×g离心10 min。加5 μL IL-17A抗体,4 ℃避光孵育40 min。1×PBS溶液洗涤并重悬细胞,过300目筛,流式细胞仪检测。
所有样本经流式细胞仪检测,并分析样品中Th17和Treg细胞的比例。阴性对照不加一抗,以相应的同型对照抗体替代。
设门方案:根据淋巴细胞物理性质,以前向角、侧向角参数设立淋巴细胞门,根据淋巴细胞生物学特性,利用细胞表面抗原荧光染色表达情况设立CD3+T淋巴细胞门,再在CD3+T淋巴细胞中设立CD4+T淋巴细胞门,在CD4+T淋巴细胞门下设CD25+Foxp3+Treg细胞门或CD4+IL17a+Th17细胞门。
1.4.4 ELISA法检测炎性细胞因子水平依照试剂盒说明书,检测组织中Th17相关细胞因子(IL-6、TNF-α);Treg相关细胞因子(IL-4、IL-10)。
2 数据统计采用SPSS13.0软件进行统计学分析。结果以均数±标准差(x±SD)表示;组间比较采用单因素方差分析;组间多重比较采用LSD法(方差齐)/Dunnett’s T3法(方差不齐);重复测量数据采用双因素方差分析,以分组作为组间因素,不同时间点作为组内因素。显著性差异水平α=0.05,P < 0.05为显著性差异,P < 0.01为极显著性差异。
3 结果 3.1 对MCAO大鼠NSS评分的影响造模前,所有实验大鼠的NSS评分均为0;假手术组各时间点的NSS评分也为0。模型组24 h的NSS评分最高,其后的时间点逐渐降低,组内比较差异显著(P < 0.01)。参芎组各时间点NSS评分也呈逐渐降低趋势,组内比较差异显著(P < 0.01);从第3天开始,与同时间点模型组NSS评分差异显著(P < 0.05,P < 0.01),见表 1。
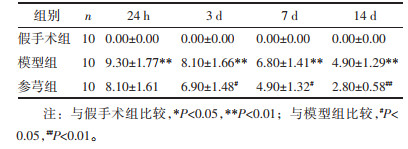
模型组24 h的脑梗死体积最大,其后的时间点梗死体积逐渐降低,组内比较差异显著(P < 0.01)。参芎组各时间点梗死体积也逐渐降低,组内比较差异显著(P < 0.01);且从24 h开始,较同时间点模型组梗死体积明显缩小,组间比较差异显著(P < 0.01),见表 2。
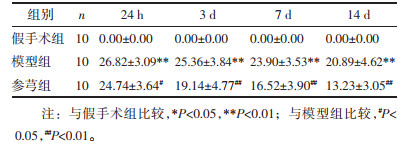
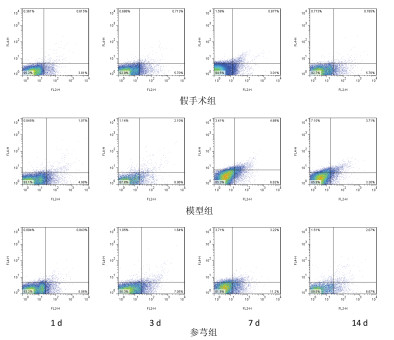
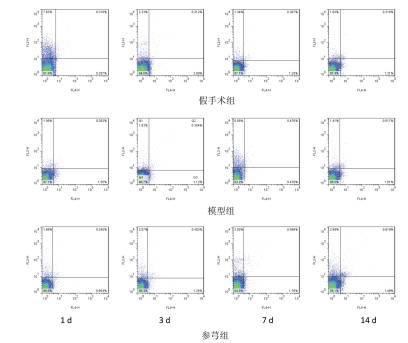
模型组脑内Th17细胞比例在造模后逐渐升高,于第7 d达到峰值,而后下降,但至14 d时仍高假手术组;第3、7、14 d的比例均高于假手术组,组间比较差异显著(P < 0.01)。模型组脑内Treg细胞比例在造模后24 h和3 d较假手术组有所降低,但组间比较无显著差异;至7 d时,模型组Treg细胞比例大量增加,与假手术组相比差异显著(P < 0.01),见表 3,图 1。
|
| 图 1 脑内Th17细胞比例 |
与模型组相比,参芎组能降低各时间点Th17细胞比例,且第3、7、14 d的降低幅度较大,与模型组比较差异显著(P < 0.05,P < 0.01);同时,参芎组能提高不同时间点Treg细胞比例,且第7 d和14 d尤为明显,与模型组比较差异显著(P < 0.05,P < 0.01),见表 3,图 2。
|
| 图 2 脑内Treg细胞比例 |
从Th17/Treg比值来看,模型组各时间点Th17/Treg比值均显著高于假手术组(P < 0.05,P < 0.01);而参芎组能降低Th17/Treg比值,与模型组比较差异显著(P < 0.05,P < 0.01)见表 3。
3.4 对MCAO大鼠脑内炎性细胞因子水平的影响模型组脑内IL-6和TNF-α水平在造模后逐渐升高,于第7 d达到峰值,而后下降,但至14 d时又高于假手术组;且各时间点的水平均高于假手术组,组间比较差异显著(P < 0.01)。模型组脑内IL-4和IL-10水平在造模后较假手术组有所降低,且IL-4降低更为明显(P < 0.05);但各时间点间差异并不显著。与模型组相比,参芎组能降低各时间点IL-6和TNF-α水平,组间比较差异显著(P < 0.05,P < 0.01);同时参芎组脑内IL-4和IL-10水平也有所升高,特别是IL-4升高更为明显(P < 0.05),见表 4。
在缺血性脑卒中的发生发展过程中,免疫炎症反应作为导致神经元凋亡、坏死的重要原因而贯穿该过程始终。作为细胞免疫应答的主体,T淋巴细胞是脑内持续炎症反应发生的核心,而各CD4+T淋巴细胞亚群则在缺血性脑卒中发病的免疫学机制中发挥着重要作用[1]。
Th17与Treg细胞是起源相同、功能相反的CD4+T细胞亚群。Th17细胞能促进炎症反应,通过分泌IL-17、IL-6、TNFα等炎症因子在炎症和自身免疫性疾病中发挥重要作用[10]。IL-17能诱导IL-6、TNF-α、趋化因子和MMPs等炎症因子释放,引起组织浸润和破坏;还能促进树突状细胞成熟和趋化、刺激T细胞活化[11]。IL-6、TNF-α等炎症因子不仅诱导中性粒细胞的募集和趋化;还能进一步促进Th17分化并表达IL-17,进而加重炎症反应。Treg细胞通过分泌细胞因子IL-10、TGF-β、IL-4等抑制炎症反应,通过控制免疫应答的强度,防止过度免疫所致的组织损伤来维持机体的免疫稳态,Foxp3是其表面特异性标志物[12]。Treg不仅直接抑制效应T细胞的活化增殖,还能与效应T细胞竞争性结合IL-2,从而诱导效应T细胞凋亡[13]。Treg还能促进TGF-β等抗炎因子分泌来抑制效应T细胞的活性。此外,Treg还能抑制树突状细胞和NK细胞的功能;进而抑制效应T细胞的活化;Treg还能抑制中性粒细胞表达MMP9,从而减少组织损伤[14]。
研究显示,Th17和Treg通过细胞因子间的相互作用、转化等参与急性缺血性脑卒中的发生和发展。MCAO小鼠缺血后72 h,可见脑内Th17细胞数量显著增加,其相关促炎因子IL-1β、IL-6、IL-17A、TNF-α表达显著上升;而Treg细胞数量及相关细胞因子IL-10未见明显变化[4]。缺血脑组织表达IL-17增多;削弱IL-17的功能后,脑缺血面积缩小[5]。脑缺血后,脑内Treg数量明显增多,脑内Treg数量与缺血面积呈负相关;增强Treg功能可减轻脑内免疫炎症反应、抑制小胶质细胞活化;并使缺血面积减小、神经功能改善;而去除Treg则阻碍神经功能恢复[15]。静脉输注体外扩增的Treg细胞,可改善脑缺血大鼠神经炎症反应[6]。采用低剂量抗原诱导缺血前免疫耐受,可导致Treg功能增强,分泌抗炎因子TGF-β和IL-10增多,从而减轻神经缺血损伤[16]。
丹参川芎嗪注射液(DCZ)为丹参素与盐酸川芎嗪的复方中药注射液。丹参素在中药丹参中含量较高,其水溶性好,易于吸收,能快速透过血脑屏障[17]。丹参素可呈剂量依赖性地抑制血小板聚集,且对凝血酶原时间、纤维蛋白原等凝血四项指标无影响,提示丹参素在溶栓方面具有良好的安全性[18]。丹参素还能通过抑制缺血性卒中脑内凋亡基因Bax、caspase-3等表达、降低NF-κB通路活性、降低IL-1β、IL-6和TNF-α等炎症因子水平[19]、减少细胞内乳酸脱氢酶水平、降低氧化损伤等,改善半暗带脑区缺血、缺氧及炎症反应水平,来减少神经元存活微环境,进而改善神经功能[20]。川芎嗪为中药川芎的主要活性物质,属生物碱类。川芎嗪是钙拮抗剂,通过抑制Ca2+内流并促进胞内Ca2+释放、提高内皮型一氧化氮合酶磷酸化水平、提高线粒体生物合成而促进有氧代谢,进而保护血管内皮细胞的功能、促进血管舒张[21]。川芎嗪可减少MCAO大鼠脑梗死面积、促进神经功能恢复、促进神经发生和轴突形成;还可促进体外培养的皮层神经元分化[22]。川芎嗪可降低血脑屏障通透性、抑制MCAO大鼠脑内中性粒细胞活化[23]、抑制NF-κB通路激活及炎症因子表达、激活Nrf2/HO-1通路以减轻缺血引起的氧化损伤、抑制神经元型一氧化氮合酶表达等发挥神经保护作用[24]。临床研究显示,丹参川芎嗪注射液能显著改善卒中患者神经缺损症状,并可改善患者血脂、降低血清同型半胱氨酸和高敏C反应蛋白水平、提高超氧化物歧化酶活性等[25-26]。
本研究结果显示,MCAO大鼠脑缺血后NSS评分明显增高,脑梗死体积较大。丹参川芎嗪注射液能明显改善其NSS评分,降低梗死体积。MCAO大鼠脑内神经炎症反应快速激活,在缺血后24 h就可见Th17细胞比例及其相关细胞因子IL-6和TNF-α水平增加;且随缺血时间延长而进一步增长。Th17细胞比例的这种变化也与NSS评分改变相一致。至缺血后3 d,Treg细胞比例较假手术组降低,直至缺血后7 d,Treg细胞比例方有所上升。而Treg相关细胞因子IL-4和IL-10水平在缺血后7 d仍低于假手术组,至缺血后14 d,二者水平方有所上升。丹参川芎嗪注射液能降低Th17细胞比例及IL-6和TNF-α水平;而增加Treg细胞比例及IL-4和IL-10水平。Th17/Treg比值能较好反映机体炎症水平,本研究发现模型组Th17/Treg比值随时间逐渐升高,至缺血后7 d达到峰值,而丹参川芎嗪注射液能明显降低Th17/Treg比值,提示丹参川芎嗪注射液可改善Th17/Treg间的平衡,抑制脑内神经炎症反应。
综上,脑缺血可快速激活MCAO大鼠脑内的神经炎症反应,表现为Th17/Treg比例失衡,促炎因子IL-6和TNF-α水平增加,而抗炎因子IL-4和IL-10水平下降。丹参川芎嗪注射液能调节缺血性卒中大鼠Th17/Treg平衡及相关炎症因子水平,进而改善神经元存活微环境,减轻神经缺血损伤。
| [1] |
BRAIT V H, ARUMUGAM T V, DRUMMOND G R, et al. Importance of T lymphocytes in brain injury, immunodeficiency, and recovery after cerebral ischemia[J]. Journal of Cerebral Blood Flow & Metabolism, 2012, 32(4): 598-611. |
| [2] |
JIN R, YANG G, LI G. Inflammatory mechanisms in ischemic stroke:role of inflammatory cells[J]. Journal of leukocyte biology, 2010, 87(5): 779-789. |
| [3] |
NOACK M, MIOSSEC P. Th17 and regulatory T cell balance in autoimmune and inflammatory diseases[J]. Autoimmunity Reviews, 2014, 13(6): 668-677. |
| [4] |
GUO Y, CHEN X, LI D, et al. PR-957 mediates neuroprotection by inhibiting Th17 differentiation and modulating cytokine production in a mouse model of ischaemic stroke[J]. Clinical & Experimental Immunology, 2018, 193(2): 194-206. |
| [5] |
GELDERBLOM M, WEYMAR A, BERNREUTHER C, et al. Neutralization of the IL-17 axis diminishes neutrophil invasion and protects from ischemic stroke[J]. Blood, 2012, 120(18): 3793-3802. |
| [6] |
KLEINSCHNITZ C, KRAFT P, DREYKLUFT A, et al. Regulatory T cells are strong promoters of acute ischemic stroke in mice by inducing dysfunction of the cerebral microvasculature[J]. Blood, 2013, 121(4): 679-691. |
| [7] |
高阳, 王桂倩, 王健, 等. 丹参川芎嗪注射液临床应用专家共识[J]. 中国中药杂志, 2019(14): 2937-2942. GAO Y, WANG G Q, WANG J, et al. Expert consensus statement on DanshenChuanxiongqin Injection in clinical practice[J]. China Journal of Chinese Materia Medica, 2019(14): 2937-2942. |
| [8] |
施新猷, 陈伟.人类疾病的动物模型[J].现代医学实验动物学, 2000, 623. SHI X Y, CHEN W. Modern medical laboratory zoology[M]. Beijing: People's Military Medical Press, 2000, 623. |
| [9] |
CHEN J, LI Y, WANG L, et al. Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats[J]. Stroke, 2001, 32(4): 1005-1011. |
| [10] |
KORN T, BETTELLI E, OUKKA M, et al. IL-17 and Th17 Cells[J]. Annual review of immunology, 2009, 27: 485-517. |
| [11] |
YOSEF N, SHALEK A K, GAUBLOMME J T, et al. Dynamic regulatory network controlling TH17 cell differentiation[J]. Nature, 2013, 496(7446): 461-468. |
| [12] |
Fehérvari Z, Sakaguchi S. CD4+ Tregs and immune control[J]. The Journal of Clinical Investigation, 2004, 114(9): 1209-1217. |
| [13] |
JOSEFOWICZ S Z, LU L F, RUDENSKY A Y. Regulatory T cells:mechanisms of differentiation and function[J]. Annual Review of Immunology, 2012, 30: 531-564. |
| [14] |
LITTMAN D R, RUDENSKY A Y. Th17 and regulatory T cells in mediating and restraining inflammation[J]. Cell, 2010, 140(6): 845-858. |
| [15] |
BREA D, AGULLA J, Rodríguez-Yá?ez M, et al. Regulatory T cells modulate inflammation and reduce infarct volume in experimental brain ischaemia[J]. Journal of Cellular and Molecular Medicine, 2014, 18(8): 1571-1579. |
| [16] |
LI P, MAO L, LIU X, et al. Essential role of program death 1-ligand 1 in regulatory T-cell-afforded protection against blood-brain barrier damage after stroke[J]. Stroke, 2014, 45(3): 857-864. |
| [17] |
袁晓捧, 甘家丽, 李悠悠, 等. 丹参素防治脑缺血-再灌注损伤的机制及研究进展[J]. 中风与神经疾病杂志, 2019, 36(6): 571-573. YUAN X P, GAN J L, LI Y Y, et al. Mechanism and research progress of Danshensu in preventing and treating cerebral ischemia-reperfusion injury[J]. Journal of Apoplexy and Nervous Diseases, 2019, 36(6): 571-573. |
| [18] |
陶梦丹, 夏一雪, 廉伟, 等. 丹参素抗血栓作用机制的研究[J]. 世界中医药, 2017, 12(2): 121-122. TAO M D, XIA Y X, LIAN W, et al. Study on the antithrombotic mechanism of Danshensu[J]. World Journal of Traditional Chinese Medicine, 2017, 12(2): 121-12. |
| [19] |
陈裕琳, 万海同, 周惠芬, 等. 丹参与红花有效成分配伍对大鼠脑缺血再灌注损伤的保护作用[J]. 中草药, 2018(16): 22. CHEN Y L, WAN H T, ZHOU H F, et al. Dan participates in the protective effect of safflower effective composition on cerebral ischemia-reperfusion injury in rats[J]. Chinese Herbal Medicine, 2018(16): 22. |
| [20] |
XU H, LIU W X, LIU T L, et al. Synergistic neuroprotective effects of Danshensu and hydroxysafflor yellow A on cerebral ischemia-reperfusion injury in rats[J]. Oncotarget, 2017, 8(70): 115434. |
| [21] |
ZHANG T, GU J, WU L, et al. Neuroprotective and axonal outgrowth-promoting effects of tetramethylpyrazine nitrone in chronic cerebral hypoperfusion rats and primary hippocampal neurons exposed to hypoxia[J]. Neuropharmacology, 2017, 118: 137-147. |
| [22] |
ZHANG G, ZHANG T, LI N, et al. Tetramethylpyrazine nitrone activates the BDNF/Akt/CREB pathway to promote post-ischaemic neuroregeneration and recovery of neurological functions in rats[J]. British journal of pharmacology, 2018, 175(3): 517-531. |
| [23] |
CHANG C Y, KAO T K, CHEN W Y, et al. Tetramethylpyrazine inhibits neutrophil activation following permanent cerebral ischemia in rats[J]. Biochemical and biophysical research communications, 2015, 463(3): 421-427. |
| [24] |
WANG A, ZHU G, QIAN P, et al. Tetramethylpyrazine reduces blood brain barrier permeability associated with enhancement of peripheral cholinergic anti inflammatory effects for treating traumatic brain injury[J]. Experimental and therapeutic medicine, 2017, 14(3): 2392-2400. |
| [25] |
关婷, 刘佳馥, 王思思. 丹参川芎嗪注射液治疗脑血栓患者的临床疗效及SOD, MDA, LPA和内皮素的作用分析[J]. 世界中医药, 2019(9): 24. GUAN T, LIU J F, WNG S S. Clinical effect of salvia miltiorrhizaligustrazine injection on patients with cerebral thrombosis and analysis of the effects of SOD, MDA, LPA and endothelin[J]. World Journal of Traditional Chinese Medicine, 2019(9): 24. |
| [26] |
陈国宁, 林泽辉, 杜永明, 等. 丹参川芎嗪注射液对缺血性脑卒中患者同型半胱氨酸, 高敏C反应蛋白和血脂水平的影响及疗效观察[J]. 中国医药导报, 2018, 15(1): 76-79. CHEN G N, LIN Z H, DU Y M, et al. The effect of DanshenChuanxiongzine Injection on homocysteine, high-sensitivity C-reactive protein and blood lipid levels in patients with ischemic stroke and its therapeutic effect[J]. China Medical Herald, 2018, 15(1): 76-79. |
 2020, Vol. 39
2020, Vol. 39