文章信息
- 石睿, 贺明帅, 吕佳霖, 王荣荣, 姜苗苗
- SHI Rui, HE Mingshuai, LYU Jialin, WANG Rongrong, JIANG Miaomiao
- 植物石胡荽中愈创木内酯型倍半萜类化学成分的研究进展
- Research progress on chemical constituents of guaiacolide-type Sesquiterpenes from Centipeda minima
- 天津中医药大学学报, 2020, 39(4): 464-469
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(4): 464-469
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.04.21
-
文章历史
收稿日期: 2020-01-15
春黄菊族属于菊科管状花亚科,在我国分布广泛,该族多种药用植物具有悠久的使用历史[1]。其中,石胡荽属是春黄菊族中一类具有代表性的属,在全世界有6种,在中国仅有一种石胡荽,又名鹅不食草(Centipeda minima),系菊科植物鹅不食草的干燥全草,性辛,温,归肺经;有发散风寒,通鼻窍,止咳的功效;用于风寒头痛,咳嗽痰多,鼻塞不通,鼻渊流涕。石胡荽主要生长于海拔300~1 900 m的阴湿处,在中国主要分布于南方地区,包括浙江、湖北、江苏等地[2]。该属植物含有多种结构多变的愈创木内酯型倍半萜。目前,研究者从石胡荽中共分离得到33种愈创木内酯型倍半萜类化学成分,有些具有良好的抗肿瘤活性、抗炎活性、抗氧化活性及抗病毒活性[3],为近年来研究的热点。为了更加充分合理地保护和利用石胡荽的植物资源,本文对石胡荽的倍半萜类化学成分的研究情况予以系统地分析和综述。
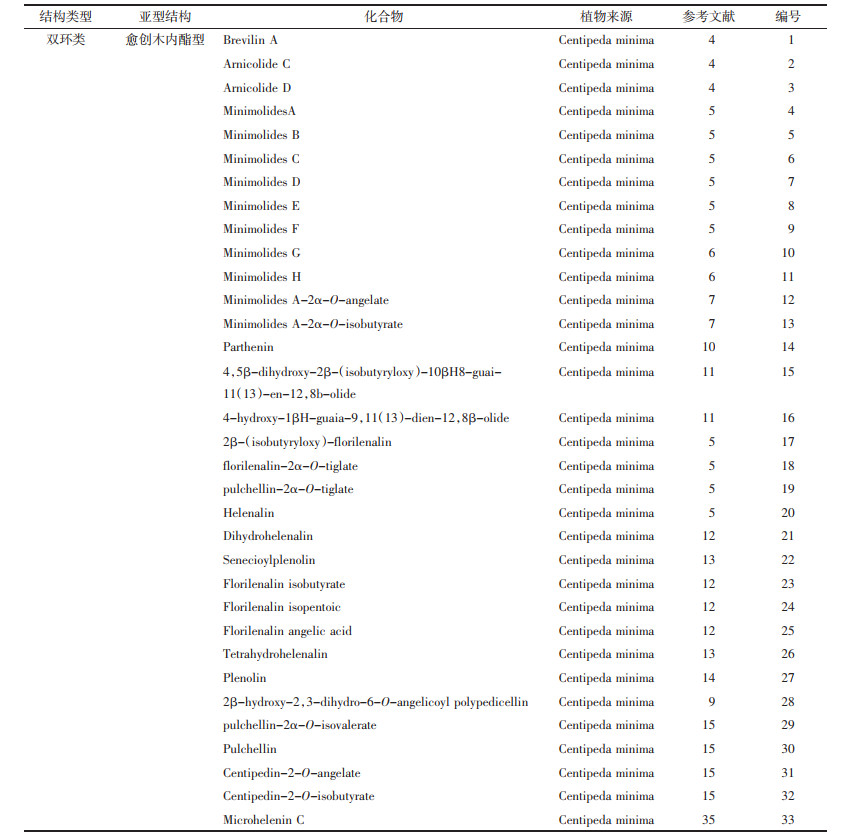
1 倍半萜化学成分研究倍半萜(sesquiterpenoid)系指由3个异戊二烯单位构成,含有15个碳原子的有机化合物类群。目前,研究者从石胡荽中提取并分离出多种愈创木内酯型倍半萜,见图 1,表 1:brevilin A(1)、arnicolide C(2)、arnicolide D[4, 8](3)、minimolides A(4)、minimolides B(5)、minimolides C(6)、minimolides D(7)、minimolides E(8)、minimolides F[5](9)、minimolides G(10)、minimolides H[6](11)、minimolides A-2α-O-angelate(12)、minimolides A-2α-O-isobutyrate[7](13)、parthenin[10](14)、4,5β-dihydroxy-2β-(isobutyryloxy)-10βH-guai-11(13)-en-12,8β-olide(15)、4-hydroxy-1βH-guaia-9,11(13)-dien-12,8α-olide(16)、2β-(isobutyryloxy)-florilenalin[11](17)、florilenalin-2α-O-tiglate(18)、pulchellin-2α-O-tiglate(19)、helenalin[5](20)、dihydrohelenalin[12](21)、senecioylplenolin[13](22)、florilenalin isobutyrate(23)、florilenalin isopentoic(24)、florilenalin angelic acid[12](25)、tetrahydrohelenalin[13](26)、plenolin[14](27)、2β-hydroxyl-2,3-dihydrogen-6-O-angeloplenolin[9](28)、pulchellin-2α-O-isovalerate(29)、pulchellin(30)、centipedin-2-O-angelate(31)、centipedin-2-O-isobutyrate[15](32)、microhelenin C[35](33)。
|
| 图 1 从石胡荽中分离得到的倍半萜类化学成分 |
Jorh[18]总结倍半萜类化合物的主要生物合成途径一般可大致分为不同的阶段,首先是以乙酰辅酶A为原料生成3-羟基-3-甲基戊二酸单酰辅酶A(HMG-CoA),后者经酶还原生成甲戊二羟酸(MVA)。MVA经数步的酶促反应还原得到焦磷酸异戊烯酯(IPP)及其双键异构体焦磷酸二甲基烯丙酯(DMPP),两者经环化酶[16]还原缩合为相应的焦磷酸香叶酯类,然后进一步与IPP反应缩合成焦磷酸金合欢酯(FPP)。倍半萜类化合物生源上的关系来自于FPP这一前体化合物,不同的倍半萜类生物合成的酶与FPP结合,经过异构化、离子化、重排等反应过程形成结构各异的倍半萜类化合物,见图 2。在机理上,这主要是因为其合成过程和反应中环的数量和位置的明显差异所致。1998年从菊苣中分离得到吉马烷A合成酶[(+)-germacrene A synthase]证明了吉马烷A(germacrene A)是愈创木烷型和桉烷型的前体[17-18],而吉马烷A前体C4-C5环氧化形成愈创木内酯型骨架结构[19]。石胡荽倍半萜内酯属于愈创木内酯,A环含α,β -不饱和内酯基团,C/B环在7,8位相连,而6位大多数具有当归酰、甲基丙烯酰和甲基巴豆酰等基团取代,特异性很强,增强了化合物的生理活性[20-21],因此,该类化合物有望成为抗肿瘤,特别是抗鼻咽癌药物的先导化合物。

|
| 图 2 愈创木内酯型倍半萜生源关系流程图 |
目前,国内外对于石胡荽中化学成分的多种生物活性研究重点集中在抗肿瘤活性、抗炎活性、抗氧化活性及抗病毒活性等以下几个方面,见表 2。
肿瘤是当前严重危害人类健康的重大疾病。通过对石胡荽中愈创木内酯型倍半萜进行大量的分子结构与构效关系的研究,研究者发现α-亚甲基-γ-丁内酯(α-Methylene-γ-butyrolactones)(图 3)是其具有较高抗癌活性的活性基团[22]。从石胡荽中提取分离得到的brevilin A(1)及一些堆心菊灵衍生物等愈创木内酯类倍半萜[23]具有较强的抗肿瘤活性。陈仲良和Robin[24]对石胡荽中分离出的brevilin A(1)在体内和体外对结肠腺癌CT26细胞进行了机制研究,体外实验表明brevilin A(1)有效提高了活性氧基团或分子(ROS)水平,降低了细胞的线粒体膜电位,并使其呈剂量依赖性地诱导CT26细胞凋亡;体内实验表明,brevilin A(1)能有效抑制PI3K、AKT和mTOR的磷酸化[25, 29],促进相关蛋白如LC3-II、Beclin1和ATG5的磷酸化表达以及诱导自噬小体的形成。结果表明,brevilin A(1)的抗肿瘤活性主要是通过诱导细胞凋亡和自噬实现。此外,从石胡荽中分离得到的arnicolide C(2)和arnicolide D(3)被认为是治疗鼻咽癌的有效成分[31]。一项新的研究结果表明[28],NF-κB被临床证实可以作为黑色素瘤诊断和治疗的重要分子靶点,而从石胡荽中分离得到的一种倍半萜内酯arnicolide D(3)具有明显的抗黑色素瘤的作用,体内和体外实验均证实,arnicolide D(3)可抑制IKKα/β的活性,抑制IκBα的降解,并有效抑制NF-κB的磷酸化和活性表达。
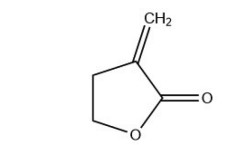
|
| 图 3 α-亚甲基- γ-丁内酯母核结构 |
近年来,研究者对石胡荽抗鼻咽癌活性的兴趣愈发浓厚,郭育卿[36]在研究中发现,石胡荽乙醇提取物对人鼻咽癌上皮细胞(CNE-1)具有明显的抑制增殖和诱导凋亡的作用。最近的研究表明,从石胡荽中分离得到具有抗鼻咽癌活性的倍半萜内酯类化合物。林雨珊[37]在体外研究中发现,石胡荽中的brevilin A(1)、arnicolide C(2)、arnicolide D(3)3种愈创木内酯型倍半萜具有明显的抗鼻咽癌活性。另外,Su[38]发现石胡荽中的一种倍半萜内酯2β-(isobutyryloxy)-florilenalin(20)对人鼻咽癌上皮细胞(CNE-1)生长具有时间依赖性抑制和诱导CNE细胞凋亡的作用。这种诱导与线粒体膜电位((ΔΨm)降低和细胞色素C释放到胞浆中调节Bcl-2家族蛋白的表达有关,这些行为导致了细胞凋亡的过程。
3.2 抗炎活性覃仁安[26]等发现石胡荽挥发油成分通过减少传统炎症介质组胺和5-羟色胺(5-HT)的释放,从而抑制小鼠棉球肉芽肿和蛋清致大鼠足肿胀。张煌[27]用水蒸气蒸馏法和硅胶柱色谱法共得到4个石胡荽挥发油(VOCM)组分VOCM1、VOCM2、VOCM3和VOCM4,将4个组分配成注射剂对SD大鼠进行腹腔注射给药,发现VOCM的抗炎镇痛活性组分主要分布在VOCM2和VOCM3两部分。此外,从石胡荽中分离得到的helenalin(23)[33]可能是通过抑制TLR4信号转导和NF-κB激活而产生NO,从而显著减弱各种炎症细胞因子,包括肿瘤坏死因子-α(TNF-α)白细胞介素-6(IL-6)和白细胞介素-1(IL-1),以更好地达到保护肝脏细胞的目的。
3.3 抗氧化活性先前的研究发现石胡荽全草具有显著的抗氧化活性,但对其抗氧化的作用机制尚不明确[30]。最近的一项研究结果表明,从石胡荽中分离得到了两种具有显著抗氧化活性的愈创木内酯类倍半萜6-O-angeloylplenolin(16)和arnicolide D(3),可有效保护神经细胞免受氧化应激,激活Nrf2信号传导通路并有效抑制诱导神经变性的ROS的产生,证明其在预防和改善神经退行性心脑血管疾病方面具有巨大的潜力。
3.4 抗病毒活性1项最近的研究表明[32],从石胡荽中分离得到的brevilin A(1)不仅具有良好的抗肿瘤活性,还可通过抑制病毒RNA的合成、病毒mRNA的表达及M和NS片段的编码的蛋白质,以及病毒核糖核蛋白(VRNPs)的核输出,从而达到对抗抗药性甲型流感病毒(IAV)的作用。
4 结语综上所述,研究者从石胡荽中已分离得到33种不同结构类型的倍半萜类化合物。目前国内外已开始对本属植物进行深入研究,因此,本文旨在揭示石胡荽中愈创木内酯类倍半萜的化学成分基础,为进一步开展作用机制研究和产品开发奠定基础。
| [1] |
蒋林. 春黄菊族药用植物[J]. 中药材, 2004, 27(5): 320-325. JIANG L. Medicinal plants of Anthemideae[J]. Journal of Chinese medicinal materials, 2004, 27(5): 320-325. |
| [2] |
中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1993: 18. Editorial Committee of flora of China, Chinese Academy of Sciences. Flora of China[M]. Beijing: Science Press, 1993: 18. |
| [3] |
郭立敏. 天然倍半萜类化合物抗炎作用机制的研究进展[J]. 中国中药杂志, 2018, 43(20): 3989-3999. GUO L M. Research progress in anti-inflammatory mechanism of natural sesquiterpenes[J]. China Journal of Chinese Materia Medica, 2018, 43(20): 3989-3999. |
| [4] |
蒲首丞. 鹅不食草抗肿瘤活性的研究[J]. 安徽农业科学, 2013, 41(36): 13833-13834. PU S C. Study on the antitumor activity of Centipeda minima[J]. Journal of Anhui Agricultural Sciences, 2013, 41(36): 13833-13834. |
| [5] |
WU P. Supercritical fluid extraction assisted isolation of sesquiterpene lactones with antiproliferative effects from Centipeda minima[J]. Phytochemistry, 2012, 76: 133-140. |
| [6] |
WU P. Two new sesquiterpene lactones from the supercritical fluid extract of Centipeda minima[J]. Journal of Asian Natural Products Research, 2012, 6: 515-520. |
| [7] |
WU P.Two new sesquiterpene lactones from the Volatile Oil of Centipeda minima[C]. 1994-2018 China Academic Journal Electronic Pbulishing House, 2010.
|
| [8] |
ROBIN S L. Antibacterial constituents of the nepalese medicinal herb, Centipeda mimina[J]. Phytochemistry, 1998, 4: 631-634. |
| [9] |
吴和珍. 鹅不食草醋酸乙酯部位化学成分的研究[J]. 时珍国医国药, 2010, 5(5): 1096-1098. WU H Z. Study on the chemical constituents of ethyl acetate from Centipeda mimina[J]. Lishizhen Medicine and Materia Medica Research, 2010, 5: 1096-1098. |
| [10] |
YU H W, WRIGHT C W, CAI Y, et al. Antiprotozoal activities of centipeda minima[J]. Phytochemistry Research, 1994, 8: 436-438. |
| [11] |
LIANG H X, BAO F K. Two new antibacterial sesquiterpenoids from Centipeda minima[J]. Chemistry & Biodiversity, 2007, 4: 2810-2816. |
| [12] |
BOHLMANN F, CHEN Z L. New guaianolides from Centipeda minina[J]. KeXue Tongbao, 1984, 29(7): 900-903. |
| [13] |
WU J B, EBIZUKA Y. Biologically active constituents of Centipeda minima:sesquiterpenes of potential anti-allergy[J]. ChemicalL & Pharmaceutical Bulletin, 1991, 39(12): 3272-3275. |
| [14] |
蒲首丞.中药鹅不食草和天胡荽的化学成分及其抗肿瘤活性研究[D].天津: 天津大学, 2009: 32-80. PU S C. Study on the chemical constituents and antitumor activity of Centipeda minima and Hydrocotyle sibthorpioides[D]. Tianjin: Tianjin University, 2009: 32-80. http://cdmd.cnki.com.cn/Article/CDMD-10056-2010090199.htm |
| [15] |
李药兰.一种鹅不食草总倍半萜内酯提取物及其制备方法和应用: 中国, 101732383[P]. 2010-06-16. LI Y L. A total sesquiterpene lactone extract from Centipeda minima and its preparation and Application: China, 101732383[P]. 2010-06-16. |
| [16] |
赵晓丹.活性愈创木烷内酯组合物的制备及其相关生合成的研究[D].沈阳: 沈阳药科大学, 2004. ZHAO X D. Preparation of active guaiacolactone composition and its related biosynthesis[D]. Shenyang: Shenyang Pharmaceutical University, 2004. |
| [17] |
DE KRAKER J W, FRANSSEN M C R, DE GROOT D E, et al. (+)-Germacrene a biosynthesis. The committed step in the biosynthesis of bitter sesquiterpene lactones in chicory[J]. Plant Physiology, 1998, 117(4): 1381-1392. |
| [18] |
JORH B. Plant terpenoid synthases:molecular biology and phylogenetic analysis[J]. Biochemistry, 1998(95): 4126-4133. |
| [19] |
吴立军. 天然药物化学[M]. 第六版. 北京: 人民卫生出版社, 2014. WU L J. Natural pharmaceutical chemistry[M]. 6th Edition. Beijing: People's Health Press, 2014. |
| [20] |
林雨珊. 鹅不食草中倍半萜内酯成分及其抗肿瘤活性的研究[J]. 中南药学, 2019, 17(3): 356-360. LIN Y S. Studies on sesquiterpene lactones and their antitumor activities in Centipeda minima[J]. Central South Pharmacy, 2019, 17(3): 356-360. |
| [21] |
JOHANSSON M H. Reversible michael additions:covalent inhibitors and prodrugs[J]. Mini Reviews in Medicinal Chemistry, 2012, 12(13): 1330-1344. |
| [22] |
HEINDEL N D. Synthesis and Antibacterial and Anticancer Evaluations of α-Methylene-γ-butyrolactones[J]. Journal of Pharmaceutical Sciences, 1981, 70(1): 84-86. |
| [23] |
徐静. 倍半萜内酯化合物药理作用[J]. 中国热带医学, 2007, 7(4): 623-624. XU J. Pharmacological action of sesquiterpene lactones[J]. China Tropical Medicine, 2007, 7(4): 623-624. |
| [24] |
ROBIN S L. Antibacterial constituents of the nepalese medicinal herb, Centipeda mimina[J]. Phytochemistry, 1998, 4: 631-634. |
| [25] |
YOU P T. Brevilin A induces apoptosis and autophagy of colon adenocarcinoma cell CT26 via mitochondrial pathway and PI3K/AKT/mTOR inactivation[J]. Biomedicine & Pharmacotherapy, 2018(98): 619-625. |
| [26] |
覃仁安. 鹅不食草挥发油抗炎作用及机制研究[J]. 中国医院药学杂志, 2006, 96(4): 369-371. QIN R A. Study on the anti-inflammatory effect and mechanism of the essential oil fromCentipeda mimina[J]. Chinese Journal of Hospital Pharmacy, 2006, 96(4): 369-371. |
| [27] |
张煌. 鹅不食草挥发油的抗炎镇痛活性[J]. 光谱实验室, 2013, 30(4): 1913-1921. ZHANG H. The anti-inflammatory and analgesic activities of the essential oil of Centipeda mimina[J]. Chinese Journal of Spectroscopy Laboratory, 2013, 30(4): 1913-1921. |
| [28] |
ZHU P L. Arnicolide D exerts anti-melanoma effects and inhibits the NF-κB pathway[J]. Phytomedicine, 2019. |
| [29] |
QIN Y G, LU H. In vitro evaluation of anti-hepatoma activity of Brevilin A:involvement of Stat3/Snail and Wnt/β-catenin pathways[J]. Royal society of chemisty, 2019, 9: 4390-4396. |
| [30] |
WANG Y J. Ethanol Extract of Centipeda minima Exerts Antioxidant and Neuroprotective Effects via Activation of the Nrf2 Signaling Pathway[J]. Oxidative Medicine and Cellular Longevity, 2019. |
| [31] |
LIU R, DOW C B, MOK D K, et al. Centipeda minima, Arnicolide D, from the herb is a therapeutic candidate against nasopharyngeal carcinoma[J]. Molecules, 2019, 24(10). |
| [32] |
ZHANG X, XIA Y, YANG L. Brevilin A, a sesquiterpene lactone, inhibits the replication of influenza avirus in vitro and in vivo[J]. Viruses, 2019, 11(9). |
| [33] |
LI Y, ZENG Y, HUANG Q, et al. Helenalin from Centipeda minima ameliorates acute hepatic injury by protecting mitochondria function, activating Nrf2 pathway and inhibiting NF-κB activation[J]. Biomedicine and Pharmacotherapy, 2019, 119: 109435. |
| [34] |
王育苗. 鹅不食草化学成分的研究[J]. 海峡药学, 2019, 31(8): 84-86. WANG Y M. Studies on the chemical constituents of Centipeda minima[J]. Strait Pharmaceutical Journal, 2019, 31(8): 84-86. |
| [35] |
LEE K H, IMAFURA Y. Antitumor sesquiterpene lactones Fr. omhelenium microcephalum:Isolation of mexicanin-E and structuralcharacterization of microhelenin-B and C[J]. Phytochemistry, 1977, 16(3): 393-395. |
| [36] |
GUO Y Q. Study on the inhibition of proliferation and induction of apoptosis of CNE-1 cells by Centipeda minima extracts[J]. Beijing, Peking Union Medical College, 2013, 22-50. |
| [37] |
林雨珊. 鹅不食草中倍半萜内酯成分及其抗肿瘤活性的研究[J]. 中南药学, 2019, 17(3): 356-360. LIN Y S. Studies on sesquiterpene lactones and their antitumor activities in Centipeda minima[J]. Central South Pharmacy, 2019, 17(3): 356-360. |
| [38] |
SU M L. 2β-(Isobutyryloxy)florilenalin, a sesquiterpene lactone isolated from the medicinal plant Centipeda minima, induces apoptosis in human nasopharyngeal carcinoma CNE cells[J]. Molecules, 2009, 14: 2135-2146. |
 2020, Vol. 39
2020, Vol. 39