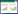文章信息
- 朱凤, 楚思, 吴慧, 刘与进, 范恒
- ZHU Feng, CHU Si, WU Hui, LIU Yujin, FAN Heng
- 复方苦参灌肠剂急性毒性及直肠黏膜刺激实验研究
- Experimental study on acute toxicity and rectal mucosal stimulation of compound sophorae enema
- 天津中医药大学学报, 2020, 39(5): 559-563
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(5): 559-563
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.05.18
-
文章历史
收稿日期: 2020-05-31
溃疡性结肠炎是一种病因未明的结肠和直肠的慢性非特异性炎症性疾病,病变局限于大肠黏膜及黏膜下层,临床以腹痛及排便异常为特征[1-2],本病缠绵难愈,严重影响患者身心健康[3],其西药治疗效果有限,且长期治疗多伴有严重不良反应。复方苦参灌肠剂是由华中科技大学同济医学院附属协和医院中医科研制的能有效治疗溃疡性结肠炎的验方,此中药复方具有清热燥湿、生肌止血、凉血解毒功效,中药结合西药治疗溃疡性结肠炎,其临床效果明显优于单纯西药治疗[4-5],且显著提高患者生活质量。虽然多数中药、天然药物作用相对温和,毒性轻,但是近年来随着对中药及其制剂的广泛应用和对毒性研究的不断深入,发现一些补益的中药和许多普遍认为“无毒”的中药也存在一定的毒副作用[6]。本研究依据《中药、天然药物急性毒性研究指导原则》的要求[7],探讨了复方苦参灌肠剂灌肠给药对小鼠的急性毒性以及对大鼠多次直肠给药后的刺激反应,结果报道如下。
1 实验药物 1.1 急性毒性实验复方苦参灌肠剂浓缩液:由湖北省中医院药剂科提供,批号:20181022。复方苦参灌肠剂:苦参600 g,地榆炭600 g,白及400 g,青黛200 g,甘草300 g,三七粉100 g,仙鹤草300 g,薏苡仁600 g,黄柏400 g,黄连400 g,秦皮400 g,白头翁300 g,煎煮2次,浓缩至3 290 mL,无菌分装14瓶,药物浓度约为1.40 g/mL,成人每日用量为230 g生药/60 kg,其中随机选取1瓶用生理盐水稀释两倍,浓度为0.7 g/mL。
1.2 直肠黏膜刺激实验复方苦参灌肠剂由华中科技大学同济医学院附属协和医院药剂科提供,批号:20181022。苦参30 g,地榆炭30 g,白及20 g,青黛10 g,甘草15 g,三七5 g,仙鹤草15 g,薏苡仁30 g,黄柏20 g,黄连20 g,秦皮20 g,白头翁15 g,浓缩至150 mL,每日剂量为230 g生药/60 kg。
2 实验动物 2.1 急性毒性实验SPF级昆明小鼠60只,体质量18~22 g,雌雄各半,由华中科技大学同济医学院实验动物中心提供,合格证编号为SCXK(鄂)2016-0009。饲养于华中科技大学实验动物中心,室温:(22±3)℃,相对湿度:55%~60%,无对流风,人工昼夜(12 h白昼、12 h黑夜)。适应性喂养1周后开始实验。
2.2 直肠黏膜刺激实验SPF级SD大鼠20只,体质量150~200 g,雌雄各半,由华中科技大学同济医学院实验动物中心提供,合格证编号为SCXK(鄂)2016-0009。
3 实验方法 3.1 急性毒性实验因复方苦参灌肠剂毒性低,动物灌肠给药受药物浓度和体积限制,测不出半数致死量(LD50),故进行最大给药量实验。取4~5周18~22 g SPF级昆明小鼠40只,其中雌雄小鼠均各随机分为2组,每组10只,将4组小鼠不同性别之间随机匹配分为2组,每组20只,雌雄各半,分为正常对照组和实验组。正常对照组予以生理盐水灌肠,实验组予以0.7 g/mL复方苦参灌肠剂灌肠,灌肠体积为0.04 mL/g。
3.2 直肠黏膜刺激实验依据参考文献[8],SPF级SD大鼠20只,其中雌雄大鼠均各随机分为2组,每组5只,将4组小鼠不同性别之间随机匹配分为2组,每组10只,雌雄各半,分为正常对照组和实验组。实验组以临床用药量、临床给药途径相同的方式,按体表面积等效剂量换算成给药剂量,大鼠每日给药11.0 g生药/kg(大鼠)。正常对照组予以等量生理盐水灌肠。给药前予以10%水合氯醛将大鼠麻醉,实验前禁食不禁水4 h,给药后2 h结束禁食,每日给药1次,连续给药7 d。
4 观察指标 4.1 急性毒性实验给药前动物禁食不禁水12 h,实验当天24 h内分别灌肠给予浓度为0.7 g/mL的复方苦参灌肠剂和生理盐水,按0.04 mL/g体积灌肠两次,灌肠前进行麻醉处理,灌肠完成后用棉花为小鼠保暖。观察并记录给药后30 min、2 h及随后14 d小鼠外观、行为、饮食、排泄物及毒性反应,每日称体质量;记录14 d内死亡小鼠数,死亡小鼠立即解剖,观察其内脏病理变化,若有肉眼可观察到的异常变化则进行病理检查。所有小鼠实验第15天脱颈处死,解剖观察心、肝、脾、肺、肾、结肠病理变化,每组各取雌雄1只,内脏组织标本经甲醛固定、石蜡包埋、切片、苏木精-伊红(HE)染色后,光镜下观察药物对各脏器的影响。
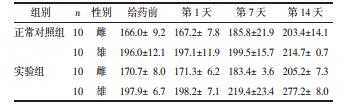
4.2 直肠黏膜刺激实验每日观察大鼠毒性反应情况,详细记录症状出现、加重、减轻或死亡的时间和出现反应的动物数量,计算动物病死率。给药后24 h时每组处死1只大鼠,解剖观察直肠黏膜充血、水肿情况,按照表 1评分判断刺激性,并行病理学检查。第8天每组解剖5只动物,剩余4只动物停药继续观察1周。同样肉眼观察解剖动物直肠黏膜有无充血、红肿等现象。按照表 1以积分评价方法判断药物对直肠黏膜是否有刺激性,并进行组织病理学检查。如果病理检查结果有异常,则停药观察的大鼠需做组织病理学检查;如果检查结果无异常,则停药观察的动物只需行解剖肉眼观察。
实验数据以均数±标准差(x±s)表示,组间比较采用两独立样本t检验,P < 0.05为差异有统计学意义。
6 实验结果 6.1 急性毒性实验结果 6.1.1 各组小鼠病死率及一般情况变化14 d内各组小鼠病死率及临床变化如下:实验组及正常对照组小鼠在两次灌肠30 min内,由于处于麻醉状态出现倦怠懒动、饮食减少,毛发、排泄物均正常,2 h后恢复反应灵敏,活动自如,饮食正常,口鼻无异常分泌物,连续观察14 d,动物一般情况良好,活动自如,皮毛光滑,饮食及二便未见明显异常;无死亡小鼠,实验结束处死所有小鼠,解剖肉眼观察小鼠心、肝、脾、肺、肾、结肠等主要脏器未见明显异常。见表 2。
灌肠给药复方苦参灌肠剂后,连续观察14 d小鼠体质量变化情况。实验表明,给药后,两组小鼠在给药后体质量均较前增加,给药后实验组体质量增长与正常对照组比较无统计学差异(P>0.05)。见表 3。
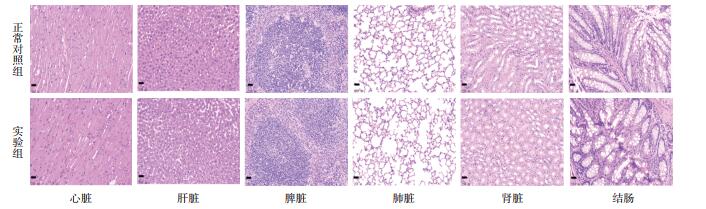
两组小鼠心、肝、脾、肺、肾及结肠组织标本HE染色结果见图 1。正常对照组与实验组的心、肝、脾、肺、肾及结肠组织均无明显病理改变。各组心脏组织心肌细胞排列有序,细胞着色未见异常,肝组织细胞排列紧密,细胞形态良好,肝小叶结构完整;肺组织肺泡结构清晰,间隔正常,管壁结构良好;脾组织淋巴细胞排列紧密,无淤血和点状坏死;肾组织结构清晰,肾小球正常;肠黏膜完整,黏膜下层腺体排列完好,可散见杯状细胞,各组各个脏器无明显炎性细胞浸出、纤维化和坏死等病理变化。
|
| 图 1 两组小鼠各器官病理染色结果( 200x ) |
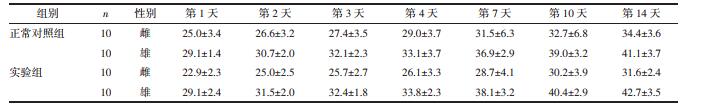
实验组及正常对照组大鼠每日给药后30 min内均出现倦怠懒动,考虑与麻药作用有关,毛发色泽及排泄物均正常,2 h后恢复正常活动状态。直至观察期结束,大鼠死亡情况见表 4,实验大鼠均未出现毒性反应。见表 4。
两组大鼠体质量均呈现增长趋势,且两组比较无统计学差异。见表 5。
给药24 h时各组解剖1只大鼠观察直肠黏膜,两组均无充血、水肿现象,灌肠部位黏膜完整,无异常分泌物,血管走形清晰。连续给药7 d后每组解剖5只大鼠观察直肠黏膜,两组直肠黏膜结构正常,黏膜完整,无异常分泌物、局部硬结及充血水肿等。两组剩余4只动物停药继续观察1周,均未见明显异常。评分结果见表 6及表 7。
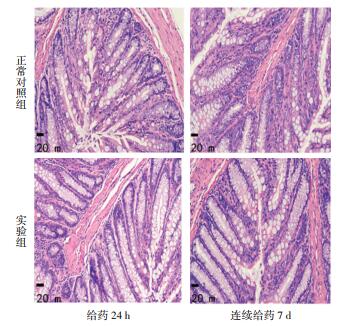
正常对照组:肠黏膜完整,无溃疡,黏膜腺体间无淋巴细胞浸润,浅表无糜烂及不典型增生,可见散在杯状细胞。实验组:肠壁黏膜全层关系清晰,结构无改变,无糜烂、溃疡,黏膜腺体间无淋巴细胞浸润,可见杯状细胞。两组直肠病理检查结果均正常。见图 2。
|
| 图 2 两组直肠病理检查结果( 200x) |
急性毒性实验是一次性给予实验动物某种受试物后,观察在短时间内对实验动物所产生的毒性反应的实验方法[9-10]。复方苦参灌肠剂临床给药成人每日剂量为230 g/60 kg,小鼠灌肠一次性最大给药量为1 680 g/60 kg,应用复方苦参灌肠剂对小鼠进行急性毒性实验,以可灌肠最高浓度0.7 g/mL,24 h内灌肠给药两次(相当于成人临床每日等效用量的14.6倍)。连续观察14 d,未见动物出现毒性反应,体质量变化无统计学差异,病理组织检查未见明显变化,因此本品小鼠灌肠最大耐受剂量>1 680 g/60 kg。在本次实验条件下,复方苦参灌肠剂多次直肠给药对大鼠直肠黏膜无刺激性,且对大鼠体质量及直肠病理检查无明显改变。
8 结论急性毒性实验表明复方苦参灌肠剂在最大给药量时对小鼠内脏无急性毒副作用,故临床拟用灌肠剂量是安全的。直肠黏膜刺激实验表明复方苦参灌肠剂多次直肠给药对大鼠直肠黏膜无刺激性,对黏膜组织无病理性损伤。因此该药临床灌肠给药安全可靠,值得临床推广应用。
| [1] |
KORNBLUTH A, SACHAR D B. Ulcerative colitis practice guidelines in adults:American College Of Gastroenterology, Practice Parameters Committee[J]. The American Journal of Gastroenterology, 2010, 105(3): 501-23. DOI:10.1038/ajg.2009.727 |
| [2] |
UNGARO R, MEHANDRU S, ALLEN P B, et al. Ulcerative colitis.Lancet[J], 2017, 389(10080): 1756-1770.
|
| [3] |
王振霞. 试论心理护理干预对慢性溃疡性结肠炎患者焦虑、抑郁情绪及躯体症状的影响[J]. 心理月刊, 2020, 15(11): 109. WANG Z X. The influence of psychological nursing intervention on anxiety, depression and physical symptoms in patients with chronic ulcerative colitis[J]. Psychology Monthly, 2020, 15(11): 109. |
| [4] |
徐萌, 范恒. 清热燥湿凉血方治疗溃疡性结肠炎82例临床分析[J]. 中西医结合研究, 2015, 7(2): 79-80. XU M, FAN H. Clinical analysis of 82 cases of ulcerative colitis treated with Qingrezaoshiliangxue Decoction[J]. Journal of Integrated Traditional Chinese and Western Medicine, 2015, 7(2): 79-80. |
| [5] |
董亚兰, 范恒. 复方苦参汤治疗溃疡性结肠炎102例临床分析[J]. 中西医结合研究, 2016, 8(5): 248-250. DONG Y L, FAN H. Clinical analysis of 102 cases of ulcerative colitis treated by Compound Sophorae Decoction[J]. Research on Integrated Chinese and Western Medicine, 2016, 8(5): 248-250. |
| [6] |
叶明远. 重视中药及其制剂的不良反应[J]. 中草药, 2003, 34(8): 22-23. YE M Y. Pay attention to the adverse reactions of traditional Chinese medicine and its preparations[J]. Chinese Herbal Medicine, 2003, 34(8): 22-23. |
| [7] |
《中药、天然药物急性毒性试验技术指导原则》课题研究组.中药、天然药物急性毒性研究指导原则[S].编号: [Z]GPT2-1. The research group of Guiding Principles of Acute Toxicity Test Techniques of Chinese Medicines and Natural Medicines. Guiding Principles of Acute Toxicity Research of Chinese Medicines and Natural Medicines[S]. Number: [Z] GPT2-1. |
| [8] |
王北婴, 李仪奎. 中药新药研制开发技术与方法[M]. 上海: 上海科学技术出版社, 2001. WANG B Y, LI Y K. Research and development technology and methods of new drugs of traditional Chinese medicine[M]. Shanghai: Shanghai Science and Technology Press, 2001. |
| [9] |
王治乔, 袁伯俊. 新药临床前评价与实践[M]. 北京: 军事医学科学出版社, 1998. WANG Z Q, YUAN B J. Preclinical evaluation and practice of new drugs[M]. Beijing: Military Medical Science Press, 1998. |
| [10] |
张陆勇. 中药新药临床前安全性评价[J]. 传染病药学, 2003, 13(1): 1-4. ZHANG L Y. Preclinical safety evaluation of new Chinese medicines[J]. Pharmacy of Infectious Diseases, 2003, 13(1): 1-4. |
 2020, Vol. 39
2020, Vol. 39