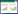文章信息
- 李娜, 于光志, 张葆青, 王晓
- LI Na, YU Guangzhi, ZHANG Baoqing, WANG Xiao
- 祛湿通络方对肺炎支原体感染的RAW264.7细胞TNF-α、IL-6表达的影响
- Effect of Qushi Tongluo Formulation on TNF-α and IL-6 expression in RAW264.7 infected with mycoplasma pneumoniae
- 天津中医药大学学报, 2020, 39(5): 564-569
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(5): 564-569
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.05.19
-
文章历史
收稿日期: 2020-06-06
2. 山东中医药大学附属医院儿科, 济南 250014
2. Department of Pediatrics, Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Jinan 250014, China
肺炎支原体肺炎(MPP)是儿童社区获得性肺炎的常见类型之一,部分患儿在经过正规大环内酯类抗生素治疗1周或以上,仍见持续发热、临床症状或影像学表现加重,称为难治性肺炎支原体肺炎(RMPP)[1-2]。RMPP与MPP相比,具有对常规大环内酯类抗生素治疗效果差、病情进展快、易产生严重并发症等特点,严重危害患儿健康。
目前RMPP的发病机制尚不完全明确,可能与大环内酯类抗生素耐药、免疫应答失调、合并感染、过度的炎症反应及治疗延迟等有关[3]。西医对于RMPP的治疗主要为在常规阿奇霉素治疗基础上加用糖皮质激素和免疫球蛋白,但目前尚无规范的疗程与剂量,且无法确立其独立疗效,并有导致免疫抑制等风险。近年来,中医药对于MPP及RMPP的临床研究日益深入,其中“祛湿通络方”是导师张葆青教授根据多年临床经验,以“甘露消毒丹”为主方化裁而成的经验方,临床取得了良好的治疗效果。因此,本研究对于RMPP的发病机制及祛湿通络方对本病的作用机制进行初步探索。
1 材料与仪器 1.1 实验动物SPF级SD大鼠,体质量200~220 g,雄性,健康,清洁级,购买于山东百朋生物科技有限公司,动物合格证编号:SCXK(鲁)20140007。实验动物饲养于山东省疾病预防控制中心SPF级的动物房中,环境温度18~22 ℃,湿度40%~70%,自然光线照射,给予普通饲料喂养,自由进食及饮水,避免噪音及其他干扰。大鼠饲料及垫料由山东鲁抗集团提供。适应性喂养1周,每日上午电子秤称取质量,记录每只大鼠体质量。活动、二便等均未见异常即进行实验。
1.2 细胞株及菌株RAW264.7细胞株,购自中国科学院上海生命科学研究院。MP标准菌株(ATCC-15531),购自上海宝录生物科技有限公司。
1.3 实验药物祛湿通络方:江阴天江中药免煎颗粒,购自山东中医药大学附属医院,组成:黄芩12 g(批号:1706015),黄连6 g(批号:18050571),虎杖12 g(批号:18071221),藿香12 g(批号:18032561),桃仁9 g(批号:1702029),茵陈15 g(批号:18071081),芦根30 g(批号:17121121),石菖蒲12 g(批号:18041591),甘草6 g(批号:1802009)。阿奇霉素分散片(君洁):鲁南贝特制药有限公司,批号:38180501,0.25 g/片。
1.4 试剂南美特级胎牛血清(LONSERA S711-001S),1 M HePes(Solarbio H1095-100,100 mL),台盼蓝染色液(0.4%,Solarbio C0040-50,50 mL),苯酚红(国药集团化学试剂有限公司,批号:20171026),二甲基亚砜(DMSO,Solarbio D8371-50,50 mL,批号:1213C0340),支原体肉汤(PPLO肉汤,海博HB8475,批号:20170427),支原体琼脂培养基(海博HB7025-3,250 g,批号:201803028),DMEM高糖培养液(Corning 10-013-CVR,500 mL,批号:22517004),肿瘤坏死因子-α(TNF-α)酶联免疫吸附(ELISA)试剂盒(华美CSB-E04741m,96 T,批号:U07019527),白细胞介素-6(IL-6)ELISA试剂盒(华美CSB-E04594m,96 T,批号:U02018095)。
1.5 主要仪器低温冰箱Forma Model 702(美国Thermo公司),常温、低温高速离心机(德国Eppendorf公司),Infinite M200酶标仪(瑞士Tecon公司),DMI 4000B荧光倒置显微镜(德国Leica公司),超净工作台(苏州净化公司),二氧化碳(CO2)细胞培养箱(美国Thereto fisher公司),移液器(德国Eppendorf公司),细胞计数板(Watson 177-112C)。
2 方法 2.1 RAW264.7细胞培养待细胞长满细胞瓶底部80%时,以1:3传代,置于37 ℃、5% CO2培养箱中培养,收集对数增长期细胞备用。细胞存活率检测(Trypanblue染色):用计数板计数活细胞和死细胞(死细胞呈蓝色,活细胞拒染)。计数时,只计上线与右线的细胞(或只计下线与左线的细胞)。细胞存活率=活细胞总数/(活细胞总数+死细胞总数)×100%。细胞存活率≥96%。
2.2 肺炎支原体(MP)培养将MP菌体接种于PPLO固体培养基与液体培养基中对照培养,置于5%CO2、37 ℃恒温箱培养1~2周。CCU浓度测定步骤:取11支无菌小试管,按1~10编号,取PPLO肉汤完全培养基1.8 mL分别装入试管。取200 μL处于对数生长期的菌种加入1号试管中,依次按1:10递减稀释。将所有试管加盖硬胶塞并用封口膜封口,于5%CO2、37 ℃恒温箱中培养,每日观察颜色有无变化以及液体有无浑浊改变。菌液发生颜色改变的最高稀释度为颜色改变单位(留取浓度为106~107 CCU/mL的菌液备用)。
2.3 含药血清的制备40只SD大鼠采用随机数字表随机分为空白对照组、中药(低、中、高剂量)组、阿奇霉素组。祛湿通络方免煎颗粒浓缩至2 g/mL,给药剂量参考徐叔云《药物试验方法学》(第3版):按20 kg小儿用量为中剂量折算,换算成大鼠的剂量为:人的临床剂量×(鼠的剂量折算系数÷人的剂量折算系数)=人的临床剂量×(0.71÷0.11),低剂量为0.5倍给药,高剂量2倍给药。中药低、中、高剂量组大鼠灌胃3次/d,空白对照组和阿奇霉素组灌胃1次/d,连灌7 d,末次灌胃后1 h,均进行心尖采血。将装有大鼠血液的促凝管静置2 h,无菌条件下用离心机离心(离心半径12 cm,3 000 r/min,15 min)分离血清。用0.22 μL的滤器分装、标记在1.5 mL EP管中,-20 ℃保存备用。
2.4 细胞分组及给药采用随机数字表随机设置空白对照组、模型组、中药低、中、高剂量组和阿奇霉素组,每组设3个复孔。1)空白对照组:DMEM完全培养液100 μL+空白含药血清100 μL。2)模型组:MP菌液100 μL+空白含药血清100 μL。3)中药低剂量组:MP菌液100 μL+中药低剂量含药血清100 μL。4)中药中剂量组:MP菌液100 μL+中药中剂量含药血清100 μL。5)中药高剂量组:MP菌液100 μL+中药高剂量含药血清100 μL。6)阿奇霉素组:MP菌液100 μL+阿奇霉素含药血清100 μL。模型组和各给药组分别加入MP菌液100 μL,使其最终浓度为10 MOI(MP/细胞)细胞计数[4],空白对照组加入等体积DMEM完全培养液,置于培养箱中培养2 h后吸出培养液,分别按上述要求加入含药血清100 μL,培养4、8、16、24 h后收集细胞上清液,-80 ℃保存,备测。
2.5 TNF-α、IL-6检测采取ELISA方法检测,操作按试剂盒说明书进行。
2.6 统计学处理用SPSS 22.0进行统计分析,实验均重复至少3次,实验数据以均数±标准差(x±s)表示,多组间比较用单因素方差分析,组间两两比较采用LSD-t检验,P < 0.05为差异有统计学意义。
3 结果 3.1 MP形态MP生长缓慢,培养10 d后,菌落中心致密隆起,深入琼脂,周边较薄,形成“荷包蛋样”菌落。生化鉴定结果为培养物能发酵葡萄糖,不发酵尿素和精氨酸,符合MP的特性[5]。
3.2 MP诱导的RAW264.7细胞形态学表现镜下发现,空白对照组细胞小而圆,视野下轮廓清晰,有光泽,如葡萄串珠状。细胞在MP刺激后,形状变大,光泽度减弱,伸出伪足,多为不规则形态或梭形。见图 1及图 2。

|
| 图 1 RAW264.7细胞24 h形态学表现(20x) |

|
| 图 2 MP诱导的RAW264.7细胞24h形态学表现(20x) |
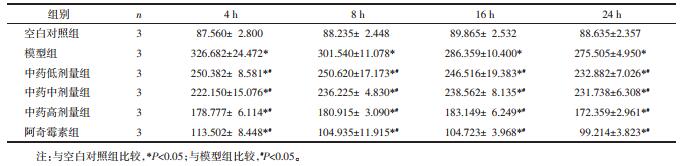
结果显示,模型组、各给药组与空白对照组比较,差异均具有统计学意义(P < 0.05),表明在MP的感染下,各组RAW264.7细胞TNF-α的分泌均显著上升;各给药组与模型组比较,差异均具有统计学意义(P < 0.05),表示各给药组均对TNF-α具有不同程度的下调作用,其中阿奇霉素组对TNF-α的调节作用最优,中药含药血清各组呈现出剂量依赖性。见表 1。
模型组及各给药组与空白对照组比较,差异均具有统计学意义(P < 0.05),表明在MP的感染下,各组RAW264.7细胞IL-6的分泌显著上升;与模型组比较,中药低剂量组在干预4、8、16、24 h时无统计学差异(P>0.05),其余各组均具有统计学差异(P < 0.05),表明阿奇霉素组对IL-6的调节作用最优,除中药低剂量组外,中药中、高剂量组对IL-6均具有不同程度的下调作用。见表 2。
MP是儿童社区获得性呼吸道感染的重要病原,可引起以间质病变为主的急性肺部炎症,同时也是引起全身性病变(如脑炎、心肌炎、肝炎、关节炎、凝血功能障碍、免疫紊乱等肺外组织或器官病变)的重要致病菌之一。由于其结构缺乏细胞壁,对作用于细胞壁的抗生素药物(如青霉素与头孢菌素类)固有耐药,主要选用大环内酯类药物(红霉素、阿奇霉素等)治疗,但近年来发现耐药率明显增加,治疗效果欠佳。而且由于抗生素耐药、过强的免疫炎症反应等多种原因,少数患者迁延不愈,易发展成为RMPP。
目前RMPP的治疗主要以大环内酯类抗生素为主,但其用药时间长,不良反应明显,且耐药性日趋严重,疗效亦有所下降,因此探求有效的中医药制剂已成为广泛关注的热点。中医学对RMPP的病因认识大致分为内、外因两个方面,强调其发病与肺、脾两脏关系密切。就其内因而言,肺、脾功能失调,是发病的基础。究其外因,多责之于外感六淫邪气及非时之感,寒热失调,邪犯肺卫而发病。罗磐真认为RMPP是由外邪犯肺,毒蕴化热,炼液为痰,痰阻气机,肺气上逆,则见咳喘气急;邪正抗争,相持未减,则高热不退,强调邪气外犯是其发病主因[6]。姚凤莉根据“湿为阴邪,其性氤氲黏腻”,并结合RMPP缠绵难愈的特点,认为RMPP属于湿热证范畴[7]。李新民认为湿邪内生、湿热互结为重症MP的病机关键,湿热内蕴,肺气郁闭,出现热势高、稽留难退的临床特点[8]。李贵尤强调血瘀的重要性,认为肺炎难愈之根本,多由病程日久,气机被郁而出现血瘀之象,进一步得出痰、瘀、闭、虚为RMPP的发病机制[9]。治疗上马融提出清热解毒、活血化瘀、泻下通腑3大治疗大法[10]。姜之炎灵活运用“通补肺络法”,以益气健脾、祛瘀消痰为主要治则[11]。李新民采取清上、畅中、渗下三焦同治,清热、利湿、解毒三法并行[12]。王雪峰重视清肺解毒,配以活血化瘀法,提出应注意中病即止,以防过用苦寒,损脾伤胃[13]。综上,笔者认为湿热内蕴是RMPP的病理基础,MPP患儿的发热多表现为弛张热,午后热甚,发热而不欲饮,面色如常而无红赤,此为湿遏热伏,郁蒸于内而致。湿热内蕴,气机阻滞,可见脘腹胀闷;湿性缠绵黏滞,则汗出热不解,口中黏腻,便溏不爽。痰、瘀、闭、虚为其病机关键,治疗上应清热祛湿与化痰通络相结合,则湿热得解,痰瘀得消,病症得除。
“祛湿通络方”是以“甘露消毒丹”为主方,根据张葆青教授多年临床经验化裁而成。“甘露消毒丹”为清代叶天士所创,首载于《续名医类案》,后由王孟英收入《温热经纬》,善利湿化浊、清热解毒,主治湿温初起,邪在气分,湿热并重证。“祛湿通络方”(组成:黄芩、黄连、虎杖、藿香、桃仁、茵陈、芦根、石菖蒲、甘草)是由“甘露消毒丹”去滑石、川贝母、木通、白豆蔻、薄荷、连翘、射干,加桃仁、虎杖、黄连、芦根组成。方中茵陈、黄芩、黄连、虎杖并用增强清利湿热之功,芦根清热生津以防热盛津耗,桃仁、虎杖活血通络以调畅肺气。在甘露消毒丹清热、芳化、利湿的基础上加上通络之法,与RMPP的湿-毒-瘀互结的病理机制更加契合。诸药合用,共奏清热解毒、化痰祛湿、祛瘀通络之效。
MP感染的免疫应答包括机体的免疫清除、免疫紊乱、病原体的免疫逃逸,这些免疫机制异常均促进了RMPP的发生。多项研究表明炎症细胞因子参与了MP感染的免疫发病机制[14-15]。RMPP患儿存在高细胞因子血症,过度产生的细胞因子TNF-α、IL-6等[16]通过与细胞膜上特异性受体结合而发挥作用,是造成患儿肺部损伤的重要原因。
TNF-α是由激活的单核-巨噬细胞合成和释放,且具有广泛生物学活性的炎性介质,其生物学活性作用可根据其浓度高低而有所不同。在正常情况下,机体内TNF-α的浓度较低,有抗肿瘤、抗感染、促进B细胞增殖分化等多种生理功能,可调节免疫应答,是机体免疫防护的重要介质。当TNF-α浓度过高时,反而会作为重要的炎症递质介导炎症反应的病理生理过程,能增加微血管壁的通透性,并刺激中性粒细胞及内皮细胞表面黏附受体,趋化中性粒细胞等炎症细胞,启动炎症反应,介导感染引起的炎症损害。MP感染亦可诱发TNF-α的产生,而增加的TNF-α还可刺激淋巴细胞、单核细胞等产生其他细胞因子参与免疫炎症反应。研究表明[17],RMPP患儿血清TNF-α水平明显高于非RMPP。此外,RMPP患儿TNF-α水平明显升高[18],且与病情严重程度呈正相关[19]。
IL-6是机体T细胞经过活化后分泌的一种重要免疫调节因子,也可被TNF-α诱导或多细胞生成。在机体免疫应答初期,作用于血管内皮细胞,可与TNF-α共同参与调节炎症反应。IL-6作为一种促炎因子,是细胞因子家族中的核心成员。研究表明[20],IL-6与过度免疫有关,可作为病情严重程度及预后的评估指标。饶鸣皋[21]发现RMPP患儿的IL-6水平明显高于普通MPP组,认为RMPP的病情演变极有可能与IL-6有关。史良俊等[22]指出在急性期和恢复期RMPP的IL-6水平均高于普通MPP组,提示RMPP患儿伴有肺组织细胞损伤,且在恢复期仍持续存在。提示IL-6在RMPP发病机制中发挥重要作用,并与病情轻重密切相关,对RMPP的诊断和治疗具有重要参考价值。
本研究结果显示,阿奇霉素、祛湿通络方均对MP诱导的RAW264.7细胞IL-6、TNF-α高表达具有下调作用,为目前中医药治疗MPP提供实验依据。但MP感染是多细胞因子共同参与的过程,其感染后细胞因子的表达也是一个复杂过程,并且体外细胞上细胞因子的表达与临床上儿童MPP或RMPP仍有区别。由于炎症反应调控机制及中药成分的复杂性,几个炎症反应调控指标的观察尚不能确定祛湿通络方的确切作用靶点及作用机制。因此,MP感染后IL-6、TNF-α如何在基因水平上表达以及祛湿通络方如何在转录水平上调节细胞因子的表达,需要进一步研究。
| [1] |
陈志敏, 赵顺英, 王颖项, 等. 肺炎支原体感染的若干问题[J]. 中华儿科杂志, 2016, 54(2): 84-87. CHEN Z M, ZHAO S Y, WANG Y X, et al. Problems of mycoplasma pneumoniae infection[J]. Chinese Journal of Pediatrics, 2016, 54(2): 84-87. |
| [2] |
The Subspecialty Group of Respiratory Disease, The Society of Pediatrics, Chinese Medical Association, et al. Guidelines for management of community acquired pneumoniain children[J]. Chinese Journal of Pediatrics, 2013, 51(10): 745-749. |
| [3] |
付红敏, 聂文莎. 难治性肺炎支原体肺炎诊治中应关注的问题[J]. 中华实用儿科临床杂志, 2008, 33(12): 891-894. FU H M, NIE W S. Problems to be paid attention to in the diagnosis and treatment of mycoplasma pneumoniae refractory[J]. Chinese Journal of Practical Pediatrics, 2008, 33(12): 891-894. |
| [4] |
张涵, 马晶, 张云凌, 等. 肺炎支原体感染RAW264[J]. 中国病原生物学杂志, 2014, 9(6): 496-499. ZHANG H, MA J, ZHANG Y L, et al. Expressionof RAW264.7NLRP3 inflammasome and downstream molecule in mycoplasma pneumoniae infection[J]. Journal of Pathogen Biology, 2014, 9(6): 496-499. |
| [5] |
车艳杰, 于霏, 高玉梅, 等. 猪肺炎支原体DJ-166株的分离鉴定[J]. 中国兽药杂志, 2016, 50(3): 6-10. CHE Y J, YU F, GAO Y M, et al. Isolation and identification of mycoplasma pneumoniae DJ-166 strain[J]. Chinese Journal of Veterinary Medicine, 2016, 50(3): 6-10. |
| [6] |
BEBAR C M, PEREYRE S. Mechanisms of drug resistance in mycoplasma pneumonia[J]. CNS & Neurological Disorders-durg Targets, 2005, 5(3): 263-271. |
| [7] |
辛德莉, 侯安存, 魏田力, 等. 肺炎支原体对大环内酯类药物的耐药分析[J]. 中华儿科杂志, 2005, 43(3): 212. XIN D L, HOU A C, WEI T L, et al. Resistance of mycoplasma pneumoniae to macrolides[J]. Chinese Journal of Pediatrics, 2005, 43(3): 212. |
| [8] |
牛波, 池跃朋, 帅金凤, 等. 儿童难治性肺炎支原体肺炎免疫机制探讨[J]. 中国医药导报, 2016, 13(6): 107-110. NIU B, CHI Y P, SHUAI J F, et al. Immune mechanism of mycoplasma pneumonia in children with refractory pneumonia[J]. China Medical Journal, 2016, 13(6): 107-110. |
| [9] |
HASSAN J, IRWIN F, DOOLEY S, et al. MycoPlasma pneumoniae infection in a pediatric population:analysis of soluble immunemarkers as risk factors for asthma[J]. Human Immunology, 2008, 69(12): 851-855. DOI:10.1016/j.humimm.2008.09.003 |
| [10] |
SHIN J E, CHEON B R, SHIM J W, et al. Increased risk of refractory Mycoplasma pneumoniae pneumonia in children with atopic sensitiza-tion and Asthma[J]. Korean Journal of Pediatrics, 2014, 57(6): 271-277. DOI:10.3345/kjp.2014.57.6.271 |
| [11] |
杨海军. 小儿肺炎支原体肺炎85例临床分析[J]. 中国当代医药, 2015, 22(25): 93-96. YANG H J. Clinical analysis of 85 cases of mycoplasma pneumoniae in children[J]. China Contemporary Medicine, 2015, 22(25): 93-96. |
| [12] |
沈晓玲, 张爱丽, 季伟. 小儿肺炎支原体感染后免疫功能的变化研究[J]. 临床肺科杂志, 2011, 16(10): 1613-1614. SHEN X L, ZHANG A L, JI W. Changes of immune function after mycoplasma pneumoniae infection in children[J]. Journal of Clinical Lung, 2011, 16(10): 1613-1614. |
| [13] |
ZHANG Y, ZHOU Y, LI S, et al. The clinical characteristics and predictors of refractory mycoplasma pneumoniae pneumonia in Children[J]. Plos One, 2016, 11(5): e0156465. DOI:10.1371/journal.pone.0156465 |
| [14] |
LU A, WANG C, ZHANG X, et al. Lactate dehydrogenase as a biomarker for prediction of refractory mycoplasma pneumoniae pneumonia in Children[J]. Respiratory Care, 2015, 1469. |
| [15] |
TANAKA H, NARITA M, TERAMOTO S, et al. Role of interleukin-18 and T-helper type 1 cytokines in the development of mycoplasma pneumoniae pneumonia in adults[J]. Chest, 2002, 121(5): 1493. DOI:10.1378/chest.121.5.1493 |
| [16] |
YOUN Y S, LEE K Y. Mycoplasma pneumiae pneumonia in children[J]. Korean Journal of Pediatrics, 2012, 55(2): 42-47. DOI:10.3345/kjp.2012.55.2.42 |
| [17] |
WANG M, WANG Y, YAN Y, et al. Clinical and laboratory profiles of refractoryMycoplasma pneumoniae pneumonia in children[J]. International Journal of Infectious Diseases, 2014, 12(29): 18-23. |
| [18] |
陈良东, 周建波, 张廷, 等. 肺炎支原体肺炎患儿TNF-α, IL-6, IL-8及T细胞亚群变化意义[J]. 临床肺科杂志, 2011, 16(9): 1374-1375. CHEN L D, ZHOU J B, ZHANG T, et al. The significance of TNF-α, IL-6, IL-8 and T cell subsets in children with mycoplasma pneumoniae pneumonia[J]. Journal of Clinical Pulmonary Medicine, 2011, 16(9): 1374-1375. |
| [19] |
穆亚平, 李娜, 刘立呈. 儿童肺炎支原体肺炎血清细胞因子变化及临床意义[J]. 中国小儿急救医学, 2011, 18(6): 504-507. MU Y P, LI N, LIU L C. Changes of serum cytokines of mycoplasma pneumoniae in children and its clinical significance[J]. Chinese Pediatric Emergency Medicine, 2011, 18(6): 504-507. |
| [20] |
MARTINEZ R, MENENDEZ R, REYES S, et al. Factors associated with inflammatory cytokine patterns in conmmunity-acquired pneumonia[J]. European Respiratory Journal, 2011, 37(2): 393-399. DOI:10.1183/09031936.00040710 |
| [21] |
饶鸣皋. 血清炎性因子在难治性肺炎支原体肺炎患儿中变化的临床意义[J]. 安徽药业, 2014, 18(9): 1710-1712. RAO M G. Clinical significance of serum inflammatory factors in children with refractory mycoplasma pneumonia[J]. Anhui Pharmaceutical, 2014, 18(9): 1710-1712. |
| [22] |
史良俊, 王俐, 张瑞连. RMMP患儿血清IL-2, IL-6, IL-10检测及分析[J]. 山东药业, 2011, 51(23): 86-87. SHI L J, WANG L, ZHANG R L. Detection and analysis of serum IL-2, IL-6, IL-10 in children with RMMP[J]. Shandong Pharmaceutical, 2011, 51(23): 86-87. |
 2020, Vol. 39
2020, Vol. 39