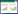文章信息
- 张姗姗, 姚梦雪, 范兰兰, 江瑜, 苏敏, 汪小莉, 洪燕, 韩燕全, 吴德玲
- ZHANG Shanshan, YAO Mengxue, FAN Lanlan, JIANG Yu, SU Min, WANG Xiaoli, HONG Yan, HAN Yanquan, WU Deling
- 多指标综合评分法正交实验优选菊花的炒制工艺
- Optimization of frying technology of Chrysanthemum by orthogonal test with multi-index comprehensive scoring method
- 天津中医药大学学报, 2020, 39(5): 570-575
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(5): 570-575
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.05.20
-
文章历史
收稿日期: 2020-05-22
2. 安徽中医药大学, 合肥 230031
2. Anhui University of Chinese Medicine, Hefei 230031, China
菊花为菊科植物菊(Chrysanthemum morifolium Ramat.)的干燥头状花序,其味苦、甘,性微寒,归肺、肝经,具有疏风清热、平肝明目、解毒消肿的功效[1]。菊花主要含有黄酮类、有机酸类、挥发油类等活性成分。现代药理研究表明菊花具有抗炎、抗菌、抗肿瘤、抗病毒和抗氧化等多种作用,目前临床多用于风热感冒、眩晕、目赤昏花等病症的治疗[2-4]。
炒菊花最先出现在宋代《类编朱氏集验医方》[5],后在明清时期发展成炒黑《药笼小品》[6]和煨炭《本草害利》[7]。清代《本草便读》[8]记载生菊花味甘性寒,善于平息肝风和肝火。脾胃虚寒,食少泄泻之病,应该少用(《本草汇言》)[9]。《实用中药炮制学》中指出菊花采用文火炒至微黄色,可以降低其寒性[10]。清代《外科大成》[11]记载“烧炭存性”,菊花炒炭后具有制寒止血的功效,而疏散风热等作用减弱(《新编中药志》)[12]。历版《中华人民共和国药典》(简称“中国药典”)均未收录炒菊花,而上海市2008年版《中药饮片炮制规范》和浙江省1986年版《中药饮片炮制规范》等[13-16]炮制规范收录了炒菊花,其炮制程度类似,以炒至表面微具焦斑或呈焦黑色为准。在菊花实际炒制过程中,具体的炮制工艺参数不清楚,炮制终点主要靠个人经验判断,导致炒菊花的质量参差不齐,进而影响其临床疗效。本实验采用多指标综合评分法正交实验,同时测定绿原酸、木犀草苷、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、木犀草素、芹菜素、总黄酮含量,并以这6种成分和总黄酮含量为考察指标,对菊花炒制工艺进行优化,以期为菊花炒制工艺的建立提供参考。
1 仪器及试剂与药品 1.1 仪器Aglient-8453型紫外分光光度计(济南赛场科学仪器有限公司),KDC-16H型离心机(科大创新股份有限公司中佳分公司),BZF-6050型真空干燥箱(上海博讯实业有限公司),BP211D型电子天平(德国Sartorius公司),KQ3200D型超声波清洗仪(江苏省昆山超声仪器有限公司),Waters Acquity型超高效液相色谱(UPLC)柱(美国Waters公司),AS-D400A红外线测温仪(武汉中测宏图测量仪器有限公司)。
1.2 试剂与药品绿原酸(批号:327-97-9),木犀草苷(批号:5373-11-5),3,4-二咖啡酰基奎宁酸(批号:12041114),3,5-二咖啡酰基奎宁酸(批号:2450-53-5),木犀草素(批号:491-70-3),芹菜素(批号:520-36-5),芦丁(批号:100080-200707),对照品均购买自成都曼思特生物科技有限公司,甲醇和乙腈均是色谱纯,水为屈臣氏蒸馏水,其他实验试剂均为分析纯。菊花购自亳州市佰世信中药饮片有限公司,批号:170803,经文章通讯作者韩燕全主任中药师鉴定为菊科植物菊(Chrysanthemum morifolium Ramat.)的干燥头状花序。采用UPLC法对菊花中绿原酸、木犀草苷、3,5-二咖啡酰基奎宁酸含量进行测定,结果均符合2015年版《中国药典》规定。
2 方法与结果 2.1 炒菊花的制备称取干净的菊花15 g,放入炒制容器内,按照2015年版《中国药典》(四部)炮制通则“0213”项下清炒法炮制,采用文火炒制,炒至菊花颜色呈现深黄色时取出,放置摊凉,筛去多余的碎屑,放于粉碎机中粉碎,留存备用。
2.2 方法学考察 2.2.1 色谱条件色谱柱:Waters Acquity BEH C18(2.1 mm×100 mm,1.7 μm);柱温30 ℃,流速0.2 mL/min,进样量为1 μL,以乙腈(A)-0.1%的磷酸(C)为流动相,检测波长为348 nm,梯度洗脱(0-4 min,18%~20%A;4-9 min,20%A;9-11 min,20%~25%A;11-13 min,25%~35%A;13-18 min,35%~10% A;18-20 min,10%~18% A;20-22 min,18%A)。在该色谱条件下,炒菊花与混合对照品色谱图见图 1。
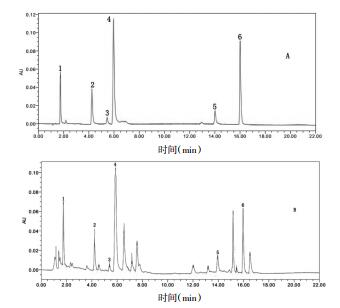
|
| 注:A:混合对照品; B:炒菊花。1:绿原酸; 2:木犀草苷; 3:3, 4-二咖啡酰基奎宁酸; 4:3, 5-二咖哨酰基奎宁酸; 5:木犀草素; 6:芹菜素。 图 1 混合对照品与炒菊花的UPLC图 |
分别精密称取绿原酸、木犀草苷、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、木犀草素、芹菜素对照品适量,置于10 mL容量瓶中,加70%甲醇定容至刻度,制成浓度分别为51 μg/mL绿原酸、25 μg/mL木犀草苷、8.3 μg/mL 3,4-二咖啡酰基奎宁酸、129 μg/mL 3,5-二咖啡酰基奎宁酸、7.2 μg/mL木犀草素、35 μg/mL芹菜素的混合对照品溶液。
2.2.3 供试品溶液的制备精密称取菊花粉末(过1号筛)0.25 g,置于50 mL具塞锥形瓶中,再精确量取70%甲醇25 mL,加入锥形瓶中,密封塞紧,称取重量,在功率为300 W,频率为45 kHz条件下超声提取40 min,放冷后,称取重量,采用浓度为70%甲醇补足减失的重量,混匀后,经0.22 μm的微孔滤膜过滤,然后取续滤液,即得。
2.2.4 线性关系考察分别精密吸取混合对照品溶液0.5、1、2、3、4、5 μL,根据上述色谱条件进样,以绿原酸、木犀草苷、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、木犀草素、芹菜素各对照品的浓度(μg/mL)为横坐标(X),以峰面积为纵坐标(Y)进行线性回归,结果见表 1。
精密吸取上述混合对照品溶液1 μL,按照上述色谱条件进样,重复进样6次,记录6种成分的峰面积,计算得到绿原酸、木犀草苷、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、木犀草素、芹菜素峰面积的相对标准偏差(RSD)值在0.12%~0.41%之间,表明仪器精密度良好。
2.2.6 稳定性实验分别精密吸取同一份炒菊花供试品溶液,分别在0、4、8、12、16、24 h进样,按照上述色谱条件测定,计算得到绿原酸、木犀草苷、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、木犀草素、芹菜素峰面积的RSD值在0.20%~1.06%之间,表明样品溶液在24 h内稳定。
2.2.7 重复性实验取同一份炮制品炒菊花分为6份,按照上述条件制备6份供试品溶液。按照上述色谱条件进样测定,计算得到绿原酸、木犀草苷、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、木犀草素和芹菜素6种指标成分含量的RSD值在0.19%~1.01%之间,说明供试品样品处理方法重复性良好。
2.2.8 加样回收率实验准备已明确其含量的6份炒菊花,根据上述条件制备6份供试品溶液,每份供试品精确吸取0.5 mL,在每份供试品中加入与样品中成分含量接近的对照品,混匀后,选择0.2 μm微孔滤膜过滤,根据上述色谱条件进样测定,计算得到绿原酸、木犀草苷、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、木犀草素和芹菜素的平均加样回收率在96.88%~110.3%之间,RSD在0.00%~0.48%之间,说明该方法准确良好。
2.3 总黄酮含量测定精密称取芦丁对照品5 mg,放于25 mL容量瓶中,加甲醇定容至刻度,混匀,即制备成浓度为200 μg/mL的芦丁对照品溶液,放置于冰箱保存,待用。
用移液管精确量取芦丁对照品溶液0、1、2、3、4、5 mL,各自放于25 mL容量瓶里,加蒸馏水6 mL,加5%亚硝酸钠(NaNO2)溶液1.0 mL,摇匀放置6 min,加10%硝酸铝[Al(NO3)3]溶液1.0 mL,摇匀放置6 min,加4%氢氧化钠(NaOH)溶液10 mL,加蒸馏水至刻度,摇匀,放置15 min。以第1管为空白对照,在510 nm波长处用紫外分光光度计测定A值[17]。以芦丁浓度为横坐标(X),A值为纵坐标(Ŷ),得到线性回归方程为Ŷ=16.03X-0.015 4,r=0.999 2。
精密量取样品溶液2 mL,按照上述方法进行操作,把波长设置成510 nm,依次用紫外分光光度计测定各个样品的A值,每个样品均需测3次,把样品的A值代入线性回归方程中,计算得到样品中总黄酮的含量。
2.4 数据处理与分析采用综合加权评分法评估菊花炒制工艺,根据其药理作用及药效方面的药用价值,将总黄酮的权重系数设为0.4,其他6个成分的权重系数分别设为0.1。综合评分=(总黄酮含量/总黄酮最大含量)×100×0.4+(绿原酸含量/绿原酸最大含量)×100×0.1+(木犀草苷含量/木犀草苷最大含量)×100×0.1+(3,4-二咖啡酰基奎宁酸含量/3,4-二咖啡酰基奎宁酸最大含量)×100×0.1+(3,5-二咖啡酰基奎宁酸含量/3,5二咖啡酰基奎宁酸最大含量)×100×0.1+(木犀草素含量/木犀草素最大含量)×100×0.1+(芹菜素含量/芹菜素最大含量)×100×0.1,优化菊花炒制工艺。
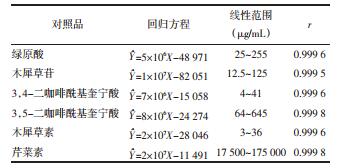
2.5 单因素实验 2.5.1 炒制温度考察称取干净的菊花饮片7份,每份15 g。将菊花放入炒制容器内,炒制温度分别设置成90、110、130、150、170、190、210 ℃,炒制时间为5 min。根据上述条件制备供试品溶液,根据上述色谱条件进样,计算各个样品中总黄酮和上述6个成分含量,并进行综合评分,结果见表 2。结果显示在炒制温度为130 ℃时,炒菊花的综合评分最高。
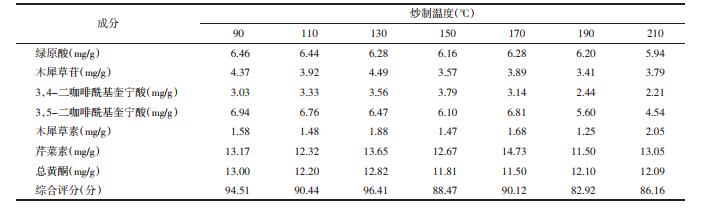
依据安徽中医药大学第一附属医院院内临方炮制炒菊花,以炒至深黄色为准,及2015年版《中国药典》(四部)炮制通则“0213”项下清炒法炒至微黄色或深黄色规定,把炒制时间设置为6个水平(5、6、7、8、9、10 min)。分别称取干净的菊花饮片6份,每份15 g。将菊花放入炒制容器内,分别炒制5、6、7、8、9、10 min。根据上述条件制备供试品溶液,根据上述色谱条件进样,计算各个样品中总黄酮和上述6个成分的含量,并进行综合评分,结果见表 3。结果表明当炒制时间为8 min时,综合评分最高。
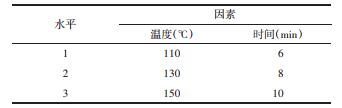
在单因素实验的基础上,以炒制温度和炒制时间为考察因素,每个因素选择3个水平,以菊花6种成分和总黄酮含量为综合评分指标。采用多指标正交实验法,优化菊花炒制工艺[18-20],因素水平见表 4。
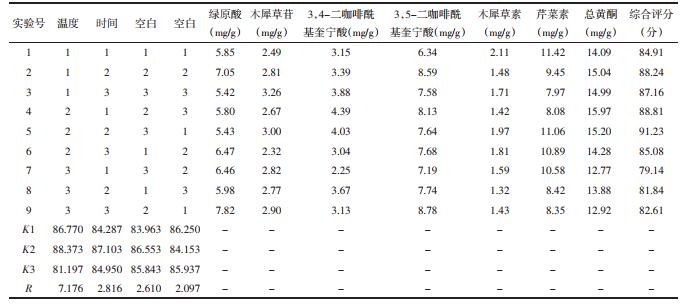
按照L9(34)正交表进行正交实验,按照上述条件制备供试品溶液,根据上述色谱条件进样,计算6种成分的含量。按照“2.3”项下方法计算总黄酮的含量。采用综合加权评分法,优化菊花炒制工艺,结果见表 5及表 6。
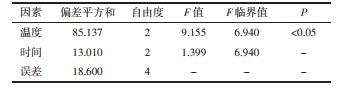
表 5和表 6结果显示,各因素对实验影响程度为炒制温度>炒制时间,在6~10 min炒制时间范围内,炒制时间对实验结果无显著影响,而炒制温度对实验结果有显著影响,差异具有统计学意义(P<0.05)。正交实验的结果表明菊花的最佳炒制工艺为炒制温度130 ℃,炒制时间8 min。
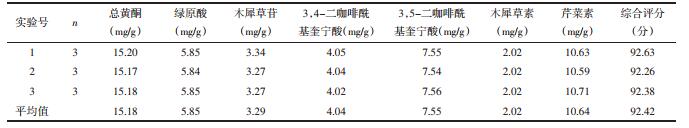
根据优选出的菊花炒制工艺制备3组炒菊花,对每组样品6种成分和总黄酮含量进行测定,得到3组验证实验的综合评分值,其综合评分值的RSD值为0.2%,说明此炒制方法稳定可行,结果如表 7所示。
实验考察了色谱柱、波长、柱温、进样量、流速和流动相等对色谱峰分离度的影响,最终确定色谱柱为Waters Acquity BEH C18(2.1 mm×100 mm,1.7 μm),波长为348 nm,柱温为30 ℃,进样量为1 μL,流速为0.2 mL/min,流动相为0.1%磷酸-乙腈。在此条件下各色谱峰基线平稳,分离度良好。本实验选择的检测方法可靠稳定。
炒菊花是安徽中医药大学第一附属医院特色临方炮制品种之一,其炒制工艺及炒制相关参数未见报道。炒制温度和炒制时间等炮制因素可能对饮片的质量产生影响。本实验通过单因素实验,确定炒制温度和炒制时间为影响菊花质量的主要因素。黄酮类和有机酸类等成分是菊花的主要活性成分,在菊花中含量较高。文献报道,黄酮类成分中木犀草素、芹菜素和木犀草苷具有抗氧化、清除自由基和修复肝细胞损伤等药理作用。有机酸类成分中3,4-二咖啡酰基奎宁酸和3,5-二咖啡酰基奎宁酸具有清除超氧化物阴离子自由基和抗氧化作用[21]。而且2015年版《中国药典》将绿原酸、木犀草苷、3,5-二咖啡酰基奎宁酸作为菊花的主要活性成分。因此,本课题选择炒制温度和炒制时间为考察因素,选择绿原酸、3,4-二咖啡酰基奎宁酸、3,5-二咖啡酰基奎宁酸、木犀草苷、木犀草素、芹菜素、总黄酮含量为考察指标,最终优选出菊花炒制工艺为炒制温度130 ℃,炒制时间8 min。同时对工艺进行验证,得到3组验证实验的综合评分值,其综合评分值的RSD值为0.2%,说明此炒制方法稳定可行。
| [1] |
国家药典委员会.中华人民共和国药典[S].北京: 中国医药科技出版社, 2015. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[S]. Beijing: China Medical Science and Technology Publishing House, 2015. |
| [2] |
GONG J, CHU B, GONG L, et al. Comparison of phenolic compounds and the antioxidant activities of fifteen chrysanthemum morifolium ramat cv.Hangbaiju in China[J]. Antioxidants (Basel), 2019, 8(8): 2-14. |
| [3] |
KUANG C L, LV D, SHEN G H, et al. Chemical composition and antimicrobial activities of volatile oil extracted from Chrysanthemum morifolium Ramat[J]. Food Science and Technology, 2018, 55(7): 2786-2794. |
| [4] |
GAO T, ZHU Z Y, ZHOU X, et al. Chrysanthemum morifolium extract improves hypertension-induced cardiac hypertrophy in rats by reduction of blood pressure and inhibition of myocardial hypoxia inducible factor-1alpha expression[J]. Pharmaceutical Biology, 2016, 54(12): 2895-2900. DOI:10.1080/13880209.2016.1190764 |
| [5] |
朱佐. 类编朱氏集验医方[M]. 上海: 商务印书馆, 1956. ZHU Z. Lei Bian Zhu Shi Ji Yan Yi Fang[M]. Shanghai: Commercial Press, 1956. |
| [6] |
彭静山. 药笼小品[M]. 沈阳: 辽宁科学技术出版社, 1983. PENG J S. Yao Long Xiao Pin[M]. Shenyang: Liaoning Science and Technology Press, 1983. |
| [7] |
凌奂. 本草害利[M]. 北京: 中医古籍出版社, 1982. LING H. Bei Cao Hai Li[M]. Beijing: Ancient Chinese Medicine Publishing House, 1982. |
| [8] |
张秉成. 本草便读[M]. 上海: 上海科学技术出版社, 1959. ZHANG B C. Ben Cao Bian Du[M]. Shanghai: Shanghai Science and Technology Press, 1959. |
| [9] |
倪朱谟. 本草汇言[M]. 北京: 中医古籍出版社, 2005. NI Z M. Ben Cao Hui Yan[M]. Beijing: Ancient Chinese Medicine Publishing House, 2005. |
| [10] |
邓来送, 刘荣禄. 实用中药炮制学[M]. 北京: 中国中医药出版社, 1993. DENG L S, LIU R L. Processing of practical Chinese medicine[M]. Beijing: China Traditional Chinese Medicine Press, 1993. |
| [11] |
祁坤. 外科大成[M]. 上海: 上海卫生出版社, 1957. QI K. Surgical Dacheng[M]. Shanghai: Shanghai Health Publishing House, 1957. |
| [12] |
肖培根. 新编中药志(第二卷)[M]. 北京: 化学工业出版社, 2000: 779-780. XIAO P G. New records of traditional Chinese medicine (Vol. 2)[M]. Beijing: Chemical Industry Press, 2000: 779-780. |
| [13] |
上海市卫生局.上海市中药饮片炮制规范[S].上海: 上海科学技术出版社, 1983. Shanghai Municipal Bureau of Health. Standard for processing Chinese Herbal Pieces in Shanghai[S]. Shanghai: Shanghai Science and Technology Press, 1983. |
| [14] |
上海市食品药品监督管理局.上海市中药饮片炮制规范[S].上海: 上海科学技术出版社, 2008. Shanghai Food and Drug Administration. Processing standard of Chinese Herbal Pieces in Shanghai[S]. Shanghai: Shanghai Science and Technology Press, 2008. |
| [15] |
浙江省卫生厅.浙江省中药炮制规范[S].浙江: 浙江科学技术出版社, 1986. Department of Health of Zhejiang Province. Processing standard of traditional Chinese medicine in Zhejiang Province[S]. Zhejiang: Zhejiang Science and Technology Press, 1986. |
| [16] |
浙江省食品药品监督管理局.浙江省中药炮制规范[S].浙江: 浙江科学技术出版社, 2016. Zhejiang Food and Drug Administration. Processing standard of traditional Chinese medicine in Zhejiang Province[S]. Zhejiang: Zhejiang Science and Technology Press, 2016. |
| [17] |
杨林林, 赵钰, 韩梅, 等. 北柴胡和狭叶柴胡中黄酮类成分及其关键酶基因表达的组织差异分析[J]. 中草药, 2019, 50(1): 188-194. YANG L L, ZHAO Y, HAN M, et al. Analysis of tissues difference of flavonoids and key enzyme genes expression in Bupleurum chinense and B[J]. Chinese Herbal Medicine, 2019, 50(1): 188-194. |
| [18] |
黄健军, 岑芳, 邓刚. 多指标综合评分结合正交试验法优选瑶药牛白藤的提取工艺[J]. 中药材, 2018, 41(8): 1937-1940. HUANG J J, CEN F, DENG G. Extraction technology optimization of Yao Medicine hedyotis hedyotidea by orthogonal test and and comprehensive scoring method[J]. Chinese Herbal Medicine, 2018, 41(8): 1937-1940. |
| [19] |
屠万倩, 张留记, 刘晓苗, 等. 多指标正交试验法优选牛膝酒炙工艺[J]. 中药材, 2018, 41(7): 1589-1592. TU W Q, ZHANG L J, LIU X M, et al. Optimization of wine-processing technology of achyranthis bidentatae radix by orthogonal test with muti-indexes[J]. Chinese Herbal Medicine, 2018, 41(7): 1589-1592. |
| [20] |
余意, 马方励, 胡明华, 等. 多指标综合评分-正交试验法优选清蒸法制熟地黄炮制工艺[J]. 中国药师, 2019, 22(1): 39-44. YU Y, MA F L, HU M H, et al. Processing procedure optimization of prepared radix rehmanniae by multiple index comprehensive score and orthogonal design[J]. Chinese Pharmacist, 2019, 22(1): 39-44. |
| [21] |
周瑞君.芹菜素对D-GalN/LPS诱发急性肝损伤的保护作用及其机制研究[D].苏州: 苏州大学, 2018. ZHOU R J. Protective effect of apigenin on D-GalN/LPS-induced acute liver injury and its possible mechanisms[D]. Suzhou: Suzhou University, 2018. |
 2020, Vol. 39
2020, Vol. 39