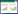文章信息
- 陈烨, 段真珍, 杨冬梨, 李琳, 李玉红
- CHEN Ye, DUAN Zhenzhen, YANG Dongli, LI Lin, LI Yuhong
- 丹红注射液通过改善线粒体功能障碍减轻缺氧/复氧诱导的心肌细胞损伤
- Danhong injection alleviates hypoxia/reoxygenation induced cardiomyocyte injury by improving mitochondrial dysfunction
- 天津中医药大学学报, 2020, 39(5): 576-581
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(5): 576-581
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.05.21
-
文章历史
收稿日期: 2020-06-08
2. 天津中医药大学中医药研究院, 天津 301617;
3. 天津市中药药理学重点实验室, 天津 301617;
4. 方剂学教育部重点实验室, 天津 301617
2. Institute of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. Tianjin Key Laboratory of Chinese Medicine Pharmacology, Tianjin 301617, China;
4. Key Laboratory of Pharmacology of Traditional Chinese Medical Formulae, Ministry of Education, Tianjin 301617, China
缺血性心脏病(IHD)严重威胁人类健康。虽然发达国家IHD发病率有所降低,但仍占35岁以上人群病死率的1/3[1]。目前临床采用经皮冠状动脉介入(PCI)、冠脉搭桥术等治疗手段,通过恢复血流供应达到缓解心脏缺血缺氧损伤的目的。然而随着血流的恢复,心功能障碍和结构损伤有时反而进一步加重,出现心肌缺血再灌注损伤(MIRI)。MIRI严重影响IHD患者预后,因而成为治疗IHD的瓶颈之一。线粒体是细胞能量代谢中心,通过呼吸链的电子传递偶联磷酸化产生三磷酸腺苷(ATP),以提供细胞生命活动所需能量。研究发现MIRI通过多种途径介导线粒体通透性转换孔(mPTP)持续开放,并进一步导致线粒体内膜通透性增加,呼吸链氧化磷酸化解偶联,从而削弱线粒体能量代谢功能,加速心肌细胞损伤[2]。挽救激酶信号通路磷脂酰肌醇-3-羟激酶(PI3K)/丝氨酸/苏氨酸激酶(Akt)和丝裂原活化蛋白激酶(MAPK)激酶(MEK)/细胞外信号调节激酶(ERK)1/2能够抑制线粒体和心肌细胞损伤,在MIRI中发挥重要作用[3]。
丹红注射液(DHI)由丹参和红花组成,临床上广泛用于治疗心脑血管疾病。丹参酮、丹酚酸、丹参酚酸、红花黄素为DHI主要活性成分,具有抗氧化、抗炎、抗凋亡等药理作用。临床研究表明,DHI能有效减轻心肌梗死引起的心脏损伤[4]。课题组前期研究[5]发现,DHI通过抑制mPTP开放保护缺氧/复氧(H/R)损伤的心肌细胞。王佩等[6]研究发现DHI激活PI3K/Akt信号通路减轻大鼠MIRI。然而DHI对MIRI线粒体氧化磷酸化功能及PI3K/Akt等挽救激酶信号通路调节的线粒体损伤机制尚不明确。因此,本研究拟采用体外H/R损伤的心肌细胞模型,从线粒体能量代谢、PI3K/Akt和MEK/ERK1/2信号通路,研究丹红注射液对H/R损伤心肌细胞的保护作用,以期为临床应用提供实验依据。
1 材料 1.1 动物新生1~3 d SD乳鼠,雌雄不分。购于中国医学科学院放射医学研究所。
1.2 主要试剂四甲基噻唑蓝(MTT)、PD98059、罗丹明123(Rh123)购于美国Sigma公司,DMEM无糖基础培养基、DMEM高糖基础培养基购于美国Gibco公司,RIPA裂解液、5×十二烷基硫酸钠(SDS)上样缓冲液、BCA法蛋白浓度测定试剂盒购于北京索莱宝科技有限公司;β-actin、磷酸化ERK(p-ERK)1/2Thr202/Tyr204、ERK1/2、磷酸化Akt(p-Akt)Ser473、Akt抗体购于美国CST公司;LY294002购于美国Apollo Scientific公司;XF分析培养基、探针水化液、线粒体应激检测试剂盒购于美国Seahorse Bioscience公司。
2 方法 2.1 原代心肌细胞分离培养与鉴定出生后1~3 d的乳鼠,75%乙醇浸泡消毒,眼科剪沿左侧肋骨快速打开乳鼠胸腔摘取心脏,洗涤后剪碎。加入0.1%Ⅱ型胶原酶和0.06%的胰蛋白酶溶液多次消化。200目筛过滤消化液去除未消化组织块,离心过滤液,弃上清收集细胞。细胞接种于培养瓶中,二氧化碳(CO2)培养箱差速贴壁1.5 h,收集未贴壁的细胞悬液,重新接种于新的培养瓶中,并于前3 d加用0.1 mmol/L溴脱氧尿苷抑制非心肌细胞的生长。培养2~3 d,待贴壁的心肌细胞连成片状,观察细胞形态及搏动情况。
2.2 H/R模型的建立参照文献[7]建立细胞糖氧剥夺的H/R模型。缺氧处理开始前,将DMEM高糖培养基换为DMEM无糖培养基,37 ℃密闭的缺氧小室中缺氧处理9 h。缺氧处理结束后,更换为DMEM高糖培养基,正常CO2培养箱复氧培养2 h。
2.3 实验分组实验分为正常组、损伤组、DHI干预损伤组、DHI和抑制剂干预损伤组、抑制剂干预损伤组。正常组细胞行正常培养,损伤组仅进行H/R损伤处理,DHI干预损伤组细胞缺氧前,用含DHI(10 μL/mL)的DMEM高糖培养基预孵育10 h,且H/R过程中培养液中添加DHI(10 μL/mL)。DHI和抑制剂干预损伤组缺氧前,用含DHI(10 μL/mL)和抑制剂(15 μmol/L的LY294002或20 μmol/L的PD98059)的DMEM高糖培养基预孵育细胞10 h,H/R过程培养液中均添加上述浓度DHI和抑制剂。抑制剂干预损伤组细胞H/R前,用含抑制剂的DMEM高糖培养基预处理10 h,H/R时培养液中添加抑制剂。
2.4 MTT法检测细胞存活率实验干预结束后,弃孔内液体,每孔加入100 μL DMEM高糖培养基和20 μL的MTT(5 g/L)。孵育4 h后,吸弃孔内液体,加入二甲基亚砜(DMSO)150 μL/孔,酶标仪读取570 nm波长下的A值,计算细胞活力。
2.5 线粒体膜电位的测定细胞经处理后,每孔加入100 μL Rh123工作液,细胞培养箱孵育30 min。荧光酶标仪检测A值(499 nm/535 nm)。
2.6 蛋白免疫印迹(Western blot)法检测心肌细胞蛋白表达实验干预结束后,提取细胞总蛋白。利用BCA法进行蛋白浓度测定,定量蛋白总量。行聚丙烯酰胺凝胶电泳,电泳结束后湿转至PVDF膜,5%脱脂奶粉室温摇床封闭2 h,4 ℃孵育Akt、p-Akt Ser473、ERK、p-ERK Thr202/Tyr204、β-actin抗体过夜。TBST洗去一抗,二抗室温孵育1 h,TBST洗膜后,化学发光并显影、定影。
2.7 线粒体呼吸的测定原代心肌细胞培养2~3 d后,收集细胞并以1×106个/mL接种于XF24细胞培养板中,细胞培养箱孵育5 h后,加入150 μL完全培养基孵育过夜。心肌细胞用含DHI终浓度为1、10 μL/mL的DMEM/F12基础培基预孵育6 h,直接进行生物能量检测。H/R处理组缺氧5 h/复氧1 h,并同时给予DHI孵育,再进行线粒体生物能量检测。通过加入不同的呼吸链复合物抑制剂寡霉素(1 μmol/L)、线粒体氧化磷酸化抑制剂(FCCP)(1.5 μmol/L)、抗霉素(1 μmol/L)、鱼藤酮(1 μmol/L),检测基础耗氧率、最大耗氧率、非线粒体呼吸,并通过计算得出ATP相关的耗氧量、质子漏及储备能力。
2.8 统计学方法采用统计学软件SPSS 23.0对实验数据进行统计学分析,实验结果采用均数±标准差(x±s)表示。多组间比较采用单因素方差分析,组间两两比较采用LSD法。P < 0.05为差异具有统计学意义。
3 结果 3.1 原代心肌细胞的鉴定倒置显微镜观察,对细胞形态进行鉴定。接种6 h心肌细胞逐渐开始贴壁,呈扁圆形或梭形,无搏动。接种24 h后细胞进一步伸展,出现分叉状伪足,并开始搏动。培养48 h后,细胞完全贴壁且呈规律性的同步搏动,细胞形态呈梭形、不规则三角形或多边形,胞浆突起呈伪足状,且伪足相互连接成片状生长。见图 1。
|
| 图 1 原代培养心肌细胞48 h后生长状态( 200x) |
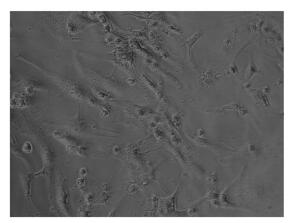
由图 2可见,与正常组相比,H/R使心肌细胞存活率、Δφm水平显著下降(P < 0.01)。与损伤组相比,DHI给药后细胞存活率、Δφm、Akt蛋白磷酸化水平显著增加(P < 0.05或P < 0.01)。在此基础上,应用PI3K抑制剂LY294002进行干预,与损伤组相比,单独给予LY294002后,心肌细胞存活率和Δφm没有显著改变。与DHI干预损伤组相比,LY294002和DHI共同干预后,DHI对H/R损伤的心肌细胞保护作用被显著抑制,表现为细胞存活率、Δφm和PI3K下游的Akt蛋白磷酸化水平显著降低(P < 0.05或P < 0.01)。
|
| 注: A.细胞存活率; B线粒体膜电位;C、D. p-Akt Ser473和Akt蛋白 表达。与正常组比较, ##P<0.01 ;与损伤组比较, *P<0.05, *P<0.01; 与DHI干预损伤组比较。+P<0.05, ++P<0.01. 图 2 DHI对H/R损伤后心肌细胞PI3K/Akt信号通路的影响 |
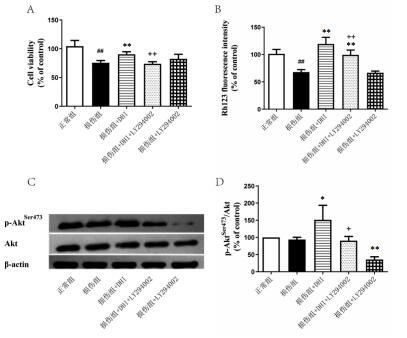
与正常组相比,H/R损伤后心肌细胞存活率显著降低,DHI可显著升高心肌细胞存活率,增加心肌细胞内ERK1/2蛋白Thr202/Tyr204位磷酸化水平(P < 0.05或P < 0.01)。MEK的抑制剂PD98059能够显著抑制DHI的心肌保护作用,使细胞存活率明显降低,且抑制DHI对MEK下游ERK1/2的促磷酸化作用,使ERK1/2Thr202/Tyr204的磷酸化水平显著下降(P < 0.05或P < 0.01)。见图 3。
|
| 注:A.细胞存活率; B. p-ERKThr202/Tyr204、ERK蛋白表达。与正常 组比较,##P<0.01;与损伤组比较,+P<0.05, ++P<0.01;与DHI干预损 伤组比较, *P<0.05, **P<0.01。 图 3 DHI对H/R损伤后心肌细胞ERK1/2信号通路的影响 |
与正常组相比,DHI预给药(10 μL/mL)能显著增加质子漏耗氧率(P < 0.05),但对基础耗氧率、最大耗氧率、ATP相关耗氧率、非线粒体呼吸耗氧率及储备能力均无影响。见图 4。
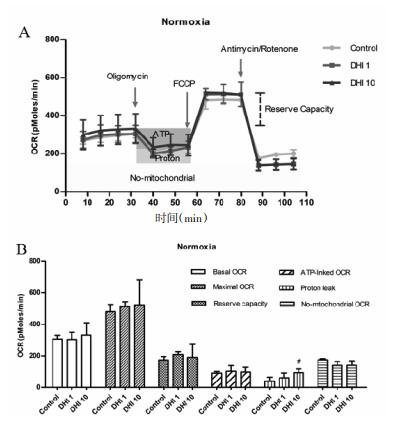
|
| 注: A.加入不同抑制剂后,心肌细胞耗氧率变化;B.基础耗氧率、最大 耗氧率.ATP相关耗氧率质子漏耗氧率、非线粒体呼吸耗氧率及储 备能力。与正常组比较. #P<0.05。 图 4 DHI对常氧培养心肌细胞线粒体能量代谢的影响 |
DHI能够增加H/R损伤的心肌细胞线粒体基础耗氧率、最大耗氧率、储备能力和非线粒体呼吸耗氧率,其中10 μL/mL的DHI干预损伤组更优(P < 0.05或P < 0.01)。见图 5。
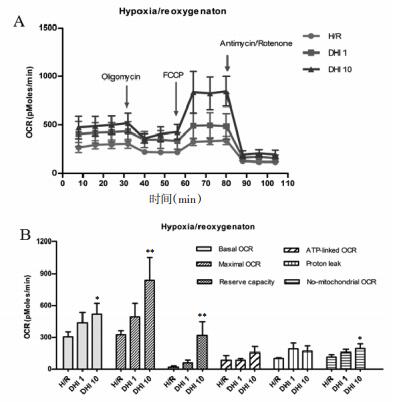
|
| 王: A.加人个同抑制剂石,心肌细胞札氧半受化;B.基端托氧率.坡大 耗氧率、ATP相关耗氧率.质子漏耗氧率.非线粒体呼吸耗氧率及储 备能力。与损伤组比较。*P<0.05, **P<0.01。 图 5 DHI对H/R损伤的心肌细胞线粒体能量代谢的影响 |
本实验运用原代培养心肌细胞H/R损伤模型,研究DHI通过激活Akt和ERK1/2,减轻H/R损伤,改善线粒体能量代谢的作用。
再灌注损伤挽救激酶信号通路主要包括PI3K/Akt和MEK/ERK1/2通路。PI3K/Akt通路与细胞生命活动息息相关,参与蛋白质合成、葡萄糖转运和血管生成等重要生理功能的调控,并介导外界刺激信号诱导细胞生长、增殖、分化、蛋白翻译、代谢、凋亡等过程[8]。ERK1/2是MAPK家族的成员之一,该家族主要参与细胞增殖分化和生存,该信号级联在再灌注早期被活化。MEK是ERK1/2的上游激活蛋白。心肌再灌注期RISK途径中Akt和ERK1/2成为介导心肌保护信号通路的关键蛋白,Juhaszova等[9]研究表明,各类不同的心肌保护剂都能激活PI3K-Akt和MEK1/2-ERK1/2通路磷酸化,抑制糖原合成酶激酶-3β(GSK-3β),抑制mPTP开放,发挥心肌保护作用。实验通过MTT检测心肌细胞活力,应用荧光分子探针Rh123检测心肌细胞Δφm,证明DHI可显著增加H/R后细胞活力和Δφm,减轻H/R引起的细胞损伤。应用PI3K通路抑制剂LY294002和MEK抑制剂PD98059干预后,抑制了DHI减轻细胞损伤的作用,Western blot蛋白检测结果也显示,DHI能增加PI3K和MEK下游的Akt、ERK蛋白磷酸化水平,DHI可能通过激活PI3K/Akt和MEK/ERK1/2信号通路发挥保护心肌细胞的作用,与文献研究相吻合[10]。
造成心肌缺血再灌注损伤的主要机制有活性氧的损伤、钙离子超载、白细胞损伤及高能磷酸化合物生成障碍,线粒体受损及引起的能量代谢障碍在MIRI中扮演着重要角色。线粒体作为细胞呼吸和氧化磷酸化的场所,约80%~90%的ATP是由位于线粒体内膜上的呼吸链及ATP合酶加工而成的,心肌缺血缺氧严重影响了线粒体呼吸功能[11],反之线粒体功能障碍,包括能量产生障碍、活性氧的产生、钙离子超载以及线粒体通路诱导的凋亡等,又进一步加重心肌细胞损伤[12]。线粒体在正常条件下,参与调节细胞的基本生命活动,在应激条件下,介导细胞的分化、凋亡等过程。线粒体的能量代谢状态是线粒体功能最显著的表现。质子漏是电子传递链跨膜泵出的质子通过不涉及ATP合成的途径而跨膜扩散流回基质的过程,形成了由呼吸链驱动的质子泵出和质子回漏的无效循环通路,质子漏在基础代谢中的作用有:产热以维持体温、提高调节代谢的潜能、减少有害自由基的产生和碳流的调节[13]。本研究运用海马生物能量检测仪,分别检测了常氧和H/R状态下DHI对心肌细胞线粒体呼吸的影响,发现DHI能够升高常氧培养心肌细胞线粒体质子漏耗氧率,进一步的机制或作用尚需要深入研究。线粒体呼吸储备能力的大小与细胞应激状态下自身的调节适应能力相关,细胞储备能力越大,则其对抗应激状态、维持细胞正常功能的能力越强[14]。本研究发现,DHI(10 μL/mL)预给药可通过增加H/R损伤的心肌细胞基础耗氧率及最大耗氧率,增加线粒体储备能力,从而增强心肌细胞抗应激能力,发挥抗H/R损伤的作用。此外,DHI(10 μL/mL)还可增加H/R后心肌细胞的非线粒体呼吸耗氧率。以线粒体的储备能力增加最为显著,表明了DHI对H/R条件下心肌细胞能量代谢的改变情况。也可能与DHI抑制了H/R引起的细胞活力降低相关,即增加了细胞活力,降低了细胞凋亡,表现出心肌细胞线粒体基础耗氧率、最大耗氧率等能量代谢的增强,如果能提取单个细胞或对活细胞进行定量,然后分析其呼吸功能,更能直接体现药物对线粒体呼吸功能的影响。
此外,线粒体既是ATP的生成中心,为生命活动提供能量,同时也是活性氧产生的主要场所,过多的活性氧对细胞产生损伤,有学者通过研究发现,药物通过抑制线粒体氧化磷酸化可以保护细胞,人参的有效成分人参皂苷Rb1、Rg1,尤其是人参皂苷Rc能够抑制大脑皮层和海马突触体的线粒体呼吸、氧化磷酸化,改变能量代谢,保护对氧化应激敏感的中枢神经细胞[15]。
综上所述,DHI能够激活心肌细胞PI3K/Akt和MEK/ERK1/2信号通路的Akt和ERK1/2,发挥抗H/R损伤的作用,通过改善H/R后线粒体能量代谢状态,增加心肌细胞储备能力。DHI对Akt和ERK1/2上游蛋白的调节作用有待进一步研究。
| [1] |
LLOYD-JONES D, ADAMS R J, BROWM T M, et al. Executive summary:heart disease and stroke statistics-2010 update:a report from the American Heart Association[J]. Circulation, 2010, 121: 948-954. DOI:10.1161/CIRCULATIONAHA.109.192666 |
| [2] |
ZHANG G, SHENG M, WANG J, et al. Zinc improves mitochondrial respiratory function and prevetns mitochondrial ROS generation at reperfusion by phosphorylating STAT3 at Ser 727[J]. Journal of Molecular and Cellular Cardiology, 2018, 118: 169-182. DOI:10.1016/j.yjmcc.2018.03.019 |
| [3] |
SHAW R J, CANTLEY L C. Ras, PI(3)K and mTOR signalling controls tumour cell growth[J]. Nature, 2006, 441: 424-430. DOI:10.1038/nature04869 |
| [4] |
CHEN J R, WEI J, HUANG Y T, et al. Danhong injection enhances the therapeutic efficacy of mesenchymal stem cells in myocardial infarction by promoting angiogenesis[J]. Front Physiology, 2018, 9: 991. DOI:10.3389/fphys.2018.00991 |
| [5] |
DUAN Z Z, LI Y H, LI Y Y, et al. Danhong injection protects cardiomyocytes against hypoxia/reoxygenation-and H2O2-induced injury by inhibitiing mitochondrial permeability transition pore opening[J]. Journal of Ethnopharmacology, 2015, 175: 617-625. DOI:10.1016/j.jep.2015.08.033 |
| [6] |
王佩, 张玉东. 丹红注射液对大鼠心肌缺血-再灌注损伤中细胞凋亡的影响[J]. 江苏医药, 2012, 38: 143-145. |
| [7] |
LI L, SHA Z M, WANG Y Y, et al. Pretreatment with a combination of Shenmai and Danshen injection protects cardiomyocytes against hypoxia/reoxygenation-and H2O2-induced injury by inhibiting mitochondrial permeability transition pore opening[J]. Experimental and Therapeutic Medicine, 2019, 17(6): 4643-4652. |
| [8] |
WEI K, LIU L, XIE F, et al. Nerve growth factor protects the ischemic heart via attenuation of the endoplasmic reticulum stress induced apoptosis by activation of phosphatidylinositol 3-kinase[J]. International Journal of Medical Sciences, 2015(12): 83-91. |
| [9] |
JUHASZOVA M, ZOROV D B, KIM S H, et al. Glycogen synthase kinase-3beta mediates convergence of protection signaling to inhibit the mitochondrial permeability transition pore[J]. Journal of Clinical Investigation, 2004, 113: 1535-1549. DOI:10.1172/JCI19906 |
| [10] |
GUAN Y, YIN Y, ZHU Y R, et al. Dissection of mechanisms of a chinese medicinal formula:danhong injection therapy for myocardial ischemia/reperfusion injury in vivo and in vitro[J]. Evidence-based Complementary and Alternative Medicine, 2013, 972370. |
| [11] |
LEISTNER M, SOMMER S, KANOFSKY P, et al. Ischemia time impacts on respiratory chain functions and Ca2+-handling of cardiac subsarcolemmal mitochondria subjected to ischemia reperfusion injury[J]. Journal of Cardiothoracic Surgery, 2019, 14(1): 92. DOI:10.1186/s13019-019-0911-1 |
| [12] |
PARADIES G, PARADIES V, RUGGIERO F M, et al. Mitochondrial bioenergetics and cardiolipin alterations in myocardial ischemia-reperfusioninjury:implications for pharmacological cardioprotection[J]. Merican Journal of Physiology-heart and Circulatory Physiology, 2018, 315(5). |
| [13] |
宋志刚, 王德华.质子漏及其在基础代谢中的作用[J].生物化学与生物物理进展, 2001: 474-477. SONG Z G, WANG D H. Proton leak and its role in basal metabolism. 2001: 474-477. |
| [14] |
WANG Y, ZHAO Y, JIANG W, et al. iTRAQ-Based proteomic analysis reveals recovery of impaired mitochondrial function in ischemic myocardium by shenmai formula[J]. Journal of Proteome Research, 2018, 17(2): 794-803. DOI:10.1021/acs.jproteome.7b00450 |
| [15] |
KONG D, TIAN X, LI Y, et al. Revealing the inhibitory effect of ginseng on mitochondrial respiration through synaptosomal proteomics[J]. Proteomics, 2018, 18(11): e1700354. |
 2020, Vol. 39
2020, Vol. 39