文章信息
- 王垚, 付新, 张聪, 纪羽婷
- WANG Yao, FU Xin, ZHANG Cong, JI Yuting
- 姜黄素对结肠炎小鼠结肠组织相关细胞因子表达的调控作用
- Regulatory effect of curcumin on expression to relevant cytokines in colonic tissue about colitis mice
- 天津中医药大学学报, 2020, 39(6): 686-689
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(6): 686-689
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.06.18
-
文章历史
收稿日期: 2020-07-08
2. 黑龙江中医药大学药学院中药化学教研室, 哈尔滨 150040
2. Department of Traditional Chinese Medicine Chemistry, School of Pharmacy, Heilongjiang University of Traditional Chinese Medicine, Harbin 150040, China
姜黄素(Cur)是从姜黄的根茎中提取的天然活性橙黄色结晶粉末,可调节多种信号分子,具有抗炎、抗氧化、抗肿瘤、抗动脉粥样硬化等多种生物学活性[1]。姜黄素被证实可通过细胞因子、环氧合酶-2、诱导型一氧化氮合酶、抗氧化应激、NF-κB、过氧化物酶体增值物激活受体、丝裂原活化蛋白激酶、STAT3通路、Toll样受体4等,被广泛地用于治疗各种疾病[2-3]。本实验利用TNBS复制UC小鼠模型,旨在探讨不同剂量姜黄素治疗结肠炎的疗效及可能机制。
1 实验材料 1.1 动物及分组清洁级健康雄性C57BL/6小鼠72只,体质量(20±2)g,由北京维通利华实验动物有限公司提供[合格证号:SCXK(京)2012-0001]。将小鼠随机分为正常组、模型组、姜黄素低剂量组、中剂量组、高剂量组、美沙拉嗪对照组,共6组,每组12只,适应性饲养3 d后使用。
1.2 药物及试剂姜黄素购自于南京广润生物制品有限公司提供(批号:GR-133-140421);美沙拉嗪购自佳木斯鹿灵制药有限公司葵花药业生产(批号:130407);三硝基苯磺酸(2,4,6,TNBS)相对分子质量为293.17,购自Sigma公司。粒细胞巨噬细胞集落刺激因子(GM-CSF)、白介素(IL)IL-2、IL-4、IL-12P40、IL-15、IL-21和IL-23等ELISA试剂盒均购于ebioscience公司。
1.3 主要仪器低温高速离心机(德国Eppendorf);酶标仪(Molecular Devices SpectraMax Plus 384);低温高速离心机(eppendorf Centrifuge 5430R)。
2 实验方法 2.1 模型复制采用三硝基苯磺酸(TNBS)复制结肠炎小鼠模型[4]。造模前禁食12 h,除正常组外,所有小鼠给予1%戊巴比妥钠溶液(5 mL/kg)肌肉注射麻醉后,按100 mg/kg TNBS计算,将其溶入0.15 mL 50%乙醇,配制TNBS乙醇复合溶液,用塑料软管(直径约为1 mm)将TNBS乙醇复合液注入距肛门约4 cm处,倒置小鼠5 min,使药液送达结肠,然后将小鼠放回原笼中,待自然苏醒,正常组注入等容积的50 %乙醇TNBS诱导后24 h,随机从模型组中挑选小鼠2只,麻醉后处死,如见小鼠结肠黏膜脱落,溃疡形成,表面有污秽物覆盖,充血水肿,提示造模成功。
2.2 给药方法自造模后1 d起,按体质量换算,姜黄素低、中、高剂量组分别为50、100、200 mg/kg姜黄素,美沙拉嗪对照组给予300 mg/kg美沙拉嗪灌胃给药,每日1次,共7 d。
2.3 动物处理与病理学观察第8天,小鼠100 g/L乌拉坦麻醉后,脱椎处死小鼠。无菌分离结肠,测量结肠质量和长度之后,计算结肠重量指数(结肠重量指数=结肠湿重/体质量×100%)。沿结肠纵轴剪开,预冷生理盐水清洗结肠内容物。取部分结肠置于40 g/L多聚甲醛溶液固定常规石蜡包埋切片5 μm。HE染色后,用光学显微镜观察。
2.4 酶联免疫吸附试验(ELISA)测定结肠组织液相关细胞因子水平参照试剂盒说明书检测结肠组织匀浆中GM-CSF、IL-2、IL-4、IL-12P40、IL-15和IL-21的含量。待测上清液、标准品使用量均为50 μL,波长450 nm下测定吸光度值。
2.5 统计学方法采用SPSS 18.0统计分析软件处理所有数据均以均数±标准差(x±s)表示,组间比较采用t检验。以P < 0.05表示差异具有统计学意义。
3 结果 3.1 小鼠一般情况观察与正常组比较,模型组从第3天开始,动物均表现出不同程度质量下降,神态呆滞、怕冷喜暗、体毛参差不齐、食量锐减、排便次数增多且溏稀,肛周污秽有脱肛状,更甚者出现便血现象。与模型组比较,姜黄素组小鼠前期质量也有下降状况但趋势较为平缓,后期趋向上升,稀便和血便程度明显减轻,活动量也随之增加,情况趋于好转。
3.2 姜黄素改善实验性结肠炎小鼠的结肠黏膜损伤HE染色比较结肠组织病理学形态改变。如图 1所示,正常组:肠壁完整,黏膜无缺损;模型组:黏膜脱落,溃疡形成,黏膜下层血管充血,炎细胞浸润,大量坏死物质形成;高剂量组:黏膜完整、未见明显溃疡,但肠壁增厚,血管扩张,炎细胞浸润明显;中剂量组:黏膜完整、未见明显溃疡,但黏膜下层充血水肿明显,少量炎细胞浸润;低剂量组:黏膜糜烂,可见小型溃疡,黏膜下层充血水肿明显,少量炎细胞浸润;美沙拉嗪组:黏膜完整,上皮细胞增生,黏膜下层充血水肿,少量坏死物质覆盖表面。

|
| 注:A.正常组;B.模型组;C.高剂量组;D.中剂量组;E.低剂量组;F.美沙拉嗪组。 图 1 各组小鼠结肠病理图片(HE染色,×200) |
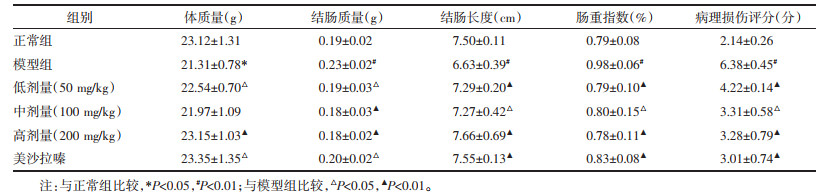
如表 1所示,与正常组比较,模型组小鼠结肠质量指数明显升高(P < 0.05),结肠长度明显缩短(P < 0.05);而经姜黄素治疗后,与模型组比较,结肠炎小鼠结肠质量指数显著下降(P < 0.05或P < 0.01),而结肠长度明显延长(P < 0.05或P < 0.01);病理损伤评分,与正常组比较,模型组病理损伤评分显著增高(P < 0.01);与模型组比较,高、中、低剂量组和美沙拉嗪组病理评分都显著增高(P < 0.05或P < 0.01)。
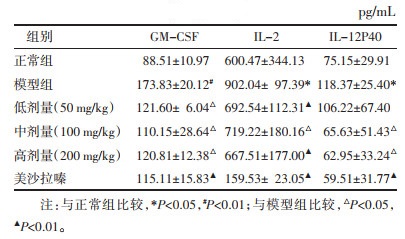
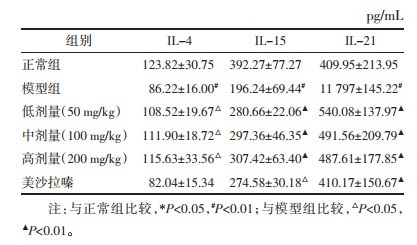
如表 2、3所示,与正常组比较,模型组小肠组织液GM-CSF、IL-2、IL-12P40、IL-21含量显著升高(P < 0.05),IL-4、IL-15和IL-23含量显著下降(P < 0.01)。与模型组相比,姜黄素各剂量组均可明显降低小肠组织液GM-CSF、IL-2、IL-12P40、IL-21含量(P < 0.05),IL-4、IL-15和IL-23含量显著升高(P < 0.05)。
本实验利用TNBS乙醇溶液成功复制实验性小鼠溃疡性结肠炎模型,与多数相关研究相似[5-6],模型组小鼠结肠缩短,结肠重量增加、结肠重量指数和结肠镜下病理损伤评分上升,结肠组织上清液中GM-CSF、IL-2、IL-12P40、IL-21的表达上升,而IL-4、IL-15和IL-23的量则是下降的;而经姜黄素治疗后,可明显恢复结肠长度,降低结肠重量、结肠重量指数、结肠镜下病理损伤评分,提示姜黄素可有效治疗小鼠结肠炎,同时姜黄素明显降低结肠组织上清液中GM-CSF、IL-2、IL-12P40、IL-21的表达,同时升高IL-4、IL-15和IL-23分泌量。结肠炎症发生时,大量中性粒细胞浸润,产生大量细胞因子,促炎因子(如GM-CSF、IL-2、IL-12P40、IL-21等)和抑炎因子(如IL-4、IL-15和IL-23)间平衡被打破,造成炎性损伤,故众所周知,调节促炎与抑炎因子间平衡可明显缓解溃疡性结肠粘膜损伤[7-9]。这些促炎因子有的可与各种免疫细胞相结合,直接或通过协同作用造成炎性损伤。而在协同方面,GM-CSF作为中性粒细胞集落刺激因子,可刺激中性粒细胞或抑制相关基因表达(如STAT3、STAT5等相关基因)的方式,促进IL-2、IL-12p40、IL-21的分泌,形成协同创伤机制[10-11]。而抑炎因子(如IL-4、IL-15和IL-23等)虽也来源于T细胞,在不同程度上可分别拮抗IL-1β、IL-8和IL-21的分泌,也可以拮抗IL-12刺激T细胞分泌IFN-γ,拮抗IL-2竞争性结合调节性T细胞,对维持免疫平衡和稳定起了关键性作用,在溃疡性结肠炎发病过程中扮演了重要角色[12-13]。本实验发现经姜黄素治疗后,结肠组织中GM-CSF、IL-2、IL-12P40和IL-21表达明显降低,而IL-4和IL-15表达水平明显升高,提示姜黄素可能通过减少GM-CSF表达水平,抑制中性粒细胞过度聚集,降低促炎因子IL-2、IL-12P40和IL-21表达,同时促进IL-4和IL-15等抑炎因子的产生,维持促炎因子与抑炎因子之间平衡,达到降低异常免疫反应和减轻炎症损伤的程度,起到治疗实验性结肠炎的目的。然而姜黄素通过何种途径抑制这些细胞因子的产生及与免疫免疫细胞的作用,其协同创伤的机制与靶点是什么还不明朗,还有待于进一步的完善。同时也注意到姜黄素治疗炎症性肠病是全方位多靶点,因此找到关键靶点和部位将是下一步重点工作。
| [1] |
KLINE LW, KARPINSKI E. Curcumin relaxes precontracted guinea piggallbladder strips via multiple signaling pathways[J]. Gastroenterology Research and Practice, 2015, 8(5): 253-259. DOI:10.14740/gr689w |
| [2] |
KUNNUMAKKARA A B, BORDOLOI D, PADMAVATHI G, et al. Curcumin, the golden nutraceutical:multitargeting for multiple chronic diseases[J]. British Journal of Pharmacology, 2017, 174(11): 1325-1348. DOI:10.1111/bph.13621 |
| [3] |
GUO L, LI C P. Mechanisms underlying therapeutic effects of curcumin onulcerative colitis[J]. World Chinese Journal of Digestology, 2014, 22(20): 2863-2869. DOI:10.11569/wcjd.v22.i20.2863 |
| [4] |
SEGAIN J P, RAINGERDDELA D, SAUZEAU V, et al. Rho kinase blockadeprevents inflammation via nuclear factor kappa B inhibition:evidence in Crohn's disease and experimental colitis[J]. Gastroenterology, 2003, 124(5): 1180-1187. DOI:10.1016/S0016-5085(03)00283-X |
| [5] |
HOU L J, TANG F, WANG X H, SUN X P. Establishment of a rat model of ulcerative colitis and analysis of factors influencing the development of this model[J]. World Chinese Journal of Digestology, 2011, 19(31): 3242-3245. |
| [6] |
ALESSANDRA G, ABDALLA SAAD, et al. Mesenteric adipose tissue alterations resulting from experimental reactivated colitis[J]. Inflmmatory Bowel Diseases, 2007, 13: 1357-1364. DOI:10.1002/ibd.20222 |
| [7] |
FAUSTO S M, AARON D L, JESUS K Y F. Role of cytokines in inflammatory bowel disease[J]. World Journalof Gastroenterology, 2008, 14(27): 4280-4288. DOI:10.3748/wjg.14.4280 |
| [8] |
BHATTACHARYA P, BUDNICK I, SINGH M, et al. Dual role of GM-CSF as a pro-inflammatory and a regulatory cytokine:implications for immune therapy[J]. Journalof Interferon and Cytokine Research, 2015, 35(8). |
| [9] |
JIANG N Y, TANG J, XU Y S. Progress in anti-tumor immunotherapy of GM-CSF[J]. Immunological Journal, 2015, 31(8): 717-722. |
| [10] |
CARBO A, OLIVARESVILLAGOMEZ D, HONTECILLAS R, et al. Systems modeling of the role of interleukin-21 in the maintenance of effector CD4+T cell responses during chronic helicobacter pylori infection[J]. Mbio, 2014, 5(4): 01243-14. |
| [11] |
WAN C K, OH J, LI P, et al. The Cytokines IL-21 and GM-CSF have opposing regulatory roles in the apoptosis of conventional dendritic cells[J]. Immunity, 2013, 63(3): 307-307. |
| [12] |
WALDMANN T A. The biology of interleukin-2 and interleukin-15:implications for cancer therapy and vaccine design[J]. Nature Reviews Immunology, 2006, 6(8): 595-601. DOI:10.1038/nri1901 |
| [13] |
PERRIER C, ARIJS I, STAELENS D, et al. Interleukin-15 receptor α expression in inflammatory bowel disease patients before and after normalization of inflammation with infliximab[J]. Immunology, 2013, 138(1): 47-56. DOI:10.1111/imm.12014 |
 2020, Vol. 39
2020, Vol. 39


 ,
,