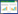文章信息
- 赵晶, 史国茹, 段宏泉
- ZHAO Jing, SHI Guoru, DUAN Hongquan
- 岩五加中具有抗癌转移活性的吲哚类生物碱的分离
- Isolatation of Antitumor metastasis indole alkaloids from Tetrastigma obtectum
- 天津中医药大学学报, 2020, 39(6): 690-694
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(6): 690-694
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.06.19
-
文章历史
收稿日期: 2020-08-20
2. 天津医科大学基础医学研究中心药学院, 天津 300070
2. School of Pharmaceutical Sciences, Research Center of Basic Medical Sciences, Tianjin Medical University, Tianjin 300070, China
中药岩五加[Tetrastigma obtectum(Wall.)Planch]主要用于治疗风湿、跌打损伤,还可治疗月经不调、骨髓炎等症[1]。目前尚无关于岩五加化学成分的报道,在同属药用植物研究中,有提取得到黄酮、甾醇、有机酸类化合物的报道[2-6]。陈圣斌[7]研究葡萄科崖爬藤属植物扁担藤[Tetrastigma planule(Hook.)Gagnep]的干燥藤茎,提取得到化学成分中含有原儿茶酸;徐硕等[8]从三叶青石油醚萃取部分首次分离得到9-羟基-10,12-十八碳二烯酸,(4R,5R)-4-羟基-5-异丙基-2-甲基环己-2-烯酮,(4S,5R)-4-羟基-5-异丙基-2-甲基环己-2-烯酮,(3R,4R,6S)-3,6-二羟基-1-薄荷烯,肉桂酸,这5种成分是首次从崖爬藤属植物中分离得到的;李兵等[9]从扁担藤乙酸乙酯部位中分离得到6种化合物,其中的正三十四烷酸、1-二十三烷醇、没食子酸乙酯和香草醛为首次从该植物中分离得到的化合物。在本文中,从岩五加的乙酸乙酯提取物中分离得到2种新的吲哚类生物碱,通过1D,2D-NMR和HR质谱数据解析化合物的结构,分别为崖爬藤碱A(1)和崖爬藤碱B(2)。化合物1和2显示出阳性的抗癌转移活性。
1 仪器与材料 1.1 仪器半制备高效液相色谱仪[SSI Lab Alliance高效液相色谱系统(Series Ⅲ pump),JASCO高效液相色谱系统(PU-2089 plus)];旋光仪[MC 241 digital polarimeter(PERKIN-ELMER)];质谱仪[Alliance 2695 Quattro Micro TM ESI(Waters,液质联用色谱仪),Varian 7.0 T ESI电喷雾质谱仪(Varian 7.0 T FTICR-MS)];核磁共振仪[Bruker AVANCE Ⅲ 400 instrument,1H-NMR(400 MHz),13C-NMR(100 MHz),各溶剂峰做内标]。
生物活性筛选实验所用到设备:全自动酶标板分析仪(Model 680,BIO-RAD公司);5%CO2细胞培养箱(HF160W,Heal Force公司);超净工作台(SW-CJ-2G,苏州净化设备有限公司)。
1.2 材料中药来源:岩五加[Tetrastigma obtectum(Wall.)Planch]全株采自湖北建始。
细胞来源:乳腺癌细胞MDA-MB-231由天津医科大学免疫教研室赠。
药品和溶剂:乙醇、甲醇、冰醋酸、乙酸乙酯、二氯甲烷,均为分析纯,天津市基准化学试剂有限公司;氘代试剂CDCl3、DMSO-d6、Cambridge Isotope Laboratories,Inc.USA。
细胞培养用试剂:胎牛血清(NUC0153,Hyclone公司);0.25%(含EDTA)胰蛋白胨(Bioin);胎牛血清白蛋白(BSA,联星生物技术有限公司分装);H-DMEM培养液(NUL0219,Hyclone公司);二甲基亚砜(DMSO,Sigma公司);四甲基偶氮唑盐(MTT,Sigma公司);EGF(CBL417F,Millipore公司);Hu Plasma Fibronectin(NMM1604793,Millipore公司)。
2 实验方法 2.1 提取和萃取取干燥岩五加茎叶7.96 kg粉碎,95%乙醇加热回流3次,每次6 h,过滤,合并滤液,减压浓缩成浸膏,得提取物400 g。提取物加水混悬后,乙酸乙酯萃取,得萃取物75 g。
2.2 乙酸乙酯提取物的分离岩五加乙酸乙酯提取物(75 g),硅胶柱色谱(400 g,100~200目)分离,用P.E.:EtOAc [3:1,2:1,1:1,EtOAc(5% MeOH),EtOAc(10% MeOH),EtOAc(20% MeOH)]和MeOH梯度洗脱,利用TLC结果合并类似组分。各组分经硅胶柱、常压柱、大孔树脂、凝胶柱色谱Toyopral HW-40、制备薄层色谱(PTLC)以及制备高效液相色谱分离,得到化合物1(140.3 mg)和化合物2(17.6 mg)。
2.3 抗癌转移活性筛选 2.3.1 MDA-MB-231细胞培养通过细胞复苏、细胞传代、细胞计数三个步骤完成。
2.3.2 EGF趋化因子浓度筛选将1、10、100、1 000 ng/mL不同浓度化学诱导因子EGF加到趋化小室下层板孔中30 μL/每孔;将预处理的8 μm的滤膜剪角处位于左上(光面朝下)置于下室上,放胶垫固定好上板,上层小室加MDA-MB-231细胞(D-MEM,0.1%BM),细胞浓度5×105个/mL,50 μL/孔。趋化板子在37 ℃、5%CO2培养箱中培养3.5 h。去掉上板,取下膜,用PBS液洗膜3次,刮去膜上非特异趋化细胞并晾干,用三步染色法进行染色。
将膜固定在载玻片上,显微镜下计数每孔趋化细胞数。每孔随机取3个视野平均值作为该孔趋化细胞数,3个复孔平均值作为该浓度的趋化细胞数。不同浓度EGF浓度趋化细胞数与相应无EGF孔趋化细胞数的比率为该孔的趋化指数。本实验重复3次,选择趋化指数最高的浓度作为EGF最佳趋化浓度。

|
将MDA-MB-231细胞铺于6孔板,置37 ℃、5% CO2培养箱中,使其贴壁,24 h后6孔板内加入样品,37 ℃、5%CO2培养箱中培养孵育24 h。
将样品处理过的细胞用0.25%的胰酶消化后,用含10%FBS培养液终止消化,将该细胞悬液1 300 rpm离心5 min。上清液倒出,加0.1%BM将细胞混匀后再次1 300 rpm离心5 min后,计数,细胞密度调成5×105个/mL,置孵箱内备用。
冰上操作配制趋化因子EGF,加在趋化小室的下室,每孔30 μL,包被好的膜左上剪角,光面朝下铺于下室上,放好胶垫,固定上室,将准备好的细胞悬液加到上室,每孔50 μL,置于CO2培养箱中培养。
3.5 h后,取出下室,刮去没有趋化的细胞,用三步染色试剂固定和染色,将膜用石蜡油固定,于显微镜下计数(方法同上)。
在统计计算方法上,数据用SPSS 11.5进行处理,计算公式:

|
化合物1在高分辨电喷雾质谱(HR-ESI-MS)中给出的分子离子峰为m/z 394.1499 [M-H]-(计算值为394.150 7),确定分子式为C19H25NO8,[α]D25-0.14(c 1.3,甲醇)。化合物1的核磁共振氢谱(低厂区)显示该化合物具有4个苯环质子[δH 7.51(1H,d,J=8.0 Hz),7.50(1H,d,J=8.0 Hz),7.12(1H,m),7.03(1H,m)],1个单峰次甲基质子信号(δH 7.24),高场区显示1个与氧原子相连的乙基信号[δH 1.16(3H,t,J=7.1 Hz),4.06(2H,q,J=7.1 Hz)],1个亚甲基质子[δH 3.06(1H,dd,J=14.5,5.0 Hz),2.92(1H,dd,J=14.5,7.6 Hz)],1个含氧次甲基信号[δH 4.26(1H,dd,J=7.6,5.0 Hz)],1个β葡萄糖端基质子(δH 5.36,d,J=9.0 Hz)。化合物1的核磁共振碳谱(13C NMR)数据中显示出19个碳信号,包括8个双键碳原子信号(δC 111.1、124.9、128.7、119.0、121.6、119.6、111.1、136.9),1个羰基信号(δC 174.2),1个含氧次甲基信号(δC 71.2),和1个葡萄糖部分。除去1个乙基和1个葡萄糖部分外,化合物1的13C NMR光谱数据与化合物(αR)-α-羟基-1H-吲哚-3-丙酸[8]的碳谱特征相似。根据以上信息,可以推测化合物1是吲哚类生物碱的葡糖苷类化合物。
在HMBC谱中,1个与氧原子相连的乙基(δH 4.06)和含氧次甲基(δH 4.26,H-9)与羰基(δC 174.2,C-10)存在远程相关,H-2(δH 7.24)和C-1’(δC 85.0)存在远程相关,H-1’(δH 5.36)和C-2(δC 124.9),以及C-7a(δC 136.9)存在远程相关。因此,乙氧基和葡萄糖基分别位于C-10和N-1位。化合物1主要的HMBC相关性结果见图 1所示。
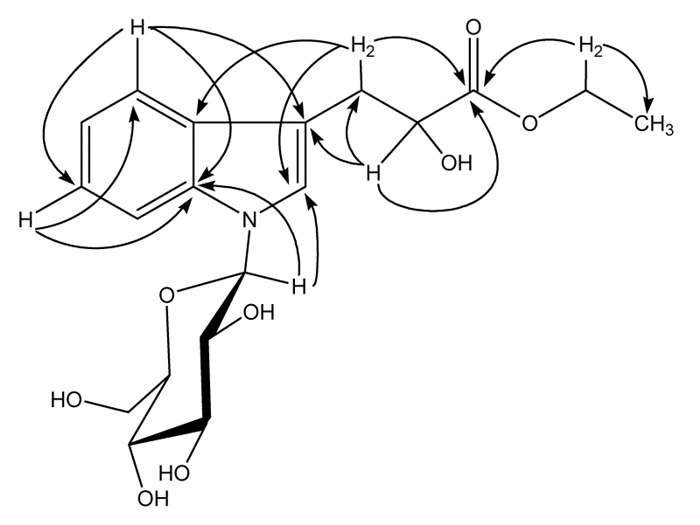
|
| 图 1 化合物1主要的HBMC相关图 |
通过酸水解实验和样品的TLC分析确定糖基为D-葡萄糖,以及H-1’(δH 5.36,d,J=9.0 Hz)的耦合常数显示为β构型的葡萄糖。此外,H-9(βH 4.26,dd,J=7.6,5.0 Hz)的耦合常数与malassezialactic acid [10]一致,显示出负旋光性。由此表明化合物1在C-9处具有R-构型。综上所述,化合物1的结构鉴定见图 2所示。
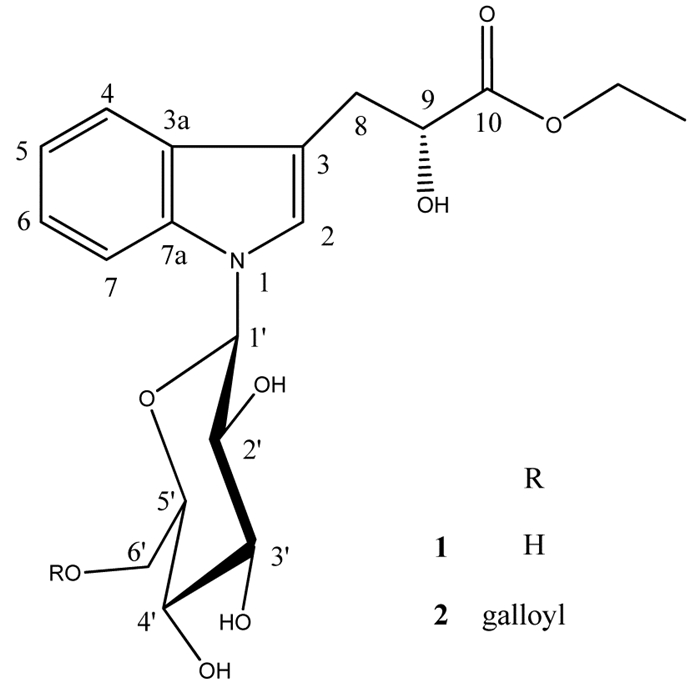
|
| 图 2 化合物1和化合物2的结构图 |
化合物2根据高分辨电喷雾质谱(HR-ESI-MS)中给出的结果,确定分子式为C26H29O12,[α]D25-0.43(c 1.4,甲醇)。化合物2的核磁共振氢谱(1H NMR)显示该化合物具有4个苯环质子[δH 7.52(1H,d,J=8.0 Hz),7.50(1H,d,J=8.0 Hz),7.05(1H,m),7.03(1H,m)],1个单峰次甲基质子信号(δH 7.24),(高场区显示)1个与吸电子基相连的次甲基信号[δH 4.27(1H,dd,J=7.3,5.0 Hz)],1个与氧原子相连的乙基信号[δH 1.11(3H,t,J=7.1 Hz),4.02(2H,q,J=7.1 Hz)],1个亚甲基质子[δH 3.05(1H,dd,J=14.5,5.0 Hz),2.93(1H,dd,J=14.5,7.3 Hz)],此外,化合物2中还有1个葡萄糖基和1个没食子酰基团。
除去化合物2中含有的1个没食子酰基,化合物2的核磁共振碳谱与化合物1的碳谱类似,通过HMBC图谱,H-6’(δH 4.50、4.19)与羰基碳(δC 166.2)存在远程相关,表明没食子酰基团定位于C-6’位。如上所述,质子和碳信号的也是通过与上述相同的方式确定的。综上所述,化合物2的结构鉴定见图 2所示。
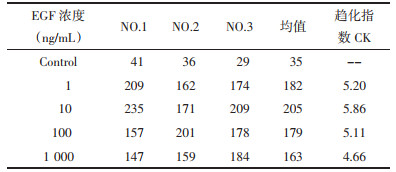
3.3 化合物1和2的抗癌活性评价通过检测化合物对表皮生长因子[11](EGF)诱导的人乳腺癌细胞MDA-MB-231趋化迁移的抑制作用,评价各天然产物的抗癌转移活性。趋化指数测定结果见表 1。一般来讲,趋化指数大于3.5以上即可用于药物筛选。本次实验选择10 ng/mL的趋化因子进行实验。筛选结果表明,与空白组相比,化合物1和2具有明显的抑制人乳腺癌细胞趋化迁移的活性,并具有一定的剂量依存性趋势。在结果见表 2所示和图 3~6所示。

|
| 图 3 DMSO对照迁移细胞图(×100) |

|
| 注:(a)化合物1浓度为0.05μg/mL;(b)化合物1浓度为1μg/mL;(c)化合物1浓度为20 μg/mL。 图 4 化合物1干预的人乳腺癌细胞迁移图(×100) |

|
| 图 5 DMSO对照的人乳腺癌细胞迁移图(×100) |

|
| 注:(a)化合物2浓度为0.05 μg/mL;(b)化合物2浓度为1 μg/mL;(c)化合物2浓度为20 μg/mL。 图 6 化合物2干预的人乳腺癌细胞迁移图(×100) |
中药的多种类型成分都具有抗肿瘤作用,主要包括生物碱、多糖类、萜类、蛋白质、黄酮类和蟾蜍甾二烯类成分[12]。其中萜类和生物碱类抗肿瘤活性成分最多[13]。
临床试验表明有多种中药通过抑制细胞增殖,影响肿瘤细胞分裂和DNA复制,起到杀伤肿瘤细胞作用。中药中提取和半合成的三尖杉酯碱、长春新碱、喜树碱、紫杉醇等是临床常用抗癌药物。另外,狼毒[14]、斑蝥素[15]等中药具有明显抗癌活性,但以上成分不仅杀伤癌细胞,同时对正常细胞也具有较强的细胞毒作用。
目前药学科研人员对中药、天然药物及其有效成分对癌转移的作用进行了大量研究,发现许多天然化合物具有抗癌转移作用,如白藜芦醇[16]、黄芩苷[17]、贯叶金丝桃素[18]和茉莉酮[19]可以抑制癌细胞侵袭和迁移;姜黄素[20]、土贝母皂苷[21],去甲斑蝥素[22]等可以抑制癌细胞黏附和侵袭;刺五加皂苷[23]、吴茱萸碱[24]可以抑制癌血管生成;槲皮素和5,7,4’-三羟基黄酮通过改善宿主微环境[25]而起到一定的抗癌转移作用。
文章对化合物1(崖爬藤碱A)和化合物2(崖爬藤碱B)进行了抗癌转移活性筛选,结果显示,化合物1和化合物2在趋化因子EGF诱导下,对乳腺癌细胞MDA-MB-231的趋化运动都有抑制作用,趋化迁移抑制率达到70.3%,显示了明显的抗肿瘤转移活性。本文首次发现吲哚类生物碱在非细胞毒剂量下具有明显的抗癌转移作用,这对于发现非细胞毒作用的抗肿瘤转移候选化合物具有重要的意义。化合物1和2的吲哚类生物碱母核相同,化合物2是化合物1葡萄糖6位羟基被没食子酰化后的产物,其趋化抑制作用弱于化合物1,其确切的构效关系和后续的抗肿瘤作用机制有待进一步进行研究。
| [1] |
SONG B Z, WAN D R. Investigation on common medicinal plants (viticulture) of Tujia nationality in Hubei Province[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2003, 61: 117-118. |
| [2] |
LIU D, JU J H, LIN G, et al. New C-glycosyflavones from Tetrastigma hemsleyanum (Vitaceae)[J]. Acta Botanica Sinica, 2002, 44(2): 227-229. |
| [3] |
LIU D, JU J H, YANG J S. Studies on chemical constituents from Tetrastigma hypoglaucum[J]. Chinese Traditional and Herbal Drugs, 2003, 34(1): 4-6. |
| [4] |
LI Y Q, LU W C, YU Z G. A Study on Chemical Components of Tetrastigma hemsleyanum Diels et Gilg[J]. Chinese Traditional and Herbal Drugs, 2003, 34(11): 982-983. |
| [5] |
LIU D, YANG J S. A Study on Chemical Components of Tetrastigma hemsleyanum Diels et Gilg.Native to China[J]. China Journal of Chinese Materia Medica, 1999, 24(10): 611-612. |
| [6] |
YANG D J, LIU H, LI X Z, et al. Chemical constituents of Te-trastigma hemsleyanum Diels[J]. China J Chin Mater Med, 1998, 23(7): 419-421. |
| [7] |
CHEN S B. Studies on the constituents from yao medicine Tetrastigma planicaul[D]. Nanning: Guangxi University of Chinese Medicine, 2017.
|
| [8] |
XU S, JIN P F, HUI H, et al. Study on the chemical constituents of the petroleum ether fraction from Tetrastigma hemsleyanum[J]. Northwest Pharmaceutical Journal, 2017, 32(03): 270-272. |
| [9] |
LI B, LIAO G F, HUA Y L. Chemical Constituents of Ethyl Acetate Fraction of Tetrastigma planicaule[J]. Journal of Chinese Medicinal Materials, 2014, 37(4): 610-611. |
| [10] |
IRLINGER B, BARTSCH A, KRAMER H J, et al. New tryptophan metabolites from cultures of the lipophilic yeast malassezia furfur[J]. Helvetica. Chimica. Acta, 2008(88): 1472-1483. |
| [11] |
WAN W, ZOU H, SUN R, et al. Investigate the role of PTEN in chemotaxis of human breast cancer cells[J]. Cellular signaling, 2007, 19(11): 2227-2236. DOI:10.1016/j.cellsig.2007.06.007 |
| [12] |
XIAO X LG, JIA H B. Study on anti-tumor mechanism of Chinese herbal medicine[J]. Nei Mongol Journal of Traditional Chinese Medicine, 2007, 4(1): 59-60. |
| [13] |
XU Z H, JIANG S M, WANG J R. Inhibitory activity of polysaccharides from bodies of flammulina velutipes sing on proliferation of human hepatoma SMMC-7721 cells[J]. Chinese Journal of Anatomy, 1998, 21(1): 55-57. |
| [14] |
LI X G, NAN X Y, DANG J G, et al. An exPerimentalstudy of effect of brueea javanica oil emulsion on human renal cell carcinoma[J]. Journal of Clinical Urology, 1998, 13(2): 82-84. |
| [15] |
LI J, ZHANG J. Research progress on anti-cancer effect of Stellera Chamaejasmel[J]. TCM Res, 1996, 9(5): 44-45. |
| [16] |
DONG D G, GUO E M, ZHANG Y, et al. Effects of resveratrol on the expressions of matrix metalloproteinase and tissue inhibitors of metalloproteinase in cervical cancer HeLa cells[J]. Chinese Journal of Cancer Prevention and Treatment, 2007, 14(7): 489-493. |
| [17] |
DON M, DELL AICA I, PEZZATO E, et al. , Hyperforin inhibits cancer invasion and metastasis[J]. Cancer Res, 2004, 64(17): 6225-6232. DOI:10.1158/0008-5472.CAN-04-0280 |
| [18] |
GUO Y, YAO S K. Effect of baicalin on invasion and metastasis of human hepatocellular line BEL-7402 in vitro[J]. Journal of Third Military Medical University, 2006, 28(6): 594-597. |
| [19] |
REISCHER D, HEYFETS A, SHIMONY S, et al. , Effects of natural and novel synthetic jasmonates in experimental metastatic melanoma[J]. Br J Pharmacol, 2007, 150(6): 738-749. DOI:10.1038/sj.bjp.0707146 |
| [20] |
WANG X L, ZHANG L Y, SUN D X, et al. Effect of curcumin on expression of p21 and CD44V6 in human breast cancer xenografts[J]. Chinese Journal of Pathophysiology, 2007, 23(8): 1524-1526. |
| [21] |
WANG C X, MA R D, YU L J. Effects of tubeimoside on adhension, invasion and migration of a human highly metastatic giant lung carcinoma cell line PGCL3[J]. Chin J Clin Pharmacol Ther, 2006, 11(1): 39-44. |
| [22] |
CHEN Y J, SHIEH C J, TSAI T H, et al. , Inhibitory effect of nor-cantharidin, a derivative compound from blister beetles, on tumor invasion and metastasis in CT26 colorectal adenocarcinoma cells[J]. Anticancer Drugs, 2005, 16(3): 292-293. |
| [23] |
FENG J D, LIN D H, LIU X Q, et al. Inhibitory effect of acanthopanax senticosus saponin on the expression of vascular endothelial growth factor in human hepG2 cell line[J]. Traditional Chinese Drug Research & Clinical Pharmacology, 2007, 18(5): 339-341. |
| [24] |
SHYU Y J, LIN S, LEE C C, et al. , Evodiamine inhibits in vitro angiogenesis:Implication for anti tumor genicity[J]. Life Science, 2006, 78(19): 2234-2243. DOI:10.1016/j.lfs.2005.09.027 |
| [25] |
PIANTELLI M, ROSSI C, IEZZI M, et al. , Flavonoids inhibit melanoma lung metastasis by impairing tumor cells endothelium interactions[J]. J Cell Physiol., 2006, 207(1): 23-29. DOI:10.1002/jcp.20510 |
 2020, Vol. 39
2020, Vol. 39