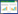文章信息
- 陈敬, 杨宁, 张雅星, 高秀梅
- CHEN Jing, YANG Ning, ZHANG Yaxing, GAO Xiumei
- 二至丸抑制皮肤黑素瘤细胞生长的分子网络机制及关键靶点探讨
- Molecular network mechanism and key targets of Erzhi Pills inhibiting the growth of melanoma cells
- 天津中医药大学学报, 2020, 39(6): 695-701
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(6): 695-701
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.06.20
-
文章历史
收稿日期: 2020-10-10
2. 天津中医药大学, 方剂学教育部重点实验室, 组分中药国家重点实验室, 天津 301617
2. Tianjin University of Traditional Chinese Medicine, Key Laboratory of Pharmacology of Traditional Chinese Medical Formulae, Ministry of Education, State Key Laboratory of Component-based Chinese Medicine, Tianjin 301617, China
二至丸(EZP)是临床常用的经典名方,仅由女贞子(酒蒸)和墨旱莲2味药(1:1)组成,可单独使用,也可随证加减。EZP是平肝补肾之良剂,主治肝肾阴虚证,研究证实其药理作用包括调节免疫力,抑制肿瘤生长,抗炎,抗氧化,抗衰老等[1-3]。中医认为肝肾二脏在皮肤病的发生发展中起着关键作用,临床实践中注重对肝肾的调补,以期对皮肤病的管理取得良好的效果。EZP临床用于多种肿瘤的防治[4-5],该药有多维度的干预肿瘤的机制,其中之一可能与上调肿瘤坏死因子-α(TNF-α)的水平有关,NF-κB与TNF-α属于上下游关系,而NF-κB信号通路在黑素瘤的发生发展过程中起着分子开关样重要的作用,能够抑制肿瘤细胞的增殖并促进肿瘤细胞的凋亡,因此EZP也用于阴虚型皮肤黑素瘤(SKCM)患者的调护[6-8]。文章采用网络药理学的研究方法,对EZP的有效成分抑制SKCM细胞生长的分子网络机制和关键靶点进行探讨。
1 资料与方法 1.1 二至丸药物有效成分筛选女贞子和墨旱莲药物有效成分的筛选,利用中药系统药理学数据库与分析平台(TCMSP),(http://tcmspw.com/tcmsp.php),筛选条件设定为口服生物利用度(OB)≥30%,类药性指数(DL)≥0.18%。同时,在TCMSP平台获取EZP有效成分对应的靶点蛋白,并在UniProtKB数据库(http://www.uniprot.org/)检索出药物靶点所对应的基因,检索条件为人源基因(Organism:Homo sapiens)。
1.2 皮肤黑素瘤相关的靶点获取在GEO数据库获得黑素瘤细胞与黑素细胞的差异基因表达,(https://www.ncbi.nlm.nih.gov/geo/,Series:GSE122910,Samples:GSM3487958,GSM3487959,GSM3487960,GSM3487961,GSM3487962,GSM3487963,GSM3487964,GSM3487965,GSM3487966,GSM3487967),检索条件为人源基因。认为P value < 0.005并|log 2(fold change)| > 1的基因具有显著表达差异,是SKCM相关靶点。
1.3 建立二至丸对黑素瘤细胞的调控网络应用CytoScape3.7.2,对EZP“成分-靶点基因”“靶点基因-黑素瘤”的数据构建网络图。
1.4 建立蛋白互作网络并进行网络拓扑分析在CytoScape中应用BisoGenet程序,建立蛋白互作网络(PPI network),将EZP推定的靶点和SKCM的相关靶点进行可视化展示。数据库来源于相互作用蛋白质数据库(DIP),交互数据集的生物通用存储库(BioGRID),人类蛋白质参考数据库(HPRD),完整的分子相互作用数据库(IntAct),分子相互作用数据库(MINT),生物分子相互作用网络数据库(BIND)。应用CytoNCA软件进行拓扑分析,中心度(DC)在网络药理学和系统药理学研究中代表了拓扑重要性,通过计算DC筛选交互网络中具有拓扑重要性的节点,筛选出枢纽基因(Hub genes)。
1.5 Hub genes的生存分析利用基因表达谱交互分析数据库(GEPIA),对按照DC筛选出的前10位的Hub genes进行验证。方法为全局的生存分析(overall survival,OS),群截断为中位数,数据集为SKCM,绘制箱线图(Boxplot)、分期图(stage plot)和生存图(survival plot)。
1.6 差异基因GO和KEGG富集分析、KEGG网络构建通过基因本体(GO)分析EZP影响SKCM的生物学通路,通过京都基因与基因组百科全书(KEGG)分析EZP影响SKCM的代谢通路。应用DAVID生物信息学资源(https://david.ncifcrf.gov)进行差异基因的富集分析,应用功能注释对黑素瘤细胞的差异基因进行分析,选择官方基因名称(OFFICIAL_GENE_SYMBOL),默认人类物种,并进行生物过程(BP)、细胞组成(CC)、分子功能(MF)和KEGG途径富集分析。筛选条件为P value < 0.05,图中仅显示前20个富集结果。应用CytoScape构建KEGG网络。
2 结果 2.1 二至丸有效成分在OB≥30%,并DL≥0.18的条件下,获得EZP有效成分21种,其中女贞子有效成分13种,墨旱莲有效成分10种,两味药物共有的有效成分2种,分别为MOL000006木犀草素(luteolin)和MOL000098槲皮素(quercetin),两者的OB值分别为36.16和46.43,DL分别为0.25和0.28,见表 1。共获得药物靶点蛋白214个,得到人类靶点基因190个。
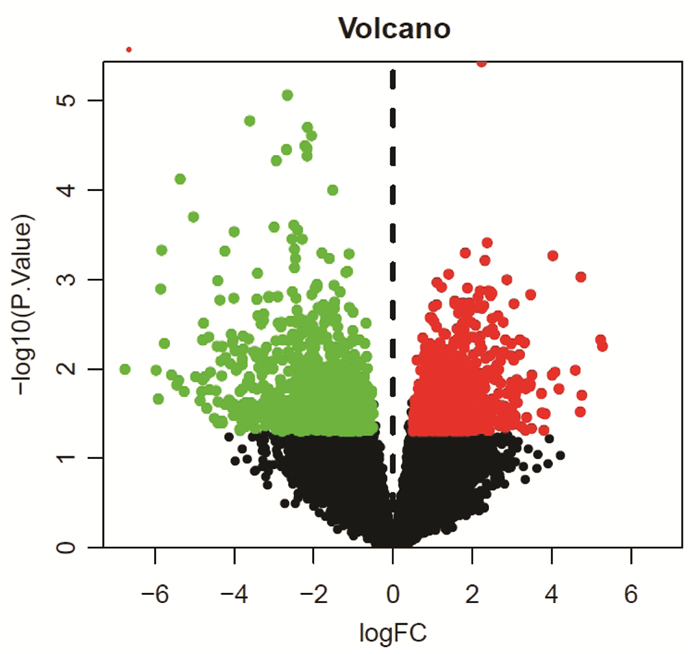
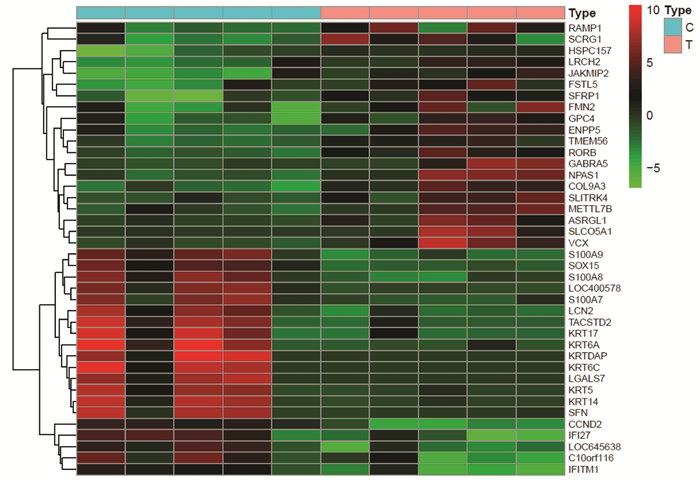
共获得1889个SKCM相关靶点,并通过图 1来显示差异表达基因的分布,图中红色点代表SKCM上调的差异表达基因的分布,绿色点代表SKCM下调的差异表达基因的分布。图 2显示黑素瘤细胞(肿瘤组,Tumor,T)与黑素细胞(观察组,Control,C)的差异表达基因,红色代表上调的基因,绿色代表下调的基因。
|
| 图 1 黑素瘤中差异基因表达分布 |
|
| 图 2 黑素瘤细胞与黑素细胞的差异基因 |
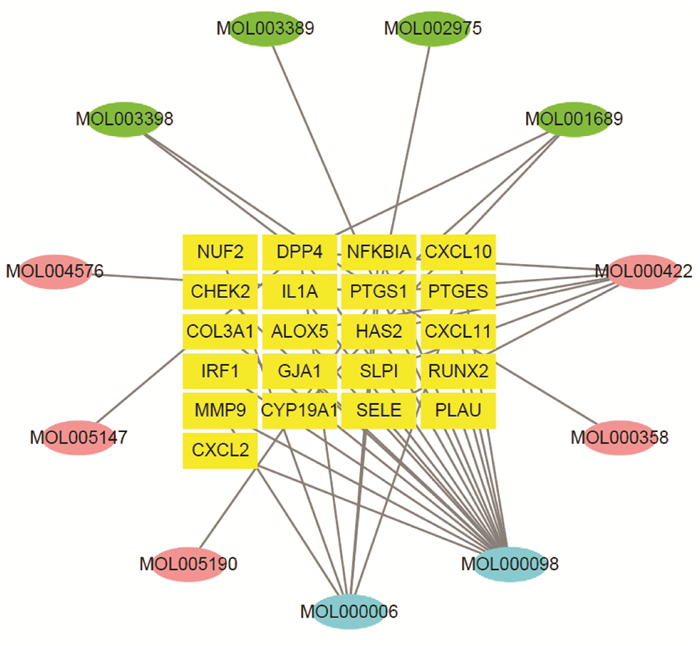
EZP有效成分与SKCM靶点基因作用的网络图,见图 3,节点共32个,其中有效成分共11种(绿色代表墨旱莲的有效成分4种,粉色代表女贞子的有效成分5种,蓝色为两味药物共有的成分2种),可调控黑素瘤细胞的基因(黄色),共21个。边线表示有效成分与靶点基因之间的相互作用,共产生边线40条。产生边线最多前3位有效成分,分别是槲皮素17条,木犀草素6条,此2者为女贞子与墨旱莲共有的成分,山奈酚(kaempferol,MOL000422)6条,此为女贞子中成分。靶点基因中PTGS1含边线10条,DPP4含边线5条,细胞核因子κB抑制剂α(NFKBIA)含边线2条,这3个靶点基因的边线均与女贞子与墨旱莲的共有成分木犀草素和槲皮素产生相互作用。
|
| 图 3 二至丸有效成分与黑素瘤靶点基因作用的网络图 |
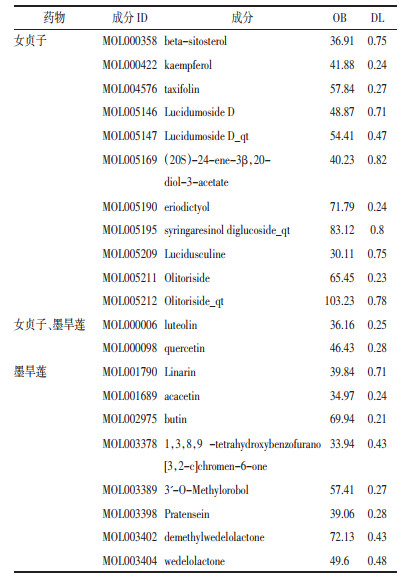
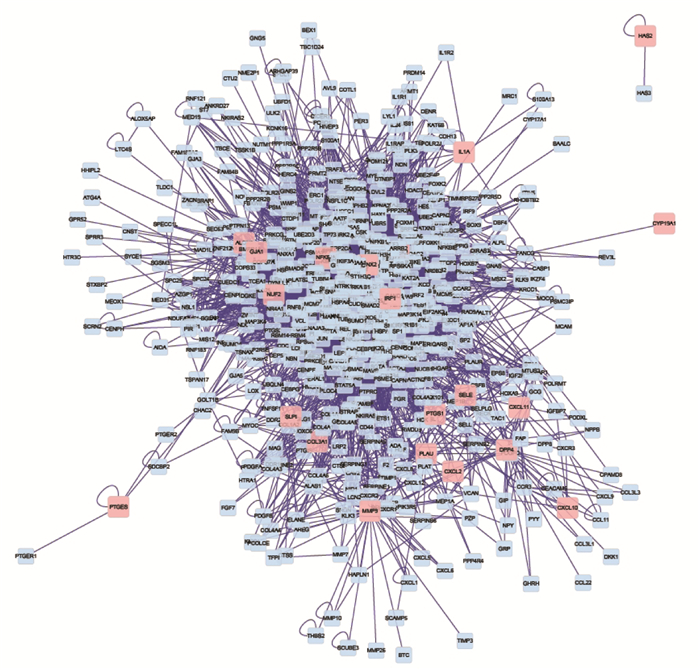
为了揭示EZP对SKCM的潜在作用机制,将EZP推定靶点的PPI网络和SKCM相关靶点的PPI网络合并,确定EZP对SKCM的候选靶点,共得出631个节点,见图 4。应用DC筛选后,平均度值为22.3708,最大度值为178,表 2列出了前10位的枢纽基因。
|
| 图 4 二至丸与黑素瘤的蛋白互作网络 |
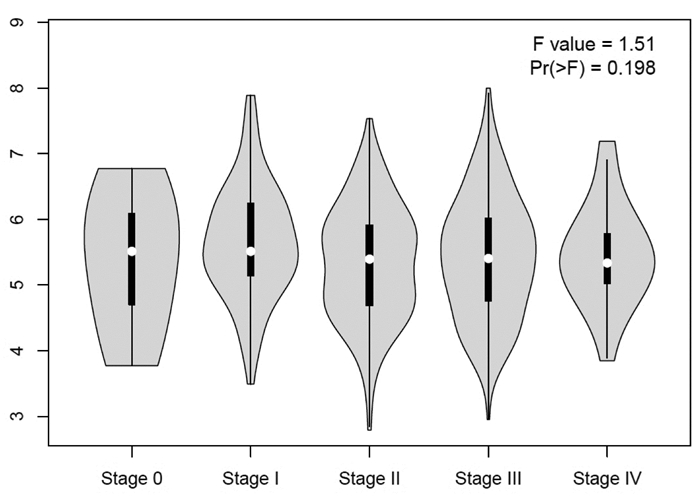
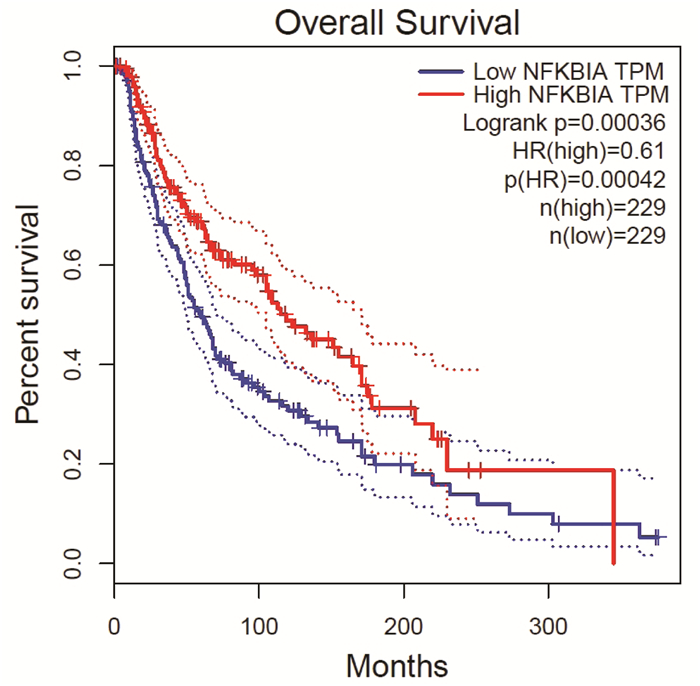
分别对NFKBIA,TP53,NTRK1,HSP90AA1,UBC,EP300进行单因素生存分析,发现NFKBIA在肿瘤组(T)是低表达,在正常人群组(Normal,N)是高表达,见图 5。同时,NFKBIA在肿瘤的0、1、2、3、4期,表达差异变化不显著,见图 6。绘制生存图发现NFKBIA低表达组生存较差,与正常组比较P < 0.005,见图 7。而TP53,NTRK1,HSP90AA1,UBC,EP300的表达差异,均未对存活期产生明显影响。

|
| 图 5 肿瘤组和正常组NFKBIA的表达 |
|
| 图 6 NFKBIA在黑素瘤不同临床分期的表达 |
|
| 图 7 NFKBIA对生存周期的影响 |
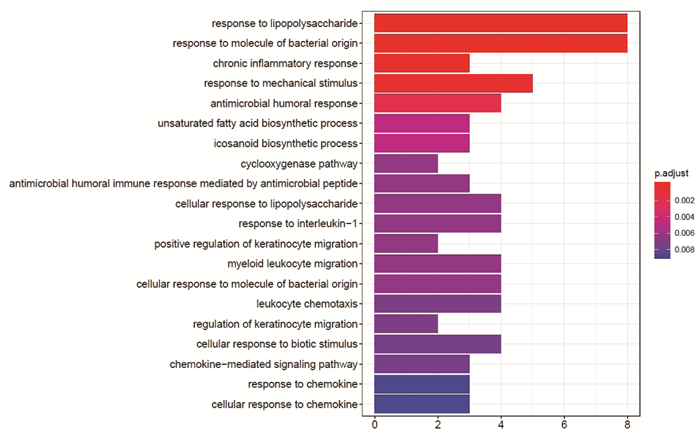
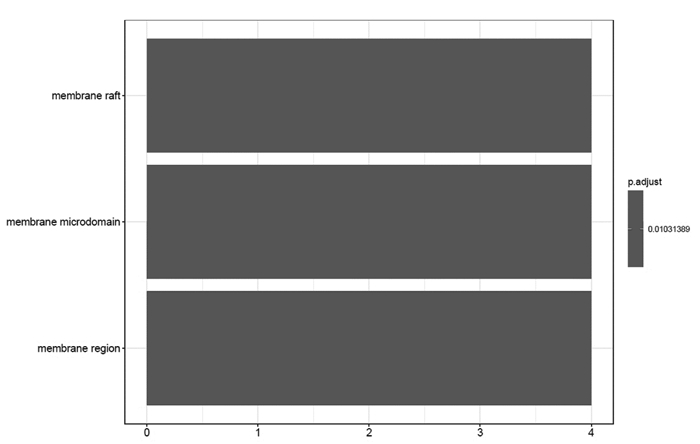
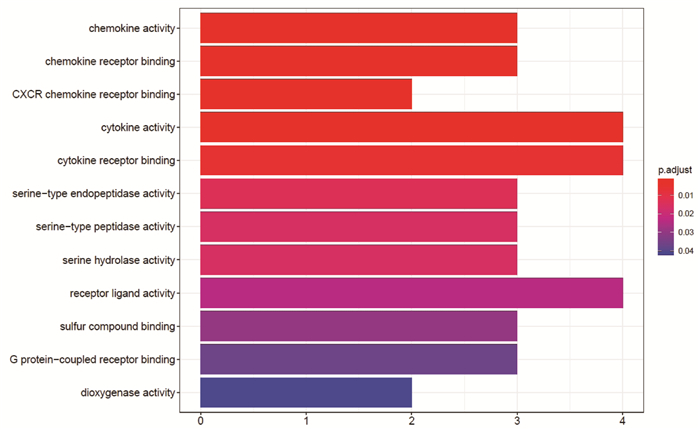
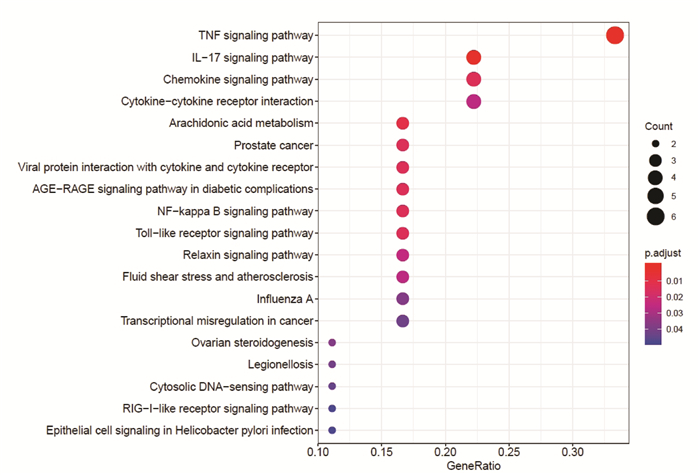
GO富集分析EZP影响SKCM的生物学通路,图中纵坐标是GO的名称,横坐标是富集在每一个GO上基因的数目,柱子越长代表富集在GO上基因的数目越多,柱子颜色代表富集的显著性,越红说明GO在这个基因上富集越显著。富集最显著的生物过程是对脂多糖的反应(response to lipopolysaccharide),对细菌来源分子的反应(response to molecule of bacterial origin),见图 8。富集最显著的细胞组成是膜筏(membrane raft),见图 9。富集最显著的分子功能是趋化因子活性(chemokine activity),趋化因子受体结合(chemokine receptor binding),CXCR趋化因子结合(CXCR chemokine receptor binding),细胞因子活性(cytokine activity),细胞因子受体结合(cytokine receptor binding),见图 10。通过KEGG途径分析,确定EZP在治疗SKCM过程中显著影响的代谢途径。图中纵坐标是KEGG的名称,横坐标是基因的比例,圆圈的大小代表富集在每一个通路上基因的数目,圆圈越大说明富集在通路上的基因数目越多,圆圈的颜色代表富集的显著性,圆圈越红说明在这条通路上富集越显著。前四位分别为肿瘤坏死因子信号通路(TNF signaling pathway),白介素-17信号通路(IL-17 signaling pathway),趋化因子信号通路(Chemokine signaling pathway),细胞因子-细胞因子受体相互作用(Cytokine-cytokine receptor interaction),见图 11。基因-通路网络分析通过KEGG关系网络可视化,即KEGG与基因之间的关系网络,外圈是通路,里面是基因,连线表示基因属于这个通路,基因和通路图形的大小代表了连接节点的数目。基因中第一位的是NFKBIA,通路中第一位是TNF信号通路,见图 12。
|
| 图 8 二至丸影响黑素瘤的GO富集-生物学过程 |
|
| 图 9 二至丸影响黑素瘤的GO富集-细胞组成 |
|
| 图 10 二至丸影响黑素瘤的GO富集-分子功能 |
|
| 图 11 二至丸影响黑素瘤的KEGG富集 |

|
| 图 12 二至丸影响黑素瘤的KEGG网络 |
SKCM是一种侵袭性皮肤癌,并且具转移性,中位生存率约为6个月,且发病率在全球范围内呈上升趋势,在中国每年新发病例约2万例左右,转移性黑素瘤预后极差,5年生存率低于10%[9-10]。SKCM起源于位于表皮基底层的黑素细胞,在正常的生理环境中,黑素细胞的生长受角质形成细胞分泌的调节,由于调节细胞生长的关键基因突变,黑素细胞无法对角质形成细胞的调节信号做出适当的反应,最终导致异常生长。近年来,尽管在黑素瘤有效治疗方法的发展方面取得了重大突破,但疾病的不可治愈性仍然是一个挑战[11]。而且,许多传统的抗癌疗法面临着许多问题,如多药耐药性、抵达癌组织前的全身分布和毒副作用等,临床上需要不断探索黑素瘤的管理方法,以期延长患者的生存时间。中草药具有广泛的药理作用,应用于各种慢性病和肿瘤的治疗,它能影响多个分子靶点和通路,在临床中显示了良好的效果。
二至丸出自明代吴旻辑的《扶寿精方》,其性平和、偏寒,归肝、肾经,其补而不腻,为平补佳品。临床广泛应用于证属肝肾虚证的多种疾病,也常用于缓解亚健康的相关症状,且鲜见不良反应的报道。EZP应用于包括SKCM等多种肿瘤的治疗,取得较好临床疗效,且对EZP药理作用的研究也表明它具有良好的抗肿瘤、抗衰老和抗炎等作用。
中医药是个高度复杂的系统,含有大量的化学成分,本研究尝试通过网络药理学方法探讨EZP治疗SKCM的有效化学成分、关键靶点及分子网络机制。
EZP中3种有效成分与SKCM靶点基因作用密切,其中木犀草素和槲皮素是女贞子和墨旱莲两药共有成分,具有较高的生物利用度;山奈酚来源于女贞子,可能是一种有效的免疫抑制剂,可减少有害的免疫反应,包括慢性炎症和自身免疫。
本研究得到的EZP对抗SKCM的候选目标,按照DC筛选枢纽基因,发现列第1位的NFKBIA在肿瘤组是低表达。NFKBIA被认为是1种抑癌基因,是避免NF-κB激活的重要抑制剂。研究表明NF-κB在SKCM细胞中被高度激活[12],NF-κB特异性抑制剂具有显著的抑制鼠黑素瘤B16细胞生长及VEGF表达的作用[7],且具有显著的抑制人黑素瘤A375细胞生长及PCNA表达的作用[8],是1种有潜力的抑制黑素瘤增殖的药物,阻断NF-κB和ERK两条信号通路对A375细胞具有增殖抑制和诱导凋亡作用,两者联合具有协同效应[13]。难以控制的黑素瘤细胞NF-κB通路持续激活[14],NFKBIA低表达显著缩短患者生存时间,且NFKBIA在黑素瘤各个临床分期中持续低表达,推测EZP可用于SKCM各期的管理,通过改善NFKBIA低表达,延长生存年限。
KEGG富集显示,EZP影响黑素瘤细胞生长的代谢通路主要为TNF信号通路,IL-17信号通路,趋化因子信号通路,细胞因子-细胞因子受体相互作用等。TNF-α具有一定的抗肿瘤效应,在小鼠黑素瘤模型研究中发现,它能够促进肿瘤的广泛坏死[15],多项临床研究将TNF-α应用于恶性黑色素瘤的肢端灌流,获得较好效果。NF-κB是IL-17信号通路下游主要的亚通路,通路持续活化可能是疾病持续存在的原因之一[16]。
综上,本研究对二至丸抑制皮肤黑素瘤细胞生长的分子机制和靶点进行了基本预测,为后期基础实验进一步验证提供了理论基础。
| [1] |
赵海梅, 周步高, 王馨, 等. 二至丸预防和治疗性给药对大鼠损伤后肝细胞再生障碍的保护作用[J]. 中国实验方剂学杂志, 2017, 23(16): 128-132. ZHAO H M, ZHOU B G, WANG X, et al. Protective effect of Erzhi Pills by two different administrations for rats with liver cytothesis obstacle after injury[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(16): 128-132. |
| [2] |
ZHAO H M, ZHANG X Y, LU X Y, et al. Erzhi pillsprotected experimental liver injury against apoptosis via the PI3K/Akt/Raptor/Rictor pathway[J]. Frontiers in Pharmacology, 2018, 9: 283. DOI:10.3389/fphar.2018.00283 |
| [3] |
王浩, 庄威, 薛晓鸥. 中药复方二至丸考源、沿革及现代药理研究进展[J]. 辽宁中医药大学学报, 2017, 19(12): 93-97. WANG H, ZHUANG W, XUE X O. Study on the origin, evolution and modern pharmacological research of traditional Chinese medicine compound Erzhi Pills[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2017, 19(12): 93-97. |
| [4] |
余文燕, 王国娟, 王桦影, 等. 二至丸对结肠癌细胞增殖及凋亡作用的实验研究[J]. 中药药理与临床, 2018, 34(4): 11-15. YU W Y, WANG G J, WANG H Y, et al. The experimental research on the effect of Erzhi Pills on proliferation and apoptosis of human colon cancer cells[J]. Pharmacology and Clinic of Traditional Chinese Medicine, 2018, 34(4): 11-15. |
| [5] |
陈芝强, 陈怡, 麦喆钘, 等. 基于网络药理学探讨二至丸治疗肝细胞癌的作用机制[J]. 中国实验方剂学杂志, 2020, 26(3): 166-174. CHEN Z Q, CHEN Y, MAI Z X, et al. Mechanism of Erzhi Pills on hepatocellular carcinoma based on network pharmacology[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(3): 166-174. |
| [6] |
周步高, 刘端勇, 左铮云. 二至丸防治肿瘤的免疫学视角分析[J]. 中华中医药杂志, 2015, 30(5): 1800-1802. ZHOU B G, LIU D Y, ZUO Z Y. Cellular immunological evidences of the prevention and cure of tumor by Erzhi Pills[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2015, 30(5): 1800-1802. |
| [7] |
周艳梅, 江从军, 张汝芝, 等. NF-κB特异性抑制剂PDTC对鼠黑素瘤B16细胞增殖及VEGF表达的影响[J]. 蚌埠医学院学报, 2012, 37(9): 1013-1015. ZHOU Y M, JIANG C J, ZHANG R Z, et al. Effects of PDTC on the proliferation of mouse melanoma cell line B16 and VEGF expression[J]. Journal of Bengbu Medical College, 2012, 37(9): 1013-1015. DOI:10.3969/j.issn.1000-2200.2012.09.002 |
| [8] |
江从军, 周艳梅, 张汝芝, 等. NF-κB抑制剂PDTC对人黑素瘤A375细胞增殖的影响[J]. 齐齐哈尔医学院学报, 2012, 33(18): 2445-2446. JIANG C J, ZHOU Y M, ZHANG R Z, et al. Effect of PDTC on proliferation of human melanoma cell line A375[J]. Journal of Qiqihar University of Medicine, 2012, 33(18): 2445-2446. DOI:10.3969/j.issn.1002-1256.2012.18.004 |
| [9] |
OLSEN C M, GREEN A C, PANDEYA N, et al. Trends in melanoma incidence rates in eight susceptible populations through 2015[J]. The Journal of Investigative Dermatology, 2019, 139(6): 1392-1395. DOI:10.1016/j.jid.2018.12.006 |
| [10] |
GIAVINA-BIANCHI M H, NETO C F, JUNIOR J A S, et al. Worse survival of invasive melanoma patients in men and "de novo" lesions[J]. Anais Brasilros de Dermatologia, 2020, 95(2): 158-164. DOI:10.1016/j.abd.2019.07.003 |
| [11] |
WICKREMESEKERA A C, BRASCH H D, LEE V M, et al. Expression of cancer stem cell markers in metastatic melanoma to the brain[J]. Journal of Clinical Neuroence, 2019, 60: 112-116. |
| [12] |
ALI F, KHAN B A, SULTANA S. Wedelolactone mitigates UVB induced oxidative stress, inflammation and early tumor promotion events in murine skin:plausible role of NFkB pathway[J]. European Journal of Pharmacology, 2016, 253-264. |
| [13] |
刘宁, 肖君刚, 潘敏, 等. 阻断NF-κB和ERK通路对黑素瘤细胞增殖及凋亡的影响[J]. 中国皮肤性病学杂志, 2014, 28(7): 667-671. LIU N, XIAO J G, PAN M, et al. The effects of blocking NF-κB and ERK signaling transduction pathway on the proliferation and apopatosis in human melanoma cell line A375[J]. The Chinese Journal of Dermatovenereology, 2014, 28(7): 667-671. |
| [14] |
ASCIERTO P A, STEICHER H Z, SZNOL M. Melanoma:A model for testing new agents in combination therapies[J]. Journal of Translational Medicine, 2010, 20(8): 38-45. |
| [15] |
DE LIMA V C C, DE CARVALHO A F, MORATO-MARQUES M, et al. TNF-alpha and melphalan modulate a specific group of early expressed genes in a murine melanoma model[J]. Cytokine, 2013, 62(2): 217-225. DOI:10.1016/j.cyto.2013.02.022 |
| [16] |
夏萍, 周小勇. 银屑病角质形成细胞核因子κB抑制剂α的表达研究[J]. 世界临床药物, 2019, 40(11): 771-775. XIA P, ZHOU X Y. The expression research of nuclear fac-tor-κB inhibitor α in the keratinocytes of psoriasis[J]. World Clinical Drugs, 2019, 40(11): 771-775. |
 2020, Vol. 39
2020, Vol. 39