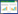文章信息
- 张钰坤, 李新悦, 张瀛, 宋旭楠, 孙新茹, 秦欢, 郭盼, 刘志东
- ZHANG Yukun, LI Xinyue, ZHANG Ying, SONG Xunan, SUN Xinru, QIN Huan, GUO Pan, LIU Zhidong
- OX26/ApoE共修饰的载小檗碱介孔二氧化硅纳米粒药动学研究
- Pharmacokinetic study of OX26/ApoE co-modified berberine-loaded mesoporous silica nanoparticles
- 天津中医药大学学报, 2020, 39(6): 702-710
- Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(6): 702-710
- http://dx.doi.org/10.11656/j.issn.1673-9043.2020.06.21
-
文章历史
收稿日期: 2020-08-08
2. 天津中医药大学, 现代中药发现与制剂技术教育部工程研究中心, 天津 301617
2. Engineering Research Center of Modern Chinese Medicine Discovery and Preparation Technique, Ministry of Education, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
小檗碱(BBR)又名黄连素,是从黄连属植物中提取的天然活性成分,为异喹啉类生物碱,具有抗炎[1]、抗菌[2]、抗肿瘤[3]、神经保护[4]、降糖[5]、降脂[6]等作用。有研究报道BBR可以阻断海马CA1区神经元的钾通道,对缺血性中风具有神经保护作用[7]。但BBR水溶性和胃肠道吸收差,口服生物利用度低且具有首过效应,这极大程度上限制了其临床应用[8]。因此,开发一种优良的载药体系以减少这些限制具有非常重要的意义。
介孔二氧化硅是一种具有有序孔道结构的无机纳米材料,大的比表面积和孔容积、高药物包载率、良好的热力学稳定性及生物相容性使其广泛应用于生物医学等不同领域[9]。通过将表面与孔道内硅羟基进行功能化,可延长药物的体内循环,同时靶向于病灶部位从而更好的发挥药理作用[10-11]。介孔二氧化硅作为一种新兴的纳米材料,成为发展前景较为广阔的药物递送载体。
血脑屏障(BBB)是存在于血浆与脑脊液之间的一种复杂结构,会阻止血液中超过98%的小分子和近100%的大分子进入中枢神经系统(CNS),导致许多潜在的脑部治疗药物无法进入CNS发挥作用[12]。脑毛细血管内皮细胞上的转铁蛋白受体(TfR)和低密度脂蛋白受体在脊椎动物BBB上的表达尤为丰富[13-14]。小鼠抗大鼠TfR的单克隆抗体[15](OX26)和载脂蛋白E[16](ApoE)可以通过TfR和低密度脂蛋白受体LDLR、LRP-1、VLDLR及ApoER-2介导的胞吞转运增加脑微血管内皮细胞对于纳米粒的摄入。
本实验拟合成粒径为100 nm以下的介孔二氧化硅纳米粒,通过OX26和ApoE两种抗体修饰构建脑靶向纳米载药系统,包载小檗碱后得到小檗碱脑靶向介孔硅纳米载体,通过与BBB上受体的特异性结合介导药物入脑,提高药物在脑内的生物利用度。
1 材料与试剂 1.1 仪器Agient 1260型高效液相色谱仪(VWD检测器及Chem Station色谱工作站,美国安捷伦公司);高速冷冻离心机(ST16R,美国赛默飞世尔科技有限公司);智能磁力加热搅拌器(巩义市予华仪有限责任公司,SZCL-4B);激光粒度分析仪(Nano ZS型,英国Malvern公司);场发射透射电子显微镜(Tecnai G2F20,美国FEI公司);红外光谱仪(Nicolet IS10,美国尼高力公司);差示扫描量热仪(Jade DSC,美国Perkin Elmer公司);高性能多通道全自动比表面与孔隙分析仪(RISTARⅡ 3020型,美国麦克公司);全自动溶出取样系统(DT-820,德国ERWEKA公司);pH计(PB-10型,北京赛多利斯仪器系统有限公司)。
1.2 试剂十六烷基三甲基溴化铵(CTAB,99%,GENVIEW);正硅酸四乙酯(TEOS,≥28.4%,国药集团化学试剂有限公司);乙二醇(阿拉丁,D1611016);氨水(天津市津科精细化工研究所,20171029);浓硫酸(95%~98%,天津利安隆博华医药化学有限公司);盐酸(36.0%~38.0%,天津利安隆博华医药化学有限公司);氢氧化钠(天津市科密欧化学试剂有限公司);2-氰基乙基三乙氧基硅烷(≥ 97%,阿拉丁);BBR提取物(纯度大于98%,南京泽朗医药科技有限公司);OX26抗体(Bio-Rad公司,MCA155G);AC(Santa Cruz Blotechnology,sc-390925);水合氯醛(分析纯,天津市瑞金特化学品有限公司);磷酸(美国Thermo Fisher公司,色谱纯);乙腈(美国Thermo Fisher公司,色谱纯);右旋四氢巴马汀(纯度大于98%,上海源叶生物科技有限公司);甲酸(日本株式会社,K3JHG-LS)。
1.3 动物健康SD大鼠,雄性,体质量220~250 g,购于北京华阜康生物科技股份有限公司,合格证号:SCXK(京)2014-0004。动物室温度:(25±2)℃,相对湿度:(50±2)℃,相关研究遵照动物实验原则进行。
2 方法与结果 2.1 羧基介孔二氧化硅纳米载体的制备采用共缩合反应[17]制备。1.2 g CTAB溶于180 mL去离子水和5.5 mL(25%)氨水,加入20 mL乙二醇,1 000 rpm、60 ℃条件下剧烈搅拌约30 min,快速加入2.0 mL TEOS和0.4 mL 2-氰基乙基三乙氧基硅,反应2 h,相同温度下静置沉化24 h。12 000 r/min离心20 min收集样品,去离子水和乙醇洗涤数次。将干燥的产物在100 ℃用9 mol/L H2SO4溶液酸化处理。模板剂CTAB通过酸性乙醇萃取(约9 mL HCl在100 mL乙醇中65 ℃搅拌24 h),12 000 r/min离心30 min分离得到产物,50 ℃真空干燥得MSNs-COOH。
2.2 OX26和ApoE共修饰的介孔二氧化硅的制备参照文献[18]采用碳二亚胺法进行偶联。60 mg MSNs-COOH分散于10 mL MES(pH 6.0)缓冲液中,加入EDC 60 mg和NHS 40 mg,室温条件下震荡1 h,离心后去掉上清液,重新分散于10 mLPBS缓冲液中,分别加入600 μg OX26、600 μg ApoE、300 μg OX26和300 μg ApoE,室温条件下震荡反应12 h,洗涤两遍并离心,得到MSNs-OX26、MSNs-ApoE、MSNs-OX26/ApoE,干燥备用。
2.3 小檗碱脑靶向载体的制备浸渍法包载BBR。取浓度为1 mg/mL的BBR NaOH溶液(pH 10.5)20 mL置于西林瓶中,加入20 mg MSNs-OX26、MSNs-ApoE、MSNs-OX26/ApoE于磁力搅拌器,37 ℃、180 r/min搅拌24 h。剩余药物溶液也于相同条件下搅拌24 h,作为对照。
2.4 介孔二氧化硅载体的表征 2.4.1 形态、粒径及Zeta电位采用场发射透射电子显微镜观察MSNs-COOH及载药后制剂形貌;通过激光粒度分析仪测定MSNs-COOH的粒径、粒径分布及Zeta电位。结果如图 1和图 2,MSNs-COOH均呈规则的球形,有清晰的孔道结构,粒径较为均一,载荷后载体形态与粒径无明显改变。MSNs-COOH粒径为(129.8±1.3)nm,Zeta电位为-(36.00±1.0)nm。
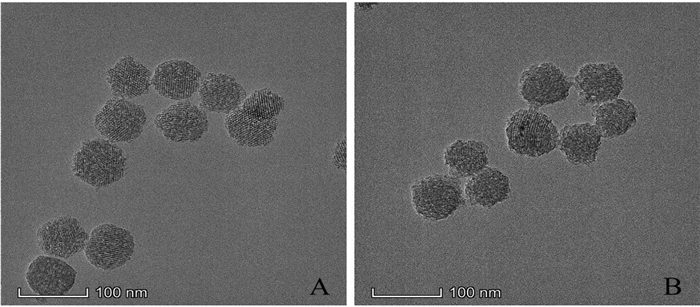
|
| 图 1 MSNs-COOH(A)、BBR-MSNs(B)的透射电镜图 |
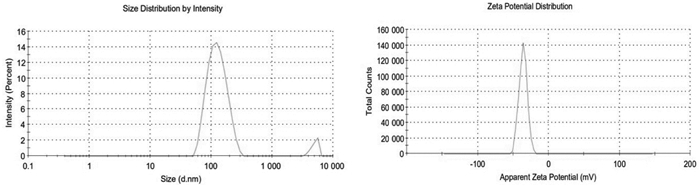
|
| 图 2 MSNs-COOH粒径(上)与Zeta电位(下)图 |
采用溴化钾压片法进行傅里叶变换红外光谱定性分析。分别扫描记录MSNs-COOH、MSNs-OX26、MSNs-ApoE及MSNs-OX26/ApoE的红外光谱图,确定其组成成分。波谱范围4000~400 cm-1,分辨率为2 cm-1。结果如图 3,1 100 cm-1位置的峰为Si-O键伸缩振动峰,3 750~3 000 cm-1位置为硅羟基O-H伸缩振动峰。图A中1 715 cm-1位置的峰归属于C=O伸缩振动吸收峰,属于-COOH结构的特征吸收峰,2 923 cm-1位置的吸收峰为2-氰基乙基三乙氧基硅烷结构中C-H伸缩振动峰,1 470 cm-1位置小峰为C-H变形振动峰。B、C、D 3种抗体修饰的MSNs在1 715 cm-1位置-COOH结构的特征吸收峰较A均减弱,推测可能是由于介孔硅载体上的一部分-COOH与抗体进行了偶联,由于抗体本身的数量少,且N-H振动峰易与3 750~3 000 cm-1位置的硅羟基O-H伸缩振动峰重合,故未发现抗体的特征峰。IR图谱结果能够表明MSNs-COOH载体表面的一部分-COOH基团能与抗体进行偶联,可以实现对介孔硅的抗体修饰。
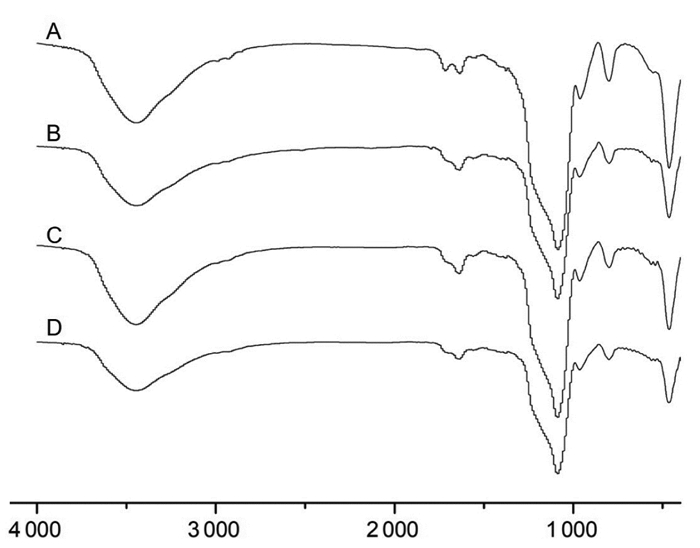
|
| 图 3 MSNs-COOH(A)、MSNs-OX26(B)、MSNs-ApoE(C)MSNs-OX26/ApoE(D)红外光谱图 |
采用多通道全自动比表面与孔隙分析仪对MSNs-COOH以及MSNs-OX26、MSNs-ApoE和MSNs-OX26/ApoE进行分析,用BET法计算比表面积和孔径,BJH模型计算孔容积。如图 4所示,4种制剂均呈现出无机有序介孔硅材料特有的Langmuir Ⅳ型等温线和H1型回滞环[19]。经计算,MSNs-COOH孔容积为1.430 cm3/g,孔径为7.802 nm,比表面积为733.0 m2/g。MSNs-OX26孔容积为1.350 cm3/g,比表面积为752.66 m2/g。MSNs-ApoE孔容积为1.330 cm3/g,比表面积为793.5 m2/g;MSNs-OX26/ApoE孔容积为0.8406 cm3/g,比表面积为649.6 m2/g。因此,将介孔硅载体与抗体OX26、ApoE以及两种抗体偶联后并未对MSNs的比表面积、孔容积等参数产生影响,均具有较大的比表面积与孔容积。
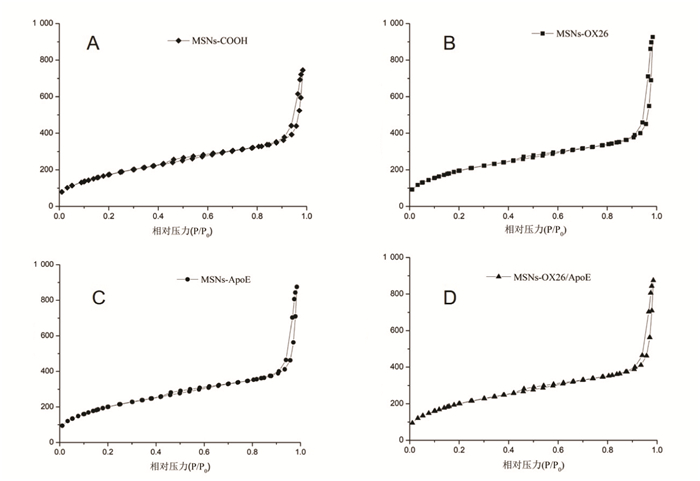
|
| 图 4 MSNs-COOH(A)、MSNs-OX26(B)、MSNs-ApoE(C)和MSNs-OX26/ApoE(D)的氮气物理吸附脱附等温线 |
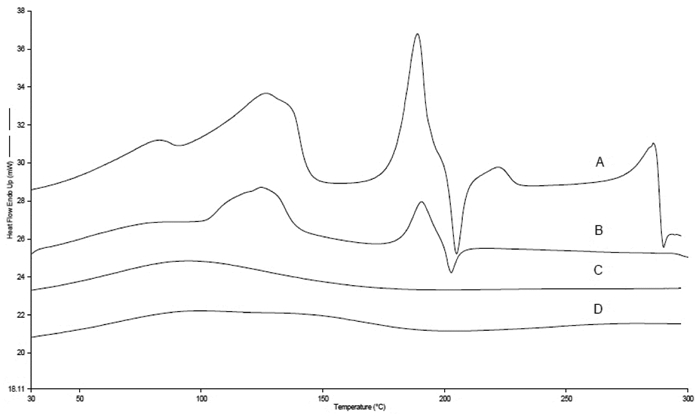
称取BBR原料药、MSNs、BBR与MSNs的物理混合物以及BBR-MSNs,放入差示扫描量热仪中,氮气保护下以10 ℃/min的速率由30 ℃加热至300 ℃,记录样品的热力学曲线。结果如图 5所示,A显示BBR有两个吸收峰,129.5 ℃出现的第一个吸收峰是BBR失去两个结晶水分子的脱水峰,191.8 ℃出现的吸收峰是BBR熔解时的熔融吸热峰。B在191.8 ℃处也出现较小的吸收峰,表明物理混合物中BBR仍以晶体形式存在,但可能是介孔硅载体的存在影响了BBR的熔点峰。而C和D的图谱中这些峰基本消失,说明BBR并非吸附于载体表面,而是被介孔硅纳米载体有效包载进入介孔结构中以非晶型存在。
|
| 图 5 BBR(A)、BBR与MSNs的物理混合物(B)、BBR-MSN(C)和MSNs(D)差式扫描量热分析图谱 |
色谱柱:Waters XBridge®Shield RP18(4.6 mm×250 mm,5 μm);流动相为乙腈(A)-0.02 mol/L磷酸二氢钾溶液(B),梯度:27%乙腈等度洗脱;检测波长:254 nm;柱温:30 ℃。
2.5.2 对照品、供试品溶液的配制精密称取适量BBR对照品,用甲醇溶解后配制成对照品溶液;收集载药后的上清液,用pH 10.5的NaOH溶液配制成供试品溶液。
2.5.3 专属性考察照“2.3.1”项下色谱条件,分别取对照品溶液、供试品溶液、空白溶剂进样测定。结果显示pH 10.5的NaOH对于BBR的含量测定无干扰。
2.5.4 线性关系考察精密量取BBR对照品,用pH 10.5的NaOH溶液稀释成质量浓度分别为1.01、2.02、5.04、10.08、25.20、50.40、100.80 μg/mL的线性溶液,进样测定。以待测物峰面积为纵坐标(Y),待测物浓度为横坐标(X)建立回归方程,标准曲线方程为Y=36.174X-62.438,r2=0.999 9,结果表明BBR在质量浓度为1.01~100.80 μg/mL范围内线性关系良好。
2.5.5 精密度实验取低、中、高3种质量浓度的BBR对照品溶液进样测定,一天内测定5次,计算日内精密度;后连续3天测定计算日间精密度。结果显示日内精密度的RSD值为0.76%,日间精密度为0.68%,说明该方法精密度良好。
2.5.6 重复性实验取同一供试品溶液6份进样测定,结果显示RSD值为1.9%,说明重复性良好。
2.5.7 稳定性实验取BBR对照品溶液,分别于0、2、4、6、8、10、12、24 h进样测定,考察样品的稳定性。经计算RSD值为1.15%,表明样品稳定性良好。
2.5.8 加样回收率取样品溶液适量,按0.8:1,1:1,1.2:1的比例加入对照品溶液,进样测定,以所测值与真实值之比计算回收率。结果分别为(91.59±0.071)%、(93.49±0.011)%、(90.82±0.032)%,加样回收率符合要求。
2.5.9 载药量的测定将载药后样品离心(12 000 r/min,10 min),取上清液稀释后进样测含量,所得为未包载的游离药物含量;同法检测对照组药物溶液,为药物总量。根据下列公式计算载药量:

|
用ACSF和PBS(pH7.4)作为释放介质,考察BBR原料药、BBR与MSNs的物理混合物、BBR-MSNs-OX26、BBR-MSNs-ApoE及BBR-MSNs-OX26/ApoE 5种制剂中BBR的释放特征。在(37±0.5)℃下,取5种制剂各3 mL于透析袋内(含BBR量均为3 mg),采用小杯法,同一时刻放入200 mL溶出介质中,搅拌速度为75 r/min。于5、10、15、30、60、120、180、240、360、480、600、720 min分别取样2 mL,同时补充同体积介质。取出液经0.45 μm滤膜过滤后进样测定。
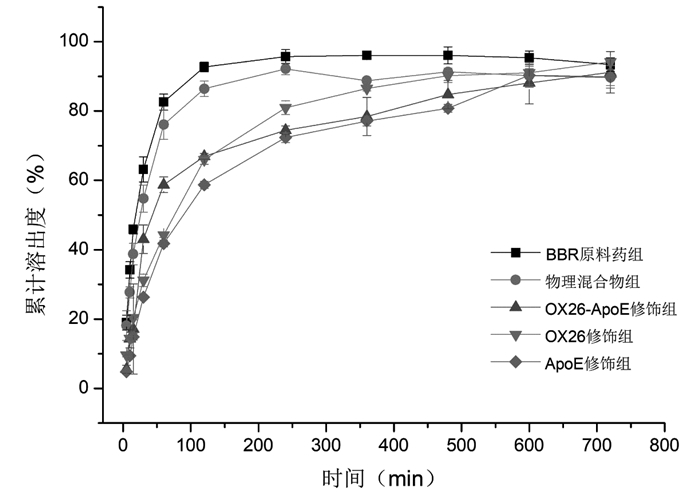
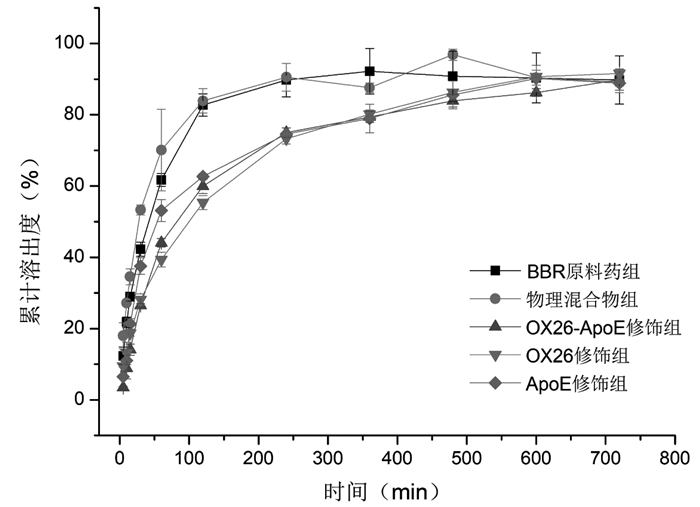
由图 7,8可知,在两种介质中,BBR原料药组与物理混合物组均在两小时内累计溶出度达90%左右,释放趋于平衡,BBR-MSNs-OX26、BBR-MSNs-ApoE和BBR-MSNs-OX26/ApoE 3组在两种介质中均在8~10 h左右达到平衡,在ACSF溶出介质中12 h内的累积溶出度分别分别为(94.18±1.0)%、(89.84±3.2)%和(91.18±6.0)%;在PBS溶出介质中在12 h内的累积溶出度分别为(91.61±0.72)%、(88.86±0.82)%和(89.88±2.9)%,均表现出一定的缓释特性,未见突释现象。
|
| 图 7 BBR原料药、物理混合物和BBR-MSNs-OX26、BBR-MSNs-ApoE和BBR-MSNs-OX26/ApoE在ACSF中的累积溶出度(%,x±s,n=3) |
|
| 图 8 BBR原料药、物理混合物和BBR-MSNs-OX26、BBR-MSNs-ApoE和BBR-MSNs-OX26/ApoE在PBS中的累积溶出度(%,x±s,n=3) |
健康雄性SD大鼠(220~250 g),给药前12 h禁食不禁水。将180只大鼠随机分为BBR溶液,BBR-MSNs、BBR-MSNs-OX26、BBR-MSNs-ApoE以及BBR-MSNs-OX26/ApoE 5组,每组36只。采用尾静脉注射方式给药,分别于给药后5 min、10 min、15 min、30 min、1 h、2 h、4 h、6 h、8 h、12 h、24 h、48 h腹主动脉取血,4 ℃,4 000 rpm条件下离心10 min,取血浆于离心管中-20℃保存。取血后生理盐水进行心脏灌流,断头取脑,将脑组织用生理盐水冲洗后,滤纸吸干水分,称质量,加入4倍量的生理盐水在高速匀浆机中匀浆,-20 ℃条件下保存。
2.7.2 血浆和脑匀浆处理方法精密量取100 μL大鼠血浆和脑匀浆样品,加入300 μL乙腈(含右旋四氢巴马汀,浓度为4.08 ng/mL),涡漩混合5 min,12 000 r/min离心10 min,取上清进行测定。
2.7.3 检测条件及线性关系考察质谱条件:电喷雾离子源(ESI源);扫描方式:正离子(ESI+)检测;检测方式:多反应离子监测(MRM)。电喷雾电压:5 kV,雾化气体:N2,喷雾气流速(Gas1):40 p.s.i;离子源温度:300 ℃。
色谱条件:色谱柱:Agilent ZORBAX Eclipse Plus C18(2.1 mm×100 mm,1.8 μm);流动相:A(0.1%甲酸溶液)-B乙腈梯度洗脱:0~5 min:85%~30% A,柱温:35 ℃。
精密称定适量BBR对照品,配制成质量浓度为508 μg/mL标准溶液。用乙腈稀释成2.540、5.080、10.16、50.80、101.6、254.0、508.0、1 016、2 032 ng/mL的线性溶液。分别取100 μL的线性溶液于离心管中,氮气吹干,加入大鼠空白血浆或脑匀浆液100 μL,涡旋5 min,加入300 μL乙腈(含右旋四氢巴马汀,浓度为4.080 ng/mL),漩涡混合5 min,12 000 r/min离心10 min,吸取上清液进样。以待测物的浓度为横坐标,待测物峰面积为纵坐标进行线性回归。得到BBR在血浆中线性回归方程为Ŷ=0.115 109X-0.055 515,r2=0.999 9,在脑组织匀浆中的线性方程为Ŷ=0.115 720X-0.095 362,r2=0.999 9,表明质量浓度在2.54~2 032.00 ng/mL范围内线性关系良好。
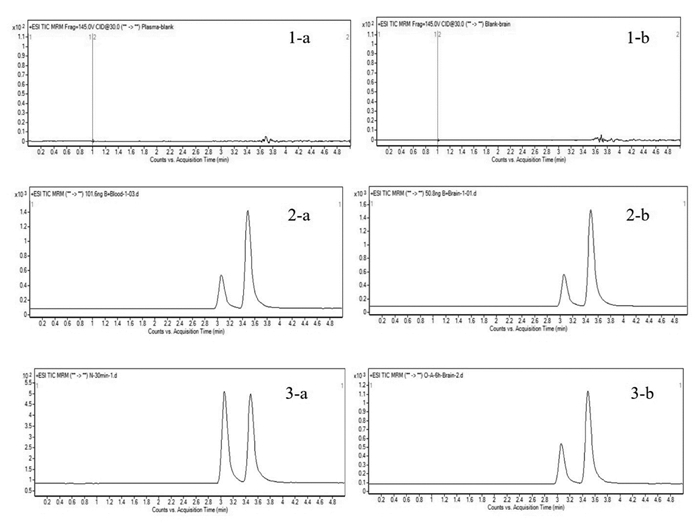
2.7.4 方法学考察取空白血浆样品、空白脑匀浆样品、对照品血浆样品、对照品脑匀浆样品和待测样品进样检测,由图 9可知血浆和脑匀浆中内源性成分对BBR的含量测定无干扰,表明该方法专属性良好。取低、中、高3种质量浓度样品,同一天内连续测定6次,RSD值分别为1.12%、1.08%、0.83%,表明日内精密度良好。每日测定1次,连续测定3 d,RSD值分别为3.6%、1.4%、0.02%,表明日间精密度良好。另取大鼠空白血浆及空白脑匀浆,加入对照品溶液和内标溶液适量,配制成低、中、高质量浓度的血浆与脑匀浆样品,每个浓度6份,进样测定方法回收率和提取回收率。结果显示低、中、高3种浓度标准品溶液在血浆和脑匀浆中的提取回收率在91.05%~99.68%之间,方法学回收率在97.02%~110.2%之间,符合生物样品测定要求。另取低、中、高质量浓度对照品溶液,加入乙腈离心取上清。每个浓度各3份,测定其在4 ℃放置24 h的稳定性,结果显示24 h内稳定性良好。
|
| 注:1.空白基质;2.对照品基质;3.待测样品;a.血浆;b.脑组织匀浆。 图 9 BBR样品专属性图谱 |
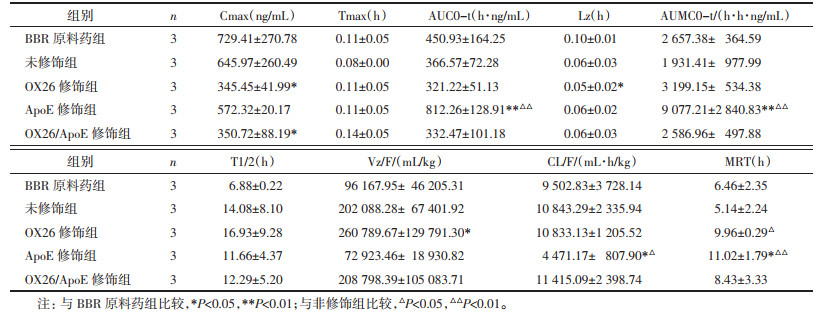
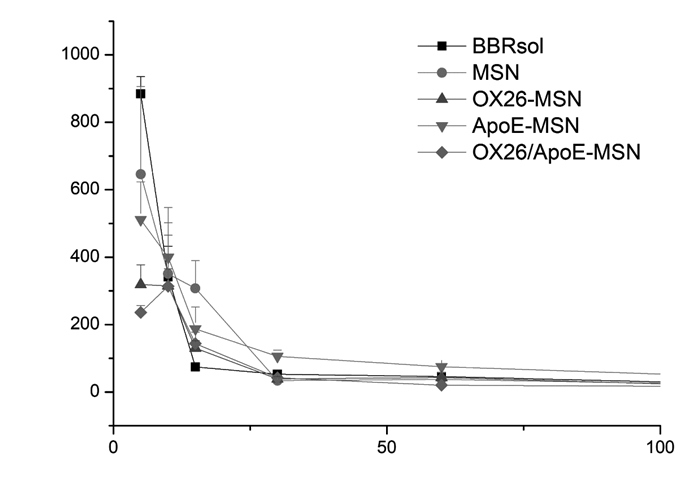
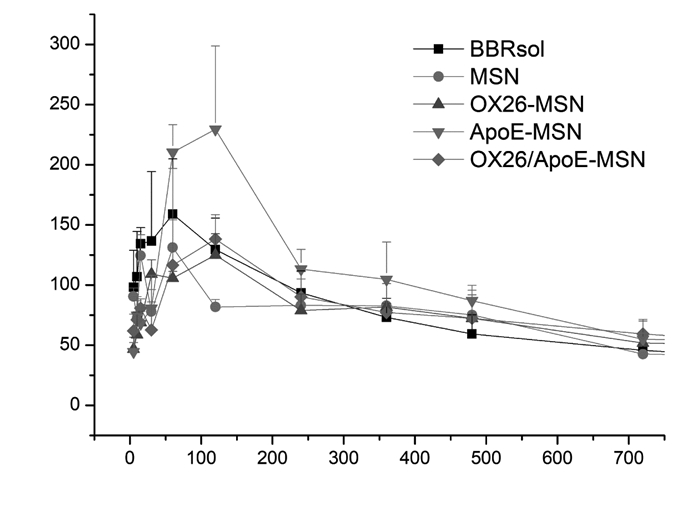
BBR溶液、BBR-MSNs、BBR-MSNs-OX26、BBR-MSNs-ApoE以及BBR-MSNs-OX26/ApoE五组在血浆中及脑匀浆中的药时曲线见图 10和图 11,以及相关药代动力学参数见表 1。由结果可知,静脉注射相同剂量的小檗碱后,5组药物含量均为逐渐下降趋势,BBR-MSNs-OX26、BBR-MSNs-ApoE及BBR-MSNs-OX26/ApoE 3组在血浆中体内清除率较溶液组低,明显延长了药物在体内的滞留时间。在脑匀浆中,BBR-MSNs-OX26、BBR-MSNs-ApoE及BBR-MSNs-OX26/ApoE 3组与溶液组相比,AUC0-t均有统计学差异(P < 0.05),明显提高了BBR在脑内的生物利用度。且BBR-MSNs-OX26、BBR-MSNs-ApoE及BBR-MSNs-OX26/ApoE 3组与溶液组相比,达峰时间和平均滞留时间延长,半衰期延长,体内清除率降低,均具有显著性差异(P < 0.05)。由此可知,所构建的小檗碱脑靶向介孔硅载体能够显著提高小檗碱的脑内生物利用度,且具有一定的脑靶向性。
|
| 图 10 大鼠尾静脉注射后5组制剂的血药浓度-时间曲线(n=3) |
|
| 图 11 大鼠静脉注射后5组制剂的脑匀浆药物浓度-时间曲线(n=3) |
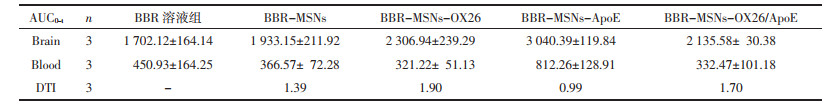
以静脉注射BBR溶液后脑匀浆中的药时曲线下的面积(AUC)为参比,将BBR-MSNs、BBR-MSNs-OX26、BBR-MSNs-ApoE以及BBR-MSNs-OX26/ApoE 4组制剂静脉注射后的AUC与其比较,计算脑靶向指数(DTI)。计算公式如下。计算得制剂组脑靶向指数均大于1,具有一定的靶向性。
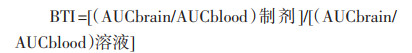
|
本研究前期运用模板剂法制备了非功能化介孔二氧化硅、氨基功能化介孔二氧化硅及羧基功能化介孔二氧化硅,通过一系列表征得出MSNs-COOH粒径较小,易于进入细胞,负电性也可使纳米粒子易在体内被清除而不引起蓄积毒性。通过激光粒度分析仪测得MSNs-COOH平均粒径为(129.8±1.3)nm,而TEM图显示MSNs-COOH粒径小于100 nm,这是由于MSNs大的比表面积使得纳米粒之间存在较大的相互作用力,如范德华力、库仑力等,通过力的相互作用,纳米粒容易团聚进而使测得的粒径比实际偏大[20]。
体外释放采用PBS(pH7.4)和ACSF作为溶出介质是模拟体内血液循环和脑部的生理环境,结果显示,BBR溶液组在2h时就出现了突释现象,累计溶出度达90%以上,而另外3组可能因为偶联抗体后大分子可封堵孔道以及阻碍吸附于载体表面的药物向外扩散,因此出现了一定的缓释作用。此结果证明抗体修饰的载小檗碱介孔二氧化硅制剂在两种介质中具有一定的缓释作用。
药动学研究中,以4 mg/kg的给药剂量通过尾静脉注射BBR溶液组、BBR-MSN、BBR-MSNs-OX26、BBR-MSNs-ApoE和BBR-MSNs-OX26/ApoE 5组制剂后,血浆中药物含量呈逐渐下降趋势,脑组织中药物含量为先上升后下降趋势。血浆中药动学参数显示抗体修饰组在血浆中体内清除率降低,明显延长了体内滞留时间。脑组织匀浆中药动学参数显示,抗体修饰组明显提高了BBR的脑内生物利用度,延长了药物的达峰时间、平均滞留时间和药物的半衰期,降低了药物的脑内清除率,且均具有显著性差异(P < 0.05)。
体外释放结果表明,将BBR包载于介孔二氧化硅中可以达到缓释作用,降低药物进入体内后的突释现象。体内药时曲线和主要药动参数表明,相比较于BBR溶液组,小檗碱脑靶向介孔硅载体到达体内后有一定的缓释作用,明显提高了BBR在体内的生物利用度,其表现出的缓效作用与体外释放动力学考察的结果相吻合。综上所述,OX26/ApoE共修饰的小檗碱脑靶向介孔硅载体能够显著提高小檗碱的脑内生物利用度,且BBR-MSNs、BBR-MSNs-OX26和BBR-MSNs-OX26/ApoE三组载体脑靶向指数均大于1。因此,本实验所构建的小檗碱脑靶向介孔硅载体能提高药物在脑内的生物利用度,实现药物脑部靶向治疗,具有一定的脑靶向性。本研究对难溶性药物靶向递送至脑内病灶而发挥作用具有一定的意义。
| [1] |
ZHANG X H, PENG L, ZHANG J, et al. Berberine ameliorates subarachnoid semorrhage injury via induction of sirtuin 1 and inhibiting HMGB1/Nf-κB pathway[J]. Frontiers in Pharmacology, 2020, 11: 1073. DOI:10.3389/fphar.2020.01073 |
| [2] |
XIAO L, POUDEL A J, HUANG L X, et al. Nanocellulose hyperfine network achieves sustained release of berberine hydrochloride solubilized with β-cyclodextrin for potential anti-infection oral administration[J]. International Journal of Biological Macromolecules, 2020, 153: 633-640. DOI:10.1016/j.ijbiomac.2020.03.030 |
| [3] |
ASEMI Z, BEHNAM M, POURATTAR M A, et al. Therapeutic potential of berberine in the treatment of glioma:insights into its regulatory mechanisms[J]. Cellarand Molecular Neurobiology, 2020, 20: 15-18. |
| [4] |
CHEN MM, LI L, LIU CQ, et al. Berberine attenuates Aβ-induced neuronal damage through regulating miR-188/NOS1 in Alzheimer's disease[J]. Molecular and Cellular Biochemistry, 2020, 474(2): 285-294. |
| [5] |
MENG Z J, YU Y, ZHANG Y N, et al. Highly bioavailable berberine formulation improves glucocorticoid receptor-mediated insulin resistance via reduction in association of the glucocorticoid receptor with phosphatidylinositol-3-kinase[J]. International Journal of Biological Sciences, 2020, 16: 2527-2541. DOI:10.7150/ijbs.39508 |
| [6] |
YANG X J, LIU F, FENG N, et al. Berberine attenuates cholesterol accumulation in macrophage foam cells by suppressing AP-1 activity and activation of the Nrf2/HO-1 pathway[J]. Journal of Cardiovascular Pharmacology, 2020, 75: 45-53. DOI:10.1097/FJC.0000000000000769 |
| [7] |
LIU D Q, CHEN S P, SUN J, et al. Berberine protects against ischemia-reperfusion injury:a review of evidence from animal models and clinical studies[J]. Pharmacological Research, 2019, 148: 104385. DOI:10.1016/j.phrs.2019.104385 |
| [8] |
SALEH S R, ABADY M M, NOFAL M, et al. Berberine nanoencapsulation attenuates hallmarks of scoplomine induced Alzheimer's-like disease in rats[J]. Current Vascular Pharmacology, 2020, 15. |
| [9] |
LEI W, SUN C S, JIANG T Y, et al. Polydopamine-coated mesoporous silica nanoparticles for multi-responsive drug delivery and combined chemo-photothermal therapy[J]. Materials Science & Engineering C-Materials for Biological Application, 2019, 105: 110103. |
| [10] |
LIU Y J, DAI R, WANG Q Y, et al. Dual-Functionalized janus mesoporous silica nanoparticles with active targeting and charge reversal for synergistic tumor-targeting therapy[J]. ACS Applied Materials & Interfaces, 2019, 11: 44582-44592. |
| [11] |
HOANG THI T T, CAO V D, NGUYEN T N Q, et al. Functionalized mesoporous silica nanoparticles and biomedical applications[J]. Materials Science & Engineering C-Materials for Biological Application, 2019, 99: 631-656. |
| [12] |
JOHNSEN K B, BURKHART A, THOMSEN L B, et al. Targeting the transferrin receptor for brain drug delivery[J]. Progress in Neurobiology, 2019, 181: 101665. DOI:10.1016/j.pneurobio.2019.101665 |
| [13] |
KASTIN A J, WADE L A, COY D H, et al. Peptides and the blood-brain barrier[J]. Peptides, 2015, 32(83): 2611-2623. |
| [14] |
KREUTER J. Mechanism of polymeric nanoparticle-based drug transport across the blood-brain barrier(BBB)[J]. Journal of Microencapsulation, 2013, 30(1): 49-54. DOI:10.3109/02652048.2012.692491 |
| [15] |
HAQQANI A S, THOM G, BURRELL M, et al. Intracellular sorting and transcytosis of the rat transferrin receptor antibody OX26 across the blood-brain barrier in vitro is dependent on its binding affinity[J]. Journal of Neurochemistry, 2018, 146: 735-752. DOI:10.1111/jnc.14482 |
| [16] |
GRAFALS-RUIZ N, RIOS-VICIL C I, LOZADA-DELGADO E L, et al. Brain targeted gold liposomes improve RNAi delivery for glioblastoma[J]. International Journal of Nanome-dicine, 2020, 15: 2809-2828. DOI:10.2147/IJN.S241055 |
| [17] |
XIE M, XU Y G, SHEN H J, et al. Negative-charge-functionalized mesoporous silica nanoparticles as drug vehicles targeting hepatocellular carcinoma[J]. International Journal of?Nanomedicine, 2014, 474: 223-31. |
| [18] |
王洁, 李倩, 吴静华, 等. CD133抗体修饰的紫草素微乳的制备及抗三阴性乳腺癌研究[J]. 中草药, 2019, 50(7): 1587-1595. WANG J, LI Q, WU J H, et al. Treatment of triple-negative breast cancer with anti CD133 antibody-modified shikonin-loaded microemulsion[J]. Chinese Traditional and Herbal Drugs, 2019, 50(7): 1587-1595. |
| [19] |
郭曼曼, 王国伟, 徐骏军, 等. 载三氧化二砷pH值响应介孔二氧化硅纳米粒的制备及体内外评价[J]. 中草药, 2020, 51(7): 982-989. SHENG X D, LIU Z, LUO Y X, et al. Preparation of elemene-loaded mesoporous silica nanoparticles and its targeted anti-tumor activity[J]. Chinese Traditional and Herbal Drugs, 2020, 51(10): 2745-2754. DOI:10.7501/j.issn.0253-2670.2020.10.016 |
| [20] |
盛晓丹, 刘臻, 罗砚曦, 等. 聚多巴胺修饰的载榄香烯介孔二氧化硅纳米粒的制备及其靶向抗肿瘤活性研究[J]. 中草药, 2020, 51(10): 2745-2754. SHENG X D, LIU Z, LUO Y X, et al. Preparation of elemene-loaded mesoporous silica nanoparticles and its targeted anti-tmor activity[J]. Chinese Traditional and Herbal Drugs, 2020, 51(10): 2745-2754. DOI:10.7501/j.issn.0253-2670.2020.10.016 |
 2020, Vol. 39
2020, Vol. 39