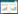文章信息
- 张玉婷, 侯秀娟, 刘小平, 朱跃兰
- ZHANG Yuting, HOU Xiujuan, LIU Xiaoping, ZHU Yuelan
- 芍甘附子汤加味对CIA大鼠关节滑膜病理及血清IL-2、IL-17A与TNF-α表达水平的影响
- Effect of modified Shaogan Fuzi Decoction on the pathology of joint synovium and expression level of serum IL-2, IL-17A and TNF-α in rats with collagen induced arthritis
- 天津中医药大学学报, 2021, 40(1): 93-97
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(1): 93-97
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.01.19
-
文章历史
收稿日期: 2020-09-18
2. 北京中医药大学东方医院风湿科, 北京 100078
2. Department of Rheumatology, Dongfang Hospital, Beijing University of Chinese Medicine, Beijing 100078, China
类风湿关节炎(RA)是一种常见的慢性、全身性自身免疫性疾病,以对称性、多关节炎为主要特点。RA病程长且常常反复发作,具有发病率高和致残率高的特点,严重危害患者的身心健康,影响患者的生活质量。RA的发病机制复杂,病因尚未完全阐明,多种促炎因子如肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-17、IL-6、IL-1、IL-21及IL-22等在RA的发病过程中起重要作用[1]。辅助性T细胞17(Th17)以及IL-17在RA发病中的重要作用越来越受重视[2-4]。其中,IL-17A通过相关信号转导通路,可从多个方面加重RA关节处炎症程度和关节损害[5]。此外,临床上针对TNF-α、IL-1及IL-6的靶向药物应用较广泛,此类生物制剂具有起效快、抑制骨破坏明显等特点。本病属于中医“痹证”范畴,中医药干预RA具有不良反应小、依从性好等特点。本实验通过建立胶原诱导性关节炎(CIA)模型,探讨芍甘附子汤加味对CIA大鼠模型关节病理改变及血清炎性细胞因子IL-2、IL-17A及TNF-α的干预作用。
1 材料与方法 1.1 材料SPF级雌性Wistar大鼠24只,体质量(200±20)g,由北京维通利华实验动物技术公司提供,动物许可证号:SCXK(京)2012-0001,适应性喂养1周。
牛Ⅱ型胶原(CⅡ,批号:20022)购自美国Chondrex公司;不完全弗氏佐剂(IFA,批号:7002)购自美国Sigma公司;IL-2酶联免疫吸附(ELISA)检测试剂盒、IL-17A ELISA检测试剂盒及TNF-α ELISA检测试剂盒均购自北京欧北生物科技有限公司;切片机(德国Leica);摊片机(德国Leica);包埋机(德国Leica);自动脱水机(德国Leica);倒置显微镜(Olymp)。
芍甘附子汤加味,方药组成:制附子15 g,白芍15 g,甘草10 g,鸡血藤15 g,青风藤15 g(以上药物由北京中医药大学东方医院药剂科统一采购,实验过程中保证所用药品为同一批次,并由北京中医药大学中药学院中药鉴定教研室鉴定质量控制),用前全部药材经煎煮(制附子先煎30 min)并过滤,水浴蒸发至其治疗剂量每1 mL药液含生药材1.42 g。雷公藤多苷片:10 mg×100片/盒,购自湖南千金协力药业有限公司,批准文号:Z43020138,用前蒸馏水配制为1 mg/mL。
1.2 造模及分组将24只大鼠随机分出6只作为正常组,其余18只均建立CIA模型,造模成功后再随机分为模型组、雷公藤组、芍甘附子汤组,每组6只大鼠。造模方法:CⅡ溶于乙酸,与等体积IFA溶液混合,制备CⅡ终浓度2 mg/mL混合液,于大鼠左足底皮下按0.1 mL/足注射,尾根部多点注射0.1 mL/只,防止局部坏死。初次免疫后第8天尾根部注射抗原(0.1 mL/只)加强免疫1次。正常组大鼠左足皮下注射等体积的0.9%氯化钠溶液。
1.3 干预方法正常组:常规饲养,自由饮水,不做任何处理;模型组:蒸馏水2 mL/(kg·d)灌胃;雷公藤组:雷公藤多苷片6.25 mg/(kg·d)灌胃;芍甘附子汤组:芍甘附子汤加味12.5 g/(kg·d)灌胃(依据人与动物体表面积换算的等效剂量)。各给药组均在造模成功后开始灌胃给药。
1.4 苏木精-伊红(HE)染色灌胃结束后处死大鼠,取后右足踝关节去除皮肤和肌肉,10%中性甲醛溶液固定24 h,12.5%乙二胺四乙酸二钠(EDTA-2Na)室温中脱钙,2 d换1次脱钙液,30 d关节基本软化后切片,HE染色,干燥并封片,显微镜下观察脱钙后关节滑膜组织病理变化。
1.5 标本采集及检测灌胃结束后,大鼠麻醉并腹主动脉取血,先以普通采血管取2 mL,室温静置1 h后,以3 000 r/min离心15 min,离心半径为60 mm,分离血清,分装于1.5 mL离心管中。ELISA法检测大鼠血清IL-2、IL-17A及TNF-α水平,具体操作严格按照试剂盒说明书进行。
1.6 统计学方法数据用SPSS 23.0统计软件进行分析,计量资料用均数±标准差(x±s)表示,多组比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05为差异有统计学意义。
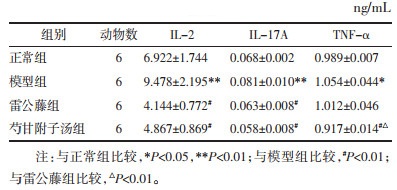
2 结果及分析 2.1 HE染色正常组踝关节组织结构正常,关节软骨表面光滑,未见滑膜组织增生及炎性细胞浸润。模型组关节腔明显狭窄,滑膜组织重度增生,局部坏死脱落,血管翳形成,关节软骨破坏明显。雷公藤组关节腔局部略狭窄,关节面大部分光滑,局部软骨脱落,滑膜组织轻微增生。芍甘附子汤组关节腔未见明显狭窄,关节软骨表面光滑,局部滑膜组织轻微增生。见图 1。

|
| 图 1 踝关节整体观(×100) |
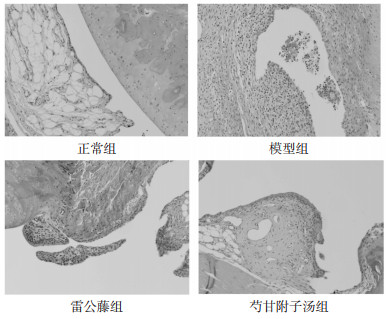
正常组滑膜细胞1~2层,未见滑膜细胞增生及炎细胞浸润。模型组滑膜组织明显增厚,局部坏死脱落,大量滑膜细胞增生及炎性细胞浸润。雷公藤组可见局部滑膜组织胶原纤维增生,未见明显炎性细胞浸润,关节面局部血管翳侵入。芍甘附子汤组可见局部滑膜组织增生,未见明显炎性细胞浸润。见图 2。
|
| 图 2 踝关节滑膜组织(×200) |
与正常组比较,模型组IL-2水平增高(P<0.01),与模型组比较,雷公藤组及芍甘附子汤组IL-2水平下降(P<0.01),芍甘附子汤组与雷公藤组比较差异无统计学意义(P>0.05)。模型组IL-17A水平较正常组增加(P<0.01),与模型组比较,雷公藤组及芍甘附子汤组IL-17A水平下降(P<0.01),芍甘附子汤组与雷公藤组比较差异无统计学意义(P>0.05)。与正常组比较,模型组TNF-α水平增高(P<0.05),与模型组比较,雷公藤组TNF-α水平有下降趋势,但差异无统计学意义(P>0.05),芍甘附子汤组含量下降(P<0.01),芍甘附子汤组与雷公藤组比较差异有统计学意义(P<0.01)。见表 1。
RA属于自身免疫性疾病,其病理表现为关节滑膜的慢性炎症、血管翳形成,并出现关节的软骨和骨破坏,最终可导致关节畸形和功能丧失。RA的发病机制尚不完全清楚,实验动物模型仍是RA疾病研究的重要载体[6]。CIA模型在临床症状、病理学改变、免疫反应等方面都与人类RA特征高度相似,故CIA模型仍是目前公认的最佳RA动物模型[7],被广泛用于研究疾病发病机制和验证治疗靶点[8]。
多种细胞因子均与RA发病密切相关[9],其中,TNF-α在活动性RA中参与多种致病机制,导致滑膜组织的炎症增生、骨和软骨的破坏、自身免疫反应和RA并发症等病理生理过程[10]。Hassan等[11]研究发现RA患者的滑液中存在高浓度的TNF-α,且与骨侵蚀有关。IL-17A是IL-17家族重要成员之一,近年来多项研究发现它在RA的发病与进展中发挥作用[12-13]。IL-2由辅助性T细胞1(Th1)分泌,是激活T细胞、维持T细胞分化和增殖的重要细胞因子,可加重炎症反应。有研究发现RA患者血清IL-2水平明显高于对照组,且血清IL-2水平与血浆红细胞沉降率(ESR)、C反应蛋白(CRP)水平及28处关节疾病活动度(DAS28)评分呈正相关,与RA疾病活动度密切相关[14]。本研究发现,模型组中TNF-α水平升高明显且HE染色中关节软骨破坏明显,血管翳形成,进一步证实了TNF-α参与RA滑膜炎症形成及对关节软骨侵蚀的过程,而芍甘附子汤组中TNF-α水平显著下降,且与雷公藤组相比具有统计学差异(P<0.01),HE染色结果可见雷公藤组关节腔局部略狭窄,局部关节软骨脱落,而芍甘附子汤组关节腔未见明显狭窄,关节软骨表面平滑,未见关节软骨脱落。由此可见,芍甘附子汤加味在降低TNF-α水平和抑制关节软骨破坏方面优于雷公藤组。在RA的发生和发展过程中T淋巴细胞起着关键的作用。CD4+/CD8+比值的变化是RA发病及免疫损伤的核心环节,模型组IL-2、IL-17A水平与正常组相比均明显升高(P<0.01),与RA的活动呈正相关,提示炎性因子表达升高导致T细胞亚群CD4+/CD8+之间相互抑制的平衡被打破,致使大鼠的细胞免疫功能降低,关节滑膜中淋巴细胞浸润而发病。本研究发现,芍甘附子汤组可降低IL-2、IL-17A及TNF-α水平,提示芍甘附子汤加味可有效改善关节及滑膜炎症,并对抑制CIA大鼠关节软骨破坏有一定的作用。
芍甘附子汤加味是在张仲景《伤寒论》芍甘附子汤的基础上加入鸡血藤、青风藤,常常用于痹证的治疗。本课题组前期临床研究结果显示,芍甘附子汤加味可改善RA患者关节肿痛、晨僵等症状,与西药联用,可降低血沉水平。现代药理学亦证实,本方中单个药物具有调节免疫、抑制炎症及抑制滑膜细胞增殖等作用[15-16]。方中附子辛、热,归心、肾、脾经,可补火助阳,通脉散寒止痛;白芍酸苦微寒,归肝、脾经,擅养血敛阴,柔肝止痛,为治疗四肢拘挛作痛的常用药之一;甘草,《注解伤寒论》认为其“益虚补血气而复脉”,味甘性平,归心、肺、脾、胃经,可补中坚筋骨,缓急止痛;附子、甘草相配辛甘化阳,白芍、甘草相伍酸甘化阴,在此基础上加用鸡血藤、青风藤以行血补血、舒筋活络、祛风湿,与附子配伍以达温阳通络之效。5药相合,邪正兼顾,标本同治,共奏扶助正气、调和阴阳、除湿散寒、化瘀通络之功。雷公藤多苷片为治疗RA的二线常用药物之一,其治疗RA疗效显著。研究表明,雷公藤多苷片治疗RA发挥抗炎作用与降低血中前列腺素E2(PGE2)、TNF-α和IL-2等因子的产生和释放有关[17]。本实验所使用的中药方剂为复方,各药物之间通过君臣佐使配伍发挥协同作用,可作用于多个靶点发挥抑制滑膜炎症和保护关节软骨的作用。本研究选择雷公藤多苷片作为阳性对照药,初步探究其与本方药在治疗RA效果的差异,芍甘附子汤组中TNF-α水平显著下降,且与雷公藤组相比差异具有统计学意义(P<0.01),提示芍甘附子汤加味在降低TNF-α水平方面优于雷公藤组。
综上所述,芍甘附子汤加味可改善CIA大鼠关节滑膜炎症,保护关节软骨,降低血清IL-2、IL-17A及TNF-α表达水平,本研究结果为芍甘附子汤加味干预RA提供一定的实验依据。同时,本研究亦存在一定不足,如芍甘附子汤组和雷公藤组相比,IL-2和IL-17A水平差异无统计学意义,将增加芍甘附子汤高、中、低剂量组,进一步分析两组之间的差异及降低炎性细胞水平与剂量依赖的相关性,并开展细胞实验研究,进一步丰富本方药治疗RA的生物学依据。
| [1] |
丁立珉, 孙万邦. 细胞因子在类风湿关节炎发病机制中作用的研究进展[J]. 中国当代医药, 2012, 19(7): 12-14. DENG L M, SUN W B. The progress of study about cytokines on the rheumatoid arthritis nosogenesis[J]. China Modern Medicine, 2012, 19(7): 12-14. |
| [2] |
郭江燕, 高梓珊, 姜姝姝, 等. IL-17和NF-κB通路与类风湿性关节炎的相关性研究[J]. 长春中医药大学学报, 2015, 31(1): 192-194. GUO J Y, GAO Z S, JIANG S S, et al. Study progress of IL-17 and NF-kappa B pathway in RA[J]. Journal of Changchun University of Chinese Medicine, 2015, 31(1): 192-194. |
| [3] |
王秋燚, 张小玲, 宁乔怡, 等. 白细胞介素-17在类风湿关节炎发病机制中的作用进展[J]. 风湿病与关节炎, 2017, 6(5): 68-72. WANG Q Y, ZHANG X L, NING Q Y, et al. Progress in the role of interleukin-17 in the pathogenesis of rheumatoid arthritis[J]. Rheumatism and Arthritis, 2017, 6(5): 68-72. |
| [4] |
李鑫, 蔡雄, 刘良. Th17细胞在类风湿关节炎发病机制中的作用研究进展[J]. 中国药理学通报, 2020, 36(3): 309-312. LI X, CAI X, LIU L. Research advances of roles of Th17 cells in pathogenesis of rheumatoid arthritis[J]. Chinese Pharmacological Bulletin, 2020, 36(3): 309-312. |
| [5] |
王静静, 宋昕阳, 钱友存. 白介素-17A与白介素-17C在炎症性疾病中的研究进展[J]. 中国免疫学杂志, 2015, 31(11): 1441-1446, 1452. WANG J J, SONG X Y, QIAN Y C. Research progress of interleukin-17A and interleukin-17C in inflammatory diseases[J]. Chinese Journal of Immunology, 2015, 31(11): 1441-1446, 1452. |
| [6] |
蔡文虹, 孙保东, 张宝凤, 等. 类风湿性关节炎动物模型研究进展[J]. 中国当代医药, 2012, 19(4): 10-12, 16. CAI W H, SUN B D, ZHANG B F, et al. Adances in research on animal models ofrheumatoid arthritis[J]. China Modern Medicine, 2012, 19(4): 10-12, 16. |
| [7] |
任妮娜, 凌益, 姚血明, 等. 类风湿关节炎动物模型研究进展[J]. 风湿病与关节炎, 2019, 8(10): 62-67. REN N N, LING Y, YAO X M, et al. Advances in animal models of rheumatoid arthritis[J]. Rheumatism and Arthritis, 2019, 8(10): 62-67. |
| [8] |
刘杨, 段学清, 严福林, 等. 异绿原酸A抑制NLRP3炎性复合体/NF-κB活化减轻胶原诱导型关节炎大鼠炎症反应[J]. 中国药理学通报, 2019, 35(10): 1415-1419. LIU Y, DUAN X Q, YAN F L, et al. Isochlorogenic acid A inhibits activation of NLRP3/NF-κB in rats with collagen-induced arthritis[J]. Chinese Pharmacological Bulletin, 2019, 35(10): 1415-1419. |
| [9] |
BRZUSTEWICZ E, BRYI E. The role of cytokines in the pathogenesis of rheumatoid arthritis-practical and potential application of cytokines as biomarkers and targets of personalized therapy[J]. Cytokine, 2015, 76(2): 527-536. DOI:10.1016/j.cyto.2015.08.260 |
| [10] |
BRENNAN F M, MCIUNES I B. Evidence that cytokines play a role in rheumatoid arthritis[J]. The Journal of Clinical Investigation, 2008, 118(11): 3537-3545. DOI:10.1172/JCI36389 |
| [11] |
HASSAN S Z, GHEITA T A, KENAWY S A, et al. Oxidative stress in systemic lupus erythematosus and rheumatoid arthritis patients: relationship to disease manifestations and activity[J]. International Journal of Rheumatic Diseases, 2011, 144(4): 325-331. |
| [12] |
KIM J, KANG S, KIM J, et al. Elevated levels of T helper 17 cells are associated with disease activity in patients with rheumatoid arthritis[J]. Annals of Laboratory Medicine, 2013, 33(1): 52-59. DOI:10.3343/alm.2013.33.1.52 |
| [13] |
LO G, ZHANG Y, QIAN Y, et al. Interleukin-17A promotes rheumatoid arthritis synoviocytes migration and invasion under hypoxia by increasing MMP2 and MMP9 expression through NF-κB/HIF-1α pathway[J]. Molecular Immunology, 2013, 53(3): 227-236. DOI:10.1016/j.molimm.2012.08.018 |
| [14] |
孟岩, 李鸣远, 张新玉, 等. 类风湿关节炎患者血清TNF-α、IL-2及IL-13变化的价值研究[J]. 海南医学院学报, 2018, 24(2): 188-190, 194. MENG Y, LI M Y, ZHANG X Y, et al. Study on the value of changes in serum TNF-alpha, IL-2 and IL-13 in patients with rheumatoid arthritis[J]. Journal of Hainan Medical University, 2018, 24(2): 188-190, 194. |
| [15] |
李晋奇, 彭成, 姬洁莹, 等. 制川乌总碱与白芍总苷、白芍多糖配伍治疗类风湿性关节炎大鼠的作用机制研究[J]. 中国中药杂志, 2009, 34(22): 2937-2946. LI J Q, PENG C, JI J Y, et al. Mechanism study of action on compatible using of total alkaloids of Radix Aconiti Praeparata and total glycosides or polysaccharides of Radix Paeoniae Alba therapy on rheumatoid arthritis in rats[J]. China Journal of Chinese Materia Medica, 2009, 34(22): 2937-2946. |
| [16] |
吴华勋, 陈镜宇, 汪庆童, 等. 白芍总苷对胶原性关节炎大鼠滑膜β抑制蛋白的影响与其抑制滑膜细胞增殖的关系[J]. 中国药理学通报, 2012, 28(7): 934-937. WU H X, CHEN J Y, WANG Q T, et al. Relationship between the effects of totalglucosides of paeony on expression of β-arrestins and inhibition on synoviocyte proliferation from CIA rats[J]. Chinese Pharmacological Bulletin, 2012, 28(7): 934-937. |
| [17] |
冯群, 孙蓉. 雷公藤多苷片抗炎作用及伴随肝毒性研究[J]. 中药新药与临床药理, 2014, 25(6): 713-716. FENG Q, SUN R. Study on hepatotoxicity accompanied with anti-inflammation effect of tripterygium wilfordii glycosides[J]. Traditional Chinese Drug Research and Clinical Pharmacology, 2014, 25(6): 713-716. |
 2021, Vol. 40
2021, Vol. 40