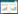文章信息
- 霍金海, 刘亚娟, 任晓蕾, 孙国东, 刘政, 孙建峰, 王伟明
- HUO Jinhai, LIU Yajuan, REN Xiaolei, SUN Guodong, LIU Zheng, SUN Jianfeng, WANG Weiming
- 基于UPLC-Q-TOF-MS/MS的防风质量差异标志物初步研究
- Study on Q-marker of Radix Saposhnikoviae based on UPLC-Q-TOF-MS/MS
- 天津中医药大学学报, 2021, 40(1): 112-118
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(1): 112-118
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.01.22
-
文章历史
收稿日期: 2020-09-28
防风为伞形科植物防风[Saposhnikovia divaricata(Turcz.)Schischk.]未抽花茎植株的干燥根,是中国常用的大宗药材之一。李时珍《本草纲目》记载:“防者防御也,因其功疗风最要,故名防风。”防风被历版《中华人民共和国药典》(简称《中国药典》)收载,具有祛风除湿解表、止痉止痛之功效[1]。主产于黑龙江省以及内蒙古自治区的关防风,属于防风中的上品。其中以黑龙江省杜尔伯特草原地区出产的小蒿子防风质量最优,驰名中外[2]。近年来,关防风的过度开发造成了野生数量丰度的锐减,以致关防风价格是栽培防风的5~6倍。《中国药典》以升麻苷的薄层和含量测定以及5-O-甲基维斯阿米醇苷含量测定为评价指标,无法准确衡量药材的质量优劣,难以实现优质优价。
近年来,刘昌孝院士等[3]基于现有质量评价与控制方法及存在问题,提出中药质量标志物(Q-marker)的概念。Q-marker是指中药材和中药产品(如中药饮片、提取物及中成药制剂等)中能够体现药理活性的化学物质,为其固有化学成分或加工制备过程中形成的物质,可以作为反映中药安全性和有效性的标志性物质进行质量控制,也可作为定性定量分析的指标性成分[4-8]。
中药材道地性评价的核心是确定Q-marker,笔者认为中药材复杂成分的快速分析和表征是确定Q-marker的前提。近年来,通过对高灵敏度的质谱(MS)和高效分离能力超高效液相色谱(UPLC)结合,加速了Q-marker的发现与鉴定。课题组前期采用超高效液相色谱-飞行时间质谱联用技术(UPLC-Q-TOF-MS/MS)分析了防风95种化学成分,并找出了47个入血成分,对色原酮类裂解规律进行了重点研究[9],并检索了其生物活性。良好的体内吸收和生物活性是中药小分子有效成分发挥药效的关键,然而在不同产地的含量差异性才是决定一个化合物能否成为质量差异标志物的关键。因此,本研究通过对不同产地防风药材应用主成分分析(PCA分析),找出差异性化学成分,初步明确防风的质量差异标志物,以期为防风质量鉴别及评价标准的建立提供新思路。
1 仪器与材料 1.1 仪器UPLC色谱仪、5600+型高分辨质谱仪(AB SCIEX,美国),数据采集软件:Analyst TF 1.6 software,数据处理软件系统:Markerview1.2.1、Peakview 2.0、masterview1.0(AB SCIEX,美国),Waters UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm)、UPLC BEH C18 VanGuard Pre-Column预柱(2.1 mm×5 mm,1.7 μm)(Waters,美国),KQ-300DB型超声提取仪(昆山超声仪器),BSA224S-CW型精密天平(德国赛多利斯),LG16-W型离心机(北京京立)。
1.2 试剂甲酸(Fisher,美国)、甲醇(科密欧,中国天津)、乙腈(Merck,德国),均为色谱纯,蒸馏水(屈臣氏,中国广州)。
1.3 药材与对照品防风药材于2016年10月取自黑龙江省、内蒙古自治区道地产区以及全国其他产地,每产地取3份样品,每份样本10株,详见表 1。防风药材均经黑龙江省中医药科学院王伟明研究员鉴定为伞形科植物防风Saposhnikovia divaricata(Turcz.)Schischk.的干燥根,置于通风处阴干,粉碎(过3号筛)备用。
5-O-甲基维斯阿米醇苷(批号:J-002-150420,成都瑞芬思生物科技有限公司)、补骨脂素(批号:110739-200511,中国药品生物制品检验检定所),纯度均在98%以上。
2 方法 2.1 对照品溶液的制备精密称取补骨脂素、5-O-甲基维斯阿米醇苷对照品各约1.25 mg置于25 mL容量瓶中,加甲醇定容制成对照品溶液。
2.2 供试品溶液的制备精密称定不同产地防风药材粉末1.0 g于50 mL锥形瓶中,精密加入25 mL甲醇并称质量,水浴回流1 h,放冷、补重后摇匀,取续滤液13 000 r/min离心5 min,离心半径为5 cm,取上清液,即得。
2.3 色谱条件Waters BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),预柱(2.1 mm×5 mm,1.7 μm),柱温30 ℃,流动相A为0.1%甲酸水,B为0.1%甲酸-乙腈,梯度洗脱(0~10 min,95%~50%A;10~13 min,50%~30%A;13~15 min,30%A;15~20 min,30%~0%A;20~20.1 min,0%~95%A;20.1~25 min,95%~A),流速0. 3 mL/min,进样量3 μL。
2.4 质谱条件采用电喷雾(ESI)正离子模式,离子源温为550 ℃,碰撞电压500 V,裂解电压(DP)为80 V,碰撞能量(CE)、碰撞能量扩展(CES)分别为35 eV、15 eV。氮气为雾化气体,辅助气Gas1、Gas2均为55 PSI,气帘气Cur Gas为35 PSI。一级质谱母离子扫描范围为80~1 500 Da,相关信息扫描(IDA)设置响应值超过100 cps的8个最高峰进行二级质谱扫描,子离子扫描范围为50~1 500 Da,设置动态背景扣除(DBS)扣除背景。
2.5 数据分析1)供试品溶液进样,采集液质图。2)通过质谱处理工作站(Markerview)进行PCA分析得到得分矩阵图(Scores)和载荷矩阵图(Loadings)。通过对Scores的获取得到产地差异数据的分型信息,而Loadings可以显示该离子在各产地样品内的提取离子(XIC)峰面积变化。3)通过鉴定差异的化合物,依据精确质量数与同位素峰度比对分子式进行确定,结合现有的文献报道,通过对照品与数据库的二级谱图比对以及裂解规律的分析,最终确定结构式。4)结合前期防风体内物质基础研究及活性文献报道,确定候选质量差异标志物。5)分析候选质量差异标志物在防风道地产区和非道地产区的含量变化规律,初步确定质量差异标志物。
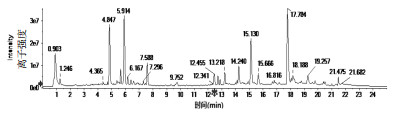
3 结果 3.1 UPLC-Q-TOF-MS/MS分析正离子模式下,按照“2.3”及“2.4”项条件进行分析,得到了良好的分离效果图及较强的离子强度峰,得到其总离子流图(TIC图)见图 1。
|
| 图 1 防风供试品正离子TIC图 |
PCA结果见图 2。由图 2A可知,黑龙江省产地的样品聚类良好,内蒙古自治区产地的样本较为分散,可能与其地理位置跨度较大有关,两者有一定的交集,该结果与关防风道地药材主产于黑龙江省东北部及内蒙古自治区,以黑龙江杜尔伯特西部草原及呼盟草原为核心产区的分布相符合。与非道地产区河北省、安徽省样本存在较大差异,与山西省产地样品有一定的差异,说明药材的道地性与其次生代谢产物之间存在一定联系。
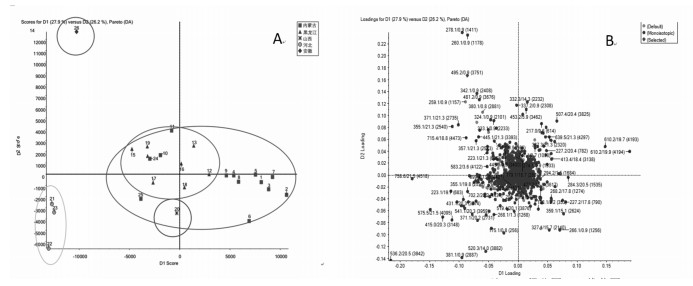
|
| 注:A.得分图;B.载荷图。 图 2 不同产地防风药材PCA图 |
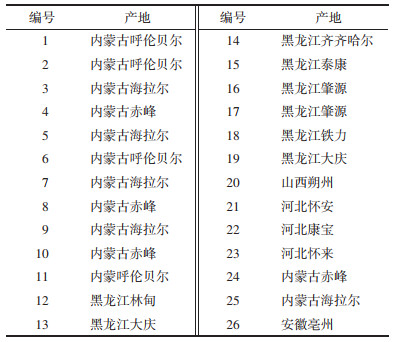
通过PCA模式识别分析,选择道地产区与非道地产区有显著性差异(P < 0.05)且离子强度差异倍数Fold Change > 1.5倍的离子,结合前期防风体内物质基础以及生物活性文献报道两个方面的信息初步确定防风10个候选质量差异标志物,分别为5-O-甲基维斯阿米醇苷、升麻素、5-O-甲基维斯阿米醇、Ledebouriellol、亥茅酚、3-O-乙酰亥茅酚、3-O-当归乙酰亥茅酚、花椒毒素、补骨脂素、紫花前胡苷元,结果见表 2,典型化合物质谱裂解规律总结如下。
呋喃色原酮是以二氢呋喃环连接的色原酮母核构成,以下为呋喃色原酮类化合物5-O-甲基维斯阿米醇苷的裂解分析。保留时间(tR)为5.91 min,准分子离子峰在正离子模式下为m/z=453[M+H]+,能够脱去1分子葡萄糖产生m/z=291[M+H-C6H10O5]+碎片离子,此碎片为色原酮母核结构,极为稳定,但在高能碰撞下进一步脱去1分子氧化氢(H2O)产生碎片离子m/z=273[M+H-C6H10O5-H2O]+,此碎片离子脱去六元环上的羰基产生m/z=245[M+H-C6H10O5-H2O-CO]+碎片离子,m/z=291[M+H-C6H10O5]+碎片离子也可以失去五元环上的丙酮醇基团,产生m/z=231[M+H-C6H10O5-C3H8O]+碎片离子,在继续失去六元环上的羰基产生m/z=203[M+H-C6H10O5-C3H8O-CO]+碎片离子,通过对元素组成分析以及相关文献报道[10],推测分子式为C22H28O10,其相对分子质量理论值为453.175 17,实测值为453.175 5,通过与其对照品的二级谱图比对,结果见图 3,可以证实这一化合物,推断其裂解途径见图 4。
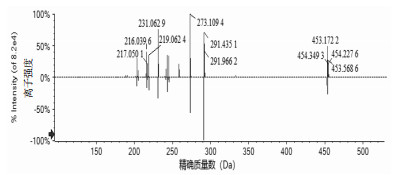
|
| 注:A.对照品;B.样品。 图 3 5-O-甲基维斯阿米醇苷的MS/MS图 |
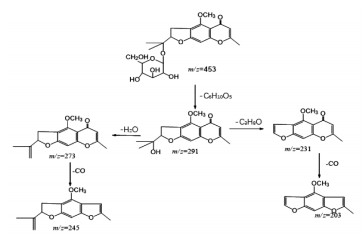
|
| 图 4 5-O-甲基维斯阿米醇苷的裂解推断 |
苯环上的7位羟基与6位或者8位形成呋喃环的香豆素称之为呋喃香豆素类,以下为呋喃香豆素类化合物补骨脂素裂解分析。tR为8.5 min,正离子模式下的准分子离子峰为m/z=187[M+H]+,脱去呋喃环上的1分子一氧化碳(CO)产生m/z=159[M+H-CO]+碎片离子,此碎片离子连续失去两分子CO产生m/z=131[M+H-2CO]+及m/z=103[M+H-3CO]+两个碎片,同时准分子离子也可脱去六元环上的1分子二氧化碳(CO2)产生碎片离子m/z=143[M+H-CO2]+,继续脱去呋喃环上的1分子CO产生m/z=115[M+H-CO2-CO]+碎片离子。通过对元素的组成分析并查阅相关文献报道[11],推测其分子式为C11H6O3,其相对分子质量理论值为187.038 05,实测值为187.038 9,通过与补骨脂素的二级谱图进行比对,结果见图 5,推测化合物为补骨脂素,裂解途径见图 6。
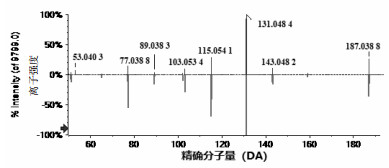
|
| 图 5 补骨脂素的MS/MS图 |
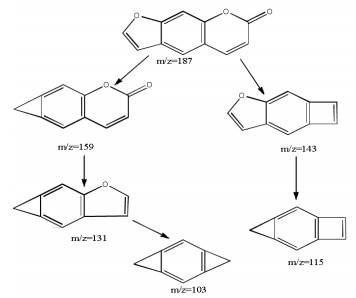
|
| 图 6 补骨脂素的裂解推断 |
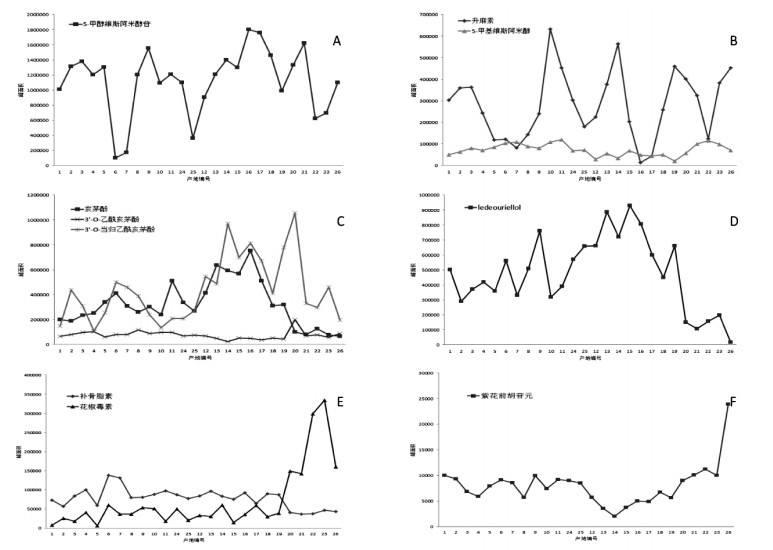
以10个候选质量差异标志物在不同产地的相对含量(峰面积)结果见图 7,其中1-11、24、25号产地内蒙古自治区,12-19号产地黑龙江省,20号产地山西省,21-23号产地河北省,26号产地安徽省。
|
| 图 7 不同产区防风候选质量差异标志物峰面积变化趋势图 |
2015版《中国药典》以5-O-甲基维斯阿米醇苷与升麻素是作为鉴别防风的指标性成分,是其主要的色原酮类化合物[12]。研究表明5-O-甲基维斯阿米醇苷并无明显的药理作用[13],但其水解产物苷元5-O-甲基维斯阿米醇和升麻素具有良好的解热、镇痛、抗炎活性[14]。从图 7A、7B可见,5-O-甲基维斯阿米醇苷及其水解产物5-O-甲基维斯阿米醇、升麻素相对含量较高,在26个产地样本中相对含量(峰面积)差异较大,在PCA分析中所占权重较大,使其成为差异标志物,但黑龙江省及内蒙古自治区所产关防风含量自身跨度较大,不能很好与其他产地防风相区分,难以成为质量差异标志物,这正是《中国药典》仅测定两个指标的局限性。
3.3.2 亥茅酚、3’-O-乙酰亥茅酚、3’-O-当归乙酰亥茅酚亥茅酚是色原酮类化合物的重要组分之一,是亥茅酚苷在体内水解后的主要化合物,促进亥茅酚苷在体内的吸收从而发挥药效[14],由图 7C可见,亥茅酚在内蒙古自治区及黑龙江省所产的关防风中含量明显高于安徽省、河北省、山西省等产地,可作为质量差异标志物来鉴别防风。而3’-O-乙酰亥茅酚、3’-O-当归乙酰亥茅酚在道地产区与非道地产区含量差异无明显规律性,不能作为质量差异标志物。
3.3.3 LedeouriellolLedeouriellol是防风的色原酮类化合物之一,它既是防风的原型成分,又可以经过体内酶的作用吸收入血,成为起到治疗作用的活性物质[14]。由图 7D可见,在内蒙古自治区及黑龙江省所产关防风中含量显著高于安徽省、河北省、山西省产地,所以Ledeouriellol也是表征关防风质量的标志物之一。
3.3.4 补骨脂素、花椒毒素、紫花前胡苷元香豆素是防风中重要的化合物,药理活性十分广泛[15-16]。由图 7E可知,补骨脂素在内蒙古自治区及黑龙江省所产关防风中含量显著高于安徽省、河北省、山西省产地,可作为标志物。而花椒毒素含量则低于以上3个地区,可能与环境导致其次生代谢途径差异密切相关,虽然含量显著降低,仍可清晰区分关防风,也可作为质量差异标志物。由图 7F可知,通过对道地产区与非道地产区的紫花前胡苷元含量对比发现差异无明显规律性,不能作为质量差异标志物。
4 讨论本研究广泛收集了来自26个产地的共计78批防风样本,代表性较强。不同产地防风中5-O-甲基维斯阿米醇苷、升麻素、5-O-甲基维斯阿米醇、亥茅酚苷、3’-O-乙酰亥茅酚、3’-O-当归乙酰亥茅酚、紫花前胡苷元含量差异较大,而Ledeouriellol、亥茅酚、补骨脂素、花椒毒素也可以在一定程度上表征关防风与其他产地防风的差异,可以作为质量差异标志物来鉴定关防风,未来需获得更多的道地产区及非道地产区防风样本,更大范围验证初步确定的质量差异标志物的适用性。此外,由于对照品和检测技术的限制,课题组后续仅对补骨脂素、花椒毒素含量限度进行了初步研究,未来仍需对其他质量差异标志物进行分离、鉴定及含量测定,更加全面地评价防风道地药材的质量。
中药道地品质差异的化学实质即是指药用植(动)物代谢产物的差异,然而药材次生代谢途径是一个十分复杂的网络,在缺乏对其代谢途径整体研究的背景下,笔者认为可通过大样本代谢谱测定与分析,确定一些质量差异标志物的固定比例关系或比例范围,能够更好地区分道地药材与非道地药材。进一步寻找生物合成途径中的关键结构基因,揭示基因表达量与药效成分含量之间的相关性,从而确定关键质量差异标志物,为关防风的道地性成因研究、质量评价标准的建立以及改良防风品种品质提供了科学依据。
| [1] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2015: 149-150. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republicof China[M]. Beijing: China Medical Science and Technology Publishing House, 2015: 149-150. |
| [2] |
王成章, 张崇禧. 防风国内外研究进展[J]. 人参研究, 2008, 21(1): 35-41. WANG C Z, ZHANG C X. Research progress of Saposhnikovia divaricata at home and abroad[J]. Ginseng Research, 2008, 21(1): 35-41. |
| [3] |
刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念[J]. 中草药, 2016, 47(9): 1443-1457. LIU C X, CHEN S L, XIAO X H, et al. A new concept on quality marker of Chinese materia medica: quality control for Chinese medicinal products[J]. Chinese Traditional and Herbal Drugs, 2016, 47(9): 1443-1457. |
| [4] |
张铁军, 许浚, 韩彦琪, 等. 中药质量标志物(Q-marker)研究: 延胡索质量评价及质量标准研究[J]. 中草药, 2016, 47(9): 1458-1467. ZHANG T J, XU J, HAN Y Q, et al. Quality markers research on Chinese materiamedica: Quality evaluation and quality standards of Corydalis Rhizoma[J]. Chinese Traditional and Herbal Drugs, 2016, 47(9): 1458-1467. |
| [5] |
刘昌孝. 基于中药质量标志物的中药质量追溯系统建设[J]. 中草药, 2017, 48(18): 3669-3676. LIU C X. Construction of traceability system of Chinese materia medica product quality based on quality marker of Chinese materia medica[J]. Chinese Traditional and Herbal Drugs, 2017, 48(18): 3669-3676. |
| [6] |
张铁军, 王杰, 陈常青, 等. 基于中药属性和作用特点的中药质量标志物研究与质量评价路径[J]. 中草药, 2017, 48(6): 1051-1060. ZHANG T J, WANG J, CHEN C Q, et al. Method of quality marker research and quality evaluation of Chinese materia medica based on drug properties and effect characteristics[J]. Chinese Traditional and Herbal Drugs, 2017, 48(6): 1051-1060. |
| [7] |
熊亮, 彭成. 基于中药质量标志物(Q-Marker)的基本条件研究益母草和赶黄草的Q-Marker[J]. 中草药, 2016, 47(13): 2212-2220. XIONG L, PENG C. Study on Q-marker of leonurus japonicus and penthorum chinense based on basic conditions of Q-Marker[J]. Chinese Traditional and Herbal Drugs, 2016, 47(13): 2212-2220. |
| [8] |
许姗姗, 许浚, 张笑敏, 等. 常用中药陈皮、枳实和枳壳的研究进展及质量标志物的预测分析[J]. 中草药, 2018, 49(1): 35-44. XU S S, XU J, ZHANG X M, et al. Research progress on Citri Reticulatae Pericarpium, Aurantii Fructus Immaturus, and Aurantii Fructus and Q-marker predictive analysis[J]. Chinese Traditional and Herbal Drugs, 2018, 49(1): 35-44. |
| [9] |
刘亚娟, 任晓蕾, 霍金海, 等. 防风色原酮类化学成分的UPLC-Q-TOF/MS分析[J]. 中国中医药科技, 2018, 25(3): 355-384. LIU Y J, REN X L, HUO J H, et al. UPLC-Q-TOF/MS analysis of the chemical constituents of Saposhnikovia divaricata chromones[J]. Chinese Journal of Traditional Medical Science And Technology, 2018, 25(3): 355-384. |
| [10] |
李丽, 桂语歌, 宗晓菲, 等. 应用电喷雾质谱技术分析鉴定防风中色原酮类化合物[J]. 辽宁中医杂志, 2011, 38(4): 711-712. LI L, GUI Y G, ZONG X F, et al. Analysis and identification of chromones in Saposhnikovia divaricata by electrospray ionization mass spectrometry[J]. Journal of Liaoning Traditional Chinese Medicine, 2011, 38(4): 711-712. |
| [11] |
郭江宁, 吴侯, 翁新楚, 等. 补骨脂中活性成分的提取分离与抗癌实验研究[J]. 中药材, 2003, 26(3): 185. GUO J N, WU H, WENG X C, et al. Study on extraction, separation and anti-cancer experiment of active components from Psoralea corylifolia[J]. Journal of Chinese Medicinal Materials, 2003, 26(3): 185. |
| [12] |
李伟, 刘亚丽, 宋永贵, 等. UPLC-Q-TOF-MSE结合OPLS-DA模式快速鉴定南、北五味子化学成分与识别差异标志物[J]. 中草药, 2015, 46(15): 2212-2217. LI W, LIU Y L, SONG Y G, et al. Rapid identification on chemical constituents in fruits of Schisandra sphenanthera and Schisandra chinensis and discrimination markers by UPLC-Q-TOF-MSE combined with OPLS-DA[J]. Chinese Traditional and Herbal Drugs, 2015, 46(15): 2212-2217. |
| [13] |
姜华, 胡立立, 王紫玮. 静脉给药防风色原酮单体药理活性对比研究[J]. 时珍国医国药, 2016, 27(7): 1575-1577. JIANG H, HU L L, WANG Z W. Comparative study on pharmacological activities of Saposhnikovia chromone monomer administered intravenously[J]. Lishizhen Medicine and Materia Medica Research, 2016, 27(7): 1575-1577. |
| [14] |
戴锦娜. 防风药效物质基础和相关成分药代动力学研究[D]. 沈阳: 沈阳药科大学, 2009. DAI J N. Study on pharmacodynamic material basis and pharmacokinetics of related components of Saposhnikovia divaricata[D]. Shenyang: Shenyang Pharmaceutical University, 2009. |
| [15] |
郑玲, 赵挺, 孙立新. 香豆素类化合物的药理活性和药代动力学研究进展[J]. 时珍国医国药, 2013, 24(3): 714-717. ZHENG L, ZHAO T, SUN L X. Research progress of the pharmacological action and pharmacokinetics of coumarins[J]. Lishizhen Medicine and Materia Medica Research, 2013, 24(3): 714-717. |
| [16] |
程果, 徐国兵. 香豆素类化合物的药理作用研究进展[J]. 中成药, 2013, 35(6): 1288-1291. CHENG G, XU G B. Research progress on pharmacological effects of coumarins[J]. Chinese Traditional Patent Medicine, 2013, 35(6): 1288-1291. |
 2021, Vol. 40
2021, Vol. 40