文章信息
- 毛营营, 栗焕焕, 任晓亮
- MAO Yingying, LI Huanhuan, REN Xiaoliang
- 附子-甘草药对配伍研究进展
- Research progress on the herb pair combination of Glycyrrhizae Radix and Radix Aconiti Lateralis Preparata
- 天津中医药大学学报, 2021, 40(1): 119-127
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(1): 119-127
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.01.23
-
文章历史
收稿日期: 2020-10-15
附子中的化学成分主要是以乌头碱、次乌头碱、新乌头碱为代表的双酯型二萜生物碱,以及苯甲酰基类的单酯型生物碱[1-3],其中双酯型生物碱既是附子发挥药效的重要物质基础,同时也是其毒性成分,服用不当会产生严重的心脏毒性[4-6]。有研究表明生附子通过浸泡、煎煮等加工处理[7-8],或与其他中药配伍使用[9],能显著降低附子自身的毒性。查阅古籍发现与附子配伍频率最高的是有缓和特性的甘味药的代表药——甘草。甘草中的主要活性成分有三萜皂苷类(甘草酸、甘草次酸)、黄酮类(甘草素、异甘草素)和甘草多糖等。现代药理研究表明,甘草有抗炎、抗抑郁、抗肿瘤、改善免疫功能、调节心律失常等作用[9-13]。而且甘草及其制剂对多种药物中毒、食物中毒及机体代谢产物中毒有一定的解毒作用[14-15]。基于甘草“能缓能和”与“解百药毒”的特性,在中药处方中,甘草常作为佐药或使药起到调和整方的作用。
1 附子-甘草配伍作用机制研究甘草可解附子之毒目前已被大多数人认可,但具体的解毒机制仍存在较大的争议。不少科研工作者已从化学组分、药物体内代谢及四气五味药性研究等方面探究甘草的解毒机制并解释附子-甘草配伍的合理性[16-18]。
1.1 对体外毒性成分含量变化的影响 1.1.1 影响毒性成分的溶出大部分研究工作者从化学组分变化这一角度阐释了甘草在与附子配伍时所起的作用,通过比较两者合煎前后水煎液中甘草及附子中化学成分的溶出度变化,找出发挥减毒作用的物质基础。许多研究均表明附子在与甘草配伍合煎后,其双酯型生物碱的煎出量显著下降。而附子的毒烈之性主要来源于其双酯型生物碱,因此控制附子中双酯型生物碱的含量是减毒的根本。
周竹晨等[19]比较了附子与甘草在不同配伍比例下附子中生物碱的溶出情况,以生物碱的溶出率为指标,从其含量变化的角度解释甘草配伍附子的减毒机制。研究结果发现不同配伍比例下的附子-甘草对生物碱含量的影响也不同,且适当的比例配伍有利于附子中活性成分——生物碱的溶出,在两者配伍比例为3∶1(甘草∶附子)时,此时合煎液中生物碱的溶出度最高。这也表明中药配伍通过影响化学成分含量的变化,可在临床上发挥更显著的效果。蓝娟等[20]研究了附子配伍炙甘草前后,其水煎液中双酯型生物碱含量的变化,发现炙甘草与附子合煎的水煎液中以乌头碱、次乌头碱、新乌头碱为代表的双酯型生物碱含量变化较显著,并且其含量明显低于附子单煎液,这说明附子在配伍甘草后,可降低附子中双酯型生物碱的含量。林彦君等[21]采用超高效液相色谱-飞行时间质谱联用技术(UPLC-Q-TOF-MS/MS)比较了附子-甘草配伍前后汤液的高效液相色谱-串联质谱法(HPLC-MS/MS)指纹图谱变化,说明附子在配伍炙甘草前后汤液中生物碱成分种类和含量的差别较大,且附子单煎液中的双酯型生物碱总量高于附子-炙甘草合煎液,说明附子-甘草配伍可通过降低双酯型生物碱的含量来缓解附子的毒性。杨明等[22]用薄层色谱(TLC)与高效液相色谱(HPLC)分别对附子单煎液、附子和甘草分煎后的混合液及附子-甘草配伍合煎液中双酯型生物碱变化情况进行了研究。比较TLC的结果,发现附子单煎液和附子-甘草合煎液这两个样品中关于生物碱的斑点均出现在同等位置,但颜色深浅不一,说明附子配伍甘草后生物碱种类的变化不大,对其含量的变化影响较大。选取甘草和附子中的两个代表性成分甘草酸和乌头碱进行配伍,分别对乌头碱单煎液水解产物、甘草酸单煎水解产物、乌头碱-甘草酸合煎水解产物进行了比较分析,发现甘草酸-乌头碱合煎组中乌头碱水解产物的含量明显高于单煎组,说明甘草酸增加了乌头碱的溶水性并促进了毒性成分的水解,实现了减毒作用。
1.1.2 与毒性成分发生沉淀反应附子-甘草是经典的酸碱药对,两者配伍后其化学成分可发生酸碱中和反应。甘草中的黄酮类、三萜类和甘草多糖类等成分都有一定的弱酸性,附子中的主要化学成分是生物碱类,有一定的碱性。因此有些学者认为甘草与附子配伍时,甘草中的酸性成分可与附子中的生物碱类成分结合,使得附子中的乌头碱类等游离型双酯型生物碱的含量下降[23],附子的毒性得到缓解。张宇燕等[24-25]从组分角度研究了附子、甘草配伍后附子与甘草中活性成分含量的变化情况,发现两者合煎后水煎液中甘草苷、甘草酸、乌头碱的含量明显低于单煎液,这也表明甘草苷、甘草酸等化学成分含量的变化是甘草-附子配伍减毒增效的重要物质基础,具体过程可能是甘草酸、甘草苷通过与乌头碱结合生成沉淀,使得附子中游离的双酯型生物碱含量明显降低,形成的沉淀复合物在胃肠道的吸收较慢,有一定的“缓释”效果。
为了近一步研究甘草发挥解毒作用的物质基础,徐珊珺等[26]通过HPLC研究了单体甘草酸和甘草次酸在降低附子毒性中所起的作用,分别测定附子单煎液、附子-甘草、附子-甘草酸、附子-甘草次酸等不同合煎液中乌头碱及次乌头碱的含量,并以小鼠的半数致死量(LD50)为指标测其急性毒性,结果发现附子-甘草合煎组确实能抑制生物碱的溶出,而在甘草酸-附子、甘草次酸-附子合煎组中,附子中的生物碱溶出量均出现了不同程度的增加。急性毒性实验结果发现小鼠口服附子-甘草、附子-甘草酸、附子-甘草次酸合煎液的LD50均明显大于附子单煎液,可见配伍后附子的毒性明显降低,推断可能是甘草中的化学成分通过与有毒生物碱结合,延缓其在胃肠道的吸收。马鸿雁等[27]比较了乌头碱单煎、甘草酸单煎及甘草酸-乌头碱合煎后成分变化的HPLC图谱,发现当乌头碱-甘草酸合煎时,甘草酸的浓度不仅没有降低反而增大,推测在煎煮初期甘草酸不是以游离状态存在,而是先与乌头碱结合成盐,之后又逐步释放出游离的乌头碱和甘草酸,使得乌头碱的水解速率加快,这说明了甘草酸对乌头碱有控释缓释和促进其水解的双重作用。王律韵等[28]通过对照组(附子生物碱组)及实验组(附子生物碱与甘草有效部位配伍液)小鼠的急性毒性实验,通过计算其LD50来比较附子配伍甘草后,附子毒性的变化,结果表明腹腔注射附子生物碱后,小鼠的LD50降低,而当附子中的生物碱与甘草的有效部位(甘草三萜和黄酮部位)配伍后,其LD50值也相应升高。综上所述,初步推测甘草中所含的三萜皂苷(甘草酸、甘草次酸)和黄酮类成分是甘草发挥“减毒增效”作用的重要物质基础。
1.1.3 甘草甜素的水解产物可降低附子毒性也有人认为甘草的解毒成分是甘草甜素,甘草甜素作为甘草中的一种重要成分,现代临床研究表明甘草甜素对一些患有心律失常、心绞痛、高血压病、甲状腺功能亢进症等忌用钙剂的氨基苷类中毒患者来说,可视为替代钙剂的优良解毒药[29-30]。有研究者认为甘草甜素自身可以通过吸附毒物以解毒,如士的宁、水合氯醛、阿托品等均可被甘草甜素吸附而起到减毒作用[31]。另外甘草甜素在一定条件下可水解生成1分子甘草次酸和1分子葡萄糖醛酸。许多科研工作者均认为葡萄糖醛酸经脱水后可与体内一些含有羟基或羧基的有毒物质如醇、酸等结合变成无毒的化合物,由尿排出体外而起到保肝解毒作用。它可与乌头碱的羟基结合,生成无毒的葡萄糖醛酸络合物由尿排出体外。为了验证此推测,陈长勋等[32]将醋酸葡醛内酯片(在体内可转化生成葡萄糖醛酸)加入到附子单煎液中,进行小鼠的急性毒性实验研究,结果发现两者混合组的LD50明显高于附子单煎液组的LD50,说明葡萄糖醛酸对乌头碱的毒性有一定拮抗作用及减毒作用。此外葡萄糖醛酸的另一水解产物——甘草次酸,其结构因与皮质酮相似,也具有肾上腺皮质激素样作用,可降低机体对各种有毒物质的反应,提高机体对毒性物质的耐受力。
1.2 对毒性成分代谢方面的影响现代研究表明甘草的减毒作用不仅与其体外活性成分密切相关,还能影响附子在体内的吸收、分布、代谢和排泄等环节,这可能也是甘草配伍附子的减毒机制之一。
1.2.1 影响毒性成分的吸收有研究发现附子-甘草在配伍合煎使用时,不仅可使毒性较大的双酯型生物碱含量降低,还可以延缓毒性成分在体内的吸收而发挥缓控释样的减毒作用。一方面由于两者在合煎过程中,甘草中的酸性成分(甘草酸、甘草次酸)提供的酸性环境不仅可促进双酯型生物碱的水解及脂交换,减少了游离型双酯型生物碱的含量,同时还可与附子中的生物碱通过生成络合物或“酸碱中和成盐”而沉淀的方式,延缓了其在胃肠道的吸收。王志琪等[33]研究了附子-甘草药材配伍对乌头碱在大鼠体内药动学的影响,分别给予大鼠灌胃附子单煎液、甘草单煎液及附子-甘草合煎液,建立血药浓度-时间曲线,结果发现单煎液中的乌头碱在大鼠体内吸收迅速,而附子-甘草合煎液中的乌头碱在大鼠体内的药动学行为发生了改变,说明附子-甘草配伍后乌头碱的吸收明显受到抑制,吸收速度变慢且吸收的量减少,同时清除的速率加快。
1.2.2 影响毒性成分在体内的分布改变药物的分布即是减少药物在非靶向部位的剂量,可以减少药物的暴露和毒副作用。现代研究表明P-糖蛋白(P-gp)在药物的转运中起到重要作用,它能够降低细胞内药物的浓度,使细胞对多种细胞毒性化合物产生耐受,通过降低细胞内毒物的积累而达到自我保护的目的[34-35]。目前已有不少科研工作者发现甘草有调控P-gp活性的功能[36]。通过诱导P-gp的功能与表达,可减少毒物在肠道内的吸收,并加快其在胃肠道的分布,促进细胞内毒物的外排,保护机体免受毒害。何丹[37]通过考察甘草提取物3种主要成分(甘草甜素、甘草次酸和甘草苷)对人结肠癌上皮细胞(Caco-2)的细胞膜上P-gp功能和表达影响,来探讨甘草的解毒机制,结果发现这3种成分通过诱导P-gp功能并上调其表达,来增加细胞内底物的外排,这为甘草解毒机制的研究提供了重要的理论基础。
1.2.3 影响毒性成分的代谢与排泄药物在体内代谢过程通常分为Ⅰ相代谢和Ⅱ相代谢,该反应均需要体内内源性物质酶的催化。现代研究表明,甘草在体内可通过诱导Ⅰ相和Ⅱ相药物代谢酶来逆转有毒中药对药物代谢酶的诱导作用,进而影响毒性成分在体内的代谢情况。缪萍等[38]研究了附子-甘草配伍对大鼠体内肝脏药物代谢酶CYP3A活性的表达及在mRNA水平上的调控,以期从药物代谢酶CYP3A角度来探讨甘草对附子的减毒作用机制,研究结果发现甘草对CYP3A酶活性及mRNA表达具有诱导作用,对CYP3A底物双酯型乌头类生物碱在大鼠肝微粒体中的代谢具有促进作用,说明附子配伍甘草后,可加快附子中双酯型生物碱乌头碱如乌头碱、次乌头碱、新乌头碱在肝脏的代谢速率。参与药物体内Ⅱ相代谢的酶类主要是谷胱甘肽转移酶(GSTs)类和尿苷二磷酸葡萄糖醛酸转移酶(UGTs)。关于甘草对药物代谢酶Ⅱ的诱导作用,国内外的一些研究学者也进行了研究,谭亲友等[39]研究了甘草提取物和18α/β甘草酸及其水解产物18α/β甘草次酸对Ⅱ相代谢酶的影响,结果发现3者均对UGTs有诱导作用,可加速毒物的排泄从而起到减毒作用。国外的Kim等[40]研究发现,甘草中的黄酮苷元甘草素可通过诱导肝脏转运蛋白与调节Ⅱ相代谢酶(UGTs与GSTs)的表达起到一定的保肝作用,进一步研究发现甘草提取物可通过干预体内的核因子E2相关因子2(Nrf2)通路,调节药物代谢酶Ⅱ的活性与肝脏转运蛋白的表达,促进了体内毒性成分的排泄,起到一定的减毒作用。
1.3 其他方面有研究者从甘草蛋白自组装这一角度解释了附子-甘草配伍减毒的机制。李冰洁等[41]分别给小鼠腹腔注射甘草单煎液、附子单煎液、附子-甘草合煎液、单体成分乌头碱及甘草蛋白-乌头碱样品,进行急性毒性实验,观察小鼠的存活情况,结果发现甘草蛋白-乌头碱体系和甘草单煎组小鼠可正常存活,其他组却出现明显的中毒现象,该结果表明经过处理后的甘草蛋白经过自组装后,可能会与乌头碱结合形成稳定的甘草蛋白-乌头碱胶体颗粒,起到减毒效果。
2 附子配伍甘草后药效的变化大量研究已表明附子-甘草配伍合煎后能够显著降低附子中双酯型生物碱的含量,起到减毒的效果。但附子中的双酯型生物碱既是活性成分又是毒性成分,在减毒的同时,保证其药效的发挥也很重要。
2.1 维持附子原有的抗炎镇痛活性现代临床研究表明,附子有抗炎镇痛的药理作用[42-43]。李立纪等[44]利用热板法和扭体法及角叉菜胶足肿胀法比较了不同炮制方法下附子的抗炎镇痛活性,发现附子不同炮制品之间的抗炎镇痛活性并无显著性差异,说明附子的抗炎镇痛作用机制及其有效活性成分不受附子炮制加工的影响。张广平等[45]将附子-甘草配伍使用,来考察甘草对附子抗炎镇痛药效的影响,用耳部肿胀法进行抗炎实验,以肿胀度为指标(左、右耳片质量之差值),发现空白对照组与附子-甘草配伍组相比,肿胀一致率并没有明显差异,说明附子配伍甘草使用后,附子原本的抗炎活性并没有因此而减弱。采用扭体法进行镇痛实验(以小鼠出现扭体反应的时间及在限定时间内的扭体次数为指标),发现单用附子组与附子-甘草配伍组相比,扭体次数没有明显差异,表明附子在配伍甘草使用后,附子的镇痛作用也没有受到影响。以上实验均说明附子配伍甘草在减毒的同时还能维持附子原本抗炎镇痛的药理活性,而两者配伍使用可以扩大附子在临床应用中的安全窗。
2.2 协同增强附子的强心作用附子有“回阳救逆第一品”之称,有较强的强心作用,其强心活性成分主要是乌头碱类成分,但同时也是附子中的毒性成分。这提示在对附子减毒的同时更要注重存效。张硕峰等[46]通过将单体成分甘草苷与乌头碱配伍,考察其对心力衰竭大鼠心功能的影响及对离体大鼠心脏的强心作用,发现甘草苷预防给药能使乌头碱增加心力衰竭大鼠心律的作用更明显;在离体大鼠的强心实验中发现,甘草苷-乌头碱组对离体大鼠的心肌舒张性能明显强于单附子组。有研究表明甘草苷也具有一定的强心作用,可改善心肌的收缩功能,增加其心率,即甘草苷和乌头碱合用可增强乌头碱原本的强心作用。附子-甘草两者配伍使用,可协同发挥显著的强心功能。
2.3 对附子引起的心肌细胞损伤有保护作用附子的毒性主要是其双酯型生物碱引起的。有研究表明,附子中的次乌头碱、乌头碱可引起心律失常,对心肌细胞有一定的损伤。而甘草中的皂苷类成分甘草酸、甘草次酸对心肌细胞有一定的保护作用。王利勤等[47-48]比较了甘草次酸与次乌头碱在不同配伍比例下对受损心肌细胞的改善作用,结果发现次乌头碱配伍甘草次酸对心肌细胞缺氧缺糖损伤有一定的保护作用,且在配伍比例为1∶1时效果最好。周天梅[49]研究了附子-甘草配伍对乌头碱致大鼠传代心肌细胞损伤的保护作用,以细胞存活率、琥珀酸脱氢酶(SDH)活性、钠-钾三磷酸腺苷(Na+-K+ATP)酶活性等为考察指标,发现附子-甘草配伍组能使细胞存活率有不同程度改善,且该组能使心肌细胞SDH活性有明显恢复,而乌头碱单用组对传代心肌细胞SDH活性影响较大,使得该组心肌细胞的SDH值明显下降,以上研究表明附子-甘草配伍对乌头碱所致的心肌细胞损伤具有恢复作用,其机制可能是通过对SDH、Na+-K+ATP酶进行能量代谢调节,在实现对心肌细胞损伤保护的同时发挥一定的减毒作用。
3 附子-甘草药对气味配伍理论研究关于中药“四气五味”药性的记载最早见于《神农本草经》,它不仅是传统中医药理论的重要组成部分,也是指导临床谴方用药的科学依据。它提出“药有酸、苦、甘、辛、咸五味,又有寒、热、温、凉四气”[50]。只有配伍中药的气味相合,才能更全面地表现出药物的功效。根据附子和甘草的气味特性,临床上常将两者配伍使用并进行组方。从“酸苦甘辛咸”五味方面阐释,附子味辛,甘草味甘,属于辛甘配对,正合《黄帝内经》中的“气味辛甘发散为阳”之旨。根据《素问·藏气法时论》中指出的“辛散,酸收,甘缓,苦坚,咸软”,阐释了辛味能散能行,有通行气血的作用,甘味能补能和能缓,有补中益气、缓急止痛之效,且甘味药的缓急之性能延长辛味药的作用时间[51-53]。附子-甘草两者配伍在药效方面有协同作用,甘草可增强附子的补火助阳之力,两者共同发挥温肾助阳之效。从“寒热温凉”四气方面,附子性热,甘草性平偏温,属于温热配对,两者配伍,甘草常表现出调和与辅制作用,用甘草的平和之性来缓和或制约附子的大辛大热[54]。两者合用可缓和单用附子时表现出的峻猛之性,也更有利于药效的发挥。
李林[55]通过总结历代本草中古人对附子的气味描述,对《伤寒论》中附子的气味配伍规律进行了研究,发现与附子配伍出现频率最高的药多是甘味药,用甘味药的甘缓之性来制约附子的毒性,如人参或甘草常被用来配伍附子应用于临床。《神农本草经集注》记载:“世方动用附子,皆须甘草、人参……相配者,正以制其毒故也。”甘草作为甘味药的代表,味甘而缓,其甘缓之性可以缓和附子的温热辛散之势并使其和缓作用更长久。关于附子-甘草的配伍使用常在方剂中体现,如郑钦安的《医理传真》一书中记载的附子甘草汤“夫附子辛热,能补先天真阳,甘草味甘,能补后天脾土,土得火生而中气可复,按附子甘草汤一方,乃先后并补之妙剂也”,阐明了在临床使用中甘草配伍附子的重要性。唐迎雪等[56]总结了近些年来有毒中药如马钱子、附子、川乌、草乌、雷公藤等的气味配伍研究,进一步阐释了甘草对这些中药有减毒存效的特殊作用。以《伤寒论》中甘草与附子组成的经典名方四逆汤为例,该方中附子为君药,甘草为佐使药,一方面甘草性温,与辛热之附子为伍,有合化阳气之功,起到佐助的作用,二是因为甘草味甘性缓,其在方中可缓和附子峻烈之性并解其毒,这些都肯定了附子-甘草配伍使用的重要性与合理性。附子-甘草配伍减毒存效机制见图 1。
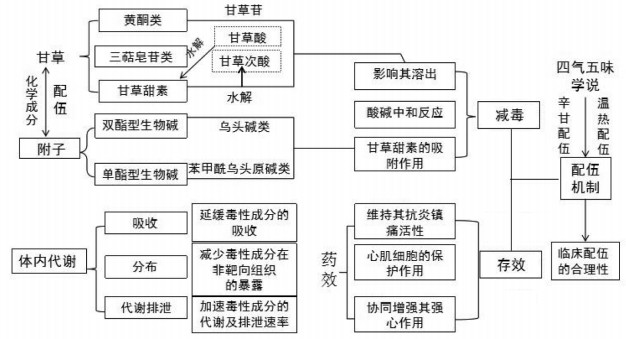
|
| 图 1 附子-甘草配伍减毒存效机制图 |
附子-甘草是中医配伍“减毒增效”的代表药对,体现了中医配伍的合理性和科学性。根据“附子之性急得甘草而后缓,附子之性毒得甘草而后解”的配伍理论,近年来不少科研工作者已从多个角度对两者配伍使用的合理性进行研究,也取得了较大的研究成果。目前对附子-甘草配伍减毒机制的解释多是从化学组分变化这一方面展开,甘草减毒的重要物质基础是以甘草酸和甘草次酸为代表的三萜皂苷类成分与以甘草素、甘草苷为代表的黄酮类成分。这些成分通过与附子中游离的生物碱相互作用,降低了附子中生物碱的溶出量,或者与附子中的生物碱进行酸碱结合形成沉淀或复合物,降低了游离型双酯型生物碱的含量,起到一定的减毒效果。两者通过配伍合煎可改变化学成分的存在形态,实现了附子中生物碱“游离态”和“结合态”的相互转化,在经胃肠道吸收时,使得其毒性成分有一定的“缓释”作用,有“缓其毒而效不减”的效果。
中药配伍的目的是增强中药药效,以专其所长,或者抑制其偏性,缓其毒性以抑其所短,产生与原来单味中药不同的效果。而中药配伍的实质是中药组分的配伍,即多种活性成分之间相互作用,通过多途径、多靶点的作用机制共同发挥药效,这也符合中医药提倡的整体观念。随着对中药配伍的深入研究,目前的中药配伍又分为中药材配伍、有效部位配伍和有效组分配伍。与中药材配伍相比,后两者在遵循传统药材配伍整体观的基础上,进行更精准的配伍,更易明确药效物质基础及作用机制,可成为中药配伍研究的突破点。对于之后的配伍研究,应该充分利用代谢组学、蛋白质组学等现代科学技术从组分配伍和药用部位这两个配伍层次来研究中药配伍的机制,这有助于推动中医精准治疗的现代化进程。
| [1] |
唐梅, 赵立春, 徐敏, 等. 附子化学成分和药理作用研究进展[J]. 广西植物, 2017, 37(12): 1624-1627. TANG M, ZHAO L C, XU M, et al. Chemical constituents and pharmacological activities of Aconiti Lateralis Radix Praeparata[J]. Guangxi Plant, 2017, 37(12): 1624-1627. |
| [2] |
张晓晨, 郑清阁, 杨菁华, 等. 附子C-(19)二萜生物碱结构及活性研究进展[J]. 中草药, 2020, 51(2): 531-541. ZHANG X C, ZHENG Q G, YANG J H, et al. Research progress on structure andactivity of C19 diterpeneoid alkaloids from Aconiti Lateralis Radix Praeparata[J]. Chinese Traditional and Herbal Drugs, 2020, 51(2): 531-541. |
| [3] |
陈思, 李武宏, 陈啸飞, 等. 附子生物碱化学成分和质量控制的研究进展[J]. 药物分析杂志, 2014, 34(10): 1709-1717. CHEN S, LI W H, CHEN X F, et al. Research progress of components and quality control analysis of alkaloids in Fuzi[J]. Journal of Pharmaceutical Analysis, 2014, 34(10): 1709-1717. |
| [4] |
孙森凤, 姜雪, 张颖颖. 附子药理作用研究进展[J]. 山东化工, 2017, 46(11): 65-67. SUN S F, JIANG X, ZHANG Y Y. Progress in research on pharmacological activities of Aconitum Carmichaeli Debx[J]. Shandong Chemical Industry, 2017, 46(11): 65-67. |
| [5] |
谭婉莹, 夏勇, 李艳苹, 等. 附子心脏毒-效物质基础及相关作用机理研究[J]. 中药药理与临床, 2019, 35(3): 95-101. TAN W Y, XIA Y, LI Y P, et al. Study on the effect of the toxic and active ingredients of aconite on the isolated frog heart and its related mechanism[J]. Pharmacology and Clinics of Chinese Materia Medica, 2019, 35(3): 95-101. |
| [6] |
何健, 吴萍, 董宇, 等. 附子不良反应分析及应用网络药理学对其产生心脏毒性的机制预测[J]. 中国中药杂志, 2019, 44(5): 1010-1018. HE J, WU P, DONG Y, et al. Adverse reactions analysis of Aconiti Lateralis Radix Praeparata and mechanism prediction of cardiac toxicity by networkpharmacology[J]. Chinese Journal of Traditional Chinese Medicine, 2019, 44(5): 1010-1018. |
| [7] |
赵纳, 侯大斌, 刘向鸿. 不同炮制方法对附子中乌头总碱和双酯型生物碱含量的影响[J]. 中药材, 2011, 34(1): 39-42. ZHAO N, HOU D B, LIU X H. Effects of different processing methods on the content of total aconitum and diester alkaloids in aconite root[J]. Journal of Chinese Medicinal Materials, 2011, 34(1): 39-42. |
| [8] |
张化为, 冯改利, 王薇, 等. 不同煎煮时间对附子总生物碱的影响及其指纹图谱研究[J]. 陕西中医学院学报, 2010, 33(4): 100-101. ZHANG H W, FENG G L, WANG W, et al. Effect of different decocting time on Fuzi alkaloid and fingerprint study[J]. Journal of Shanxi University of Traditional Chinese Medicine, 2010, 33(4): 100-101. |
| [9] |
张利. 甘草的药理作用及现代研究进展[J]. 中医临床研究, 2014, 6(10): 147-148. ZHANG L. A review on pharmacological effects of licorice[J]. Clinal Journalof Chinese Medicine, 2014, 6(10): 147-148. |
| [10] |
李冀, 李想, 曹明明, 等. 甘草药理作用及药对配伍比例研究进展[J]. 上海中医药杂志, 2019, 53(7): 83-87. LI J, LI X, CAO M M, et al. Research progress in pharmacological actions of liquorice and proportion of couplet medicines in combination[J]. Shanghai Journal of Traditional Chinese Medicine, 2019, 53(7): 83-87. |
| [11] |
JIANG M, ZHAO S, YANG S. An "essential herbal medicine"-licorice: a review of phytochemicals and its effects in combination preparations[J]. Journal of Ethnopharmacology, 2020, 249: 112439. DOI:10.1016/j.jep.2019.112439 |
| [12] |
YU X, BAO Y, MENG X, et al. Multi-pathway integrated adjustment mechanism of licorice flavonoids presenting anti inflammatory activity[J]. Oncology letters, 2019, 18(5): 4956-4963. |
| [13] |
王元, 瞿彩云, 彭雪晶. 甘草及其衍生物药理作用的研究新进展[J]. 甘肃医药, 2011, 30(7): 398-401. WANG Y, QU C Y, PENG X J. New progress in research on pharmacological effects of licorice and its derivatives[J]. Gansu Medical Journal, 2011, 30(7): 398-401. |
| [14] |
魏旭雅, 邱子栋, 陈金龙, 等. 有毒乌头类中药炮制与配伍减毒机制的研究进展[J]. 中国中药杂志, 2019, 44(17): 3695-3704. WEI X Y, QIU Z D, CHEN J L, et al. Research advancement in mechanisms of processing and compatibility for detoxication of Aconitums[J]. Chinese Journal of Traditional Chinese Medicine, 2019, 44(17): 3695-3704. |
| [15] |
佟姝丽, 张无士. 甘草解毒小议[J]. 中外医疗, 2009, 28(10): 107-108. TONG S L, ZHANG W S. Discussion on detoxification of Licorice[J]. China Foreign Medical Treatment, 2009, 28(10): 107-108. |
| [16] |
杨波, 董辉, 孙晖, 等. 基于尿液代谢组学的附子配伍甘草减毒作用研究[J]. 中国现代中药, 2019, 21(7): 895-902. YANG B, DONG H, SUN H, et al. Urine metabolomics analysis of toxicity attenuation effects of Fuzi compatibility with Gancao[J]. Modern Chinese Medicine, 2019, 21(7): 895-902. |
| [17] |
陈艳琰, 曹玉洁, 唐于平, 等. 基于化学成分相互作用研究大黄-甘草配伍应用的物质基础[J]. 世界科学技术-中医药现代化中药研究, 2019, 21(11): 2443-2450. CHEN Y Y, CAO Y J, TANG Y P, et al. Research on Rhubarb-Licorice based onthe interaction of chemical components material basis for compatibility applicatio[J]. Modernization of Traditional Chinese Medicine and Materia Materia-World Science and Technology, 2019, 21(11): 2443-2450. |
| [18] |
罗伟康, 胡渊龙. 《伤寒论》炙甘草气味配伍规律探析[J]. 国医论坛, 2017, 32(5): 5-6. LUO W K, HU Y L. Analysis on the compatibility law of flavor of Radix Glycyrrhizae Preparata in Treatise on Febrile Diseases[J]. Forum on Traditional Chinese Medicine, 2017, 32(5): 5-6. |
| [19] |
周竹晨, 裴俊弛, 武宇佳, 等. 附子与甘草不同配伍对生物碱溶出及抗炎作用的影响[J]. 中国中医急症, 2018, 27(12): 2072-2075. ZHOU Z C, PEI J C, WU Y J, et al. Compatibility of aconite with licorice on the contents of alkaloids and anti-inflammatory effects[J]. Journal Emergency Traditional Chinese Medicine, 2018, 27(12): 2072-2075. |
| [20] |
蓝娟, 阿衣夏木夏衣提, 何雷萍, 等. 炙甘草配伍对附子水煎液中乌头类生物碱的含量和离体肠吸收的影响[J]. 中国药科大学学报, 2012, 43(5): 430-434. LAN J, AYIXIAMU X Y T, HE L P, et al. Influence on content and in vitro intestinal adsorption of aconite alkaloids in water decoction after compatibility of Radix Aconite Lateralis Preparata and baked Radix Glycyrrhizae[J]. Journal of China Pharmaceutical University, 2012, 43(5): 430-434. |
| [21] |
林彦君, 游宇, 季宁平. HPLC-Q-TOF/MS指纹技术对比分析附子配伍炙甘草前后化学组分变化[J]. 中草药, 2014, 11(45): 1556-1560. LIN Y J, YOU Y, JI N P. Rhizoma changes of chemical ingredients before and after compatibility of Aconiti Lateralis Radix Praeparata and Glycyrrhizae Radixet Praeparata cum melle analyzed by HPLC-Q-TOF/MS fingerprint technology[J]. Chinese Traditional and Herbal Drugs, 2014, 11(45): 1556-1560. |
| [22] |
杨明, 刘小彬, 黄庆德. 附子甘草配伍减毒增效机理探析[J]. 时珍国医国药, 2003, 25(4): 197-198. YANG M, LIU X B, HUANG Q D. The increasing effect and reducing effectprincipe of compatibility of Radix Aconiti Laterlis Preparata and Radix Glycyrrhizae[J]. Li Shizhen Medicine and Materia Medica Research, 2003, 25(4): 197-198. |
| [23] |
PETAR C, KATARZYNA J, MICHAL T. Glycerolic licorice extracts as activecosmeceutical ingredients: extraction optimization, chemicalcharacterization, and biological activity[J]. Antioxidants (Basel), 2019, 8(10): 445. DOI:10.3390/antiox8100445 |
| [24] |
张宇燕, 杨洁红. 甘草中甘草苷的测定及与附子配伍前后含量的变化[J]. 中华中医药学刊, 2008, 27(7): 1493-1495. ZHANG Y Y, YANG J H. Detemination of liquirtin in licorice and its change before and after compatbity of licorice with aconite[J]. Chinese Archives of Traditional Chinese Medicine, 2008, 27(7): 1493-1495. |
| [25] |
张宇燕, 万海同, 杨洁红, 等. 附子配伍甘草减毒增效的研究[J]. 中医杂志, 2012, 53(16): 1365-1368. ZHANG Y Y, WAN H T, YANG J H, et al. Study on aconite with licorice to reducetoxicity and increase effect[J]. Journal of Traditional Chinese Medicine, 2012, 53(16): 1365-1368. |
| [26] |
徐姗珺, 陈长勋, 高建平, 等. 甘草与附子配伍减毒的有效成分及作用环节研究[J]. 中成药, 2006, 28(4): 526-530. XU S J, CHEN C X, GAO J P, et al. Attenuated effect of active components of Radix Glycyrrhizae on Radix Aconiti Laterlis and the related mechanisms[J]. Chinese Traditional Patent Medicine, 2006, 28(4): 526-530. |
| [27] |
马鸿雁, 刘小彬, 李楠, 等. 乌头碱和甘草酸作用的研究[J]. 时珍国医国药, 2006, 17(2): 208-209. MA H Y, LIU X B, LI N, et al. Study of interaction of aconitine and glycyrrhizic acid by HPLC[J]. Li Shizhen Medicine and Materia Medica Research, 2006, 17(2): 208-209. |
| [28] |
王律韵, 杨洁红, 张宇燕, 等. 附子与甘草配伍减毒增效的物质基础初探[J]. 中国中医急症, 2011, 20(2): 248-250. WANG Y L, YANG J H, ZHANG Y Y, et al. Preliminary study on material baseof the decreasing toxicity and increasing efficacy in the compatibility of aconite with licorice[J]. Journal Emergency of Traditional Chinese Medicine, 2011, 20(2): 248-250. |
| [29] |
王肖娜, 金玉姬, 刘洋. 甘草甜素的应用及研究现状[J]. 吉林药学院学报, 2014, 35(2): 144-147. WANG X N, JIN Y J, LIU Y. Application and research of glycyrrhizi[J]. Journal of Jilin Medical College, 2014, 35(2): 144-147. |
| [30] |
王秀锋, 单风平. 甘草甜素抗炎及抗肿瘤机制研究进展[J]. 微生物学杂志, 2013, 33(4): 88-92. WANG X F, SHAN F P. Advanced in glycyrrhizin's anti-inflammation and antitumor mechanism[J]. Journal of Microbiology, 2013, 33(4): 88-92. |
| [31] |
何丹, 刘凤琴, 李焕德. 甘草解毒作用研究进展[J]. 中南药学, 2009, 7(12): 927-931. HE D, LIU F Q, LI H D. Research progress on detoxification effect of licorice[J]. Central South Pharmacy, 2009, 7(12): 927-931. |
| [32] |
陈长勋, 徐姗珺. 甘草、干姜与附子配伍减毒的物质基础与作用环节研究进展[J]. 中药新药与临床药理, 2006, 17(6): 472-476. CHEN C X, XU S J. Research progress on the material basis and action links of the compatibility of licorice, dried ginger and aconite[J]. Traditional Chinese Drug Research & Clinal Pharmacology, 2006, 17(6): 472-476. |
| [33] |
王志琪, 曾嵘, 谭志荣, 等. 附子与甘草配伍前后乌头碱和甘草次酸在大鼠体内的药动学比较[J]. 中成药, 2012, 34(12): 2305-2309. WANG Z Q, ZENG R, TAN Z R, et al. Pharmacokinetics of aconitine and glycyrrhetic acid in separation and combination with Aconiti lateralis Radix praeparata and Glycyrrhizae Radix et Rhizoma in rats[J]. Chinese Traditional Patent Medicine, 2012, 34(12): 2305-2309. |
| [34] |
唐霞, 辛华雯. 常见中草药及其有效成分对CYP3A和P-gp代谢与转运的影响[J]. 中国药师, 2013, 16(10): 1588-1592. TANG X, XIN H W. The effects of common Chinese herbal medicines and their active ingredients on the metabolism and transport of CYP3A and P-gp[J]. China Pharmacist, 2013, 16(10): 1588-1592. |
| [35] |
何雪辉. 柚皮素对CYP3A代谢酶和P-糖蛋白转运体影响的研究[D]. 张家口: 河北北方学院, 2014. HE X H. Effects of naringenin on CYP-3A and P-gp[D]. Zhangjiakou: Hebei North University, 2014. |
| [36] |
董月柳. 多成分环境下P-gp对甘草次酸吸收的影响研究[D]. 北京: 北京中医药大学, 2017. DONG Y L. Study on the effect of P-gp on the absorption of glycyrrhetinic acid in a multi-component environment[D]. Beijing: Beijing University of Traditional Chinese Medicine, 2017. |
| [37] |
何丹. 甘草提取物及其三种主要成分对Caco-2细胞膜上P-gp功能和表达的影响[D]. 长沙: 中南大学, 2010. HE D. Effects of Radix Glycyrrhiza and its three main components on the function and expression of glycoprotein in Caco-2 cells[D]. Changsha: Central South University, 2010. |
| [38] |
缪萍, 裘福荣, 曾金, 等. 甘草诱导CYP3A促进附子代谢的减毒配伍机制[J]. 中华中医药杂志, 2014, 29(9): 2813-2817. MIAO P, QIU F R, ZENG J, et al. Antitoxin compatible mechanism of Glycyrrhiza uralensis Fisch. inducing CYP3A to promote the metabolism of Aconitum carmichaelii Debx[J]. Chinese Traditional Journal of Chinese Medicine, 2014, 29(9): 2813-2817. |
| [39] |
谭亲友. 甘草酸18H差向异构体及其水解产物对Ⅱ相解毒酶的影响及其机制的研究[D]. 长沙: 中南大学, 2012. TAN Q Y. Effects of C-18 Epimers of glycyrrhizic acid and their hydrolysis products on Ⅱ Phase detoxification enzymes and its mechasim research[D]. Changsha: Central South University, 2012. |
| [40] |
KIM Y W, KANG H E, LEE M G, et al. Liquiritigenin, a flavonoid aglycone from licorice, has a choleretic effect and the ability to induce hepatic transporters and phase-Ⅱ enzymes[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2009, 296(2): 372-381. DOI:10.1152/ajpgi.90524.2008 |
| [41] |
李冰洁, 沈勇, 廖日滔, 等. 从蛋白质自组装的角度探析甘草附子配伍减毒机制[J]. 中国中药杂志, 2015, 40(4): 661-666. LI B J, SHEN Y, LIAO R T, et al. Investigating mechanism of toxicity reductionby combination of Glycyrrhizae Radix et Rhizoma and Aconiti Lateralis Radix Preparata on terms of proteins self-assembly[J]. Chinese Journal of Traditional Chinese Medicine, 2015, 40(4): 661-666. |
| [42] |
邓晓红, 黄建华, 董竞成. 附子药理作用的分子机制研究进展[J]. 江西中医药大学学报, 2018, 30(1): 121-124. DENG X H, HUANG J H, DONG J C. Research progress of mocular mechanismof pharmacological effects of Fuzi[J]. Journal of Jiangxi University of Traditional Chinese Medicine, 2018, 30(1): 121-124. |
| [43] |
陈荣昌, 孙桂波, 张强, 等. 附子及其复方中药的药理作用研究进展[J]. 中草药, 2014, 45(6): 883-888. CHEN R C, SUN G B, ZHANG Q, et al. Research progress on pharmacologicalactions of of Aconiti Lateralis Radix Praeparata and its herbal compound[J]. Chinese Traditional and Herbal Drugs, 2014, 45(6): 883-888. |
| [44] |
李立纪, 张风雷, 吴荣祖, 等. 新法加工附子与附片抗炎镇痛作用比较研究[J]. 云南中医中药杂志, 2004, 25(4): 34-35. LI L J, ZHANG F L, WU R Z, et al. A Comparative study on the anti-inflammatory and analgesic effects of Fuzi processed by new methods[J]. Journal of Yunnan Traditional Chinese Medicine, 2004, 25(4): 34-35. |
| [45] |
张广平, 解素花, 朱晓光, 等. 附子甘草配伍减毒增效/存效实验研究[J]. 中国中医药信息杂志, 2012, 19(6): 31-34. ZHANG G P, XIE S H, ZHU X G, et al. Experimental study on effects of Radix Glycyrrhizae on toxicity and efficacy of Radix Aconiti Carmichaeli in compatibility[J]. Chinese Journal of Information on TCM, 2012, 19(6): 31-34. |
| [46] |
张硕峰, 吴金英, 贾占红. 甘草苷对乌头碱强心作用效-毒剂量关系的影响[A]. 中华中医药学会中药实验药理分会2012年学术年会论文集[C]. 中华中医药学会, 2012: 27-28. ZHANG S F, WU J Y, JIA Z H. The influence of glycyrrhizin on the relationship between aconitine's heart strengthening effect and toxic dose[A]. Proceedings of 2012 Academic Annual Meeting of Experimental Pharmacology Branch of China Association of Traditional Chinese Medicine[C]. China Association of Traditional Chinese Medicine, 2012: 27-28. |
| [47] |
王利勤, 张宇燕, 何昱, 等. 附子、甘草有效成分不同配伍比例对H9c2心肌细胞缺氧缺糖损伤的影响[J]. 中医杂志, 2016, 57(15): 1327-1331. WANG L Q, ZHANG Y Y, HE Y, et al. Comparison of the different compatibility ratios of the effective ingredients of aconite and licorice to the effect of H9c2 cardiomyocyte hypoxia and glucose deprivation injury[J]. Journal of Traditional Chinese Medicine, 2016, 57(15): 1327-1331. |
| [48] |
王利勤. 次乌头碱配伍甘草次酸抗心肌缺血及抗心衰的作用及机制研究[D]. 杭州: 浙江中医药大学, 2017. WANG L Q. Study on the protective effects and mechanism of the compatibility of hypaconitine and glycyrrhetinic acid on cardiac ischemic and heart failure[D]. Hangzhou: Zhejiang University of Traditional Chinese Medicine, 2017. |
| [49] |
周天梅. 附子甘草活性物质配伍对乌头碱致传代心肌细胞损伤保护作用的实验研究[D]. 杭州: 浙江中医药大学, 2013. ZHOU T M. Experimental study of protective effects of the aconite and glycyrrhiza compatibility on the aconite-induced passaged rat myocardial cellingury[D]. Hangzhou: Zhejiang University of Traditional Chinese Medicine, 2013. |
| [50] |
马继兴. 神农本草经辑注[M]. 1版. 北京: 人民卫生出版社, 1995: 16. MA J X. Shennong's materia medica compilation notes[M]. 1st edition. Beijing: People's Medical Publishing House, 1995: 16. |
| [51] |
王志强. 炙甘草汤的气味配伍理论及应用[J]. 新中医, 2011, 43(9): 129-130. WANG Z Q. The odor compatibility theory and application of prepared Liquorice Decoction[J]. Journal of New Chinese Medicine, 2011, 43(9): 129-130. |
| [52] |
程昭寰, 王永炎. 方剂气味配伍理论探析[J]. 上海中医药杂志, 2004, 38(2): 6-8. CHENG Z H, WANG Y Y. Theory of herbal prescription combination through property and flavor[J]. Shanghai Journal of Traditional Chinese Medicine, 2004, 38(2): 6-8. |
| [53] |
丛素环. 《内经》气味理论研究[D]. 济南: 山东中医药大学, 2011. CONG S H. Study on theory of property and flavor of internal classic[D]. Jinan: Shangdong University of Traditional Chinese Medicine, 2011. |
| [54] |
孙冰, 邓家刚, 张作纪. 平性药配伍理论探究[J]. 中华中医药杂志, 2012, 27(3): 525-527. SUN B, DENG J G, ZHANG Z J. Study on the compatibility theory of the neutral-nature traditional Chinese medicine[J]. Chinese Journal of Traditional Chinese Medicine, 2012, 27(3): 525-527. |
| [55] |
李林. 张仲景附子配伍规律研究[D]. 济南: 山东中医药大学, 2011. LI L. Zhongjing compatibility law of aconite[D]. Jinan: Shandong University of Traditional Chinese Medicine, 2011. |
| [56] |
唐迎雪, 梁晓东, 樊凯芳. 生物碱类有毒中药气味结合配伍减毒增效的古今应用[J]. 中药药理与临床, 2011, 27(2): 138-140. TANG Y X, LIANG X D, FAN K F. The ancient and modern application of alkaloid toxic traditional Chinese medicine odor combined with compatibility attenuation and efficiency enhancement[J]. Pharmacology and Clinics of Chinese Medicine, 2011, 27(2): 138-140. |
 2021, Vol. 40
2021, Vol. 40