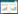文章信息
- 刘圣越, 王跃飞, 何永志, 李霖, 房士明, 张晗
- LIU Shengyue, WANG Yuefei, HE Yongzhi, LI Lin, FANG Shiming, ZHANG Han
- 内生真菌对宿主植物生长和次级代谢产物影响研究进展
- Research progress on the effect of endophytic fungi on the growths and secondary metabolites of host plants
- 天津中医药大学学报, 2021, 40(1): 128-136
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(1): 128-136
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.01.24
-
文章历史
收稿日期: 2020-09-17
2. 天津中医药大学制药工程学院, 天津 301617
2. College of Pharmaceutical Engineering of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
内生真菌是指一类存在于健康植物内部各个组织及细胞内,且不会对植物引起明显病害症状的微生物[1]。已经报道的内生真菌都属于子囊菌类,广泛分布于苔藓、蕨类、灌木、藻类、草本及被子与裸子植物。在长期发展进化的过程中,内生真菌与植物建立了互利共惠的关系。宿主植物能够提供内生真菌生长所需的营养物质[2-3]。内生真菌通过调节植物激素促进植物生长或者协助植物抵抗干旱、虫害、病原菌侵害等外界因素的胁迫[4-9]。有研究发现内生真菌通过分泌真菌诱导子来诱导植物产生次级代谢产物,增加次级代谢产物的量,或者自身产生与植物相似的次级代谢产物[10-11]。文章对内生真菌促进植物生长、协助宿主对抗外界因素胁迫和影响植物次级代谢产物的产生和积累3个方面进行总结概括,以期为研究内生真菌对宿主植物作用以及中药资源研究提供一定参考。
1 内生真菌促进植物生长光源、碳源、土壤及水对于植物生长至关重要,内生真菌对宿主植物生长也有很大影响。相关研究表明内生真菌主要通过调节吲哚-3-乙酸(IAA)[12]和乙烯[13]等植物激素水平来促进植物种子萌发和植物生长。
1.1 内生真菌调节IAA水平促进植物生长植物激素IAA是一种生长素,是植物生长和发育关键的调节因子,对细胞分裂、生长、衰老发挥着重要作用[14]。植物中合成IAA是通过色氨酸(Trp)依赖性途径或用Trp非依赖性途径从头合成。在Trp依赖性途径中,Trp转化成IAA有4种生物合成途径[15],而在真菌中,主要有两种途径:一种是通过氨基转移酶(TAA)将Trp转化成吲哚-3-丙酮酸(IPA),然后IPA在黄素单加氧酶(FMO)的作用下转化成IAA。另一种则是Trp经色氨酸脱羧酶(TDC)形成色胺(TAM),TAM在胺氧化酶(AO)的催化下形成吲哚-3-乙醛(IAAld),后者再经吲哚-3-乙醛脱氢酶(IAD)转化成IAA[16]。而在Trp非依赖性途径中,吲哚-3-甘油磷酸作为前体,在吲哚合酶(INS)的作用下形成吲哚,后者再转化成IAA,但植物吲哚如何转化成IAA的机制尚不清晰,可能通过吲哚-3-乙腈(IAN)、IPA、吲哚-3-乙酰胺(IAM)等中间体合成IAA[17]。见图 1。

|
| 注:实线代表已经确定的酶;虚线代表可能存在的中间体。 图 1 真菌中IAA的合成途径 |
文献报道内生真菌可产生IAA从而促进植物种子萌发及根、茎、叶的生长。Chutima等[18]从兰花根中分离出3种高产IAA的瘤菌根菌属真菌Tulasnella CMU-SLP 007、Tulasnella CMU-NUT 013和Tulasnella CMU-AU 006,将这3种真菌接种于芸豆及玉米种子中,发现芸豆根生长长度增加,促进了玉米种子萌发。内生真菌还通过调控TAA影响IAA的合成。Kulkarni等[19]从种植鹰嘴豆土壤样品中分离出镰刀菌属真菌Fusarium delphinoides,采用气相色谱分析检测该菌中存在IPA,并且TAA活性增强,IAA含量增加,促进了鹰嘴豆生长。Kumla等[20]用高效液相色谱(HPLC)法检测出6种真菌的粗酶提取物中都有IPA,且这些真菌中的TAA活性均增强。同时在接种这6种真菌的燕麦中发现这些真菌均能产生IAA,促进燕麦胚芽鞘伸长。有研究显示内生真菌还能通过调控色胺途径中IAD促进植物生长。Reineke等[21]将敲除IAD基因的黑粉菌属真菌Ustilago maydis突变体接种于玉米,显示IAAld向IAA转化过程受阻,而具有IAD基因的原始菌株能产生较高水平的IAA,从而促进玉米生长。内生真菌不仅能通过Trp依赖性途径合成IAA,还能通过Trp非依赖性途径合成IAA。Khan等[22]使用液相色谱-串联质谱(LC-MS)法对从乳香树中分离出的短梗霉属真菌Aureobasidium sp. BSS6菌株培养滤液中的IAA进行分析,发现其培养滤液中存在吲哚-3-甘油磷酸而无Trp,并且该菌株显示较高的IAA合成,促进了乳香树生长。强晓晶[23]分析从披碱草种子中筛选出的3种链格孢属真菌Alternaria sp. LQ1230、Alternaria sp. LQ2、Alternaria sp. LQ141的纯培养滤液,发现这3种菌株内无Trp存在,但这3种真菌仍能产生IAA,将这3种真菌接种于小麦幼苗中,均能显著促进小麦生长。上述文献研究表明内生真菌能通过Trp依赖途径和非Trp依赖途径合成IAA,并且自身调控这两种途径中涉及的中间产物及酶,增加植物IAA水平,进而促进植物根、茎、叶的生长及果实成熟。
1.2 内生真菌通过降低乙烯水平刺激植物生长乙烯是一种有生物活性的气体分子,低浓度乙烯能促进植物生长,而高浓度乙烯则会抑制其生长,因此降低乙烯水平有助于植物生长发育、果实成熟及延缓组织衰老等[24]。在乙烯的生物合成途径中,甲硫氨酸在S-腺苷甲硫氨酸合成酶(SAMS)的作用下形成S-腺苷甲硫氨酸(SAM),SAM在氨基环丙烷羧酸合酶的催化下合成氨基环丙烷羧(ACC),后者在氨基环丙烷羧氧化酶作用下进一步合成乙烯[25]。其中ACC是合成乙烯的重要前体物质。见图 2。
|
| 图 2 乙烯的合成途径 |
内生真菌可产生1-氨基环丙烷-1-羧酸脱氨酶(ACCD),该酶能将乙烯合成途径中的前体物质ACC裂解成α-酮丁酸和氨,从而减少乙烯的合成,刺激植物的生长。Zhang等[26]检测到含有木霉属真菌Trichoderma asperellum ACCC30536的拟南芥中ACCD活性增强,拟南芥中乙烯含量降低,根长、根数、鲜质量、种子等生长参数均增加。此外Zhang等[27]还检测到含有木霉属真菌Trichoderma asperellum ACCC30536的杨树幼苗中ACCD活性增强,发现其中乙烯含量降低,促进了杨树幼苗的生长。Jolanta等[28]发现定殖了木霉属真菌Trichoderma DEMTkZ3A0的小麦幼苗根部重量增加,在小麦幼苗的根部检测到ACCD增加,乙烯含量减少,促进小麦幼苗生长。综上所述,内生真菌可以产生ACCD,该酶降解乙烯合成的前体物质ACC,从而降低植物中乙烯的浓度,达到促进植物生长的作用。
2 内生真菌激活植物防御系统对抗恶劣环境植物在生长过程中会受到干旱、高盐、重金属及病原体等带来的侵害,如干旱能降低种子发芽率、导致叶片气孔开放减少、植物光合作用受到抑制以及增加植物中的活性氧含量[29-30]。重金属会破坏土壤质量,并且损害植物细胞的结构,影响植物的生长和代谢[31]。高盐会使植物中养分失衡,导致特定的离子毒性,同时也会产生大量的活性氧使得植物细胞受损[32]。然而植物中的内生真菌能协助植物对抗胁迫,内生真菌通过调控植物激素的水平,如调控赤霉素(GA)[33]、水杨酸(SA)[34]和茉莉酸(JA)[35]等物质的水平,协助植物对抗环境胁迫。此外,内生真菌还能调节活性氧协助植物对抗恶劣环境[36]。
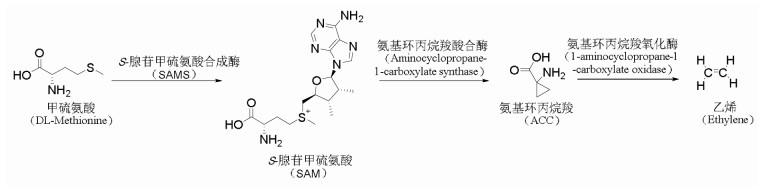
2.1 内生真菌产生GA诱导植物适应胁迫GA是一种植物激素,能抵御干旱、盐等各种胁迫[37-39]。GA主要由前体物质牻牛儿牻牛儿基焦磷酸(GGDP)在古巴焦磷酸合成酶(CPS)和内根-贝壳杉烯合成酶(KS)的催化下形成内根-贝壳杉烯,进而经内根-贝壳杉烯氧化酶(KO)的催化下依次形成内根-贝壳杉烯醇、内根-贝壳杉烯醛和内根-贝壳杉烯酸(KA)。KA则在内根-贝壳杉烯酸氧化酶(KAO)的作用下合成GA12-醛,后者进一步转化成中间产物GA12。GA12在GA13氧化酶的催化下形成GA53,GA53在GA20-oxidase、GA3-oxidase和GA2-oxidase氧化酶的催化下形成不同种类的GA[40]。见图 3。
|
| 图 3 GA的合成途径 |
内生真菌通过合成GA可提高植物中GA水平,从而协助植物对抗环境胁迫。Khan等[41]将从黄瓜植株中分离得到的拟青霉菌属真菌Paecilomyces formosus LHL10接种于处于盐胁迫下的宿主植物中,并与未接种菌株的植物相比较,结果显示接种菌株的植物中GA分子GA20合成增加,GA含量显著增高,减弱了宿主植物受到的盐胁迫。Cosme等[42]将梨形孢属真菌印度梨形孢Piriformospora indica接种于含有稻水象甲的水稻中,与未接种内生真菌的水稻比较,发现在接种内生真菌的水稻中KS的基因表达和GA含量高于未接种内生真菌的水稻,并且可以抵御稻水象甲的侵害。Bilal等[43]将拟青霉菌属真菌Paecilomyces formosus LHL10接种于处于镍胁迫下的大豆植物,结果发现接种该菌减弱了大豆植物的镍胁迫,并且通过实时荧光聚合酶链式反应(RT-PCR)分析发现该真菌内GA合成过程中GA20-oxidase基因上调,大豆植物中GA含量增加。上述文献结果表明,植物在遭遇外在环境胁迫时,其内生真菌可以调控GA合成过程中的酶来合成GA,提高植物体内GA水平,进而帮助植物抵御胁迫。
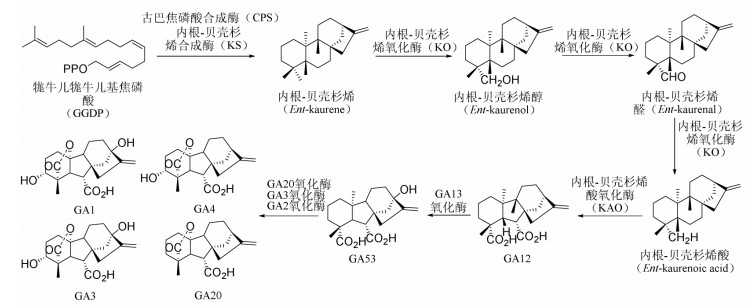
2.2 内生真菌通过调控SA和JA抵御环境胁迫SA和JA是高等植物的内源性调节物质,可以促进植物对病原体的抵御。SA的合成途径是苯丙氨酸先转化成肉桂酸(t-CA),t-CA经苯丙氨酸解氨酶(PAL)催化形成苯甲酸,苯甲酸在苯甲酸2-羟化酶(BA2H)作用下经羟基化形成SA,其中PAL是其合成过程中的关键酶。见图 4。
|
| 图 4 SA的合成途径 |
JA则是α-亚麻酸在13-脂氧合酶(LOX)的作用下氧化成13-氢过氧-亚麻酸,再由13-氢过氧化物脱水酶催化成12-13环氧亚麻酸,并由13-氢过氧化物环化酶催化成12-氧-植物二烯酸,此物质再由12-氧-植物二烯酸还原酶催化成3-氧-2-(2-戊烯基)-环戊烷辛酸,再由β氧化生成JA。其中LOX是JA合成过程中的关键酶[44-45]。见图 5。
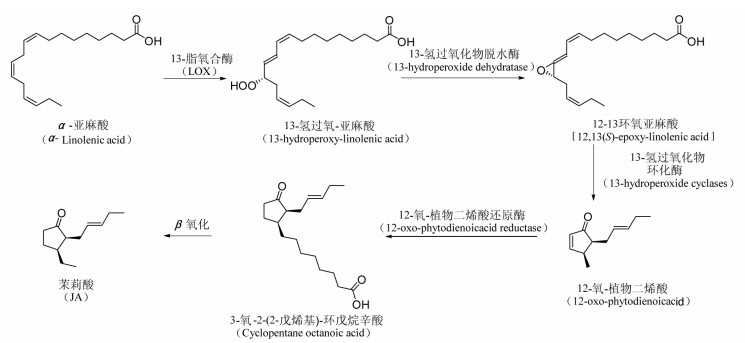
|
| 图 5 JA的合成途径 |
植物经常会受到虫害、病原菌及机械创伤造成的侵害,而内生真菌能调控SA和JA的水平诱导其宿主植物对抗这些侵害。马碧花等[46]从兰州大学草地农业科学院采摘带内生真菌和不带内生真菌的多年生黑麦草,赋予这两种黑麦草干旱胁迫,两者相比较,带内生真菌的黑麦草枝叶茂盛,而不带内生真菌的黑麦草枝叶凋落。经检测带有内生真菌的黑麦草相对含水量、叶绿素含量和SA含量高于不带内生真菌的黑麦草。Mishra等[47]将链格孢菌属真菌Alternaria alternata接种于宿主植物并给予其病原体侵害,与未接种内生真菌的宿主植物相比,其SA合成过程中PAL基因上调,植物中SA含量增加,宿主植物受到病原体的伤害减弱。Pappas等[48]将镰刀菌属真菌Fusarium solani接种于番茄中,给予叶螨侵染,结果发现与未接种该菌的番茄相比,番茄中叶螨的产卵下降,并且发现LOX基因的表达增强,番茄中JA含量增加。综上所述,内生真菌调控植物中SA和JA的含量,协助宿主植物对抗病原体的进攻。
2.3 内生真菌调控活性氧对抗胁迫活性氧是指机体内或者自然环境中由氧组成,并且性质活泼的物质总称,包括超氧阴离子、过氧化氢(H2O2)及氧气,也是体内正常代谢的副产物。当植物长期暴露于干旱、高盐、病原体感染等环境时,这些环境会迫使植物产生活性氧,而过量的活性氧则会造成蛋白质和植物细胞氧化受损[49]。
NADPH氧化酶(NoxA)是活性氧形成过程中的关键酶,电子供体NADPH转移的电子通过黄细胞色素B558转至细胞膜的胞质侧,这些电子与电子受体反应并产生超氧化物,进而产生大量的活性氧[50]。内生真菌能调节植物体内的抗氧化酶,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)来抑制NADPH氧化酶活性,协助植物清除活性氧进而减少细胞受损[51]。张诗婉[52]从盘锦红海滩碱蓬Suaeda glauca Bunge叶片中分离出内生真菌Y1-1,将其接种于重金属镉感染的水稻幼苗中,与未接种真菌的水稻幼苗比较,有效缓解了水稻幼苗受到的镉侵害,经检测发现接种真菌的水稻幼苗中SOD、CAT、POD等抗氧化酶活性增加,使得处于干旱胁迫下的水稻中的镉含量和活性氧减少。胡桂馨等[53]将顶头胞霉菌Acremonium coenophialum接种于高羊茅中,置于干旱环境下,与未接种的高羊茅相比,接种内生真菌的高羊茅中SOD、CAT等抗氧化酶活性和相对含水量均高于未接种的高羊茅。张永雯[54]将细交链孢菌Alternaria alternata、根腐离蠕孢Bipolaris sorokiniana和燕麦镰刀菌Fusarium avenaceum接种于盐胁迫下的野大麦,发现野大麦中POD、CAT、SOD酶活性增强,活性氧的含量降低。上述研究表明,内生真菌能增强抗氧化酶活性来抑制活性氧形成过程中的NADPH氧化酶,维持植物中活性氧与抗氧化性的平衡,进而协助植物对抗环境胁迫。
3 增加宿主次级代谢物质积累植物次级代谢产物对人类健康有着重要影响,但是植物次级代谢产物的获取受植物生长周期限制,而且有些成分含量极低。植物内生真菌不仅能通过自身产生诱导物质促进植物次级代谢产物的生物合成[55-56],而且还能产生与宿主植物相似的次级代谢产物[57-61]。
3.1 内生真菌通过真菌诱导子刺激宿主次级代谢物质积累刺激次级代谢产物产生的分子称为诱导子,而诱导则是增加植物中次级代谢产物产生的有效手段之一。内生真菌中的诱导子如寡糖、多糖、甘露聚糖及植物激素可以活化植物中特定的某类次级代谢产物的代谢途径,进而调控这类物质的生物合成。Li等[62]从镰刀菌属真菌Fzarium oxysporum Dzf17的菌丝体中制备寡糖,将其加入盾叶薯中,发现薯蓣皂苷元含量增大。Zhong等[63]将镰刀菌属真菌Fusarium oxysporum Fat9中的胞外多糖加入苦荞麦中,发现苦荞麦芽中芦丁和槲皮素的总产量增加。Chen等[64]从孔球孢霉属真菌Gilmaniella sp. AL12中提取出胞外甘露聚糖,将其加入到苍术中,显示部分甘露聚糖被降解为甘露糖,并被己糖激酶活化,促进了光合作用、能量代谢及萜类化合物的生成。Jie等[65]研究发现内生真菌Gilmaniella sp. AL12能诱导白术中的乙烯生成,并且刺激H2O2和一氧化氮(NO)的信号通路转导,从而刺激白术中倍半萜类化合物的合成。Ren等[66]先用JA抑制剂布洛芬(IBU)和去甲二氢愈创木酸处理白术,抑制了白术中JA和挥发油的产生,随后将内生真菌孔球孢霉Gilmaniella sp.AL12接种于白术中,经检测发现白术中JA含量增加,同时增加了白术中的挥发油含量。上述研究结果说明内生真菌能通过各种真菌诱导子刺激植物产生次级代谢产物,增加其积累。
3.2 内生真菌产生与其宿主相同或相似的代谢产物内生真菌不仅能刺激植物产生次级代谢产物积累,由于与宿主共同进化还可能会产生与其宿主相同或相似的代谢产物。其原因是植物代谢过程中某些关键酶的基因垂直传递给内生真菌,导致真菌产生与植物相同或类似的代谢产物[67]。Strobel等[68]从西藏红豆杉中分离出1株拟盘多毛孢属真菌Pestalotiopsis microspora,从该菌的提取物中分离出一种与紫杉醇类似的化合物,通过进一步的LC-MS和核磁共振(NMR)分析,并与对照品紫杉醇比对,证实该化合物为紫杉醇。张春燕[69]从构树[Broussonetia papyrifera(L.)Vent]中分离出48株内生真菌,其中两株真菌Chaetomium globousm和Alternaria sp产生与构树相似的生物碱类化合物。厉秀秀等[70]从黄连中分离得到12株内生真菌,其中1株拟茎点霉属内生真菌Phomopsis HL-BC,经HPLC检测,该内生真菌的发酵液中含有小檗碱。袁丽红等[71]从盾叶薯蓣根状茎中分离出1株盘针孢菌属内生真菌Libertella sp.RE0105,发现其能产生与盾叶薯蓣相同的代谢产物——薯蓣皂苷元。上述研究表明,内生真菌能产生与宿主植物相同或类似的次级代谢产物,可从内生真菌中获得与植物相同或类似的代谢产物,具有不受植物资源限制的优势。
4 结论与展望药用植物中的内生真菌种类众多,资源丰富,是一类尚未充分利用并且应用前景广阔的微生物。内生真菌可以促进植物生长,协助其宿主植物对抗恶劣环境胁迫,产生与宿主植物相类似的次级代谢产物及诱导植物次级代谢产物积累。因此对内生真菌进行全面深入的研究有助于植物的开发与保护,并且产生具有良好生物活性的成分。在现阶段研究中,关于植物通过什么路径将其代谢过程中的关键酶基因传递给内生真菌有待进一步研究。一些珍贵稀少的植物还未展开内生真菌的研究。目前对于内生真菌的研究还处于实验室中,尚未进行大规模的工业生产。因此对于药用植物中内生真菌的研究还有待进一步深化,应该利用现代生物技术进行更深层次的机制研究,阐明内生真菌与宿主植物之间的关系,有利于保护珍稀、濒危的药用植物,大规模分离内生真菌,寻找新颖的活性先导化合物,为新药研发奠定基础。
| [1] |
HARTLAY S E, GANGE A C. Impacts of plant symbiotic fungi on insect herbivores: mutualism in a multitrophic context[J]. Annual Review of Entomology, 2009, 54(1): 323-342. DOI:10.1146/annurev.ento.54.110807.090614 |
| [2] |
GARY S. The emergence of endophytic microbes and their biological promise[J]. Journal of Fungi (Basel), 2018, 4(2): 57-76. DOI:10.3390/jof4020057 |
| [3] |
邢晓科. 药用植物内生真菌资源——一个亟待开发的宝库[J]. 菌物学报, 2018, 37(1): 14-21. XIN X K. Endophytic fungal resource of medicine plants-a treasure need to be developed urgently[J]. Mycosystema, 2018, 37(1): 14-21. |
| [4] |
CHEN F. What is the basis of variation in stress tolerance in plants?[J]. Chinese Science Bulletin, 2017, 62(28-29): 3295-3301. DOI:10.1360/N972017-00563 |
| [5] |
HARDOIM P R, VAN OVERBEEK L S, BERG G, et al. The hidden world within plants: ecological and evolutionary considerations for defining functioning of microbial endophytes[J]. Microbiology & Molecular Biology Reviews, 2015, 79(3): 293-320. |
| [6] |
ARNOLD A E, HENK D A, EELL R L, et al. Diversity and phylogenetic affinities of foliar fungal endophytes in loblolly pine inferred by culturing and environmental PCR[J]. Mycologia, 2007, 99(2): 185-206. DOI:10.1080/15572536.2007.11832578 |
| [7] |
RYU H, CHO Y G. Plant hormones in salt stress tolerance[J]. Journal of Plant Biology, 2015, 58(3): 147-155. DOI:10.1007/s12374-015-0103-z |
| [8] |
ZHANG H W, SONG Y C, TAN R X. Biology and chemistry of endophytes[J]. Natural Product Reports, 2006, 23(5): 753-771. DOI:10.1039/b609472b |
| [9] |
GILL S S, RITU G, TRIVEDI D K, et al. Piriformospora indica: potential and significance in plant stress tolerance[J]. Frontiers in Microbiology, 2016, 7(906): 332-352. |
| [10] |
郭龙妹, 高林怡, 孙文静, 等. 药用植物内生真菌研究进展[J]. 安徽农业科学, 2019, 47(9): 11-13, 18. GUO L M, GAO L Y, SUN W J, et al. Research progress of endophytic fungi of medicinal plants[J]. Journal of Anhui Agricultural Sciences, 2019, 47(9): 11-13, 18. |
| [11] |
靳锦, 赵庆, 张晓梅, 等. 植物内生菌活性代谢产物最新研究进展[J]. 微生物学杂志, 2018, 38(3): 109-119. JIN J, ZHAO Q, ZHANG X M, et al. Research progress on bioactive products from endophytes[J]. Journal of Microbiology, 2018, 38(3): 109-119. |
| [12] |
车永梅, 赵方贵, 陈同金, 等. AM真菌、木霉和PGPR组合的促生效应研究[J]. 青岛农业大学学报: 自然科学版, 2019, 36(2): 95-102. CHE Y M, ZHAO F G, CHEN T J, et al. Study on growth promoting effects of Co-inoculation with different AM fungi, Trichoderma harzianum sp. and growth-promoting rhizobacteria[J]. Journal of Qingdao Agricultural University(Ziran Kexueban), 2019, 36(2): 95-102. |
| [13] |
BARAZANI O, DAHL C C V, BALDWIN I T. Sebacina vermifera promotes the growth and fitness of nicotiana attenuata by inhibiting ethylene signaling[J]. Plant Physiology, 2007, 144(2): 1223-1232. DOI:10.1104/pp.107.097543 |
| [14] |
TEALE W D, PAPONOV I A, PALME K. Auxin in action: signalling, transport and the control of plant growth and development[J]. Nature Reviews Molecular Cell Biology, 2006, 7(11): 847-859. DOI:10.1038/nrm2020 |
| [15] |
王家利, 刘冬成, 郭小丽, 等. 生长素合成途径的研究进展[J]. 植物学报, 2012, 47(3): 292-301. WANG J L, LIU D C, GUO X L, et al. Research advances in auxin biosynthesis[J]. Bulletin of Botany, 2012, 47(3): 292-301. |
| [16] |
ZHAO Y D. Auxin biosynthesis: a simple two-step pathway converts tryptophan to indole-3-acetic acid in plants[J]. Molecular Plant, 2012, 5(2): 334-338. DOI:10.1093/mp/ssr104 |
| [17] |
DI D W, ZHANG C, LUO P, et al. The biosynthesis of auxin: how many paths truly lead to IAA?[J]. Plant Growth Regulation, 2016, 78(3): 275-285. DOI:10.1007/s10725-015-0103-5 |
| [18] |
CHUTIMA R, LUMYONG S. Production of indole-3-acetic acid by thai native orchid-associated fungi[J]. Symbiosis, 2012, 56(1): 35-44. DOI:10.1007/s13199-012-0158-2 |
| [19] |
KULKARNI G B, SANJEEVKUMAR S, KIRANKUMAR B, et al. Indole-3-Acetic acid biosynthesis in fusarium delphinoides strain GPK, a causal agent of wilt in chickpea[J]. Applied Biochemistry & Biotechnology, 2013, 169(4): 1292-1305. DOI:10.1007/s12010-012-0037-6 |
| [20] |
KUMLA J, SUWANNARACH N, MATSUI K, et al. Biosynthetic pathway of indole-3-acetic acid in ectomycorrhizal fungi collected from northern Thailand[J]. PLoS One, 2020, 15(1): e0227478. DOI:10.1371/journal.pone.0227478 |
| [21] |
REINEKE G, HEINZE B, SCHIRAWSKI J, et al. Indole-3-acetic acid (IAA) biosynthesis in the smut fungus Ustilago maydis and its relevance for increased IAA levels in infected tissue and host tumour formation[J]. Molecular Plant Pathology, 2008, 9(3): 339-355. DOI:10.1111/j.1364-3703.2008.00470.x |
| [22] |
KHAN A L, AL-HARRASI A, AL-RAWAHI A, et al. Endophytic fungi from frankincense tree improves host growth and produces extracellular enzymes and indole acetic acid[J]. PLoS One, 2016, 11(6): e0158207. DOI:10.1371/journal.pone.0158207 |
| [23] |
强晓晶. 披碱草内生真菌对小麦抗旱性的影响机制[D]. 北京: 中国农业科学院, 2019. QIANG X J. Mechanisms underlying the effects of endophytic fungi isolated from Elymus dahuricus on the drought resistance of wheat[D]. Beijing: Doctoral Dissertation of Chinese Academy of Agricultural Sciences, 2019. |
| [24] |
赵葵, 郜熙阳, 邱立友. 真菌激素研究进展[J]. 微生物学通报, 2019, 46(11): 3102-3109. ZHAO K, GAO X Y, QIU L Y. Research progress on fungal hormone[J]. Microbiology China, 2019, 46(11): 3102-3109. |
| [25] |
JU C, YOON G M, SHEMANSKY J M, et al. CTR1 phosphorylates the central regulator EIN2 to control ethylene hormone signaling from the ER membrane to the nucleus in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(47): 19486-19491. DOI:10.1073/pnas.1214848109 |
| [26] |
ZHANG F, JU Z, LONG C, et al. Heterologous expression of ACC deaminase from Trichoderma asperellum, improves the growth performance of Arabidopsis thaliana, under normal and salt stress conditions[J]. Plant Physiology & Biochemistry, 2015, 94: 41-47. |
| [27] |
ZHANG F L, LIU Z H, GULIJIMILA M, et al. Functional analysis of the 1-aminocyclopropane-1-carboxylate deaminase gene of the biocontrol fungus Trichoderma asperellum ACCC30536[J]. Canadian Journal of Plant Science, 2016, 96(2): 265-275. DOI:10.1139/cjps-2014-0265 |
| [28] |
JOLANTA J, RENATAT, ARTUR N, et al. Phytohormones (Auxin, Gibberellin) and ACC deaminase in vitro synthesized by the mycoparasitic Trichoderma DEMTkZ3A0 strain and changes in the level of auxin and plant resistance markers in wheat seedlings inoculated with this strain conidia[J]. International Journal of Molecular Sciences, 2019, 20(19): 4923-4958. DOI:10.3390/ijms20194923 |
| [29] |
GREENBERG B M, HUANG X D, GERWING P, et al. Use of a multi-process phytoremediation system for decontamination of petroleum impacted soils: results of successful field trials[A]. In: Proceeding of the 33rd AMOP Technical Seminar on Environmental Contamination and Response, Technical Seminar[C]. Environment Canada, Ottawa, 2008.
|
| [30] |
XU Z Z, JIANG Y L, JIA B R, et al. Elevated-CO2 response of stomata and its dependence on environmental factors[J]. Frontiers in Plant Science, 2016, 7: 657-662. |
| [31] |
OJUEDERIE O B, BABALOLA O O. Microbial and plant-assisted bioremediation of heavy metal polluted environments: a review[J]. International Journal of Environmental Research and Public Health, 2017, 14(12): 1504-1530. DOI:10.3390/ijerph14121504 |
| [32] |
ABBASI H, JAMIL M, HAQ A, et al. Parveen Salt stress manifestation on plants, mechanism of salt tolerance and potassium role in alleviating it: a review[J]. Zemdirbyste-Agriculture, 2016, 103(2): 229-238. DOI:10.13080/z-a.2016.103.030 |
| [33] |
WAQAS M, KHAN A L, KAMRAN M, et al. Endophytic fungi produce gibberellins and indoleacetic acid and promotes host-plant growth during stress[J]. Molecules, 2012, 17(9): 10754-10773. DOI:10.3390/molecules170910754 |
| [34] |
朱晓琴, 段明晓, 张亚, 等. 丛枝菌根真菌和水杨酸对番茄幼苗耐盐性的影响[J]. 北方园艺, 2019, 14(23): 1-5. ZHU X Q, DUAN M X, ZHANG Y, et al. Effects of arbuscular mycorrhizal fungi and salicylic acid on salt tolerance in tomato[J]. Northern Horticulture, 2019, 14(23): 1-5. |
| [35] |
曹莹. 盐胁迫下茉莉酸与内生真菌互作对野大麦的影响[D]. 兰州: 兰州大学, 2018. CAO Y. Effects of interaction between jasmonic acid and endophytic fungi on wild barley under salt stress[D]. Lanzhou: Lanzhou University, 2018. |
| [36] |
宋梅玲. 野大麦内生真菌共生体耐盐性的生理机制研究[D]. 兰州: 兰州大学, 2015. SONG M L. Mechanisms of salt tolerance improved by Epichloe endophyte in wild barley[D]. Lanzhou: Lanzhou University, 2015. |
| [37] |
XU H, LIU Q, YAO T, et al. Shedding light on integrative GA signaling[J]. Current Opinion in Plant Biology, 2014, 21: 89-95. DOI:10.1016/j.pbi.2014.06.010 |
| [38] |
PAVLISTA A D, SANTRA D K, BALTENSPERGER D D. Bioassay of winter wheat for gibberellic acid sensitivity[J]. American Journal of Plant Sciences, 2013, 4(10): 2015-2022. DOI:10.4236/ajps.2013.410252 |
| [39] |
PEARCE S, VANZETTI L S, DUBCOVSKY J. Exogenous gibberellins induce wheat spike development under short days only in the presence of vernalization1[J]. Plant Physiology, 2013, 163(3): 1433-1445. DOI:10.1104/pp.113.225854 |
| [40] |
李强, 吴建明, 梁和, 等. 高等植物赤霉素生物合成及其信号转导途径[J]. 生物技术通报, 2014, 30(10): 16-22. LI Q, WU J M, LIANG H, et al. Gibberellins biosynthesis and signaling transduction pathway in higher plant[J]. Biotechnology Bulletin, 2014, 30(10): 16-22. |
| [41] |
KHAN A L, HAMAYUN M, KANG S M, et al. Endophytic fungal association via gibberellins and indole acetic acid can improve plant growth under abiotic stress: an example of paecilomyces formosus LHL10[J]. BMC Microbiology, 2012, 12(1): 3-17. DOI:10.1186/1471-2180-12-3 |
| [42] |
COSME M, LU J, ERB M, et al. A fungal endophyte helps plants to tolerate root herbivory through changes in gibberellin and jasmonate signaling[J]. New Phytologist, 2016, 211(3): 1065-1076. DOI:10.1111/nph.13957 |
| [43] |
BILAL S, KHAN A L, SHAHZAD R, et al. Endophytic paecilomyces formosus LHL10 augments glycine max L. adaptation to Ni-contamination through affecting endogenous phytohormones and oxidative stress[J]. Frontiers in Plant Science, 2017, 8: 870-887. DOI:10.3389/fpls.2017.00870 |
| [44] |
RASKIN I. Role of salicylic acid in plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1992, 43(1): 439-463. DOI:10.1146/annurev.pp.43.060192.002255 |
| [45] |
MALAMY J, KLESSIG D F. Salicylic acid and plant disease resistance[J]. Plant Journal, 1992, 2(5): 643-654. DOI:10.1111/j.1365-313X.1992.tb00133.x |
| [46] |
马碧花, 蔺伟虎, 高敏, 等. 干旱胁迫下水杨酸和内生真菌对多年生黑麦草的影响[J]. 草业学报, 2020, 29(1): 135-144. MA B H, LIN W H, GAO M, et al. Effects of salicylic acid and Epichloe on perennial ryegrass (Lolium perenne) under drought stress[J]. Acta Prataculturae Sinica, 2020, 29(1): 135-144. |
| [47] |
MISHRA A, SINGH S P, MAHFOOZ S, et al. Endophyte-mediated modulation of defense-responsive genes and systemic resistance in Withania somnifera (L.) Dunal under Alternaria alternata stress[J]. Applied & Environmental Microbiology, 2018, 84(8): e02845. |
| [48] |
PAPPAS M L, LIAPOURA M, PAPANTONIOU D, et al. The beneficial endophytic fungus Fusarium solani strain k alters tomato responses against spider mites to the benefit of the plant[J]. Frontiers in Plant Science, 2018, 9: 1603-1621. DOI:10.3389/fpls.2018.01603 |
| [49] |
ASADA K, FOYER C H, MULLINEAUX P M. Production and action of active oxygen species in photosynthetic tissues[J]. Pure and Applied Chemistry, 1994, 79(12): 2217-2227. |
| [50] |
APEL K, HIRT H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction[J]. Annual Review of Plant Biology, 2004, 55(10): 373-399. |
| [51] |
FOYER C H, NOCTOR G. Ascorbate and glutathione: the heart of the redox hub[J]. Plant Physiology, 2011, 155(1): 2-18. DOI:10.1104/pp.110.167569 |
| [52] |
张诗婉. 植物内生真菌高Y1-1对镉胁迫下水稻幼苗生长缓解作用的研究[D]. 沈阳: 沈阳师范大学, 2016. ZHANG S W. Study of plant endophytic fungi GY 1-1 in rice resistance under Cd stress[D]. Shengyang: Shenyang Normal University, 2016. |
| [53] |
胡桂馨, 王代军, 刘荣堂. 干旱胁迫下内生真菌对高羊茅保护酶活性的影响[J]. 草原与草坪, 2001, 32(1): 28-31. HU G X, WANG D J, LIU R T. The effect of endophyte on activities of protective enzyme of tall fescue under ought stress[J]. Grassland and Turf, 2001, 32(1): 28-31. |
| [54] |
张永雯. 内生真菌对野大麦种带真菌及其盐胁迫条件下抗病性的影响[D]. 兰州: 兰州大学, 2019. ZHANG Y W. Effects of Epichloe endophyte on seed associated fungi and disease resistance of wild barley under salt stress condition[D]. Lanzhou: Lanzhou University, 2019. |
| [55] |
THWE A, ARASU M V, LI X, et al. Effect of different Agrobacterium rhizogenes strains on hairy root induction and phenylpropanoid biosynthesis in tartary buckwheat (Fagopyrum tataricum Gaertn)[J]. Frontiers in Microbiology, 2016, 7: 657. |
| [56] |
张金家, 谈荣慧. 诱导子对丹参毛状根丹酚酸类化合物积累的影响[J]. 上海中医药大学学报, 2017, 31(5): 91-94. ZHANG J J, TAN R H. Effects of elicitors on the accumulation of salvianolic acids in hairy roots of Salvia miltiorrhiza[J]. Academic Journal of Shanghai University of Traditional Chinese Medicine, 2017, 31(5): 91-94. |
| [57] |
陈美兰, 杨立, 李琴, 等. 龙脑樟中内生真菌bn12分子鉴定及挥发性代谢产物分析[J]. 中国中药杂志, 2011, 36(23): 3217-3221. CHEN M L, YANG L, LI Q, et al. Volatile metabolites analysis and molecular identification of endophytic fungi bn12 from Cinnamomum camphora[J]. China Journal of Chinese Materia Medica, 2011, 36(23): 3217-3221. |
| [58] |
TOGHUEO R M K, BOYOM F F. Endophytic fungi from Terminalia species: a comprehensive review[J]. Journal of Fungi (Basel), 2020, 5(2): 43-65. |
| [59] |
GONG A, ZHOU T, XIAO C, et al. Association between dipsacus saponin Ⅵ level and diversity of endophytic fungi in roots of Dipsacus asperoides[J]. World Journal of Microbiology and Biotechnology, 2019, 35(3): 42-56. DOI:10.1007/s11274-019-2616-y |
| [60] |
陈刚, 周谦, 王旻, 等. 产紫杉醇植物内生真菌的研究进展[J]. 中国野生植物资源, 2015, 34(4): 24-29. CHEN G, ZHOU Q, WANG M, et al. Advances on endophytic fungi producing taxol[J]. Chinese Wild Plant Resources, 2015, 34(4): 24-29. |
| [61] |
高敏. 产马钱苷山茱萸内生真菌的分离鉴定及其培养条件的研究[D]. 西安: 陕西师范大学, 2019. GAO M. Isolation, identification and culture conditions of endophytic fungi from Cornus officinalis[D]. Xi'an: Shaanxi Normal University, 2019. |
| [62] |
LI P, MAO Z, LOU J, et al. Enhancement of diosgenin production in Dioscorea zingiberensis cell cultures by oligosaccharides from its endophytic fungus Fusarium oxysporum Dzf17[J]. Molecules, 2011, 16(12): 10631-10644. DOI:10.3390/molecules161210631 |
| [63] |
ZHONG L Y, NIU B, TANG L, et al. Effects of polysaccharide elicitors from endophytic fusarium oxysporum Fat9 on the growth, flavonoid accumulation and antioxidant property of fagopyrum tataricum sprout cultures[J]. Molecules, 2016, 21(12): 1590-1603. DOI:10.3390/molecules21121590 |
| [64] |
CHEN F, REN C G, ZHOU T, et al. A novel exopolysaccharide elicitor from endophytic fungus Gilmaniella sp. AL12 on volatile oils accumulation in atractylodes lancea[J]. Scientific Reports, 2016, 6: 34735-34746. DOI:10.1038/srep34735 |
| [65] |
JIE Y, KAI S, MENG-YAO D W, et al. The mechanism of ethylene signaling induced by endophytic fungus gilmaniella sp. AL12 mediating sesquiterpenoids biosynthesis in atractylodes lancea[J]. Frontiers in Plant Science, 2016, 7(63): 361-372. |
| [66] |
REN C G, DAI C C. Jasmonic acid is involved in the signaling pathway for fungal endophyte-induced volatile oil accumulation of Atractylodes lancea plantlets[J]. BMC Plant Biology, 2012, 12(1): 128-139. DOI:10.1186/1471-2229-12-128 |
| [67] |
杨明静. 我国药用植物内生真菌多样性研究进展[J]. 江西农业, 2017, 36(8): 118. YANG M J. Advances in research on diversity of endophytic fungi from medicinal plants[J]. Jiangxi Agriculture, 2017, 36(8): 118. |
| [68] |
STROBEL G, YANG X S, SARS J, et al. Taxol from Pestalotiopsis microspora, an endophytic fungus of Taxus wallachiana[J]. Microbiology, 1996, 142: 435-440. DOI:10.1099/13500872-142-2-435 |
| [69] |
张春燕. 构树内生真菌及其抗肿瘤次级代谢产物研究[D]. 上海: 第二军医大学, 2013. ZHANG C Y. Endophytic fungi from Broussonetia papyrifera and their anti-tumor secondary metabolites[D]. Shanghai: Second Military Medical University, 2013. |
| [70] |
厉秀秀, 方玉鹏, 赖毕, 等. 黄连产小檗碱内生真菌的分离鉴定[J]. 草地学报, 2013, 23(5): 1005-1011. LI X X, FANG Y P, LAI B, et al. Isolation and identification of berberine-producing endophytic fungus from Coptis chinensis Franch[J]. Acta Agrectir Sinica, 2013, 23(5): 1005-1011. |
| [71] |
袁丽红, 陆玉婷, 许琳, 等. 与盾叶薯蓣细胞共生培养的内生真菌分离及其生物学特性[J]. 生物加工过程, 2008, 6(6): 72-78. YUAN L H, LU Y T, XU L, et al. Acta agrectir sinicaIsolation and characterization of endophytic fungus from Dioscorea zingiberensis C.H.Wright co-cultivated with host calli[J]. Chinese Journal of Bioprocess Engineering, 2008, 6(6): 72-78. |
 2021, Vol. 40
2021, Vol. 40