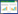文章信息
- 韩强, 柳国斌, 秦亮, 严仕梦, 黄仁燕, 徐烽, 施陈燕, 陈君灏
- HAN Qiang, LIU Guobin, QIN Liang, YAN Shimeng, HUANG Renyan, XU Feng, SHI Chenyan, CHEN Junhao
- 紫朱软膏对金黄色葡萄球菌感染糖尿病足溃疡炎症反应及NF-κB/JNK/PI3K信号表达的影响
- Effect of Zizhu Ointment on inflammatory response and NF-kB/JNK/PI3K signal expression of diabetic foot ulcer infected by staphylococcus aureus
- 天津中医药大学学报, 2021, 40(2): 226-234
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(2): 226-234
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.02.18
-
文章历史
收稿日期: 2020-11-25
2. 上海市浦东新区北蔡卫生服务中心, 上海 200000;
3. 上海健康医学院医疗器械学院, 上海 200000
2. Beicai Health Service Center, Pudong New Area, Shanghai 200000, China;
3. Medical Instrumentation College, Shanghai University of Medicine&Health Sciences, Shanghai 200000, China
有研究显示全世界目前有4.2亿的人口患有糖尿病,2040年这一数字将达到6.4亿[1]。据估计中国约有1.1亿糖尿病患者,糖尿病前期状态者约4.9亿[2],而糖尿病足溃疡是糖尿病患者严重的下肢并发症,是导致糖尿病患者截肢的重要风险因素[3]。有研究显示糖尿病足患者的死亡率远高于非糖尿病足患者[4],中国糖尿病足的治疗花费约占糖尿病治疗整体总费用的1/3[5]。糖尿病足溃疡给社会和患者造成了沉重的负担,是急需解决的重大民生问题。
糖尿病足溃疡属于慢性难愈性溃疡,愈合时间较普通溃疡长,阻碍创面愈合的因素较多。金黄色葡萄球菌是糖尿病足溃疡最为常见的感染致病菌,同时耐药菌的比例非常高[6],造成治疗难度加大。糖尿病状态造成的创面修复细胞和生长因子活性降低,持续的慢性炎症,外周血流降低和局部血管生成减少等病理改变也导致糖尿病足溃疡愈合困难[7-8]。
创面愈合的进程与炎症、细胞增殖、血管形成以及组织形成有关[9]。创面愈合受损重要原因是持续的炎症反应和细胞增殖期和重塑期的进程延迟[10]。糖尿病足溃疡愈合进程的炎症反应造成各类细胞、细胞因子的协调过程出现紊乱,细菌定植或感染进一步破坏了愈合过程[11]。有研究表明糖尿病溃疡会刺激促炎细胞因子IL-1β,IL-6和TNF-α表达[12-14]。糖尿病足细菌感染患者炎症因子CRP、TNF-ɑ、IL-6与缺血程度相关[15],此外糖尿病足溃疡愈合的炎症期向增殖期过渡也更困难,这与糖尿病患者细胞增殖受损,血管生成减少,生长因子下降有关[14, 17]。
在前期临床病例研究[16-17]中发现紫朱软膏能够有效提高糖尿病足及下肢慢性皮肤溃疡的治愈率。在本研究通过金黄色葡萄球菌感染糖尿病足溃疡大鼠模型为平台,观察糖尿病足溃疡大鼠在金黄色葡萄球菌感染下的炎症反应特点以及紫朱软膏对炎症相关途径的影响。
1 材料和方法 1.1 实验材料 1.1.1 实验动物雄性Sprague-Dawley(SD)大鼠,清洁级,体质量(180±10)g,由上海中医药大学实验动物中心提供。饲养环境:室温为(23±2)℃,相对湿度为(56±10)%,12 h无光照/12 h人工光照,自由饮食。实验程序遵循上海中医药大学实验动物中心指导原则。
1.1.2 主要试剂及药物高脂饲料成分:基础饲料73%(大麦15%,小麦31%,玉米15%,麸皮15%,鱼粉6%,豆粕、油和盐共18%),猪油20%,奶粉2%,胆固醇1%,蔗糖4%,上海中医药大学实验动物中心提供。
链脲佐菌素(STZ),Sigma公司;1.5% STZ液配制方法:柠檬酸(FW:210.14)2.1 g加入双蒸水100 mL中配成A液。柠檬酸钠(FW:294.10)2.94 g加入双蒸水100 mL中配成B液。用时将A、B液按一定1∶1比例混合,pH计测定pH=4.2~4.5,即是所需的STZ的柠檬酸缓冲液。注射时用柠檬酸缓冲液以1.5%的浓度溶解,按空腹体重注射35 mg/kg的STZ液,配制后在30 min内注射完毕。
质控菌株金黄色葡萄球菌-ATCC28923,上海市疾病预防控制中心提供;外用重组牛碱性成纤维细胞生长因子(商品名:贝复济,rb-bFGF),珠海亿胜生物制药有限公司,国药准字S10980077。
紫朱软膏主药与基质辅料的比例为1∶8,其中主药(重量计)∶朱砂、紫草、龙血竭、黄芪、黄芪、冰片。各药物比例为7∶3∶3∶6∶5∶1。辅料及配比∶泊洛沙姆、泊洛沙姆、水、丙三醇(甘油)、聚乙二醇(PEG)、聚乙二醇(PEG)1500、聚乙二醇(PEG)4000、对羟基苯甲酸乙酯。各辅料比例为34∶24∶70∶26∶9∶9∶3∶0.06。所有药物购自上海康桥中药饮片有限公司,经质量控制标准检测合格。按照配置工艺由武汉马应龙车间加工生产。
1.1.3 主要仪器烫伤仪SQL-5Q烫伤仪,上海欣软信息科技有限公司;ELISA试剂盒,BD公司;PureLink RNA Mini Kit(Thermo fisher)用于提取mRNA;SuperScript Ⅲ第一链合成系统,Life Technologies公司;SYBRGreenFastMix,Takara公司。测汞仪F-732型,上海华光仪器仪表有限公司。血糖仪,罗氏公司;微孔板扫描分光光度计MOX200R型,BioTek公司;荧光定量PCR仪,Applied Biosystems公司;电泳仪,BIO-RAD公司。转膜仪,BIO-RAD公司;微孔板扫描分光光度计MOX200R型BioTek公司;管式电炉石蜡切片机Leica公司;酶标仪Thermo公司。
1.2 糖尿病模型的建立方法本研究参考文献[18]采用高脂饲料配合STZ药物建立糖尿病,恒温恒压烫伤仪制备溃疡创面,皮下注射标准菌株建立感染的方法制备糖尿病足溃疡感染模型,即实验模型,对照模型采用非糖尿病溃疡模型与糖尿病模型为对照。具体操作方法如下。
1.2.1 糖尿病制备阶段方法:实验组模型(E、F、GZ0、GZ1、GZ2、GZ3)与糖尿病足溃疡模型(B),高脂饲料喂养8周后,禁食24 h,1.5%链脲佐菌素溶解于pH值4.5的柠檬酸-柠檬酸钠缓冲液按35 mg/kg的剂量左下腹注射,评价标准:注射24 h后血糖大于16.7 mml/L,出现多饮多尿,背毛污秽,垫料潮湿,3 d后检测血糖仍大于16.7 mml/L即判定为糖尿病,随后改为普通饲料喂养。非糖尿病溃疡模型(A)大鼠普通饲料喂养8周后,禁食24 h后,注射等量柠檬酸-柠檬酸钠缓冲液。
1.2.2 糖尿病溃疡模型制备阶段方法:糖尿病制备完成1周后,实验组模型(E、F、GZ0、GZ1、GZ2、GZ3)与对照模型(A、B),采用3%戊巴比妥钠2 mL/kg剂量腹腔注射麻醉后,使用SQL-5Q恒温恒压烫伤仪,设置温度90 ℃,接触时间10 s,压力9.8 N,选用面积4 cm2探头,麻醉后于背部下端皮肤进行烫伤。评价标准:观察到烫伤处皮肤即刻苍白,肿胀或有水泡出现。24 h后取交界区皮肤做病理切片,苏木精-伊红(HE)染色观察达到深度Ⅱ烫伤。稳定48 h后进入感染制备阶段。
1.2.3 复合感染模型制备阶段方法:实验组模型(E、F、GZ0、GZ1、GZ2、GZ3)选用微生物检测质控菌种金黄色葡萄球菌-ATCC25923进行接种,菌悬液浓度:1×108/mL。操作方法:刮取传代后菌落,PBS液10倍梯度稀释后菌悬液计数。使用分光光度计,设置OD值600,析光度为1,即为1×108/mL。每个创面皮下注射该浓度0.1 mL磷酸盐缓冲液(PBS)。评价标准:感染48 h后取创面分泌物做脓培养:使用Phoenix-100-BD,做细菌鉴定及药敏,检测出不耐药细菌或机会感染菌即为造模成功。24 h后沿着烫伤边缘清除皮肤开放创面,各组按照方案进行药物干预。
1.2.4 动物分组48只SD大鼠按照随机数字表法分为对照模型:非糖尿病溃疡组(A)采用生理盐水每日换药;糖尿病组(B)作为糖尿病空白对照无处理。实验模型根据药物干预分为:实验模型空白对照组(F)采用生理盐水每日换药,西药组(E)采用贝复济(重组牛碱性成纤维细胞生长因子、rb-bFGF)800IU每日换药。中药组GZ0、GZ1、GZ2、GZ3分别采用基质(含0.312 5 g基质的纱布),低(1/2倍),中(正常剂量),高剂量(2倍)紫朱软膏纱布每日换药。(正常剂量每片0.312 5 g紫朱软膏,高低剂量分别配置药物浓度加倍/减倍的药物。药物纱布制作方法:20 g药膏制作4张药物纱布,每张剪成16片,每次1片换药)。干预观察14 d后麻醉处死取材。
1.3 检测方法免疫组化:在用戊巴比妥钠使大鼠安乐死后收获创面组织。然后将创面组织在4%甲醛缓冲溶液中固定2 h。然后样品在一系列增加的乙醇浓度下进行标准脱水过程24 h。然后,将组织包埋在石蜡中,并使用组织学切片机切片。将8 μm厚的组织切片安装在载玻片上,并在加热板上干燥过夜。然后将载玻片在去离子水中洗涤,然后在PBS中洗涤。进行热诱导的抗原修复,将载玻片置于Citrate 6缓冲液(Sigma)中,94 ℃下20 min。然后将载玻片在PBS中洗涤并在室温下在0.2%Triton-X-100的PBS溶液中透化10 min。然后将样品在PBS中的5%山羊血清(微孔)中在室温下封闭1 h。将一抗和二抗在封闭溶液中稀释。将初级抗体CD34+或VEGF中的温育在4 ℃下孵育过夜,并在二抗(1∶200)中在室温下孵育1 h。然后根据制造商的说明在ABC试剂盒(Vectorlabs)和DAB(Vectorlab)溶液中进行样品。
酶联免疫吸附法(ELISA):根据制造商的说明书,使用市售的ELISA试剂盒(R & D Systems,Minneapolis,MN,USA)测定伤口中炎性细胞因子(包括IL-6,CRP和NO)的浓度。从标准曲线计算蛋白质浓度。将这些值标准化为由Pierce BCA测定法测定的总蛋白质含量。
蛋白质印迹法(Western blot):在RIPA缓冲液(Sigma)中裂解伤口组织的总蛋白,包括完整/磷酸酶终止混合物(Millipore)。使用Pierce BCA测定法(Thermo)测量蛋白质浓度。然后通过6%~10% SDS-PAGE分离裂解物(每泳道20 μg)并转移到硝酸纤维素膜上。将转移的膜与封闭溶液[5%牛奶(BD)在TBST中在室温下孵育1 h,然后与第一抗体在4 ℃下孵育过夜]。将膜与HRP-缀合的二抗(Millipore)在室温下孵育1 h。用ECL试剂盒(Millipore)检测免疫反应性。使用ImageJ(NIH)分析免疫反应性条带的光密度。
RNA分离和real-time PCR:根据制造商的说明书,使用PureLink RNA Mini Kit(Thermo fisher)从创面组织中分离总RNA。使用Life Technologies的SuperScript Ⅲ Ⅲ-Strand Synthesis System合成第一链cDNA。使用SYBR Green作为实时PCR进行指标,采用ABI StepOne Plus实时PCR系统。PCR在95 ℃下进行40个循环15 s,在60 ℃下进行1 min。在反应过程中读取荧光,允许连续监测PCR产物的量。使用Gapdh mRNA作为内部对照标准化数据。引物如下:VEGF,正向5'-CTGCTGCAATGATGAA- GCCC-3,反向5'-TCCCGAAACCCTGAGGGAG-3';E-钙粘蛋白,正向5'-CGAAGGCCTAAGCACAAC- AGC-3',反向5'-CGGTGTACACAGCATTCCACG-3;GAPDH,正向5'-TGCTGAGTATGTCGTGGAGT-3',反向5-GTCTTCTGAGTGGCAGTGAT-3'。
汞(Hg)冷原子吸收法:汞蒸气对波长253.7 nm的紫外光具有强烈的吸收作用,试样经适当处理后,将各种形态的汞转变成汞离子,用氯化亚锡将汞离子还原成元素汞,再用测汞仪进行测定,汞浓度与吸收值成正比。操作方法:1)样品处理:准确称取处理好样本置于石英舟中(上盖一小块滤纸),将石英舟放入管式电炉的石英管里,石英管的一端与氧气瓶连接,另一端与盛有20 mL吸收液的吸收管连接。将炉温控制在(750±50)℃通氧气(流速2 L/min),分段燃烧3 min,样品中的汞富集于吸收液中,备作测定。2)测定:准确吸取一定体积吸收液(燃烧后的)于汞反应瓶中,加入2 mL 30%氯化亚锡溶液后立即塞紧瓶塞,开动循环泵,读取最大吸收值。
1.4 统计分析实验数据符合正态分布的计量资料的采用均数±标准差(x±s)表示,不符合正态分布的计量资料用中位数表示,利用非参数Mann Whitney U检验两组差异;两组计量资料如服从正态分布且方差齐的用One Way ANOVA单因素方差分析,同组内比较用t-test,组间比较用Student’s t检验,方差不齐的校正后再行方差分析;不服从正态分布的采用Nonparametric tests,P < 0.05的结果被认为是统计学意义,使用GraphPad Prism8.0分析和绘制结果。
2 结果 2.1 紫朱软膏的HgS安全性及金葡菌感染糖尿病足溃疡大鼠炎症因子表达结果为确定金葡菌感染性糖尿病足溃疡大鼠模型与普通溃疡的炎症因子水平以及紫朱软膏是否能够改善实验模型的炎症因子,使用用生理盐水(F)和西药贝复济(E)作为紫朱软膏各组的对照。在治疗期的两周期间,定期采集静脉眼眶血进行血液汞(Hg)含量的测定,观察结束后,获取血清、创面组织用于炎症指标测定,见图 1A。
|
| 注:** 表示P < 0.01,*** 表示P < 0.001。 图 1 大鼠Hg冷原子吸收法含量测定及各组炎症因子ELISA测定结果 |
由于紫朱软膏中药朱砂主要成份是纯度98%以上的HgS,既是主要的药物作用成份,也可能存在一定的药物毒性,前期我们建立了紫朱软膏Hg的检测方法[19],为此了充分评估药物安全,首先,评估采取HE染色对肝脏和肾脏的形态观察,结果显示:在肝脏和肾脏中,紫朱软膏治疗大鼠肝肾组织无异常,与对照组无差异。在实验的第3天,第10天和第14天处死后测量血液Hg含量水平。在糖尿病足溃疡大鼠中,观察到用药天数增加血液中的Hg水平增高,并且GZ3组中的Hg水平高于其他两组,GZ1在第10 d开始下降,可能与创面面积缩小,药物吸收减少有关,见图 1A。
紫朱软膏对金黄色葡萄球菌糖尿病足溃疡模型炎症因子的影响结果显示:与先前的研究[20-21]相比,金葡菌感染糖尿病足溃疡大鼠中炎症因子CRP,IL-6和促炎介质NO的表达比普通溃疡对照大鼠(A)或糖尿病大鼠(B)增加。各剂量紫朱软膏外用和西药组治疗均能降低了糖尿病大鼠的CRP,IL6和NO水平,其中中剂量的紫朱软膏下降趋势最明显,见图 1B、图 1C和图 1D。
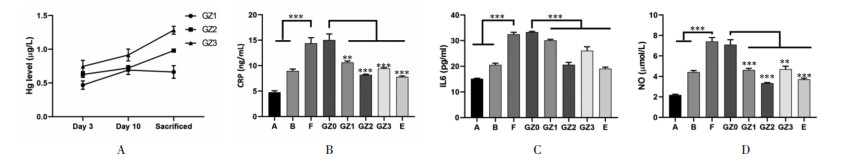
2.2 紫朱软膏对创面组织血管生成的影响血管生成在创面愈合中起重要作用,并且与血管生成因子如CD34和VEGF的表达有关[22-23]。通过免疫化学和RT-PC对CD34,VEGF和E-钙粘蛋白测量创面组织的血管生成和增殖速率。结果显示各剂量治疗的糖尿病足溃疡大鼠均存在增加的趋势,中等剂量(正常剂量)的紫朱软膏治疗可明显增加金葡菌感染糖尿病足溃疡大鼠的CD34和VEGF表达,见图 2A、图 2B。这与前期的药物前研究工作对紫朱软膏的药物筛选优化的结果一致[24-25]。
|
| 注:** 表示P < 0.01,*** 表示P < 0.001。 图 2 各组血管生成因子的免疫组化结果(×100) |
通过RT-PCR测量了VEGF和E-钙粘着蛋白基因的表达。与普通溃疡对照大鼠(A)或糖尿病大鼠(B)相比,糖尿病足溃疡大鼠(D)创面组织中VEGF和E-钙黏蛋白基因的表达降低,而通过紫朱软膏能够促进VEGF和E-钙粘蛋白的表达上调,见图 2C、图 2D。
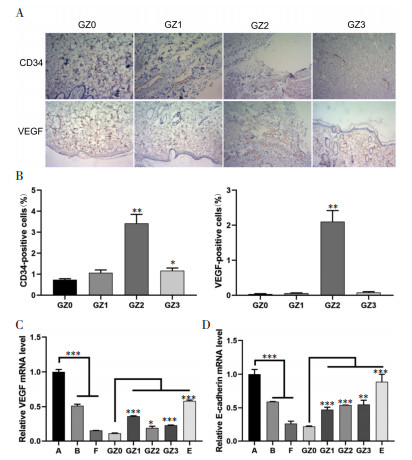
2.3 紫朱软膏对炎症相关通路NF-κB、JNK、PI3K的影响有研究报道显示,糖尿病足溃疡愈合过程中炎症反应较高,也是延迟创面愈合的重要原因[23, 26-27]。本研究通过对经典炎症相关通路NF-κB、JNK、PI3K的检测,研究紫朱软膏能够调节糖尿病足溃疡炎症相关通路的作用。研究结果显示糖尿病足溃疡(F)大鼠较糖尿病模型大鼠(B)或普通溃疡模型大鼠(A)中NF-κB、JNK、PI3K信号表达增加。同时通过中药各组与F组的比较,显示紫朱软膏能显著抑制金葡菌感染糖尿病足溃疡创面组织中NF-κB、JNK、PI3K信号通路的表达,从而降低创面炎症反应强度,促进创面愈合,而紫朱软膏基质(Z0)对炎症相关信号因子无明显作用,见图 3A、图 3B。
|
| 注:** 表示P < 0.01,*** 表示P < 0.001。 图 3 各组NF-κB、JNK、PI3K信号表达的影响结果 |
糖尿病足溃疡极易继发细菌感染,感染对溃疡的愈合具有明显的延迟作用。溃疡久治不愈的糖尿病足溃疡截肢率超过15%[28-29]。中医药对治疗糖尿病足溃疡具有具有鲜明的特色和良好的疗效。治疗疮疡的中药制剂具有良好的抗菌抑菌作用及良好的抗耐药性,能够显著促进糖尿病溃疡愈合[30-32]。研究显示,中药具有包括促进创面愈合[33],调节免疫力[34],抗氧化[35]以及抗炎[36]的作用。其中中药复方与单独的草药相比,复方表现出更高的治疗效率、协同增加的效力和更低的毒性[37-38]。
中医在长期的对抗糖尿病足的斗争中总结出了许多理论,如温阳活血法、煨脓长肉法、祛腐生肌法,提脓祛腐法、益气活血法等。根据糖尿病足病情分期及证型分类选用合适的中医药疗法,均能取得满意的效果。中医除了独特的治疗理论还有大量的特色药物,中国的各地区医疗机构都有各自治疗各类溃疡的院内“独门秘方”,如各类生肌膏、愈合膏等。这类验方制剂通常疗效显著,经过长期的临床使用具有良好的口碑和良好的新药开发前景。紫朱软膏是柳国斌教授临床总结出的治疗糖尿病溃疡的经验方。“煨脓长肉”是紫朱软膏治疗糖尿病足溃疡的指导理论,临床结合中医外治法使用,以达到祛腐生肌,煨脓长肉,促进创面愈合的目的。
中医外科“煨脓长肉”是治疗疮疡特色疗法。“煨脓长肉”首见于申斗桓的《外科啓玄》记载:“大凡疮毒已平,脓水来少,开烂已定,或少有疼痒,肌肉末生,若不贴其膏药,赤肉无其遮护,风冷难以抵挡,故将太乙膏等贴之则煨脓长肉,风邪不能侵,内当补托里,使其气血和畅,精神复旧,至此强壮诸疮,岂能致于败坏乎?”[39]《外科全生集》指出:“毒之化必由脓,脓之来必由气血。”“煨脓长肉”是指在疮疡腐去肌生、肌平皮长阶段,运用中草药膏剂或散剂外敷,使药物经过皮肤和创面对药物的吸收作用,促进局部气血通达,增强抗病防御能力,疮面脓液渗出增多,疮面能够湿润保持,达到促进疮面生长愈合,减少瘢痕的一种中医外科独特的外治方法[40]。唐汉钧教授提出“脓”随着疮面愈合其性质也随之改变,在初期,脓多色浊,稀薄,臭秽,这是因皮肉热胜肉腐蒸酿而成的脓,或染外邪浸淫所致,属于脓毒,应尽快排出,加速腐肉脱落,加强引流,宜“提脓祛腐”为先截断扭转病势。创面中后期,腐肉已尽,此时的脓呈现色淡黄泽明净、质黏稠、有拉丝感、味淡腥不臭秽的形状,此阶段的“脓”与创面早期“脓腐”是不同的,此时的脓是疮面气血旺盛的正常代谢产物,治疗宜“煨脓”为先,为创面的愈合提供了良好的湿润环境,疮面经这种脓液煨养,既促进创面肉芽组织生长又有助于创面上皮化,是创面愈合不可缺少的物质基础,能够加速创面愈合,有利于瘢痕修复。故有“无脓不生肌”之说[41]。
创面愈合是一个复杂的生物生理过程,包括炎症期、增殖期和修复期3个阶段,涉及细胞增殖,血管生成,炎症,伤面闭合和重塑[42]。同时创面愈合也是一个具有序惯性和时相性的精密调控的过程。伤面引发急性炎症反应,其中中性粒细胞,单核细胞和巨噬细胞浸润到损伤部位并产生细胞因子[43]。这类细胞去除坏死组织和细菌。此外,它们通过产生影响血管生成,纤维组织形成和细胞外基质合成来协调修复[44]。创面愈合受损是由于异常的炎症反应[45],血管生成减少[46]和成纤维细胞增殖不足[47]。在产生细胞因子以募集中性粒细胞和巨噬细胞清除创面细菌和其他污染物时,需要促炎介质的充分表达[48]。然而,这些炎症因子的持续的表达又可导致愈合进程的延迟,导致溃疡转为慢性[49]。有研究显示CRP,IL-6和NO的最佳释放可以促进伤口愈合,这些标记不仅作为参与细胞炎症的介质,而且还在调节细胞增殖,血管生成和伤口恢复中起重要作用。本研究中,在金葡菌感染的糖尿病足溃疡大鼠的CRP,IL-6和NO水平均显著增加,普通溃疡大鼠无增加。结果显示紫朱软膏的不同剂量浓度明显降低这3种标志物的浓度。
血管生成是伤口愈合过程中必不可少的过程,最有效的血管生成因子是VEGF。另一方面,CD34是一种内皮抗原,已用于衡量微血管血管密度,作为新血管生成程度的直接标记。有研究表明,糖尿病大鼠皮肤溃疡的血管生成VEGF水平下降。这与本研究的结果一致,在金葡菌感染的糖尿病足溃疡大鼠的创面组织也观察到血管生成因子VEGF和CD34的下降,通过紫朱软膏干预提高了VEGF和CD34的表达。
在创面愈合的炎症期,NF-κB信号激活和JNK磷酸化被认为起关键作用。磷脂酰肌醇3-激酶(PI3K)信号是参与细胞增殖、分化、凋亡和葡萄糖转运等糖尿病足溃疡愈合过程重要信号通路。为进一步研究紫朱软膏抑制炎症反应的机制,通过对糖尿病足溃疡创面组织NF-κB JNK磷酸化、PI3K信号因子的检测,发现紫朱软膏可显着抑制糖尿病或糖尿病感染模型中NF-κB、JNK、PI3K通路的激活。综合本研究的结果表明,紫朱软膏可通过抑制了NF-κB、JNK、PI3K信号通路介导炎症反应,降低创面的糖尿病足溃疡过度炎症反应,从而促进创面愈合。
本研究结果显示紫朱软膏可通过降低CRP、IL-1、IL-6、TNF-α等炎症因子的表达,抑制NF-κB、JNK、PI3K信号通路,增加血管生成因子CD34和VEGF刺激创面血管新生等途径改善金黄色葡萄球菌感染糖尿病足溃疡创面的炎症反应,促进糖尿病足溃疡大鼠的创面愈合。本研究为紫朱软膏是治疗糖尿病足溃疡患者提供了科学依据,提示其作为糖尿病创面愈合的新型伤口抗菌敷料具有良好的应用前景。
| [1] |
REUSCH J E B, MANSON J A E. Management of type 2 diabetes in 2017:getting to goal[J]. The Journal of the American Medical Association, 2017, 317(10): 1015-1016. DOI:10.1001/jama.2017.0241 |
| [2] |
XU Y, WANG L, HE J, et al. Prevalence and control of diabetes in Chinese adults[J]. The Journal of the American Medical Association, 2013, 310(9): 948-959. DOI:10.1001/jama.2013.168118 |
| [3] |
ANTONINO T, CARLO M, ANTONIO P. Diabetic foot syndrome: immune-inflammatory features as possible cardiovascular markers in diabetes[J]. World Journal of Orthopedics, 2015, 6(1): 62-76. DOI:10.5312/wjo.v6.i1.62 |
| [4] |
JUDE E B, OYIBO S O, CHALMERS N, et al. Peripheral arterial disease in diabetic and nondiabetic patients: a comparison of severity and outcome[J]. Diabetes Care, 2001, 24(8): 1433-1437. DOI:10.2337/diacare.24.8.1433 |
| [5] |
中华医学会糖尿病学分会, 中华医学会感染病学分会, 中华医学会组织修复与再生分会. 中国糖尿病足防治指南(2019版)(Ⅰ)[J]. 中华糖尿病杂志, 2019, 11(2): 92-107. Diabetes Branch of Chinese Medical Association, Infectious Diseases Branch of Chinese Medical Association, Tissue Repair and Regeneration Branch of Chinese Medical Association. Guidelines for prevention and treatment of diabetic foot in China (2019 edition)(Ⅰ)[J]. Chinese Journal of Diabetes, 2019, 11(2): 92-107. |
| [6] |
MALGRANGE D. Physiopathology of the diabetic foot[J]. La Revue de Médecine Interne, 2008, 29(2): 231-237. |
| [7] |
WUKICH D K, ARMSTRONG D G, ATTINGER C E, et al. Inpatient management of diabetic foot disorders: a clinical guide[J]. Diabetes Care, 2013, 36(9): 2862-2871. DOI:10.2337/dc12-2712 |
| [8] |
SHAW J E, BOULTON A J. The pathogenesis of diabetic foot problems: an overview[J]. Diabetes, 1997, 46(2): 58-61. |
| [9] |
杨雪梅, 林珊珊, 郭丽敏. 150例糖尿病足感染患者细菌分布及药敏反应特点[J]. 山东医药, 2019, 59(25): 76-78. YANG X M, LIN S S, GUO L M. Bacterial distribution and drug sensitivity in 150 patients with diabetic foot infection[J]. Shandong Medicine, 2019, 59(25): 76-78. |
| [10] |
HARDWICKE J T, HART J, BELL A, et al. The effect of dextrin-rhEGF on the healing of full-thickness, excisional wounds in the (db/db) diabetic mouse[J]. Journal of Control Release, 2011, 52(3): 411-417. |
| [11] |
GEORGE H, ROGER C. Chronic wound healing: a review of current management and treatments[J]. Advances in Therapy, 2017, 34(3): 599-610. DOI:10.1007/s12325-017-0478-y |
| [12] |
WOAN S T, PALANISAMY A, SHIOW-FERN N, et al. Improvement of diabetic wound healing by topical application of vicenin-2 hydrocolloid film on sprague dawley rats[J]. BMC Complementary and Alternative Medicine, 2019, 19(1): 20. DOI:10.1186/s12906-018-2427-y |
| [13] |
LANDEN N X, LI D Q, STAHLE M, et al. Transition from inflammation to proliferation: a critical step during wound healing[J]. Cellular and Molecular Life Sciences: CMLS, 2016, 73(20): 3861-3885. |
| [14] |
FALANGA V. Wound healing and its impairment in the diabetic foot[J]. The Lancet, 2005, 366(9498): 1736-1743. DOI:10.1016/S0140-6736(05)67700-8 |
| [15] |
CORY E D, LAURIE P S. The cytokine milieu of diabetic wounds[J]. Diabetes Manag, 2015, 5(6): 525-537. DOI:10.2217/dmt.15.44 |
| [16] |
FARSHAD Z, MARYAM S. Role of growth factors and biomaterials in wound healing[J]. Artificial Cells, Nanomedicine, and Biotechnology, 2018, 46(1): 906-911. |
| [17] |
DAVID L S. Clinical evaluation of recombinant human platelet-derived growth factor for the treatment of lower extremity diabetic ulcers[J]. Plast Reconstr Surg, 1995, 21(1): 71-81. |
| [18] |
宋蓓, 金文波, 张红瑾, 等. 糖尿病足细菌感染患者感染深度、C-反应蛋白、肿瘤坏死因子α、白介素-6及免疫蛋白水平与下肢血管病变的关系[J]. 中华医院感染学杂志, 2017, 27(3): 586-589. SONG B, JIN W B, ZHANG H J, et al. The relationship between infection depth, C-reactive protein, tumor necrosis factor alpha, interleukin-6 and immune protein levels in patients with diabetic foot bacterial infection and lower extremity vascular disease[J]. Chinese Journal of Hospital Infection, 2017, 27(3): 586-589. |
| [19] |
王丽翔, 陆姿赢, 柳国斌. 紫朱软膏外用治疗下肢慢性溃疡疗效观察[J]. 四川中医, 2016, 34(10): 81-83. WANG L X, LU Z Y, LIU G B. External application of Zizhu Ointment in the treatment of chronic ulcers of lower limbs[J]. Sichuan Traditional Chinese Medicine, 2016, 34(10): 81-83. |
| [20] |
陆姿赢, 王丽翔, 焦晶, 等. 紫朱软膏外用治疗下肢慢性皮肤溃疡72例临床疗效观察[J]. 浙江中医药大学学报, 2015, 39(4): 289-291. LU Z Y, WANG L X, JIAO J, et al. Clinical observation on 72 cases of chronic skin ulcers of lower limbs treated with Zizhu Ointment for external use[J]. Journal of Zhejiang University of Traditional Chinese Medicine, 2015, 39(4): 289-291. |
| [21] |
韩强, 李守伟, 柳国斌, 等. 金黄色葡萄球菌感染糖尿病足大鼠模型的建立及评价[J]. 天津中医药大学学报, 2014, 33(3): 146-151. HAN Q, LI S W, LIU G B, et al. Establishment and evaluation of rat model of diabetic foot infection by Staphylococcus aureus[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2014, 33(3): 146-151. |
| [22] |
李西林, 于鑫, 夏晶, 等. ICP-OES法测定紫朱软膏中总汞的含量[J]. 上海中医药杂志, 2019, 53(8): 89-91. LI X L, YU X, XIA J, et al. Determination of total mercury in Zizhu ointment by ICP-OES method[J]. Shanghai Journal of Traditional Chinese Medicine, 2019, 53(8): 89-91. |
| [23] |
YURI S, JUNKO K, MARIKO T, et al. The dietary isoflavone daidzein reduces expression of pro-inflammatory genes through PPARα/γ and JNK pathways in adipocyte and macrophage co-cultures[J]. PloS One, 2016, 11(2): e0149676. DOI:10.1371/journal.pone.0149676 |
| [24] |
TRIPATHI P, TRIPATHI P, KASHYAP L, et al. The role of nitric oxide in inflammatory reactions[J]. FEMS Immunology and Medical Microbiology, 2007, 51(3): 443-452. DOI:10.1111/j.1574-695X.2007.00329.x |
| [25] |
LI W W, TALCOTT K E, ZHAI A W, et al. The role of therapeutic angiogenesis in tissue repair and regeneration[J]. Advances in Skin & Wound Care, 2005, 18(9): 491-500. |
| [26] |
BITTO A, IRRERA N, MINUTOLI L, et al. Relaxin improves multiple markers of wound healing and ameliorates the disturbed healing pattern of genetically diabetic mice[J]. Clinical Science, 2013, 125(12): 575-585. DOI:10.1042/CS20130105 |
| [27] |
牛东霞, 李西林, 夏晶, 等. 紫朱软膏质量标准研究[J]. 中国中医药信息杂志, 2014, 21(6): 95-97. NIU D X, LI X L, XIA J, et al. Study on the quality standard of Zizhu ointment[J]. China Journal of Information on Traditional Chinese Medicine, 2014, 21(6): 95-97. DOI:10.3969/j.issn.1005-5304.2014.06.029 |
| [28] |
于鑫, 李西林, 柳国斌, 等. 正交试验法优选水溶性紫朱软膏基质[J]. 中国实验方剂学杂志, 2012, 18(15): 42-44. YU X, LI X L, LIU G B, et al. Orthogonal test method to optimize water-soluble Zizhu ointment base[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2012, 18(15): 42-44. DOI:10.3969/j.issn.1005-9903.2012.15.011 |
| [29] |
ZHU P, REN M, YANG C, et al. Involvement of RAGE, MAPK and NF-kappa B pathways in AGEs-induced MMP-9 activation in HaCaT keratinocytes[J]. Experimental Dermatology, 2012, 21(2): 123-129. DOI:10.1111/j.1600-0625.2011.01408.x |
| [30] |
WANG Y L, ROUABHIA M, ZHANG Z. Pulsed electrical stimulation benefits wound healing by activating skin fibroblasts through the TGFβ1/ERK/NF-κB axis[J]. Biochim Biophys Acta, 2016, 1860(7): 1551-1559. DOI:10.1016/j.bbagen.2016.03.023 |
| [31] |
JINGER L, YANG D, ZHANG B, et al. Analysis of risk factors and drug resistance of multidrug resistant bacteria infection in patients with diabetic foot[J]. Chinese Journal of Nosocomiology, 2017, 27(7): 1531-1534. |
| [32] |
ABOTT C A, VILEIKYTE L, WILLIAMSON S, et al. Multicenter study of the incidence of and predictive risk factors for diabetic neuropathic foot ulceration[J]. Diabetes Care, 1998, 21(7): 1071-1075. DOI:10.2337/diacare.21.7.1071 |
| [33] |
FU X, SHENG Z, CHERRY G W, et al. Epidemiological study of chronic dermal ulcers in China[J]. Wound Repair Regen, 1998, 6(1): 21-27. DOI:10.1046/j.1524-475X.1998.60105.x |
| [34] |
WU X B, LUO X Q, GU S Y, et al. The effects of Polygonum cuspidatum extract on wound healing in rats[J]. Journal of Ethnopharmacology, 2012, 141(3): 934-937. DOI:10.1016/j.jep.2012.03.040 |
| [35] |
HSIAO C Y, HUNG C Y, TSAI T H, et al. A study of the wound healing mechanism of a traditional Chinese medicine, angelica sinensis, using a proteomic approach[J]. Evidence-Based Complementary and Alternative Medicine, 2012, 2012: 1-14. |
| [36] |
LAU T W, SAHOTA D S, LAU C H, et al. An in vivo investigation on the wound-healing effect of two medicinal herbs using an animal model with foot ulcer[J]. European Surgical Research, 2008, 41(1): 15-23. DOI:10.1159/000122834 |
| [37] |
YE Y N, SO H L, LIU E S L, et al. Effect of polysaccharides from Angelica sinensis on gastric ulcer healing[J]. Life Sciences, 2003, 72(8): 925-932. DOI:10.1016/S0024-3205(02)02332-9 |
| [38] |
ZHAO K J, DONG T T X, TU P F, et al. Molecular genetic and chemical assessment of radix angelica (Danggui) in China[J]. Journal of Agricultural and Food Chemistry, 2003, 51(9): 2576-2583. DOI:10.1021/jf026178h |
| [39] |
KUANG X, YAO Y, DU J R, et al. Neuroprotective role of Z-ligustilide against forebrain ischemic injury in ICR mice[J]. Brain Research, 2006, 1102(1): 145-153. DOI:10.1016/j.brainres.2006.04.110 |
| [40] |
YANG X, ZHAO Y, WANG H, et al. Macrophage activation by an acidic polysaccharide isolated from angelica sinensis (Oliv.) diels[J]. Journal of Biochemistry & Molecular Biology, 2007, 40(5): 636. |
| [41] |
DAU Y, BUT P H, CHAN Y P, et al. Antipruritic and antiinflammatory effects of aqueous extract from Si-Wu-Tang[J]. Biological & Pharmaceutical Bulletin, 2002, 25(9): 1175-8. |
| [42] |
LIU F X, SUN S, CUI Z Z. Analysis of immunogical enhancement of immunosuppression chickens by Chinese herbal extracts[J]. Journal of ethnopharmacology, 2009, 127(2): 251-256. |
| [43] |
徐杰男, 唐汉钧. 唐汉钧教授治疗慢性下肢溃疡经验撷英[J]. 四川中医, 2014, 32(4): 7-9. XU J N, TANG H J. Professor TANG Hanjun's experience in treating chronic lower extremity ulcers[J]. Sichuan Traditional Chinese Medicine, 2014, 32(4): 7-9. |
| [44] |
徐杰男, 阙华发, 唐汉钧. 外科煨脓长肉湿润法结合中药内服治疗慢性下肢溃疡132例临床观察[J]. 上海中医药大学学报, 2010, 24(6): 47-49. XU J N, QUE H F, TANG H J. Clinical observation of 132 cases of chronic lower extremity ulcers treated by surgical simmering and growing flesh moisturizing method combined with oral administration of traditional Chinese medicine[J]. Journal of Shanghai University of Traditional Chinese Medicine, 2010, 24(6): 47-49. |
| [45] |
徐杰男, 阙华发, 唐汉钧. "祛瘀补虚煨脓长肉"外治疗法治疗下肢慢性溃疡临床研究[J]. 辽宁中医杂志, 2018, 45(9): 1882-1887. XU J N, QUE H F, TANG H J. Clinical study on the treatment of chronic ulcers of lower extremities with external therapy of "removing blood stasis and replenishing deficiency, simmering pus and growing flesh"[J]. Liaoning Journal of Traditional Chinese Medicine, 2018, 45(9): 1882-1887. |
| [46] |
LEE K K, KIM J H, CHO J J, et al. Inhibitory effects of 150 plant extracts on elastase activity, and their anti-inflammatory effects[J]. International Journal of Cosmetic Science, 1999, 21(2): 71-82. DOI:10.1046/j.1467-2494.1999.181638.x |
| [47] |
WANG Y, JIE D P, WU B H, et al. Cinnabar induces renal inflammation and fibrogenesis in rats[J]. Biomed Research International, 2015, 4(2015): 280958. |
| [48] |
TABANCA N, KIRIMER N, DEMIRCI B, et al. Composition and antimicrobial activity of the essential oils of Micromeria cristata subsp. phrygia and the enantiomeric distribution of borneol[J]. Journal of Agricultural & Food Chemistry, 2001, 49(9): 4300-4303. |
| [49] |
LAU K M, LAI K K, LIU C L, et al. Synergistic interaction between Astragali Radix and Rehmanniae Radix in a Chinese herbal formula to promote diabetic wound healing[J]. Journal of Ethnopharmacology, 2012, 141(1): 250-256. DOI:10.1016/j.jep.2012.02.025 |
 2021, Vol. 40
2021, Vol. 40