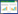文章信息
- 刘萍, 徐龙进, 霍青, 邱朝阳
- LIU Ping, XU Longjin, HUO Qing, QIU Zhaoyang
- 水木和宁方对鱼藤酮诱导的帕金森模型小鼠自噬功能的影响
- Effect of Shuimu Hening Formulation on autophagy function of rotenone-induced Parkinson's model mice
- 天津中医药大学学报, 2021, 40(2): 235-240
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(2): 235-240
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.02.19
-
文章历史
收稿日期: 2020-11-28
2. 山东省疾病预防控制中心, 济南 250014;
3. 山东中医药大学附属医院脑病科, 济南 250011;
4. 潍坊医学院, 潍坊 261000
2. Shandong Provincial Center for Disease Control and Prevention, Jinan 250014, China;
3. The Affiliated Hospital of Shandong University of Traditional Chinese Medicine, Neurosurgery Department, Jinan 250011, China;
4. Weifang Medical College, Weifang 261000, China
帕金森病(PD)是一种多发于中老年人的中枢神经系统退行性疾病,其临床症状复杂多样,病情持续进展,无法根治,致残率高,严重的影响了患者的生活质量,给家庭和社会造成了沉重的负担。高水平的α-突触核蛋白(α-syn)的异常聚集被认为是导致多巴胺(DA)能神经元变性、坏死的元凶[1]。自噬-溶酶体途径(ALP)是机体清理自身多余或者被损伤的细胞器,降解错误折叠、异常聚集蛋白质的一种途径。自噬在维持DA神经元内α-syn蛋白质稳态中发挥重要作用,自噬激活能够清除细胞内异常聚集的α-syn,减轻其细胞毒性,保护DA能神经元[2]。因此,寻找一个有效的治疗方法,改善自噬功能,促进异常聚集α-syn的降解成为防治PD的一个新突破口。
水木和宁方为导师霍青教授临床治疗帕金森病的经验方,方以滋补肝肾、活血通络、祛瘀化痰为原则,课题组前期多项临床研究表明其可有效改善PD患者的运动及非运动症状,但其潜在靶点尚不明确[3-5]。本研究采用颈背部皮下注射鱼藤酮的方法建立PD小鼠模型,从自噬途径探讨水木和宁方对α-syn及中脑黑质内酪氨酸羟化酶(TH)的影响,明确水木和宁方治疗PD的可能作用机制。
1 资料与方法 1.1 帕金森模型制备SPF级雄性C57/BL小鼠120只,8周龄,体质量20~22 g。适应3 d后,随机分为6组。除正常组外其余小鼠颈背部皮下注射鱼藤酮[1 mg/kg,二甲基亚砜(DMSO)∶鱼藤酮∶生理盐水=7∶2∶1]制作PD模型,每日1次,连续42 d,正常组注射等量的DMSO、生理盐水的混合液。参照陈忻等[6]制定的模型评价标准,采用评分2~8分的小鼠作为PD模型。
1.2 药物制备水木和宁方颗粒剂(生地黄10 g,熟地黄10 g,山茱萸6 g,黄精10 g,枸杞子10 g,牛膝10 g,当归10 g,白芍10 g,桃仁10 g等32味药,共301 g)购于山东中医药大学附属医院。将颗粒煎煮、过滤后,置60 ℃水浴箱内浓缩药液。美多芭0.25 g,每片含左旋多巴200 mg、盐酸苄丝肼50 mg,上海罗氏制药有限公司,批号:SH2070,以蒸馏水配制混悬液。
1.3 实验动物分组选取造模成功的小鼠60只,随机分为高剂量组、中剂量组、低剂量组、美多芭组、模型组,每组12只,正常组随机选取12只,共6组。高、中、低剂量组分别给予水木和宁方60 g/kg、30 g/kg、15 g/kg灌胃。美多芭组以美多芭50 mg/kg灌胃。模型组及正常组予生理盐水0.2 mL灌胃。每日两次,连续4周。
1.4 观察指标 1.4.1 行为学检测1)体质量检测:分别在造模后、药物干预后下午3点进行体质量检测。2)外观及行为学评分:观察动物造模后、药物干预后毛发、运动、拒捕行为等改变。3)步态分析:长约50 cm,宽10 cm,高15 cm的塑料走道,一端无遮盖,另一端通向用黑布遮盖的的笼子,形成一个一端光明一端黑暗的走道环境。走道底部铺上白色纸带,与走道相适应。实验前让小鼠适应爬行一段时间,然后使其脚掌蘸上墨水(前脚掌红色,后脚掌蓝色),头部正对黑暗一端,自然爬行。取最长的3个前后肢距离,计算平均值。4)游泳实验:40 cm×30 cm×20 cm的水箱中注入温水,水温为22~25 ℃,水深约15 cm,观察小鼠的游泳情况,时间为1 min,间隔30 min,检测3次。评分标准如下:1 min内连续不断游泳者3.0分;超过整个受试时间50%游泳偶尔漂浮者2.5分;漂浮时间占整个受试时间50%以上者2.0分;偶尔游泳者记1.5分;偶尔用后肢游动并漂浮者1.0分;四肢无活动者0分。
1.4.2 中脑黑质免疫组化检测TH、α-syn小鼠腹腔注射4%水合氯醛400 mg/kg,深度麻醉后剪开胸腔,头皮针插入左心经心脏依次灌入生理盐水40 mL及多聚甲醛40 mL,灌注至肢体僵硬,持续约5~6 min。完整取出脑组织,固定于4%多聚甲醛中约14 h。以视交叉前缘和乳头体后缘为鼠脑表标志,取冠状位厚约2 mm中脑组织。经脱水、透明、浸蜡,石蜡后包埋。然后用石蜡切片机作连续冠状位约5 μm厚切片。将切片滴加一抗、二抗,DAB显色液,阳性为棕黄色,显微镜镜检,拍照、分析。
1.4.3 蛋白质印迹法(Western blot)检测中脑黑质TH、α-syn、LC3、Beclin1、p62小鼠给予10%水合氯醛麻醉,断头取脑,冰盘上快速剥离,取出中脑黑质部分,放入1.5 mL EP管内,-80 ℃保存。组织裂解液提取蛋白,测定浓度后-80 ℃冰箱保存。上样前加磷酸盐缓冲溶液(PBS)及5×loading buffer配成等质量等体积的100 μL蛋白体系,水浴锅加热8 min。根据蛋白分子量配制12%的聚丙烯酰胺凝胶电泳,上样量为10 μL;转膜保持电流260 mA,根据分子量的大小转膜时间在1.5~2 h之间,大分子量时间稍长,小分子量时间稍短;PVDF膜奶粉封闭,一抗、二抗孵育,然后放入显影液显影。
1.4.4 聚合酶链式反应(PCR)检测中脑黑质TH、α-syn、LC3Ⅱ、Beclin1、p62Trizol法提取RNA,加入DEPC水使RNA溶解,测定浓度,-80 ℃冰箱内保存。5×g DNA Eraser Buffer、gDNA、Total RNA、RNase Free dH2O冰上配制反应混合液,去除基因组DNA。配制Master Mix 37 ℃ 15min 85 ℃ 5sec 4 ℃合成cDNA。配制RT-PCR反应体系,加入无酶96孔板中,每孔上样量为1 μL,每个基因重复3个孔,封膜。离心机3 000 rpm,离心3 min。使用高通量实时荧光定量PCR仪进行检测,见表 1。
实验结果采用SPSS 20.0统计软件进行分析,计量资料以均数±标准差(x±s)表示,组间对比采用单因素方差分析,均数组间比较采用LSD-t检验,P<0.05认为差异有统计学意义。
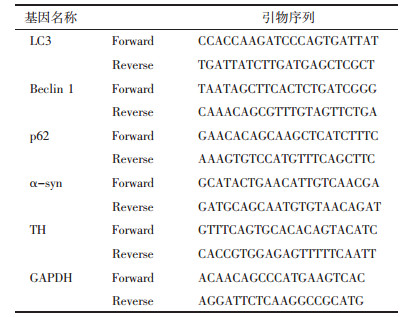
2 结果 2.1 水木和宁方对小鼠行为学的影响 2.1.1 小鼠一般状态的变化造模后小鼠表现出毛发变黄粗糙,颈背部疤痕明显,活动迟缓、拒捕反应减弱,进食减少,身体瘦弱,精神状态萎靡不振。药物干预4周后,毛发较前柔顺有光泽,活动增多,拒捕反应增强,进食增多,体质量增长。药物干预后称取各组小鼠体质量,高、中、低剂量组和美多芭组可增加小鼠体质量,与模型组相比有显著差异性(P<0.05),见表 2。
药物干预后,高、中、低剂量组及美多芭组行为学评分均有下降趋势,与模型组相比,具有统计学意义(P<0.05)。中剂量组与美多芭组无明显差异(P>0.05),表明水木和宁方对小鼠行为学的改善作用与美多芭相当,见表 2。
2.1.3 水木和宁方对小鼠步态实验的影响治疗后高、中、低剂量组和美多芭组的前后肢步长与生理盐水组无明显差异(P>0.05),说明水木和宁方对小鼠步态无明显改善,见表 2。
2.1.4 水木和宁方对小鼠游泳实验的影响治疗后,高、中、低剂量组及美多芭组的游泳评分均高于模型组,差异具有统计学意义(P<0.05);中剂量组游泳评分最高,与美多芭组相比无统计学差异(P>0.05)。说明水木和宁方有改善小鼠体力的作用,其效果与美多芭相当,见表 2。
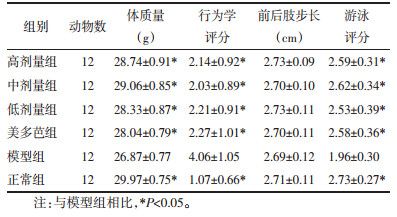
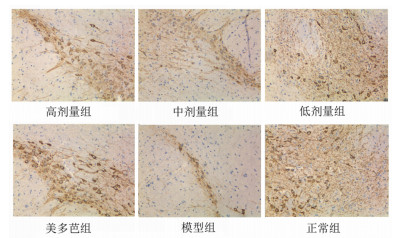
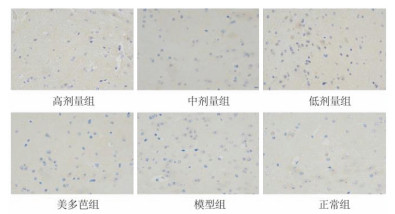
2.2 免疫组化检测各组小鼠中脑黑质TH、α-syn的表达使用IPP6.0软件对免疫组化照片进行光密度分析,每张切片选取3张400倍照片,计算其平均光密度进行比较分析。结果显示,与模型组相比,高、中、低剂量组和美多芭组小鼠黑质区TH阳性表达显著升高(P<0.05),α-syn阳性表达显著减少(P<0.05)。中剂量组α-syn表达最低,较高、低剂量组及美多芭组差异具有统计学意义(P<0.05),见图 1,图 2,表 3。
|
| 图 1 各组小鼠中脑黑质TH阳性细胞表达 |
|
| 图 2 各组小鼠中脑黑质α-syn阳性细胞表达 |
每组取5只小鼠进行Western blot实验,结果显示:与模型组相比,高、中、低剂量组及美多芭组LC3Ⅱ、Beclin1、TH蛋白表达升高(P<0.05),p62、α-syn蛋白表达降低(P<0.05),中剂量组效果最佳,与美多芭组相比,TH蛋白表达无统计学差异(P>0.05),LC3Ⅱ、Beclin1蛋白表达明显升高(P<0.05),p62、α-syn蛋白表达降低,见图 3,表 4。
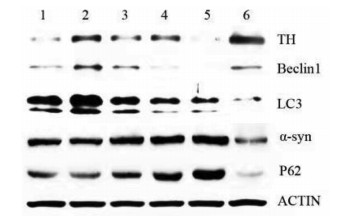
|
| 注:1.高剂量组;2.中剂量组;3.低剂量组;4.美多芭组;5.模型组;6.正常组。 图 3 各组小鼠中脑α-syn、TH、LC3、p62、Beclin1的蛋白表达 |
每组取4只小鼠进行PCR实验,研究结果显示:与模型组相比,高、中、低剂量组和美多芭组LC3ⅡmRNA、Beclin1 mRNA、TH mRNA表达升高,p62 mRNA、α-syn mRNA表达降低,差异均有统计学意义(P<0.05);中剂量组优于高、低剂量组及美多芭组(P<0.05),见表 5。
PD的主要病理表现为黑质多巴胺神经元的变性丢失,导致抑制性递质多巴胺含量减少,从而出现全身主动肌、拮抗肌同时兴奋的症状。美多芭可补充脑内DA的含量,对于PD有明确的治疗作用,但对受损的DA能神经元没有保护作用,故只能用于改善临床症状。小剂量的左旋多巴虽可有效改善帕金森症状,但不良反应发生率较高,且不能阻止病程进展。由于外源性补充左旋多巴产生脉冲样的多巴胺能刺激,且脑对多巴胺能活性的下降缺乏代偿性能力,随着美多芭治疗时间的延长,患者多会出现运动并发症反而加重病情。因此在控制临床症状的基础上,延缓病情进展,减少药物不良反应是治疗PD的关键。
异常聚集的α-syn形成的路易小体是帕金森病的主要病理特征,可引起DA能神经元变性、坏死,最终致使患者出现PD症状[8]。α-syn的降解受泛素蛋白酶复合体系统(UPS)和自噬溶酶体通路(ALP)共同调节。α-syn的过度表达可抑制Atg9定位于泡膜,使自噬体形成受阻,还可导致神经炎症的发生,影响突触囊泡的完整性及胞质DA水平,并能阻碍内质网-高尔基囊泡运输功能,进而影响自噬的发生[9]。自噬功能降低可促进α-syn的异常聚集,α-syn过度积累后又可阻碍自噬的发生,形成恶性循环,因此自噬对于维持多巴胺能神经元内α-syn的稳态发挥关键作用,自噬激活可促进沉积在细胞内的α-syn的降解,缓解其细胞毒性,保护DA能神经元,延缓PD病程[10]。
自噬作为一种重要的物质代谢方式和自我保护机制与肝主疏泄、肾气推动气化作用相似,是推动五脏运化津血为机体提供能量和运化痰瘀等病理产物这两方面功能的微观体现[11-12]。肝肾亏虚,五脏虚损,疏泄不及,动力不足,津血运行失常,痰瘀内生,这与自噬功能低下,代谢废物堆积的过程相对应。本研究所采用的水木和宁方以滋补肝肾、活血通络、祛瘀化痰为治则,中药复方具有多靶点、整体治疗的特点,结合辨证论治,可从整体调节机体阴阳平衡,改善微环境。鉴于自噬在中医中和本虚、痰瘀的关系,及水木和宁方治疗帕金森病的确切疗效,推测自噬溶酶体通路可能就是水木和宁方治疗PD的潜在靶点。方中熟地黄、山茱萸、黄精3药合用,肝、脾、肾并补,龟板、怀牛膝补益肝肾,强健腰膝,兼能活血。肉苁蓉、淫羊藿温肾助阳,鼓舞肾气,亦取“阳中求阴”之义。桃仁、红花、当归活血化瘀通络而不伤血,地龙深入隧络攻剔痼结之痰瘀,引诸药力直达络中。石菖蒲、陈皮、佛手疏肝健脾、理气化痰。知母、麦冬、白芍滋阴敛液,舒筋和脉。党参、黄芪、茯苓、白术健脾益气以补后天之本。整方虚实并调,寓通于补,以滋补肝肾、活血通络、祛瘀化痰为主,兼养阴柔筋、健脾益气。现代药理研究亦证明方中多味药不仅具有抗神经炎症、抗氧化应激、抗凋亡的作用,还可通过调节自噬和泛素蛋白酶体途径促进α-syn的降解,升高TH的表达,增加DA的含量,发挥保护神经元的作用[13-15]。
本研究显示,药物干预后,水木和宁方可提高TH蛋白及mRNA含量,中剂量组效果最佳,与美多芭疗效相当;可降低α-syn蛋白及mRNA含量,疗效优于美多芭。提示水木和宁方可缓解鱼藤酮造成的DA能神经元损害,提高TH及其mRNA的活性和表达,清除细胞中过量的α-syn,减轻α-syn对DA能神经元的毒性作用。LC3Ⅱ存在于自噬体形成的各阶段中,自噬激活初期,大量的自噬体形成,LC3Ⅱ蛋白的含量上升,当自噬体和溶酶体融合时其含量降低。p62受体蛋白在α-syn的降解中发挥重要作用[16]。Western blot及PCR结果显示,与正常组相比,模型组LC3Ⅱ、p62 mRNA及蛋白含量均增高,提示自噬过程遭到阻滞并未完成;高、中、低剂量及美多芭组LC3ⅡmRNA及蛋白含量增加,p62 mRNA及蛋白含量降低,提示自噬激活,自噬流顺利完成。其中中剂量组疗效最佳,优于美多芭组。Western blot及PCR结果显示,与正常组相比,模型组Beclin1 mRNA及蛋白表达含量降低,提示模型组自噬活性降低;高、中、低剂量组及美多芭组Beclin1 mRNA及蛋白表达含量升高,提示自噬激活。中剂量组Beclin1 mRNA及蛋白表达含量最高,提示中剂量组自噬活性最高。
综上所述,水木和宁方从PD的关键发病机制α-syn异常聚集出发,水木和宁方对PD小鼠中脑黑质区α-syn的异常聚集具有抑制作用,并认为上调自噬水平,改善自噬障碍可能是这种保护作用的关键机制,为水木和宁方治疗PD提供实验依据。由于实验条件的制约,实验未对调控自噬的具体机制进行深入研究。后续实验可深入研究水木和宁方对自噬的调控机制,进一步明确水木和宁方治疗PD的作用机制。
| [1] |
YASUDA T, NAKATA Y, MOCHIZUKI H. Alpha-synuclein and neuronal cell death[J]. Molecular Neurobiology, 2013, 47(2): 466-483. |
| [2] |
MALAGELADA C, JIN ZH, JACKSON-LEWIS V, et al. Rapamycin protects against neuron death in vitro and in vivo models of Parkinson's disease[J]. Journal of Neuroscience, 2010, 13(7): 805-811. |
| [3] |
霍青, 柳琳, 李强, 等. 水木和宁方对帕金森病非运动障碍干预作用的研究[J]. 现代中西医结合杂志, 2012, 27(3): 249-252. HUO Q, LIU L, LI Q, et al. Study on the intervention effect of Shuimu Hening Formulation on non-motor disorder in Parkinson's disease[J]. Journal of Modern Integrated Chinese and Western Medicine, 2012, 27(3): 249-252. |
| [4] |
霍青, 徐向青, 李强, 等. 水木和宁方对帕金森病患者睡眠障碍改善作用的研究[J]. 云南中医中药杂志, 2016, 37(10): 53-55. HUO Q, XU X Q, LI Q, et al. Study on the effect of Shuimu Hening Formulation on the improvement of sleep disorder in Parkinson's disease patients[J]. Yunnan Journal of Traditional Chinese Medicine, 2016, 37(10): 53-55. |
| [5] |
霍青, 柳琳, 李强, 等. 水木和宁方改善帕金森病患者生活质量的研究[J]. 环球中医药, 2016, 9(12): 1553-1555. HUO Q, LIU L, LI Q, et al. Study on improving quality of life of Parkinson's disease patients with Shuimu Hening Formulation[J]. Global Chinese medicine, 2016, 9(12): 1553-1555. DOI:10.3969/j.issn.1674-1749.2016.12.039 |
| [6] |
陈忻, 张楠, 赵晖, 等. 鱼藤酮致帕金森病大鼠行为学与黑质病理损伤的关系[J]. 中国神经精神疾病杂志, 2008, 34(4): 232-234. CHEN X, ZHANG N, ZHAO H, et al. Relationship between behavior and substantia nigra pathological lesion in rats with Parkinson's disease induced by rotenone[J]. Chinese Journal of Neuropsychiatric Disorders, 2008, 34(4): 232-234. DOI:10.3969/j.issn.1002-0152.2008.04.011 |
| [8] |
熊中奎, 胡雅儿. α-突触核蛋白的生物学功能及其在帕金森病中的作用[J]. 中国病理生理杂志, 2010, 26(9): 1855-1858. XIONG Z K, HU Y E. Biological function of alpha-synuclein and its role in Parkinson's disease[J]. Chinese Journal of Pathophysiology, 2010, 26(9): 1855-1858. DOI:10.3969/j.issn.1000-4718.2010.09.039 |
| [9] |
WINSLOW AR, RUBINSZTEIN DC. The Parkinson disease protein α-synuclein inhibits autophagy[J]. Autophagy, 2011, 7(4): 429-431. DOI:10.4161/auto.7.4.14393 |
| [10] |
MARTINI-STOICA H, XU Y, BALLABIO A, et al. The autophagy-lysosomal pathway in neurodegeneration: a TFEB perspective[J]. Trends Neurosci, 2016, 39(4): 221-234. |
| [11] |
尚奇, 任辉, 沈耿杨, 等. 基于肾阴阳理论探讨自噬在激素性骨质疏松症中的作用[J]. 中华中医药杂志, 2016, 33(8): 3300-3303. SHANG Q, REN H, SHEN G Y, et al. Study on the role of autophagy in hormone-induced osteoporosis based on the theory of kidney-yin and yang[J]. Chinese Journal of Traditional Chinese Medicine, 2016, 33(8): 3300-3303. |
| [12] |
黎颖贤, 敖海清. 从微观角度探究细胞自噬与肝主疏泄功能相关性[J]. 辽宁中医药大学学报, 2016, 23(2): 45-47. LI Y X, AO H Q. Study on the correlation between autophagy and primary liver catharsis from microscopic perspective[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2016, 23(2): 45-47. |
| [13] |
XUE Q, LIU Y, HE R, et al. Lyophilized powder of catalpol and puerarin protects neurovascular unit from stroke[J]. International Journal of Biological Sciences, 2016, 12(4): 367-380. DOI:10.7150/ijbs.14059 |
| [14] |
周龙云, 田子睿, 刘书芬, 等. 黄芪对中枢神经系统的药理作用及毒理研究现状[J]. 中草药, 2008, 49(20): 224-233. ZHOU L Y, TIAN Z R, LIU S F, et al. Research status of pharmacological action and toxicology of astragalus membranaceus on central nervous system[J]. Chinese Herbal Medicine, 2008, 49(20): 224-233. |
| [15] |
孟胜喜, 霍清萍. 地龙及其有效成分对神经系统疾病的作用[J]. 山东中医杂志, 2016, 35(10): 933-936. MENG S X, HUO Q P. Effects of Ground dragon and its active components on nervous system diseases[J]. Shandong Journal of Traditional Chinese Medicine, 2016, 35(10): 933-936. |
| [16] |
MICSENYI MC, SIKORA J, STEPHNEY G, et al. Lysosomal membrane permeability stimulates protein aggregate formation in neurons of a lysosomal disease[J]. Journal of Neuroscience, 2013, 33(26): 10815-10827. |
 2021, Vol. 40
2021, Vol. 40