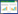1. 天津中医药大学, 天津 301617;
2. 和田地区维吾尔医医院, 和田 848000;
3. 广东药科大学, 广州 510006
收稿日期: 2020-12-22
基金项目: 新疆地产中药民族药新药研发培育项目(2017-02-09,2017-02-10);教育部创新团队发展计划资助项目(IRT_14R41)
作者简介:
胡鹏(1994-), 男, 硕士, 主要研究方向为药理学.
Study on the neuroprotective effect and mechanism of Zhitong Nujia Honey Paste extraction
1. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
2. Hetian Uygur Medical Hospital, Hetian 848000, China;
3. Guangdong Pharmaceutical University, Guangzhou 510006, China
脑卒中是一种突发性且进展迅速的脑缺血性或出血性疾病,病死率高,致残性强,复发率高[1]。目前临床治疗方法主要为静脉溶栓和机械取栓[2],组织纤溶酶原激活剂(t-PA)是目前唯一经美国食品药品监督管理局正式批准的用于治疗急性缺血性卒中的有效药物,其治疗时间窗狭窄(发病后4.5 h内),存在颈部血肿,脊髓血肿,血管性水肿和过敏反应等不良反应,其临床应用受到很大限制[3],且这些治疗方法不能有效防止缺血引起的脑组织损伤与功能障碍[4],需要寻找能够有效防治脑缺血损伤的神经保护药物。
维吾尔医学历史悠久,是中国新疆维吾尔族在长期与疾病作斗争过程中形成的、具有独特理论的医学体系,是中医学的重要组成部分。维药止痛努加蜜膏是由诃子肉、毛诃子肉、余甘子、西青果等19味中药组成的复方制剂,收载于中华人民共和国卫生部药品标准-维吾尔药分册[5]中,为棕色的蜜膏,用于临床治疗脑梗死后遗症恢复早期引起的偏瘫,疗效确切。然而,原制法制得的蜜膏具有剂量大、服用不便,以原粉入药、微生物易超标的缺点,为方便临床使用拟将其开发成止痛努加片。因此,本研究基于pMCAO模型大鼠考察止痛努加蜜膏提取物对局灶性脑缺血的预防药效学,进一步揭示不同剂量下止痛努加蜜膏提取物对缺血性脑卒中的神经保护作用及其作用机制。
1 材料
1.1 仪器
FA 2004型万分之一分析天平(上海舜宇恒平仪器有限公司);数显恒温水浴锅(金坛市科析仪器有限公司)。
1.2 药物及试剂
止痛努加蜜膏组成:诃子肉、毛诃子肉、西青果等全方药材均购置于新疆和田地区维吾尔医院,经天津中医药大学王艳副教授鉴定诃子肉、毛诃子肉、余甘子、菟丝子、陈皮、大黄、西红花、玫瑰花符合《中国药典》(2005年版一部)规定;薰衣草、阿里红、小豆蔻、牛舌草符合《中华人民共和国卫生部药品标准》(维吾尔药分册)规定;乳香符合《关于颁布儿茶等43种进口药材质量标准的通知》(国食药监注[2004]144号)规定;西青果、盒果藤(根皮)、欧亚水龙骨、铁力木、毛甘松符合《自定标准》规定;超氧化物歧化酶(SOD)试剂盒(批号:MBS268427,Mybiosource);肿瘤坏死因子-α(TNF-α)试剂盒(批号:RTA00,R&D Systems);磷酸盐缓冲溶液(PBS)溶液(0.01 mol/L,拜意尔生物公司);2838-4A型线栓直径(0.38±0.02)mm(北京西浓科技有限公司);2,3,5-氯化三苯基四氮唑(TTC,批号:080322,上海华东师范大学化工厂);硫酸庆大霉素注射液(批号:20190226,石家庄市藁城区四海药业有限公司);HEPES(批号:1002072328,SIGMA)。
1.3 动物
SPF级雄性SD大鼠,体质量(300±20)g,由北京维通利华实验动物技术有限公司提供(北京,质量合格证No. 11401500052236)。实验前将大鼠置于光照12 h、温度24~26 ℃、相对湿度为40~70%的环境中自由进食和饮水,适应性饲养一周后进行实验。
2 方法
2.1 止痛努加蜜膏提取物制备
称取阿里红、铁力木、毛甘松、小豆蔻、乳香、牛舌草、陈皮、大黄、西红花粉碎成细粉,称取诃子肉、毛诃子肉、余甘子、西青果、盒果藤根皮、欧亚水龙骨、菟丝子、薰衣草、玫瑰花置于圆底烧瓶,加入8倍量水回流提取2次,每次3 h,浓缩至0.010 8 g/mL与0.032 4 g/mL,加入上述细粉,备用。
2.2 分组
SPF级雄性SD大鼠60只,随机分为5组,分别为假手术组、模型组、止痛努加蜜膏提取物高(0.324 g/kg)、低(0.108 g/kg)剂量组、止痛努加蜜膏提取物高剂量+LY294002组。各组大鼠按所设剂量灌胃给药,连续4 d,于末次给药2 h后造模。LY294002为侧脑室注射给药,于末次灌胃给药2 h后侧脑室注射LY294002,再进行造模。
2.3 大鼠永久性脑缺血模型制作[6]
根据改良的Zea Longa线栓法,制成大鼠左侧大脑永久性中动脉梗死模型(pMCAO),禁食12 h,称质量后,按0.35 mL/100 g腹腔注射10%水合氯醛,麻醉后将大鼠放在电热恒温板(37.0±0.5)℃上仰位固定大鼠,碘酒消毒颈部,颈正中偏右切口,暴露右侧颈总动脉,分离颈外动脉和颈内动脉。在颈外动脉穿1根3.0号外科缝合线结扎颈外动脉的近心端。在颈总动脉远心端剪一“V”字形口,插入线栓18~20 mm至大脑中动脉。缝合皮肤,消毒,观察生命体征,待动物清醒后放入饲养笼中,自由进食进水。假手术组除不插入线栓外手术方法与模型组相同。
2.4 侧脑室注射LY294002
去除大鼠头部毛发,麻醉后酒精消毒,取头颅正中做纵行切口,分离颅骨上腱膜及颅骨外膜,充分暴露前囟、后囟及冠状缝。在定位仪上固定好预先装有10 μL的微量注射器。移动微量注射器的尖端到前囟后0.8 mm,中线向左旁开1.5 mm处,然后用电钻在颅骨表面钻孔,直径约为1.0 mm。微量注射器沿钻孔进针,深度3.5 mm,缓慢匀速注射LY294002,留置10 min后缓慢退出注射器。手术区域给予少许氨苄青霉素,缝合切口,30 min后进行pMCAO模型制备[7]。
2.5 神经功能障碍评分
参考Longa评分法[8],无神经功能缺损症状为0分;不能完全伸展梗死对侧前爪或后爪为1份;行走时,向手术对侧转圈为2分;行走时,向手术对侧倾倒为3分;不能自发行走,意识丧失为4分,判断大鼠神经功能缺损程度。
2.6 脑梗死体积测定
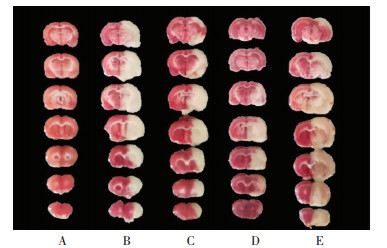
大鼠麻醉后取脑,于-20 ℃冰箱中速冻20 min左右后,作2 mm厚度的连续切片,共7片。将切片置于2%的TTC中,避光,于37 ℃电热板染色20 min,将染色的脑片按切片顺序排列,标号、设定标尺并拍照,利用Image J(版本1.42)图像处理软件计算脑梗死体积。梗死体积%=梗死体积/大脑体积×100%。
2.7 脑组织中SOD和TNF-α含量测定
造模后,麻醉大鼠,使用PBS心脏灌流,去除红细胞和血块。取脑组织,称取梗死半脑质量,于匀浆管中加入9倍量HEPES进行匀浆,制成10%组织匀浆。将组织匀浆于4 ℃,离心半径2 000 rpm/min离心15 min,取上清备用。按照SOD和TNF-α试剂盒操作说明,对脑组织匀浆中SOD和TNF-α的含量进行测定。
2.8 Western Blot法检测p-Akt、NF-κB、Nrf2的表达
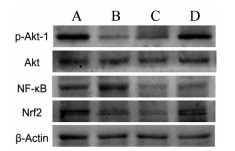
造模24 h后,每组取6只动物,切取缺血半脑组织,加入裂解液裂解细胞提取总蛋白,BCA法测定样本蛋白含量。经SDS凝胶分离蛋白后转模于PVDF膜,封闭1 h,加入对应一抗,4 ℃过夜,二抗室温避光摇床孵育1 h。曝光显影,用Image J软件分析灰度值。以p-Akt、NF-κB、Nrf2灰度值与β-actin灰度值的比值反映蛋白表达水平。
2.9 统计学方法
采用GraphPad软件进行统计学分析。实验数据均采用均数±标准差(x±s)表示,多组数据的组间比较采用单因素方差分析(one-way ANOVA)多个样本均数间的两两比较采用Tukey法,P < 0.05表示具有统计学差异。
3 实验结果
3.1 止痛努加蜜膏提取物对pMCAO大鼠神经保护作用研究
由表 1可知,假手术组大鼠神经功能评分为0,模型组神经功能损伤评分升至(3.00±0.93)分,较假手术组显著增高(P < 0.01),表明模型建立成功。与模型组比较,止痛努加蜜膏提取物高剂量组(1.50±0.58)大鼠神经功能评分显著降低(P < 0.05)。表明止痛努加蜜膏提取物能改善pMCAO大鼠神经功能损伤。与高剂量组相比,侧脑室注射LY294002后,神经功能评分显著上升(P < 0.05)。表明提取物可能通过激活PI3K-Akt通路发挥神经保护作用。
表 1 止痛努加蜜膏提取物对pMCAO大鼠神经功能的影响(x±s)
3.2 止痛努加蜜膏提取物对pMCAO大鼠脑缺血损伤的影响
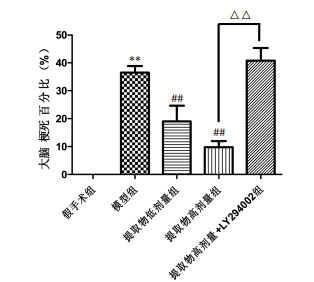
由图 2可知,与假手术组比较,模型组的脑梗死率显著增加(P < 0.01),说明造模成功;与模型组比较,止痛努加蜜膏提取物低剂量组,高剂量组的脑梗死率显著降低(P < 0.01)。表明止痛努加蜜膏提取物具有降低脑梗死率的作用,对脑缺血损伤具有保护作用,且侧脑室注射LY294002后,保护作用被逆转。表明提取物可能通过激活PI3K-Akt通路发挥对脑缺血损伤的保护作用。
3.3 止痛努加蜜膏提取物对pMCAO大鼠脑组织中NF-κB,Nrf2及p-Akt蛋白表达的影响
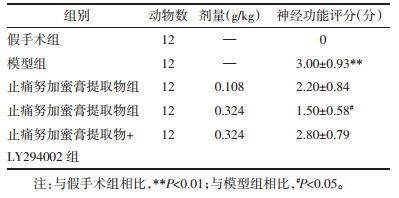
由表 2可知,各组大鼠脑组织中Akt含量未发生明显改变。与假手术组相比,模型组大鼠大脑中p-Akt和Nrf2的表达显著减少,NF-κB的表达明显增加(P < 0.01)。与模型组相比,止痛努加蜜膏提取物给药组能够增加p-Akt和Nrf2的表达,减少NF-κB的表达(P < 0.01)。表明止痛努加蜜膏提取物能够激活PI3K-Akt通路,调节NF-κB,Nrf2蛋白的表达,进而发挥抗脑缺血损伤的作用。
表 2 各组大鼠脑组织NF-κB、Nrf2及p-Akt蛋白表达水平(x±s)
3.4 止痛努加蜜膏提取物对pMCAO大鼠脑组织中SOD和TNF-α含量的影响
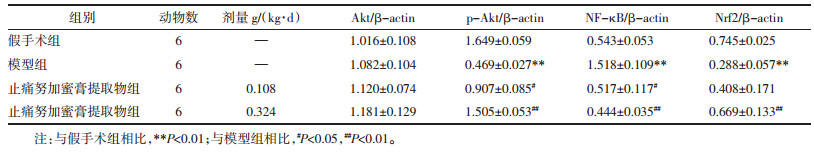
由表 3可知,与假手术组相比,模型组大鼠大脑中SOD含量显著减少(P < 0.01)。与模型组相比,止痛努加蜜膏提取物组大鼠脑组织中SOD含量显著增加(P < 0.01)。表明止痛努加蜜膏提取物可能通过增加Nrf2蛋白表达,增加脑组织中SOD含量,进而发挥抑制氧化反应的作用。与假手术组相比,模型组大鼠大脑中TNF-α含量显著增加(P < 0.01)。与模型组相比,止痛努加蜜膏提取物组大鼠脑组织中TNF-α含量显著减少(P < 0.05)。表明止痛努加蜜膏提取物可能通过减少NF-κB蛋白表达,减少TNF-α含量,最终抑制炎症反应。
表 3 各组大鼠脑组织中SOD、TNF-α水平(x±s)
4 讨论
研究表明,缺血后神经保护治疗可以显著延长静脉溶栓治疗时间窗[9],止痛努加蜜膏是防治脑缺血损伤的维药复方制剂,具有通阻养神、神经保护的作用,但目前对于其抗脑缺血损伤的实验研究较少,其作用机制尚不明确。本研究采用大鼠脑中动脉阻塞法构建永久性局部脑缺血损伤模型,观察止痛努加蜜膏提取物对脑缺血损伤的作用并探讨其可能的作用机制。实验结果显示,模型组大鼠脑梗死体积明显增大,神经功能缺损严重,止痛努加蜜膏提取物对大鼠灶脑缺血损伤具有良好的保护作用,可有效改善脑pMCAO大鼠神经功能损伤程度,减小梗死面积,降低脑组织中TNF-α含量,升高SOD活性,上调脑组织中p-Akt、Nrf2蛋白表达和下调NF-κB蛋白表达。侧脑室注射LY294002后,提取物神经保护作用被逆转。
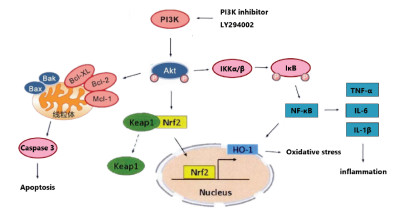
研究药物的分子机制,探寻药物作用的靶点有利于药物的使用和优化。近年来,越来越多的证据表明,缺血性脑损伤过程中常伴有氧化应激、炎症、细胞凋亡的现象[10]。PI3K/Akt信号通路是一种重要的信号介质,与细胞代谢、程序性凋亡死亡、氧化损伤、炎症等方面都有联系,是一条神经保护信号通路[11-15]。本研究发现,p-Akt在pMCAO模型大鼠脑组织中表达减少,给予止痛努加蜜膏提取物后p-Akt的蛋白表达明显升高。注射PI3K特异性抑制剂LY294002[16]后,止痛努加蜜膏提取物的神经保护作用被抑制。由此可见,止痛努加蜜膏提取物可通过激活PI3K/Akt信号通路发挥对大鼠脑缺血损伤的保护作用。
Nrf2属于转录因子亮氨酸拉链转录激活因子家族成员,是细胞防御应激损伤的关键因子[17],生理状态下,Nrf2与胞质接头蛋白Keap1结合,活性被抑制,在PI3K/Akt的调控下,Keap1的构象发生改变[18],Nrf2与Keap1解离进入细胞核,诱导Ⅱ相酶基因表达[19],通过诱导HO-1表达,构成高效的细胞内抗氧化体系,清除氧自由基[20]。SOD是机体中重要的自由基清除剂之一,脑组织中自由基含量上升时,SOD将被大量消耗,导致脑组织中SOD含量减少[21]。因此SOD含量能间接反映脑组织受自由基损害的程度。实验结果显示止痛努加蜜膏提取物可增加SOD含量和上调Nrf2蛋白表达,对局灶性脑缺血损伤有明显的抗氧化应激的保护作用。
NF-κB是一种具有多向转录调节作用的转录因子,在发生脑缺血损伤后,NF-κB被激活,从而启动相关靶基因的转录,参与炎症反应、自由基损伤和细胞凋亡等病理生理过程。Akt可直接或间接的调节IκB激酶活性,抑制NF-κB进入细胞核,进而抑制相关炎症因子的表达,同时NF-κB也可以调节HO-1活性及其生物学作用。TNF-α是体内一种重要的炎症因子,其表达水平反映组织中的炎症程度[22]。见图 4。实验结果显示,止痛努加蜜膏提取物能够降低脑组织中TNF-α含量,减少NF-κB的蛋白表达,减轻局灶性脑缺血损伤中的炎症反应,继而发挥脑保护作用。
综上所述,止痛努加蜜膏提取物能够改善pMCAO大鼠的神经功能损伤,降低脑梗死率,对脑缺血损伤具有保护作用,其机制可能是通过激活PI3K/Akt信号通路,促进Akt的磷酸化,进而调节Nrf2、NF-κB蛋白表达,发挥抗炎和抗氧化作用,最终产生对脑缺血损伤的保护作用。
 2021, Vol. 40
2021, Vol. 40