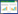文章信息
- 王冬萍, 王萌, 任晓亮
- WANG Dongping, WANG Meng, REN Xiaoliang
- 基于化学动力学的异绿原酸A在水溶液中的降解规律研究
- Study on the degradation of isochlorogenic acid A in aqueous solution based on chemical kinetics
- 天津中医药大学学报, 2021, 40(2): 247-252
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(2): 247-252
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.02.21
-
文章历史
收稿日期: 2020-12-30
2. 天津中医药大学中药学院, 天津 301617
2. Tianjin University of Traditional Chinese Medicine College of Traditional Chinese Medicine, Tianjin 301617, China
异绿原酸A,又称3,5-二咖啡酰奎宁酸,属于咖啡酰奎宁酸类。异绿原酸A不仅存在于菊科、忍冬科、豆科等药食两用植物中[1],在水果(如杏、李子)和蔬菜(胡萝卜)等食品中也大量存在[2-3]。作为功能性天然产物,异绿原酸A的研究已深入到食品、医药和保健等多个领域。绿原酸类物质为众多中药材(如金银花、茵陈蒿、杜仲)以及中成药(如复肝宁、双花注射液、粉刺口服液、银黄颗粒)的主要药效成分[4],2015版《中华人民共和国药典》规定异绿原酸A为银黄颗粒的指标性成分[5]。现代药理研究表明,异绿原酸A具有较强的抑菌、抗炎、抗氧化、降血压等作用[6-8],并能有效抑制人体免疫缺陷病毒-1(HIV-1)的复制[9]。异绿原酸A属于酚类化合物,该类物质的酯键、不饱和双键在水溶液中可能发生水解,酚羟基易发生氧化降解[10-11],但目前尚无系统的有关异绿原酸A稳定性研究的报道。因此本实验依照《人用药物技术要求国际协调理事会》(ICH)和《国家药品监督管理局》(NMPA)对药物稳定性的指导原则,采用化学反应动力学方法系统研究了异绿原酸A在多种物理、化学环境下的降解规律,预期为含有异绿原酸A的药物制剂在开发、生产、贮藏及合理应用上提供参考。
1 材料 1.1 试剂和药品异绿原酸A对照品(上海源叶生物科技有限公司,批号B21539,纯度≥98%);乙腈、甲醇[色谱纯,赛默飞世尔(中国)科技有限公司];蒸馏水(广州屈臣氏食品饮料有限公司);盐酸(分析纯,天津化学试剂一厂);甲酸(色谱纯,美国ROE SCIENTIFIC INC);氯化铁、氯化亚铁(分析纯,阿拉丁试剂上海有限公司);氢氧化钠、氯化钠(分析纯,天津市大茂化学试剂厂);3% H2O2(分析纯,河北吉捷生物科技有限公司)。
1.2 仪器Acquity H-class超高效液相色谱(美国Waters公司);SB-3200D数控超声波清洗器(宁波新芝生物科技股份有限公司);AX224ZH十万分之一天平(奥豪斯仪器有限公司);HH-2数显恒温水浴锅(常州金坛良友仪器有限公司);DELTA 320 pH仪(瑞士Mettler Toledo公司)。
2 方法与结果 2.1 超高液相色谱(UPLC)色谱条件Waters Acquity UPLC BEH C18(2.1 mm×50 mm,1.7 μm)色谱柱;流速0.2 mL/min;柱温30 ℃;检测波长212 nm;梯度洗脱0~6 min:10%~40%乙腈。
2.2 对照品及样品溶液制备精密称取异绿原酸A对照品5.12 mg,置于5 mL棕色量瓶中,用甲醇定容至刻度,摇匀,配制成质量浓度为1.024 mg/mL的对照品储备液。精密吸取上述储备液200 μL置于10 mL棕色容量瓶中,用纯水及各稳定性研究介质溶液定容至刻度,摇匀,得到浓度为20.48 μg/mL的对照品溶液和稳定性试验用样品溶液。
2.3 异绿原酸A稳定性研究 2.3.1 酸碱性对异绿原酸A稳定性的研究绿原酸和异绿原酸A分属于单咖啡酰奎尼酸和二咖啡酰奎尼酸,生物合成途径相似,常常共存在植物体内[10]。绿原酸由一分子咖啡酸和一分子奎宁酸缩合而成,分子结构中有酯键、不饱和双键及二元酚3种不稳定基团,碱性条件下酯键极不稳定,容易水解[11]。为了考察酸碱性对异绿原酸A稳定性的影响,采用氢氧化钠和盐酸溶液配制成不同pH值溶液(pH 3.0、5.0、6.2、8.0、10.0),用多点校正过的pH计测定其pH值。采用“2.2”项下样品配制方法,取异绿原酸A储备液200 μL置于10 mL棕色容量瓶中,分别采用以上不同pH水溶液定容至刻度,精密制得质量浓度为20.48 μg/mL的样品溶液,密封后置80 ℃水浴中。间隔一定时间取样,UPLC测定异绿原酸A在不同pH值中的含量变化,得到不同pH值下异绿原酸A的降解动力学曲线并计算降解速率常数k。异绿原酸A对照品及碱性样品色谱图见图 1。
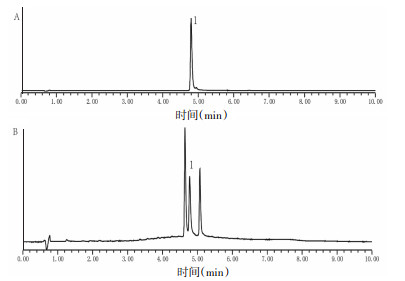
|
| 注:1. 异绿原酸A 图 1 异绿原酸A对照品(A)及碱性样品(B)UPLC色谱图 |
以Ln(Ct/C0)为纵坐标,时间为横坐标作图,得到在不同pH值条件下异绿原酸A的降解动力学曲线,见图 2。由实验结果可得异绿原酸A在不同pH值下的降解均符合一级反应过程,且在所有试验条件下的动力学曲线的相关系数均大于0.98。
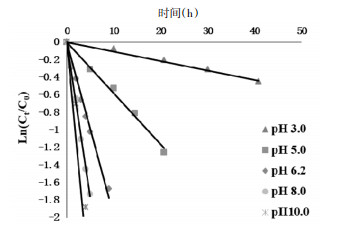
|
| 图 2 80 ℃不同pH值条件下异绿原酸A在水溶液中的降解动力学曲线 |
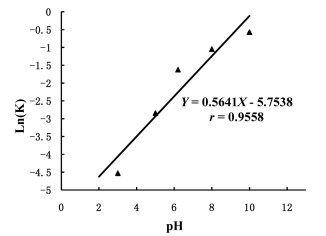
以不同pH值和其所对应的Ln(K)作图,得到pH值与异绿原酸A降解速率的关系图,见图 3。异绿原酸A在酸性条件下较稳定;在碱性条件,特别是强碱条件下易降解。在pH 3~10下,随着pH的增大,降解速率加快,pH 10和pH 3水溶液中异绿原酸A的降解速率常数分别为0.546 4、0.010 8,pH 10条件下的降解速率常数为pH 3条件下的52倍,表明异绿原酸A在碱性水溶液中的水解过程可能由氢氧根离子催化发生。
|
| 图 3 异绿原酸A降解速率与pH值的关系图 |
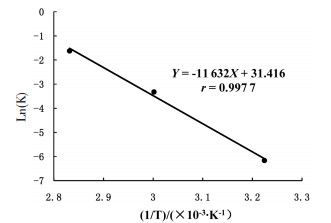
多酚绿原酸类物质由于其结构中的多个酚羟基,高温加热情况下容易分解[11]。一般来说,温度升高时大部分化学反应的速率会升高。研究证明,温度每升高10 ℃,化学反应速率会增加2~4倍[12]。为了考察温度对异绿原酸A稳定性的影响,采用“2.2”项下样品配制方法,取异绿原酸A储备液200 μL置于10 mL棕色容量瓶中,用纯水定容至刻度,精密制得质量浓度为20.48 μg/mL的样品溶液,密封后分别置于37、60、80 ℃水浴中。间隔一定时间取样,UPLC测定异绿原酸A在不同温度下的含量变化,得到异绿原酸A在不同温度下的降解动力学曲线并计算降解速率常数k。以Ln(K)为纵坐标,1/T为横坐标作图,得到温度对异绿原酸A降解速率的影响,见图 4。可得异绿原酸A随温度升高,降解速率明显加快。通过阿仑尼乌斯方程Ln(K)=LnA-Ea/RT计算异绿原酸A降解反应的活化能,式中A表示异绿原酸A水解反应的指前因子,Ea表示活化能(J/mol),R表示摩尔气体常数(8.314 J/K/mol),T表示绝对温度(K)。计算得出异绿原酸A在25 ℃,中性条件下降解速率常数k为0.000 5,降解半衰期(t1/2)为1 381.9 h,活化能(Ea)为96.71 kJ/mol。
|
| 图 4 不同温度下异绿原酸A的降解速率常数k |
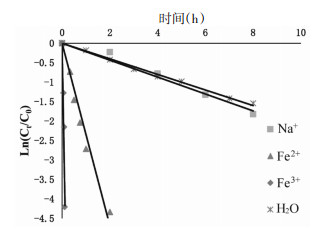
按照药典规定,绿原酸是评价金银花质量的主要标准[5]。大量研究发现当金银花保存在铁容器中时,绿原酸的含量会明显下降[13]。本研究采用不同价态的金属离子(Fe3+、Fe2+、Na+)考察其对异绿原酸A降解速率的影响。采用“2.2”项下样品配制方法,取异绿原酸A储备液200 μL置于10 mL棕色容量瓶中,分别用含有0.1 mol/L FeCl3、FeCl2、NaCl的水溶液定容至刻度,精密制得质量浓度为20.48 μg/mL的样品溶液,密封后置于80 ℃水浴中。间隔一定时间取样,UPLC测定异绿原酸A在不同价态金属离子条件下的含量变化,得到异绿原酸A在不同价态金属离子中的降解动力学曲线。结果见图 5,异绿原酸A在水溶液和加入0.1 mol/L Fe3+、Fe2+和Na+的溶液中的t1/2分别为3.458 h、0.020 h、0.295 h、3.185 h。结果证明Fe3+对异绿原酸A的降解速率影响明显,Fe2+次之,而Na+对异绿原酸A降解速率无明显影响。
|
| 图 5 异绿原酸A受不同金属离子的降解动力学曲线 |
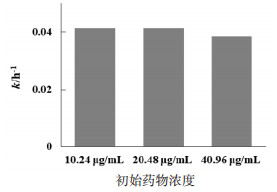
采用“2.2”项下样品配制方法,分别取异绿原酸A储备液100、200、400 μL分别置于10 mL棕色容量瓶中,用纯水定容至刻度,精密制得质量浓度分别为10.24、20.48、40.96 μg/mL的样品溶液,密封后置于60 ℃水浴中。间隔一定时间取样,UPLC测定异绿原酸A含量变化,得到异绿原酸A在不同初始浓度的降解速率常数。以降解速率常数对各样品质量浓度作图,结果见图 6。可知异绿原酸A的初始药物浓度增大,其降解速率无明显变化,说明初始药物浓度对异绿原酸A的降解速率无影响。
|
| 图 6 不同初始药物浓度下异绿原酸A的降解速率 |
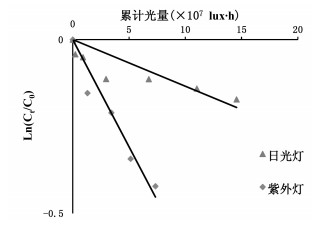
光照在中药储存、晾晒、过程中不可避免,同时也易造成药材发生氧化、分解等化学反应[14]。绿原酸类物质分子结构中含有的酯键、不饱和双键及多元酚是其光不稳定的主要原因[15-17]。采用“2.2”项下样品配制方法,取异绿原酸A储备液200 μL置于10 mL棕色容量瓶中,用纯水定容至刻度,精密制得质量浓度为20.48 μg/mL的样品溶液,密封后分别于日光灯(1.55×106 lux)、紫外灯(4.16×105 lux)及避光条件下放置。间隔一定时间取样,UPLC测定异绿原酸A在不同光照条件下的含量变化。在光源一定时,药物在光照射下的含量下降的程度与入射光的强度E和时间t的乘积Et(累计光量)有关[12]。计算异绿原酸A在两种不同光照条件下的累计光量,得到异绿原酸A累计光量与含量的关系图。从图 7可知,异绿原酸A的降解速率为紫外灯>日光灯,表明紫外光对异绿原酸A的降解速率影响更大。因此,异绿原酸A及含该成分的相关药物在杀菌过程中应避免使用紫外线杀菌,防止其发生光化学反应。
|
| 图 7 异绿原酸A在不同光照条件下累计光量与含量关系图 |
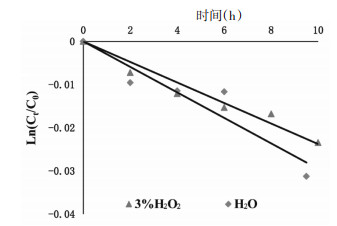
多酚类物质以其良好的抗氧化活性成为科学研究的一个热点[18]。绿原酸是重要的膳食抗氧化成分,其能够提供氢原子给自由基,抑制氧化损伤的发生。提供氢原子后,绿原酸被氧化成苯氧基自由基,苯氧基自由基进一步通过共振而达到稳态[19]。为了考察氧化对异绿原酸A稳定性的影响,采用“2.2”项下样品配制方法,用3% H2O2精密制得20.48 μg/mL的异绿原酸A水溶液,保持温度25 ℃。间隔一定时间取样,UPLC测定异绿原酸A的含量变化,得到异绿原酸A在氧化条件下的降解动力学曲线。由图 8可知,加入3% H2O2的样品溶液与水溶液相比,降解速率常数变化不明显,说明异绿原酸A的稳定性受H2O2的影响较小。
|
| 图 8 氧化条件下异绿原酸A的降解动力学曲线 |
研究表明异绿原酸A在多种物理、化学环境中均不稳定,且在各条件下的水解作用均遵循(伪)一级动力学过程。异绿原酸A的降解过程呈现明显的pH及温度依赖性,在酸性环境中异绿原酸A的稳定性较好,溶液碱性增强及温度升高均会使降解反应速度加快;而初始药物浓度及氧化对降解速率的影响不明显;金属离子Fe3+、Fe2+的引入以及紫外光均会使异绿原酸A的降解反应速率加快。异绿原酸A的活化能为96.71 kJ/mol,表明异绿原酸A在中性水溶液中的降解反应对于温度较为敏感,降解反应随着温度升高而大大加快。因此,异绿原酸A及含有该成分的相关药物应在低温条件下保存,在开发、生产及使用含有异绿原酸A药物时应使用弱酸性的条件,并控制容器及溶剂中存在的铁离子,避免与紫外光接触,防止其降解。在碱性条件下发现异绿原酸A产生两种降解产物,但目前暂无对异绿原酸A降解产物的研究。异绿原酸A属于二咖啡酰奎尼酸,为两分子咖啡酸和一分子奎宁酸结合而成的酯类化合物[10, 20]。从异绿原酸A结构组成出发,推测其两种降解产物可能为咖啡酸和奎宁酸。本实验研究了异绿原酸A在不同条件下的降解规律,具体降解产物的研究会在后续进行。本研究从化学动力学的角度,探究了异绿原酸A在不同环境中的降解规律,为异绿原酸A及含有该成分的药物制剂的合理使用提供了依据。
| [1] |
WANG S Y, CHANG H N, LIN K T, et al. Antioxidant properties and phytochemical characteristics of extracts from Lactuca indica[J]. Journal of Agricultural and Food Chemistry, 2003, 51(5): 1506-1512. DOI:10.1021/jf0259415 |
| [2] |
WU Y X, LIU B, CHANG Y L, et al. Optimization of modified supercritical CO2 extraction of chlorogenic acid from the flower buds of lonicera Japonica Thunb and determination of antioxidant activity of the extracts[J]. Journal of Liquid Chromatography & Related Technologies, 2015, 38(4): 443-450. |
| [3] |
KASAI H, FUKADA S, YAMAIZUMI Z, et al. Action of chlorogenic acid in vegetables and fruits as an inhibitor of 8-hydroxydeoxyguanosine formation in vitro and in a rat carcinogenesis model[J]. Food and Chemical Toxicology, 2000, 38(5): 467-471. DOI:10.1016/S0278-6915(00)00014-4 |
| [4] |
李玉山. 绿原酸在天然植物中的分布和提取纯化工艺研究进展[J]. 解放军药学报, 2012, 28(4): 355-359. LI Y S. Research progress on the distribution, extraction and purification of chlorogenic acid in natural plants[J]. Pharmaceutical Journal of Chinese People's Liberation Army, 2012, 28(4): 355-359. |
| [5] |
国家药典委员会. 中华人民共和国药典[S]. 北京: 中国医药科技出版社, 2020. National Pharmacopoeia Committee. Pharmacopoeia of people's Republic of China[S]. Beijing: China Medical Science Press, 2020. |
| [6] |
周志娥, 罗秋水, 熊建华, 等. 绿原酸、异绿原酸A对大肠杆菌的抑菌机制[J]. 食品科技, 2014, 39(3): 228-232. ZHOU Z E, LUO Q S, XIONG J H, et al. Antimicrobial mechanisms of 3-O-caffeoyl quinic acid and 3, 5-di-O-caffeoyl quinic acid against Escherichia coli[J]. Food Science and Technology, 2014, 39(3): 228-232. |
| [7] |
KONCSOL A, BENI Z, SIPOS M M, et al. Antioxidant activity-guided phytochemical investigation of Artemisia gmelinii Webb. ex Stechm.: isolation and spectroscopic challenges of 3, 5-O-dicaffeoyl (epi?) quinic acid and its ethyl ester[J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, 59: 83-89. DOI:10.1016/j.jpba.2011.10.012 |
| [8] |
PARK K H, PARK M, CHOI S E, et al. The anti-oxidative and anti-inflammatory effects of caffeoyl derivatives from the roots of Aconitum koreanum R. RAYMOND[J]. Biological & Pharmaceutical Bulletin, 2009, 32(12): 2029-2033. |
| [9] |
ROBINSON W E, REINECKE M G, ABDEL-MALEK S, et al. Inhibitors of HIV-1 replication that inhibit HIV inintergrase[J]. Proceedings of the National Academy of Sciences of the USA, 1996, 93(13): 6323-6331. |
| [10] |
张鞍灵, 马琼, 高锦明, 等. 绿原酸及其类似物与生物活性[J]. 中草药, 2001, 2(2): 79-82. ZHANG A L, MA Q, GAO J M, et al. Studies on bioactivities of chlorogenic acid and its analogues[J]. Chinese Traditional and Herbal Drugs, 2001, 2(2): 79-82. |
| [11] |
AREE T. Understanding structures and thermodynamics of β-cyclodextrin encapsulation of chlorogenic, caffeic and quinic acids: implications for enriching antioxidant capacity and masking bitterness in coffee[J]. Food Chemistry, 2019, 293(4): 550-560. |
| [12] |
张师愚, 夏侯林. 物理化学[M]. 北京: 中国医药科技出版社, 2014: 194. ZHANG S Y, XIA H L. Physical Chemistry[M]. Beijing: China Medical Science Press, 2014: 194. |
| [13] |
仉劲. 金银花生长发育和加工过程中的成分变化研究[D]泰安: 山东农业大学, 2014. JI J. Study on the composition changes of honeysuckle during growth, development and processing[D]. Tai'an: Shandong Agricultural University, 2014. |
| [14] |
刘翠样. 浅析中药材的贮存[J]. 世界最新医学信息文摘, 2016, 16(87): 211. LIU C X. Analysis on the storage of Chinese medicinal materials[J]. World Latest Medicine Information, 2016, 16(87): 211. DOI:10.3969/j.issn.1671-3141.2016.87.182 |
| [15] |
张英, 林峰, 饶长全, 等. 金银花中绿原酸防晒作用研究[J]. 日用化学工业, 2014, 44(8): 448-451, 459. ZHANG Y, LIN F, RAO C Q, et al. Studies on sunscreen efficacy of chlorogenic acid in Flos lonicerae[J]. China Surfactant Detergent&Cosmetics, 2014, 44(8): 448-451, 459. |
| [16] |
孙阳, 黄和, 胡燚. 绿原酸提取纯化方法的研究进展[J]. 化学试剂, 2017, 39(3): 257-262. SUN Y, HUANG H, HU Y. Progress on extraction and purification of chlorogenic acid[J]. Chemical Reagent, 2017, 39(3): 257-262. |
| [17] |
高文兰, 刘清龙. 氯原酸与异氯原酸薄层扫描的定量研究[J]. 沈阳药学院学报, 1989, 33, 2(2): 25-29. GAO W L, LIU Q L. Quantitative study on TLC scanning of chlorogenic acid and isochlorogenic acid[J]. Journal of Shenyang Pharmacy, 1989, 33, 2(2): 25-29. |
| [18] |
FRAGA C. Plant polyphenols: from free radical scavengers to modulators of cell signaling[C]. Free Radical Research, 2006, 40(3): S58.
|
| [19] |
王晓梅, 奚宇, 范新光, 等. 绿原酸的生物利用率和抗氧化活性研究进展[J]. 中国食品学报, 2019, 19(1): 271-279. WANG X M, XI Y, FANG X G, et al. Research progress on bioavailability and antioxidant activity of chlorogenic acid[J]. Chinese Food Journal, 2019, 19(1): 271-279. |
| [20] |
JIAO Q, ZHANG W, JIANG Y, et al. Study on the Interactions between caffeoylquinic acids with bovine serum albumin: spectroscopy, antioxidant activity, LC-MS(n), and molecular docking approach[J]. Frontiers in Chemistry, 2019, 7(8): 840. |
 2021, Vol. 40
2021, Vol. 40