文章信息
- 王嘉欣, 薛鹏辉, 广晨曦, 王颖超, 马腾, 邱峰
- WANG Jiaxin, XUE Penghui, GUANG Chenxi, WANG Yingchao, MA Teng, QIU Feng
- 鹅不食草正丁醇部位化学成分研究
- Study on chemical constituents from n-BuOH extract of Centipeda minima (L.) A.Br.et Aschers
- 天津中医药大学学报, 2021, 40(2): 253-259
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(2): 253-259
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.02.22
-
文章历史
收稿日期: 2020-12-04
2. 组分中药国家重点实验室, 天津 301617
2. The State Key Laboratory of Component-based Chinese Medicine, Tianjin 301617, China
鹅不食草为菊科石胡荽属植物鹅不食草Centipeda minima(L.)A.Br.et Aschers.的干燥全草,又名石胡荽或食胡荽,主产于中国东北、华北等地[1]。鹅不食草味辛,性温,归肺经,具有散风、止咳、通鼻窍的功效,临床上常用于治疗风寒头痛,咳嗽痰多,鼻塞不通,鼻渊流涕等症[2]。现代研究表明鹅不食草中主要含有萜类,黄酮类及甾体类等成分,这些成分具有抗肿瘤[3-5],抗原生动物[6],抗炎[7],抗氧化[7],保肝[8]等多种药理作用。目前,对鹅不食草化学成分研究较少,且缺乏系统性,限制了对其进一步的开发和利用。本研究对鹅不食草95%及60%乙醇提取物的化学成分进行研究,从中共分离得到14个化合物,通过其理化性质及谱学数据鉴定了它们的结构:木犀草素-7-O-β-D-葡萄糖苷(1),槲皮素-3-O-β-D-葡萄糖苷(2),芹菜素-7-O-β-D-葡萄糖醛酸苷(3),nudicaucins A(4),guaiacin D(5),绿原酸(6),4,5-二咖啡酰奎宁酸-甲酯(7),对羟基苯甲酸(8),水杨酸(9),芥子酸(10),芥子酸甲酯(11),阿魏酸(12),咖啡酸甲酯(13),丁香酸(14)。化合物1~14均为首次从石胡荽属植物中分离得到。
1 仪器与材料CPA225D十万分之一电子天平(赛多利斯科学仪器有限公司);ZF-20D暗箱式紫外分析仪(上海顾村电光仪器厂);Waters e2695分析型高效液相色谱仪(美国Waters公司);Waters 2535制备型高效液相色谱仪(美国Waters公司);岛津LC-6AD制备液相色谱仪(日本岛津株式会社);Waters Xevo G2-S UPLC-Q/TOF(美国Waters公司);Bruker AVANCE 600 MHz核磁共振波谱仪(德国Bruker公司);EYELA N-1100系列旋转蒸发仪(日本东京理化器械株式会社);EYELA CA-1111型冷却水循环装置(日本东京理化器械株式会社)。
D101大孔吸附树脂(天津市光复精细化工研究所);Macroporous resin KSP-10-8300(山东济南博纳生物科技有限公司);柱色谱硅胶(100~200目,200~300目)(青岛海洋化工厂);薄层层析硅胶GF-254(青岛海洋化工有限公司);Sephadex LH-20(瑞典Pharmacia公司);ODS开放柱色谱填料5~50 μm(日本YMC公司);分析型YMC C18色谱柱,4.6 mm×250 mm,5 μm(日本YMC公司);制备型YMC C18色谱柱,20 mm×250 mm,5 μm(日本YMC公司);乙酸乙酯、二氯甲烷、甲醇、乙醇等分析纯试剂,甲醇、乙腈、甲酸等色谱纯试剂(天津市康科德科技有限公司);氘代甲醇,氘代二甲基亚砜等氘代试剂(青岛腾龙微波科技有限公司)。
鹅不食草药材购自于河北安国药材市场,经天津中医药大学张丽娟教授鉴定为植物鹅不食草[Centipeda minima(L.)A.Br.et Aschers.],现保存于天津中医药大学中药学院。
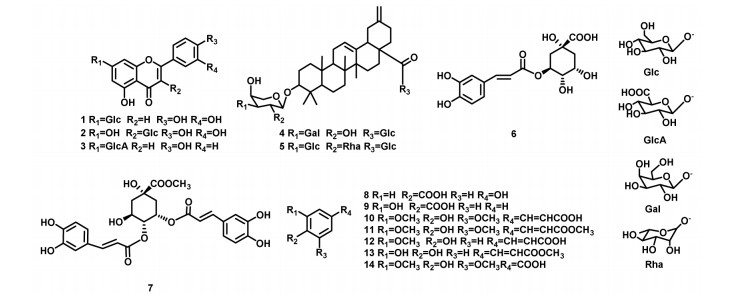
2 提取与分离鹅不食草干燥全草4.8 kg,剪碎后用4倍量体积分数为95%的乙醇溶液回流提取2次,每次2 h;再用4倍量体积分数为60%的乙醇溶液回流提取2次,每次2 h。合并滤液,减压浓缩至无醇味,所得浸膏用水混悬后依次以等体积的石油醚(60~90 ℃)、二氯甲烷、乙酸乙酯、正丁醇萃取3次,合并各层萃取液,减压浓缩得到石油醚层(250.0 g)、二氯甲烷层(200.0 g)、乙酸乙酯层(80.0 g),和正丁醇层(80.0 g)。其中正丁醇层经D101大孔吸附树脂,以乙醇-水(体积比为0:100 - 100:0)梯度洗脱,共得到7个流分(Fr.1~Fr.7)。Fr.4(15.1 g)经小孔吸附树脂,以乙醇-水(体积比为0:100 - 100:0)梯度洗脱,共得到7个流分(Fr.4-1~Fr.4-7),Fr.4-4(7.0 g)经开放ODS柱色谱,以甲醇-水(体积比为10:90-100:0)梯度洗脱得到6个流分(Fr.4-4-1~Fr.4-4-6),Fr.4-4-1经高效液相色谱(甲醇∶水=50∶50,V/V),制备得到化合物12(6.2 mg),13(9.7 mg)。Fr.4-4-3经Sephadex LH-20柱色谱,流动相甲醇等度洗脱得到9个流分,Fr.4-4-3-3、Fr.4-4-3-4、Fr.4-4-3-5合并为Fr.4-4-3-H,Fr.4-4-3-H经开放ODS柱色谱,以甲醇-水(体积比为10:90-100:0)梯度洗脱得到10个流分,Fr.4-4-3-H2经高效液相色谱(甲醇∶水=40∶60,V/V)制备得到化合物1(28.0 mg)。Fr.4-4-3-H3经高效液相色谱(甲醇∶水=45∶55,V/V)制备得到化合物2(20.2 mg)。Fr.4-4-3-H4经高效液相色谱(甲醇∶水=40∶60,V/V)制备得到化合物3(7.8 mg)。Fr.4-4-3-7经高效液相色谱(甲醇∶水=20∶80,V/V)制备得到流分Fr.4-4-3-7-1和Fr.4-4-3-7-2,Fr.4-4-3-7-1经高效液相色谱(甲醇∶水=50∶50,V/V)制备得到化合物7(5.3 mg),6(18.3 mg)。Fr.4-4-3-H9经高效液相色谱(甲醇∶水=60∶40,V/V),制备得到化合物8(8.6 mg),10(12.4 mg)。Fr.4-4-3-H10经高效液相色谱(甲醇∶水=80∶20,V/V)制备得到化合物9(10.9 mg),11(7.7 mg),14(6.7 mg)。Fr.4-4-4经开放硅胶柱色谱,乙酸乙酯-甲醇-水(体积比为20∶1∶1-0∶1∶1)梯度洗脱,得到10个流分,Fr.4-4-4-9,Fr.4-4-4-10,经制备薄层色谱,展开剂乙酸乙酯∶甲醇∶水=4∶1∶1展开,得到化合物4(5.1 mg)和化合物5(4.2 mg)。化合物结构见图 1。
|
| 图 1 化合物1-14结构 |
化合物1:黄色粉末。HR-ESI-MS(高分辨电喷雾质谱):m/z 447.094 0 [M-H]-(calcd. 447.103 9,C21H19O11),结合1H-NMR,13C-NMR数据推测分子式为C21H20O11。1H-NMR(600 MHz,DMSO-d6):δ 6.76(1H,s,H-3),6.45(1H,d,J=1.4 Hz,H-6),6.80(1H,d,J=1.4 Hz,H-8),7.42(1H,br s,H-2′),6.91(1H,d,J=8.3 Hz,H-5′),7.44(1H,d,J=8.3 Hz,H-6′),12.98(1H,s,5-OH),10.00(1H,br s,3′-OH),9.44(1H,br s,4′-OH),5.09(1H,d,J=7.0 Hz)为糖端基质子信号,并根据偶合常数确定苷键构型为β型[11];13C-NMR(150 MHz,DMSO-d6):δ 164.2(C-2),103.3(C-3),182.0(C-4),161.2(C-5),99.6(C-6),163.0(C-7),94.8(C-8),157.0(C-9),105.4(C-10),121.5(C-1′),113.6(C-2′),145.8(C-3′),150.0(C-4′),116.1(C-5′),119.3(C-6′)。糖基部分:δ 100.0(C-1′′),73.2(C-2′′),76.5(C-3′′),69.6(C-4′′),77.2(C-5′′),60.7(C-6′′)。以上数据与文献报道一致[9],故确定该化合物的结构为木犀草素-7-O-β-D-葡萄糖苷。
化合物2:淡黄色粉末。HR-ESI-MS:m/z 447.092 4 [M-H2O+H]+(calcd. 447.092 7,C21H21O11),根据1H-NMR,13C-NMR数据推测分子式为C21H20O12。1H-NMR(600 MHz,DMSO-d6):δ 6.17(1H,br s,H-6),6.38(1H,br s,H-8)6.84(1H,d,J=8.0 Hz,H-5′),7.58(1H,d,J=8.0 Hz,H-6′),12.63(1H,br s,5-OH)。δ 5.46(1H,d,J=7.1Hz,H-1′′)为糖端基质子信号,并根据偶合常数确定苷键构型为β型[11];13C-NMR(150 MHz,DMSO-d6):δ 156.3(C-2),133.1(C-3),177.2(C-4),161.1(C-5),98.7(C-6),164.2(C-7),93.5(C-8),155.9(C-9),103.6(C-10),121.0(C-1′),115.1(C-2′),l44.7(C-3′),148.4(C-4′),116.0(C-5′),121.5(C-6′),糖基部分:δ 100.9(C-1′′),74.1(C-2′′),76.5(C-3′′),69.9(C-4′′),77.6(C-5′′),61.0(C-6′′)。以上数据与文献基本一致[10],故确定该化合物的结构为槲皮素-3-O-β-D-葡萄糖苷。
化合物3:淡黄色粉末。HR-ESI-MS:m/z 447.092 3 [M+H]+(calcd. 447.092 7,C21H19O11),根据1H-NMR,13C-NMR数据推测分子式为C21H18O11。1H-NMR(600 MHz,DMSO-d6):δ 6.81(1H,br s,H-3),6.42(1H,br s,H-6),6.80(1H,br s,H-8),7.90(2H,d,J=7.7 Hz,H-2′,6′),6.91(2H,d,J=7.7Hz,H-3′,5′),5.10(1H,d,J=7.1 Hz,H-1′′)为糖端基质子信号,并根据偶合常数确定苷键构型为β型[11];13C-NMR(150 MHz,DMSO-d6):δ 162.4(C-2),102.9(C-3),181.9(C-4),161.6(C-5),99.5(C-6),162.9(C-7),94.6(C-8),156.9(C-9),105.3(C-10),120.7(C-1′),128.5(C-2′,6′),116.0(C-3′,5′),161.0(C-4′),糖基部分:δ 99.5(C-1′′),72.9(C-2′′),74.5(C-3′′),71.8(C-4′′),76.3(C-5′′),171.8(C-6′′)。以上数据与文献报道基本一致[9],故确定该化合物的结构为芹菜素-7-O-β-D-葡萄糖醛酸苷。
化合物4:白色粉末。HR-ESI-MS:m/z 941.468 2 [M+HCOO]-(calcd. 941.468 2,C47H73O19),结合1H-NMR,13C-NMR数据推测分子分子式C46H72O17。1H-NMR(600 MHz,CD3OD):δ 5.32(1H,br t,H-12),4.61(1H,d,J=4.0 Hz,H-29),1.19(3H,s,23-CH3),0.85(3H,s,24- CH3),0.81(3H,s,25-CH3),0.96(3H,s,26-CH3),1.05(3H,s,27-CH3),4.28(1H,d,J=7.5 Hz,Ara-1),4.50(1H,d,J=7.6 Hz,Gal-1),5.36(1H,d,J=8.0 Hz,H-28-Glc-1)为糖端基质子信号,在吡喃型糖的优势构象中,当C2-OH位于平伏键(e键)时,同时C1-OR亦位于e键时,H-1和H-2为反式直立键,其两面角为180°,端基质子的偶合常数通常为6~8 Hz[11],根据偶合常数确定三个糖苷键构型均为β型;13C-NMR(150 MHz,CD3OD):δ 39.9(C-1),27.2(C-2),90.6(C-3),40.4(C-4),57.2(C-5),19.5(C-6),34.1(C-7),40.9(C-8),38.0(C-10),24.3(C-11),124.5(C-12),144.4(C-13),43.0(C-14),29.0(C-15),24.7(C-16),42.7(C-19),149.6(C-20),31.0(C-21),38.6(C-22),28.6(C-23),17.2(C-24),16.2(C-25),17.9(C-26),26.5(C-27),177.4(C-28),107.5(C-29),糖基部分:δ 106.3(Ara-1′),72.3(C-2′),84.1(C-3′),69.9(C-4′),66.7(C-5′),107.2(Gal-1′′),74.0(C-2′′),74.8(C-3′′),70.4(C-4′′),76.9(C-5′′),62.7(C-6′′),95.9(28-Glc-1′′′),73.1(C-2′′′),78.4(C-3′′′),71.2(C-4′′′),78.8(C-5′′′),62.5(C-6′′′)。以上数据与文献报道基本一致[12],故确定该化合物的结构为nudicaucins A。
化合物5:白色粉末。HR-ESI-MS:m/z 1 087.522 7 [M+HCOO]-(calcd. 1087.522 7,C53H83O23),结合1H-NMR,13C-NMR数据推测分子分子式C52H82O21。1H-NMR(600 MHz,CD3OD):δ 5.21(1H,br s,H-12),4.60 1H,br s,H-29),1.19(3H,s,23-CH3),0.85(3H,s,24-CH3),0.80(3H,s,25-CH3),0.95(3H,s,26-CH3),1.02(3H,s,27-CH3),4.28(1H,d,J=7.5 Hz,Ara-1),4.50(1H,d,J=7.6Hz,Glc-1),5.36(1H,d,J=8.0 Hz,H-28-Glc-1),5.19(1H,d,J=1.5 Hz,Rha-1),1.21(1H,d,J=6.2 Hz,Rha-6-CH3),其中4.28(1H,d,J=7.5 Hz,Ara-1),4.50(1H,d,J=7.6Hz,Glc-1),5.36(1H,d,J=8.0 Hz,H-28-Glc-1),为糖端基质子信号,在吡喃型糖的优势构象中,当C2-OH位于平伏键(e键)时,同时C1-OR亦位于e键时,H-1和H-2为反式直立键,其两面角为180°,端基质子的偶合常数通常为6~8 Hz[11],根据偶合常数确定三个糖苷键构型均为β型,鼠李糖苷键构型不能通过1H-NMR偶合常数进行判断;13C-NMR(150 MHz,CD3OD):δ 40.2(C-1),27.2(C-2),89.7(C-3),40.4(C-4),57.2(C-5),19.3(C-6),34.0(C-7),40.8(C-8),38.0(C-10),24.2(C-11),124.3(C-12),144.2(C-13),43.0(C-14),29.0(C-15),24.6(C-16),42.6(C-19),149.4(C-20)38.5(C-21),30.9(C-22),28.7(C-23),17.9(C-24),16.1(C-25),17.3(C-26),26.3(C-27),177.3(C-28),107.5(C-29)。糖基部分:δ 105.1(Ara-1′),75.4(C-2′),84.4(C-3′),68.5(C-4′),64.8(C-5′),104.3(Glc-1′′),73.9(C-2′′),78.3(C-3′′),70.3(C-4′′),78.0(C-5′′),62.4(C-6′′),102.0(Rha-1′′′),72.3(C-2′′′),72.1(C-3′′′),73.8(C-4′′′),69.8(C-5′′′),17.9(C-6′′′),95.8(28-Glc-1′′′′),75.3(C-2′′′′),78.7(C-3′′′′),71.2(C-4′′′′),78.3(C-5′′′′),62.4(C-6′′′′)。根据鼠李糖碳谱数据,特别是端基碳与其他碳的化学位移变化[11]可以判断鼠李糖苷键构型为α型。以上数据与文献报道基本一致[12],故确定该化合物的结构为guaiacin D。
化合物6:淡黄色粉末。HR-ESI-MS:m/z 353.089 7 [M-H]-(calcd. 353.087 3,C16H17O9),结合1H-NMR,13C-NMR数据推测分子分子式C16H18O9。1H-NMR(600 MHz,DMSO-d6):δ 2.04~2.23(4H,m,H-2,6),5.32(1H,m,H-3),4.153.72(1H,dd,J=8.4,3.2 Hz,H-4),(1H,m,H-5),7.04(1H,d,J=2.0 Hz,H-2′),6.77(1H,d,J=8.4 Hz,H-5′),6.96(1H,dd,J=8.4,2.0 Hz,H-6′),7.55(1H,d,J=16.0 Hz,H-7′),6.25(1H,d,J=16.0 Hz,H-8′);13C-NMR(150 MHz,DMSO-d6):δ 76.3(C-1),38.4(C-2),73.6(C-3),72.1(C-4),71.4(C-5),39.0(C-6),177.2(C-7),127.9(C-1′),116.6(C-2′)147.2(C-3′),149.7 C-4′),115.4(C-5′),123.1(C-6′),146.9(C-7′),115.3(C-8′),168.8(C-9′)。以上数据与文献报道基本一致[13],故确定该化合物的结构为绿原酸。
化合物7:淡绿色粉末。HR-ESI-MS:m/z 529.134 3 [M-H]-(calcd. 529.134 6,C26H25O12),结合1H-NMR和13C-NMR数据,推测其分子式为C26H26O12。1H-NMR(600 MHz,CD3OD):δ 2.09(2H,m,H-2),4.35(1H,m,H-3),5.12(1H,m,H-4),5.55(1H,m,H-5),2.28(2H,m,H-6),7.02(1H,d,J=2.0 Hz,H-2′),7.05(1H,d,J=2.0 Hz,H-2′′),6.76(1H,d,J=8.0 Hz,H-5′),6.78(1H,d,J=8.0 Hz,H-5′′),6.93(2H,dd,J=8.0,2.0 Hz,H-6′,6′′),7.54(1H,d,J=16.0 Hz,H-7′),7.60(1H,d,J=16.0 Hz,H-7′′),6.18(1H,d,J=16.0 Hz,H-8′),6.29(1H,d,J=16.0 Hz,H-8′′),3.74(3H,s,-OCH3);13C-NMR(150 MHz,CD3OD):δ 75.9(C-1),38.4(C-2),68.7(C-3),75.0(C-4),69.1(C-5),38.7,(C-6),175.2(C-7),127.6(C-1′),114.6(C-2′),146.8(C-3′),149.7(C-4′),116.5(C-5′),123.1(C-6′),147.7(C-7′),115.2(C-8′),168.0(C-9′),127.7(C-1′′),114.8(C-2′′),146.8(C-3′′),149.7(C-4′′),116.5(C-5′′),123.1(C-6′′),147.7(C-7′′),115.2(C-8′′),168.5(C-9′′),53.1(-OCH3)。以上数据与文献报道基本一致[14],故确定该化合物的结构为4,5-二咖啡酰奎宁酸-甲酯。
化合物8:无色针晶。HR-ESI-MS:m/z 139.040 1 [M+H]+(calcd. 139.039 5,C7H7O3),结合1H-NMR和13C-NMR数据,推测其分子式为C7H6O3,计算不饱和度为5。1H-NMR(600 MHz,CD3OD):δ 7.88(2H,d,J=8.7 Hz,H-2,6),6.83(2H,d,J=8.7 Hz,H-3,4);13C-NMR(150 MHz,CD3OD):δ 122.8(C-1),133.1(C-2,6),116.2(C-3,5),163.4(C-4),170.3 C-7)。以上数据与文献报道基本一致[15],故确定该化合物的结构为对羟基苯甲酸。
化合物9:白色粉末。HR-ESI-MS:m/z 137.029 3 [M-H]-(calcd.137.035 0,C7H5O3),结合1H-NMR和13C-NMR数据,推测其分子式为C7H6O3,计算不饱和度为5。1H-NMR(600 MHz,CD3OD):δ 7.85(1H,dd,J=7.9,1.8 Hz,H-3),6.88(1H,td,J=7.9,1.0 Hz,H-4),7.45(1H,td,J=7.9,1.8 Hz,H-5),6.91(1H,dd,J=8.2,0.9 Hz,H-6);13C-NMR(150 MHz,CD3OD):δ 114.0(C-1),163.4(C-2),118.3(C-3),136.8(C-4),120.2(C-5),131.7(C-6),173.7(C-7)。以上数据与文献报道基本一致[16],故确定该化合物的结构为水杨酸。
化合物10:白色粉末。HR-ESI-MS:m/z 223.065 6 [M-H]-(calcd. 223.060 6,C11H11O5),结合1H-NMR和13C-NMR数据,推测其分子式为C11H12O5,计算不饱和度为5。1H-NMR(600 MHz,CD3OD):δ 7.58(1H,d,J=15.8 Hz,H-7),6.89(2H,s,H-2,6),6.34(1H,d,J=15.8 Hz,H-8),3.87(6H,s,3-OCH3,5-OCH3);13C-NMR(150 MHz,CD3OD):δ 126.9(C-1),107.0(C-2,6),149.6(C-3,5),139.6(C-4),147.2(C-7),116.6(C-8),171.1(C-9),57.0(3-OCH3,5-OCH3)。以上数据与文献报道基本一致[17],故确定该化合物的结构为为芥子酸。
化合物11:白色粉末。HR-ESI-MS:m/z 239.091 2 [M+H]+(calcd.239.091 9,C12H15O5),结合1H-NMR和13C-NMR数据,推测其分子式为C12H14O5。1H-NMR(600 MHz,CD3OD):δ 6.89(2H,s,H-2,6),7.56(1H,d,J=15.9 Hz,H-7),6.53(1H,d,J=15.9 Hz,H-8),3.79(6H,s,3-OCH3,5-OCH3),3.70(3H,s,-OCH3);13C-NMR(150 MHz,CD3OD):δ 124.4(C-1),106.3(C-2,6),148.0(C-3,5),138.3(C-4)),145.4(C-7),114.6(C-8),169.8(C-9),56.1(3-OCH3,5-OCH3),51.2(-OCH3)。以上数据与文献报道基本一致[18],故确定该化合物的结构为芥子酸甲酯。
化合物12:黄色固体。HR-ESI-MS:m/z 195.066 5 [M+H]+(calcd. 195.065 7,C10H11O4),结合1H-NMR和13C-NMR数据,推测其分子式为C10H10O4,计算不饱和度为6。1H-NMR(600 MHz,CD3OD):δ 7.18(1H,d,J=2.0 Hz,H-2),6.81(1H,d,J=9.0 Hz,H-5),7.07(1H,dd,J=9.0,2.0 Hz,H-6),7.60(1H,d,J=15.9 Hz,H-7),6.31(1H,d,J=15.9 Hz,H-8),3.89(3H,s,3-OCH3);13C-NMR(150 MHz,CD3OD):δ 127.9(C-1),111.8(C-2),150.6(C-3),149.5(C-4),116.6(C-5),124.1(C-6),147.0(C-7),116.1(C-8),171.1(C-9),56.0(3-OCH3)。以上数据与文献报道基本一致[19],故确定该化合物的结构为阿魏酸。
化合物13:黄色粉末。HR-ESI-MS:m/z 195.065 7 [M+H]+(calcd. 195.065 7,C10H11O4),结合1H-NMR和13C-NMR数据,推测其分子式为C10H10O4,计算不饱和度为6。1H-NMR(600 MHz,CD3OD):δ 7.03(1H,d,J=2.0 Hz,H-2),6.77(1H,d,J=8.2 Hz,H-5),6.94(1H,dd,J=8.2,2.0 Hz,H-6),7.54(1H,d,J=15.8 Hz,H-7),6.26(1H,d,J=15.8 Hz,H-8),3.75(3H,s-OCH3);13C-NMR(150 MHz,CD3OD):δ 127.8(C-1),115.3(C-2),147.1(C-3),149.7(C-4),116.6(C-5),123.1(C-6),147.0(C-7),115.0(C-8),169.9(C-9),52.1(-OCH3)。以上数据与文献报道基本一致[20],故确定该化合物的结构为咖啡酸甲酯。
化合物14:白色粉末。HR-ESI-MS:m/z 242.180 5 [M-H]- calcd. 242.175 6,C10H11O7),结合1H-NMR和13C-NMR数据,推测其分子式为C9H10O5,计算不饱和度为5。1H-NMR(600 MHz,CD3OD):δ 7.33(2H,s,H-2,6),3.80(6H,s,3-OCH3,5-OCH3);13C-NMR(150 MHz,CD3OD):δ 122.1(C-1),108.5(C-2,6),149.0(C-3,5),141.9(C-4),170.1(C-7),56.9(3-OCH3,5-OCH3)。以上数据与文献报道基本一致[21],故确定该化合物的结构为丁香酸。
4 结果与讨论鹅不食草是中医治疗鼻炎的常用良药,但目前国内外对其物质基础研究较少。本研究利用多种现代色谱分离方法,对鹅不食草95%乙醇和60%乙醇合并提取物进行系统分离及结构鉴定。化合物1~14为首次从石胡荽属植物中分离得到,扩大了该属的化学成分组成,为进一步对鹅不食草进行研究奠定了基础。
研究表明,鹅不食草提取物具有一定的抗炎作用[22]。黄酮类和酚酸类化合物具有潜在的抗炎活性[4, 23-24]。在脂多糖诱导的RAW264.7细胞(小鼠单核巨噬细胞系)中,化合物3可以通过下调炎症相关的基因表达,从而抑制AP-1(核转录因子激活蛋白-1)和MAPK(丝裂原激活的蛋白激酶)信号通路,发挥其抗炎活性[25];化合物6可以通过显著降低NO(一氧化氮)的产生和抑制COX-2(环氧合酶-2)和iNOS(诱导型一氧化氮合酶)的表达发挥其抗炎活性[26]。本研究中分离得到的黄酮类化合物和酚酸类化合物是否为鹅不食草发挥抗炎活性的药效物质值得进行进一步研究。
| [1] |
中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1983: 132. Editorial Committee of flora of China. Chinese Academy of Sciences. Flora of China[M]. Beijing: Science Press, 1983: 132. |
| [2] |
国家药典委员会. 中华人民共和国药典[S]. 北京: 中国医药科技出版社, 2020. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republicof China[S]. Beijing: China Medical Science and Technology Publishing House, 2020. |
| [3] |
SU M X, WU P, LI Y L, et al. Antiproliferative effects of volatile oils from centipeda minima on human nasopharyngeal cancer CNE cells[J]. Natural product communications, 2010, 5(1): 151-156. |
| [4] |
GUO Y Q, SUN H Y, CHEN S B, et al. Centipeda minima (Ebushicao) extract inhibits PI3K-Akt-mTOR signaling in nasopharyngeal carcinoma CNE-1 cells[J]. Chinese Medicine, 2015, 10(1): 26. DOI:10.1186/s13020-015-0058-5 |
| [5] |
HUANG X, AWANO Y, MAEDA E, et al. Cytotoxic activity of two natural sesquiterpene lactones, isobutyroylplenolin and arnicolide D, on human colon cancer cell line HT-29[J]. Natural Product Research, 2014, 28(12): 914-916. DOI:10.1080/14786419.2014.889133 |
| [6] |
YU H W, WRIGHT C W, CAI Y, et al. Antiprotozoal activities of Centipeda minima[J]. Phytotherapy Research, 1994, 8(7): 436-438. DOI:10.1002/ptr.2650080713 |
| [7] |
HUANG S S, CHIU C S, LIN T H, et al. Antioxidant and anti-inflammatory activities of aqueous extract of Centipeda minima[J]. Journal of Ethnopharmacology, 2013, 147(2): 395-405. DOI:10.1016/j.jep.2013.03.025 |
| [8] |
LIN X, ZHANG S J, HUANG R B, et al. Helenalin attenuates alcohol-induced hepatic fibrosis by enhancing ethanol metabolism, inhibiting oxidative stress and suppressing HSC activation[J]. Fitoterapia, 2014, 95(4): 203-213. |
| [9] |
冯晓茹, 李晓波, LUU THI THANH THUY, 等. 荨麻根脂溶性化学成分研究[J]. 中国药学杂志, 2017, 52(14): 1217-1222. FENG X R, LI X B, THUY L T T, et al. Liposoluble constituents of Urticae rhizoma[J]. Chinese Pharmaceutical Journal, 2017, 52(14): 1217-1222. |
| [10] |
郭启雷, 杨峻山, 刘建勋. 掌叶覆盆子的化学成分研究[J]. 中国药学杂志, 2007, 42(15): 1141-1143. GUO Q L, YANG J S, LIU J X. Studies on chemical constituents in fruits of Rubus chingii[J]. Chinese Pharmaceutical Journal, 2007, 42(15): 1141-1143. |
| [11] |
裴月湖, 华会明, 李占林, 等. 核磁共振法在苷键构型确定中的应用[J]. 药学学报, 2011, 46(2): 127-131. PEI Y H, HUA H M, LI Z L, et al. Application of nuclear magnetic resonance to the determination of the configuration of glycoside bond[J]. Acta Pharmaceutica Sinica, 2011, 46(2): 127-131. |
| [12] |
KONISHI M, HANO Y, TAKAYAMA M, et al. Triterpenoid saponins from Hedyotis nudicaulis[J]. Phytochemistry (Oxford), 1998, 48(3): 525-528. DOI:10.1016/S0031-9422(98)00038-7 |
| [13] |
许浚, 张铁军, 龚苏晓, 等. 小蓟止血活性部位的化学成分研究[J]. 中草药, 2010, 41(4): 542-544. XU J, ZHANG T J, GONG S X, et al. Study on the chemical constituents of the hemostatic active site of Cirsiumsetosum[J]. Chinese Traditional and Herbal Drugs, 2010, 41(4): 542-544. |
| [14] |
MA HA A, ABOUL E, ABDALLA M, et al. New quinic acid derivatives from hepatoprotective inula crithmoides root extract[J]. Helvetica Chimica Acta, 2012, 95(1): 61-66. DOI:10.1002/hlca.201100282 |
| [15] |
冯小路, 辛海量, 张磊, 等. 野西瓜化学成分的研究(Ⅰ)[J]. 中草药, 2009, 28(S1): 106-108. FENG X L, XIN H L, ZHANG L, et al. Study on the chemical composition from Capparis spinosa[J]. Chinese Traditional and Herbal Drugs, 2009, 28(S1): 106-108. |
| [16] |
XIN X L, AISA H A, WANG H Q. Flavonoids and phenolic compounds from seeds of the Chinese plant Nigella glandulifera[J]. Chemistry of Natural Compounds, 2008, 44(3): 368-369. DOI:10.1007/s10600-008-9066-3 |
| [17] |
吴剑锋, 陈四保, 吴立军, 等. 香港远志化学成分的分离与鉴定[J]. 中国中药杂志, 2007, 32(9): 819-821. WU J F, CHEN S B, WU L J, et al. Isolation and structure identification of chemical constituents from Polygala hongkongensis[J]. China Journal of Chinese Materia Medica, 2007, 32(9): 819-821. |
| [18] |
DUAN L, FENG B, CHEN F, et al. Sinapic acid derivatives from the seeds of Raphanus nussatirus L[J]. Journal of Asian Natural Products Research, 2007, 9(6): 557-561. DOI:10.1080/10286020600883468 |
| [19] |
LEE J, LEE D, BEAR D R, et al. Phenylpropanoids from red kohlrabi sprouts inhibits nitric oxide production in RAW 264.7 macrophage cells[J]. Food Science and Biotechnology, 2014, 23(3): 965-969. DOI:10.1007/s10068-014-0130-4 |
| [20] |
WANG W, GUO J, ZHANG J, et al. Isolation, identification and antioxidant activity of bound phenolic compounds present in rice bran[J]. Food Chemistry, 2015, 171(8): 40-49. |
| [21] |
RUSSELL K, MOLAN P, WILKINS A, et al. Identification of some antibacterial constituents of New Zealand Manuka honey[J]. Journal of Agricultural and Food Chemistry, 1989, 38(1): 10-13. |
| [22] |
HUANG X, AWANO Y, MAEDA E, et al. Cytotoxic activity of two natural sesquiterpene lactones, isobutyroylplenolin and arnicolide D, on human colon cancer cell line HT-29[J]. Natural Product Research, 2014, 28(12): 914-916. DOI:10.1080/14786419.2014.889133 |
| [23] |
KASSIM M, ACHOUI M, MUSTAFA M R, et al. Ellagic acid, phenolic acids, and flavonoids in Malaysian honey extracts demonstrate in vitro anti-inflammatory activity[J]. Nutrition Research, 2010, 30(9): 650-659. DOI:10.1016/j.nutres.2010.08.008 |
| [24] |
MAHER K, YASSINE B A, SOFIANE B. Anti-inflammatory and antioxidant properties of Eriobotrya japonica leaves extracts[J]. African Health Ences, 2015, 15(2): 613-620. DOI:10.4314/ahs.v15i2.39 |
| [25] |
HU W C, WANG X F, WU L, et al. Apigenin-7-O-β-D-glucuronide inhibits LPS-induced inflammation through the inactivation of AP-1 and MAPK signaling pathways in RAW 264.7 macrophages and protects mice against endotoxin shock[J]. Food & Function, 2016, 7(2): 1002-1013. |
| [26] |
HWANG S J, KIM Y W, PARK Y, et al. Anti-inflammatory effects of chlorogenic acid in lipopolysaccharide-stimulated RAW 264.7 cells[J]. Inflammation Research, 2014, 63(1): 81-90. DOI:10.1007/s00011-013-0674-4 |
 2021, Vol. 40
2021, Vol. 40