文章信息
- 张懂懂, 王丽芝, 陈好, 刘唱, 李先宽, 夏天蕊, 王海英
- ZHANG Dongdong, WANG Lizhi, CHEN Hao, LIU Chang, LI Xiankuan, XIA Tianrui, WANG Haiying
- 镉胁迫对文山川芎矿质营养吸收和分配的影响
- Effect of cadmium stress on absorption and distribution of mineral nutrients in Ligusticum sinense sp.
- 天津中医药大学学报, 2021, 40(3): 367-373
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(3): 367-373
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.03.20
-
文章历史
收稿日期: 2021-01-29
近年来,由于农药化肥的过量施用、工业废水污水的灌溉以及对矿区的随意开采,土壤中的重金属含量超标问题日益突出[1]。镉(Cd)是毒性极强的重金属元素之一,在土壤-植物系统中具有很强的生物迁移能力,往往在不影响植物正常生长的情况下在植物体内积累,然后通过食物链进入人体[2]。一旦人体内累积的Cd达到一定水平,即可呈现毒性,严重时还会危及人们的健康与生命安全。如在1922—1965年间,日本由于Cd中毒死亡的人数就超过了100人。研究表明,部分药用植物对Cd具有富集作用,影响了中药材的安全利用。因此,采取有效措施,将中药材中Cd含量控制在安全线以下(≤0.3 mg/kg),是保障人们用药安全的重要基础。
文山川芎(Ligusticum sinense sp.)是一种伞形科藁本属多年生草本植物,“川芎”是当地的习称,其地上部分与四川川芎相似,地下根茎则呈不规则圆柱形,有分枝,气味浓郁,与藁本类似。文山川芎根茎可入药,作为藁本替代品使用,地上部分则在当地多作为蔬菜食用。调查显示,云南农村局部地区存在土壤重金属含量超标情况,Cd污染的影响最大[3-4]。伞形科植物通常对重金属有一定的富集作用。因此,无论作为食品还是作为药品,在Cd污染土壤中生长的文山川芎都可能会给人们带来健康风险。迄今为止,尚未见对文山川芎Cd吸收、积累规律的报道。本研究通过研究Cd对文山川芎在Cd胁迫下矿质元素吸收与积累及转移特性的影响,旨在阐明文山川芎的Cd吸收、转运规律,为其安全应用奠定科学基础。
1 材料与方法 1.1 实验材料 1.1.1 材料培养文山川芎采自云南省红河州老寨苗族乡牛作底村。选择大小一致的根茎作为繁殖材料,先将根茎用营养土栽培,1个月后,选择长势一致的植株移栽至Hoagland营养液中水培,每日充氧0.5 h以上,3 d更换1次营养液。
1.1.2 Cd处理待幼苗适应水培,发出新根后,分别加50、100 μmol/L的氯化镉(CdCl2)溶液处理,每组重复3次,未加CdCl2溶液的作为对照组,于第14天取样检测。将全株收获后用20 mmol/L的乙二胺四乙酸二钠(EDTA-Na2)浸泡3 h,再用蒸馏水冲洗干净,去除植株表面吸附的Cd离子(Cd2+)。将植株分离成须根、根茎、地上茎和叶片4个部分,105 ℃杀青10 min,80 ℃烘至恒质量后保存,用于元素含量测定。
1.2 测定方法准确称取样品0.2 g,加入浓硝酸消煮,定容后用电感耦合等离子体发射光谱仪(ICP-MS,Thermo Fisher iCAP6300,英国)测定各元素含量。
1.3 转运系数计算转运系数指文山川芎后一部位中Cd含量与前一部位中Cd含量的比值(包括须根到根茎、根茎到地上茎以及地上茎到叶)。计算公式如下:TF=Clatter/Cformer[C:文山川芎某部位Cd含量;Clatter:文山川芎后一部位(分别对应为根茎、地上茎、叶)中Cd含量;Cformer:文山川芎前一部位(分别对应为须根、根茎、地上茎)中Cd含量]。
1.4 统计学分析数据采用SPSS 17.0软件处理,数据重复3次,以均值±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用Duncan检验。相关分析采用Pearson相关分析。P < 0.05表示差异有统计学意义。
2 结果与分析 2.1 Cd胁迫对文山川芎不同部位Cd积累及转运特性的影响Cd处理下,文山川芎4种器官中的Cd含量均随着Cd处理浓度的增加而显著上升。各部分Cd的积累表现为须根>根茎>地上茎>叶。与其他部位相比,须根作为元素的直接吸收器官,富集的Cd最多,50、100 μmol/L Cd处理下,须根中Cd含量为604.43、1 071.22 mg/kg,远超过根茎、地上茎和叶片。见图 1。

|
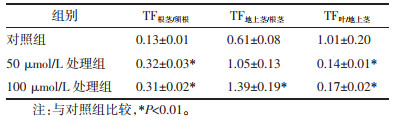
| 注:与对照组比较,*P<0.01;与50 μmol/L处理组比较,#P<0.01。 图 1 Cd处理对文山川芎不同器官中Cd含量的影响(x±s) |
文山川芎Cd的转运特性如表 1所示。从中可以看出,须根有较强的截留Cd的能力。对照中,TF根茎/须根仅为0.13;50、100 μmol/L的Cd处理虽与对照相比显著提高,但TF根茎/须根也仅为0.32、0.31,表明大部分Cd留在了须根中。与须根不同,根茎向地上茎转运Cd的能力较强,且Cd处理浓度越高,转运系数越大。100 μmol/L Cd处理下,TF地上茎/根茎为1.39,显著高于对照中的0.61。另外,两种浓度Cd处理显著降低了Cd从地上茎向叶片的运输。50、100 μmol/L Cd处理下,TF地上茎/根茎分别为0.14、0.17,显著低于对照中的1.01。
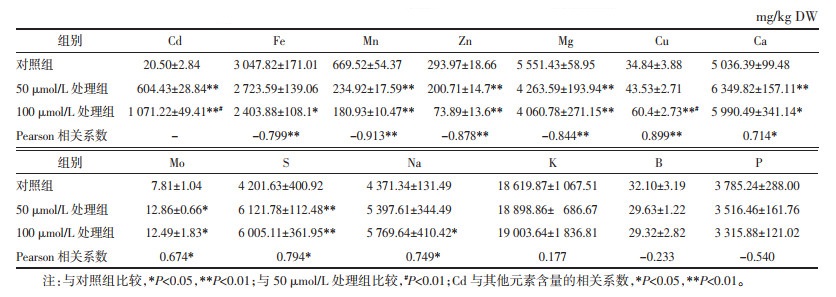
Cd处理对文山川芎须根中12种元素的影响如表 2所示。从中可以看出,须根中各元素的含量与对照相比有3种类型:1)Fe、Zn、Mn、Mg含量随着处理Cd浓度的升高而显著下降,4种元素含量与Cd浓度呈显著负相关。2)Cu、Ca、Mo、Na、S含量在两种浓度的Cd处理下均显著高于对照,Cd浓度与5种元素含量分别呈显著正相关。3)K、B、P含量处理与对照间没有统计学差异,但从变化趋势来看,K元素含量随Cd处理浓度上升有所增加,而B、P含量则下降。
从表 3可以看出,与对照相比,根茎中Fe、Zn、Mg含量与Cd浓度呈显著负相关。Mn元素在50 μmol/L Cd处理下的含量与对照没有显著差别,但在100 μmol/L Cd处理的根茎中,Mn含量显著低于对照,表明较高浓度的Cd处理会抑制根茎对Mn的吸收。另外,100 μmol/L Cd处理显著降低了根茎中Cu、Ca两种元素的含量,但提高了K元素的浓度。与对照相比,根茎中Na含量在50 μmol/L Cd处理下显著增加,100 μmol/L处理下则又下降到近似对照水平。Mo、S、P、B 4种元素含量与对照没有统计学差异。
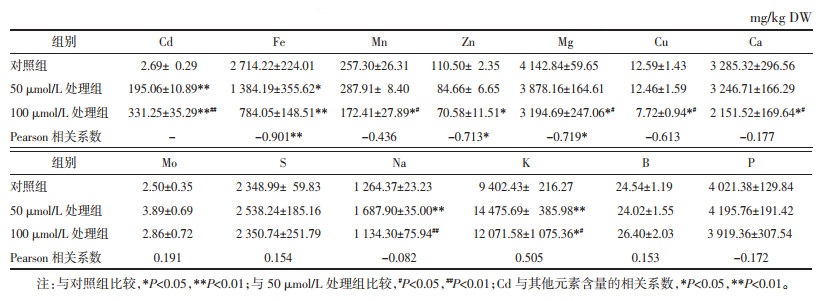
Cd处理对文山川芎地上茎中矿质元素含量的影响如表 4所示。从中可以看出,与对照相比,地上茎中Fe、Mg、Mo、K含量均显著降低。50 μmol/L Cd处理下,S、Na、P含量与对照没有统计学差异,但100 μmol/L Cd处理则使S含量显著上升,Na、P含量显著下降,表明较高浓度的Cd处理可在地上茎中抑制Na、P而促进S的吸收。Mn、Zn、Cu、Ca、B含量与对照相比没有统计学差异。
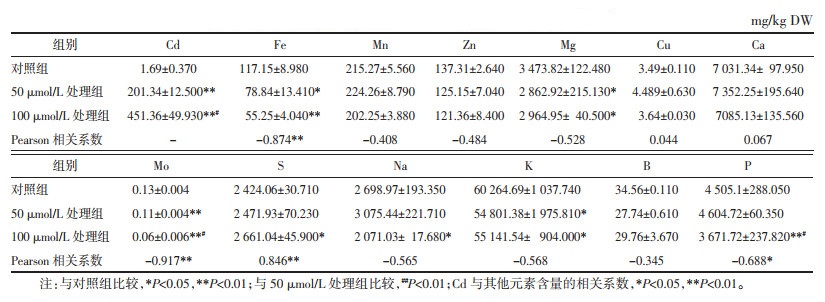
从表 5可以看出,与对照相比,叶片中Fe、Zn、Cu、Na 4种元素含量显著下降,与Cd浓度呈显著负相关。Mg、Ca、S、B含量则增加,且Mg、Ca、S含量与Cd呈统计学正相关。其余4种元素虽然处理与对照间没有统计学差异,但Mn含量在100 μmol/L处理下有比较明显的上升;Mo元素含量则随Cd浓度上升而下降;P元素含量在50 μmol/L Cd处理下上升,100 μmol/L处理下下降;K含量与对照含量相近,没有明显变化。
不同物种、同一物种的不同基因型或同一植株的不同部位积累某种元素的能力不同[5]。根系通常较地上部分会积累更多的Cd[6-7],文山川芎中也得到了相似的结果。须根是积累Cd最多的器官,且其对Cd截留作用明显,两种浓度的Cd处理下,只有约30 %的Cd被转运到根茎。由于须根没有药用及食用价值且容易去除,因此,其对Cd的截留作用对于文山川芎的安全利用有重要意义。
根茎与地上茎中积累的Cd虽低于须根,但远高于叶片。50、100 μmol/L CdCl2处理下,根茎、地上茎中Cd含量分别为195.06、331.25和201.34 mg/kg DW、451.36 mg/kg DW,远远高于叶片中的28.01、74.51 mg/kg DW。这一结果提示,无论是入药部位,还是食用部分,在Cd污染地区生长的文山川芎中Cd含量超标的风险均较大。尤其是药用部位根茎,应慎重使用,避免给患者带来健康风险。文山川芎地上部分长势旺盛,叶片繁茂,在作为蔬菜食用时,应尽量以叶片为主,少食用或不食用茎秆,以最大限度保障食用安全。
3.2 Cd污染环境对文山川芎无机元素含量的影响中药材中的无机元素与其疗效密切相关[8]。尤其是微量元素,摄入过量、缺乏或不平衡,都会不同程度地引起人体生理的异常或引发身体机能病变[9]。本研究检测了文山川芎中除Cd以外11种必须元素[铁(Fe)、锌(Zn)、锰(Mn)、铜(Cu)、硼(B)、钼(Mo)、镁(Mg)、钙(Ca)、硫(S)、钾(K)、磷(P)]、1种有益元素[钠(Na)]的含量,与对照相比,作为入药部位的根茎中元素含量发生显著改变的有8种,可食用部位地上茎中7种,叶片中8种。其中,从微量元素来看,作为入药部位的根茎中,Fe、Mn、Zn、Cu含量显著下降;可食用部位地上茎和叶片中的Fe、Zn、Mn、Mo和Fe、Zn、Mn、Cu含量也分别出现了明显改变。这一结果表明,在Cd污染地区生长的药用植物,除了可能具有Cd含量超标的安全隐患外,元素间的平衡也会被打破,影响药材的质量,进而对疗效产生影响。因此,药用植物的栽培中,应严格保障栽培环境的安全,在土壤、空气质量符合国家规定的道地产区进行生产。
3.3 Cd污染环境下文山川芎中矿质元素含量变化的原因探讨 3.3.1 Cd污染环境对文山川芎中微量元素的影响植物细胞中没有专门的Cd运输载体[10],但其可以通过Fe、Zn、Ca等必需元素的转运蛋白或通道蛋白进入到植物根系。如锌铁转运蛋白(ZIP)家族蛋白、天然抗性相关巨噬细胞蛋白(Nramp)家族蛋白等,都具有吸收、转运多种2价金属离子Zn、Fe、Mn、Cd等元素的功能[11-12]。当外界环境中Cd供应较多时,Cd与Zn、Fe、Mn等元素可能因共用上述相同的转运蛋白而产生竞争性抑制,最终导致植物体内Zn、Fe等元素含量的下降[13]。本研究检测的文山川芎12种元素中,Fe、Zn元素受Cd影响最大,在4种器官中均呈下降趋势,表明Cd很可能与Fe、Zn共用相同的载体或通道蛋白,因营养液中Cd的过量供应与Fe、Zn产生了竞争性抑制,最终降低了各器官中Fe、Zn的吸收及向上转运。
Cd对文山川芎中Mn含量的影响与Zn、Fe有所不同。在须根、根茎中显著降低,而叶片中却明显增加。造成这一现象的原因,一方面可能与Zn、Fe相似,Mn与Cd共用载体或通道蛋白,Cd的大量结合导致Mn吸收受阻;另一方面,可能是Cd处理改变了Mn在文山川芎中的分配。研究表明,外源添加Mn可使Cd胁迫下植物叶绿素的合成增加、类囊体结构恢复、保护酶活性提高[14-15]。Carvaiho等[16]认为,植物可通过对Mn在不同器官中的重新分配,使其在叶中更多积累,以降低Cd带来的毒害。因此,Cd胁迫下文山川芎叶片中Mn含量的上升,很可能是为了保障植株正常生长或解毒的需要,Mn更多地被向地上部转运,而这种转运也是最终造成地下须根及根茎中Mn含量降低的另一个原因。
在对西红柿[17]、向日葵[18]、白羽扇豆[19]等植物的研究中发现,根系中Cd与Cu表现出协同作用,Cu含量随Cd浓度的上升而增加,在叶片中则显著下降。本研究中得到了相似的结果:Cd处理下,文山川芎须根中Cu含量增加,根茎、叶片中降低。须根中Cu与Cd的协同吸收可能与文山川芎的解毒有关。Kudo等[20]报道,大麦根系质膜中Cu比Cd可以更快地在质膜囊泡上结合,从而阻碍过量Cd的吸收。作为直接的吸收器官,文山川芎须根中Cd与Cu的协同作用很可能是其为了避免更多的Cd进入细胞的一种保护机制。另外,植物维管组织的功能也可能会受到Cd胁迫的影响而发生改变,使Cu的转运受阻[19],导致根茎、叶片中Cu含量降低。
B可以影响植物细胞壁结构和组成,进而影响Cd与细胞壁组分的螯合,在阻止Cd进入细胞中发挥着重要作用[21-22]。Mo对Cd胁迫下根、茎的发育都有促进作用[23]。本研究中,Cd处理对文山川芎中B、Mo元素在不同器官中的影响不同,可能与其解毒过程造成的重新分配有关。
3.3.2 Cd胁迫对文山川芎大量元素含量的影响S与植物对Cd的耐受性密切相关[24]。Cd胁迫下,文山川芎须根、地上茎和叶片对S的积累显著增加,与Bertoli等[17]、Kupper等[25]在西红柿、遏蓝菜中的研究结果一致。S参与富含半胱氨酸的谷胱甘肽、植物螯合肽、金属硫蛋白等物质的合成[17],这些物质与Cd的结合能够降低Cd对植物的危害,是植物受到Cd胁迫后的自我保护以及解毒机制。
Mg含量在文山川芎须根、根茎、地上茎中较对照显著下降,在叶片中明显上升。研究表明,植物根系中Mg含量的降低有助于植物适应Cd胁迫[26]。Chou等[27]报道,低Mg供应可以提高水稻中的抗氧化潜能,从而提高其对Cd的耐受性。另外,Mg是叶绿素的重要成分,叶片中Mg的增加能够抑制Cd结合叶绿素或酶的催化位点[25],从而维持光合器官的功能。
文山川芎的须根、叶片中,Ca的吸收与香蒲[28]、风滚草[29]中一样,与Cd表现出协同作用,随Cd浓度的升高而增加。Ca的增加是植物对抗Cd毒害的一种自我保护机制,Cd促进Ca离子通道和转运蛋白的转录和翻译,以弥补Cd对Ca离子通道的阻滞作用,进而增加了对Ca的吸收[29]。根茎中Ca含量的降低则可能与其向地上部转运增加有关。
与对照相比,文山川芎中K含量只在根茎中上升、地上茎中下降,P则只是在地上茎中显著下降。两种元素在其他部位的含量与对照相比虽有变化,但均不显著。这些结果表明,Cd污染条件下,文山川芎中K、P的吸收和积累受Cd胁迫的影响较小。另外,Na一般认为对植物的生长有益,Cd胁迫下,文山川芎中Na含量变化明显,可能也与植物的适应性有关。
需要说明的是,本研究中,在未添加CdCl2的营养液中生长的文山川芎4种器官中也检测出1.86~20.5 mg/kg DW的Cd。造成这一现象的原因,可能是由于使用的文山川芎繁殖器官为地下根茎,在其原生境中含有Cd,因此根茎中本就积累了一定量的Cd,而水培过程中,Cd在各器官间进行了再分配。王树凤等[30]在杞柳中、张圆圆等[31]在东南景天中均发现过类似现象。另外,也可能是配制营养液的部分试剂被污染或含量不纯、混有重金属元素等所致。
| [1] |
CHUNHABUNDIT R. Cadmium exposure and potential health risk from foods in contaminated area, Thailand[J]. Toxicological Research, 2006, 32(1): 65-72. |
| [2] |
URAGUCHI S, MORI S, KURAMATA M, et al. Root-to-shoot Cd translocation via the xylem is the major process determining shoot and grain cadmium accumulation in rice[J]. Journal of Experimental Botany, 2009, 60(9): 2677-2688. DOI:10.1093/jxb/erp119 |
| [3] |
张旭辉, 熊庆, 栗旸. 云南农田土壤中铅、镉、铬水平及分布规律[J]. 环境与职业医学, 2019, 36(3): 238-241. ZHANG X H, XIONG Q, LI Y. Concentrations of lead, cadmium, and chromium in farmland soil in Yunnan[J]. Journal of Environmental & Occupational Medicine, 2019, 36(3): 238-241. |
| [4] |
赵晓慧, 王瑾. 云南不同地区稻谷中5种重金属元素分布特征[J]. 食品安全质量检测学报, 2019, 10(22): 7738-7743. ZHAO X H, WANG J. Distribution characteristics of 5 heavy metal elements in rice in different regions of Yunnan[J]. Food Safety and Quality Detection Technology, 2019, 10(22): 7738-7743. |
| [5] |
CARVALHO M E A, PIOTTO F A, GAZIOLA S A, et al. New insights about cadmium impacts on tomato: plant acclimation, nutritional changes, fruit quality and yield[J]. Food and Energy Security, 2018, 7(2): e00131. DOI:10.1002/fes3.131 |
| [6] |
PIOTTO F A, CARVAIHO M E A, SOUZA L A, et al. Estimating tomato tolerance to heavy metal toxicity: cadmium as study case[J]. Environmental Science and Pollution Research, 2018, 25(6): 27535-27544. |
| [7] |
KATO F H, CARVALHO M E A, GAZIOLA S A, et al. Lysine metabolism and amino acid profile in maize grains from plants subjected to cadmium exposure[J]. Scientia Agricola, 2019, 77(1): 2020. |
| [8] |
汤舒, 陈永刚, 邹吉利. 中药材黄芪中无机元素含量的环境影响因素的Logistic回归分析[J]. 世界中医药, 2019, 14(12): 3160-3163. TANG S, CHEN Y G, ZOU J L. Logistic regression analysis of environmental factors influencing the content of inorganic elements in Radix Astragali seu Hedysari[J]. World Chinese Medicine, 2019, 14(12): 3160-3163. DOI:10.3969/j.issn.1673-7202.2019.12.013 |
| [9] |
濮玲, 李海朝, 濮御, 等. 十二种常用中草药中微量元素的主成分分析[J]. 广西师范大学学报(自然科学版), 2014, 32(4): 96-100. PU L, LI H C, PU Y, et al. Principal component analysis of trace elements in 12 commonly used Chinese herbal medicines[J]. Journal of Guangxi Normal University(Natural Science Edition), 2014, 32(4): 96-100. |
| [10] |
HUANG D, GONG X, LIU Y, et al. Effects of calcium at toxic concentrations of cadmium in plants[J]. Planta, 2017, 245(5): 863-873. DOI:10.1007/s00425-017-2664-1 |
| [11] |
CHEN W R, FENG Y, CHAO Y E. Genomic analysis and expression pattern of OsZIP1, OsZIP3, and OsZIP4 in two rice (Oryza sativa L.) genotypes with different zinc efficiency[J]. Russian Journal of Plant Physiology, 2008, 55(3): 400-409. DOI:10.1134/S1021443708030175 |
| [12] |
曹玉巧, 聂庆凯, 高云, 等. 植物中镉及其螯合物相关转运蛋白研究进展[J]. 作物杂志, 2018, 34(3): 15-24. CAO Y Q, NIE Q K, GAO Y, et al. The studies on Cadmium and its chelate related transporters in plants[J]. Crops, 2018, 34(3): 15-24. |
| [13] |
MOURATO M, PINTO F, MOREIRA I, et al. The effect of Cd stress in mineral nutrient uptake in plants[J]. Cadmium Toxicity and Tolerance in Plants, 2019, 10(33): 327-348. |
| [14] |
RAHMAN A, NAHAR K, HASANUZZAMAN M, et al. Manganese-induced cadmium stress tolerance in rice seedlings: coordinated action of antioxidant defense, glyoxalase system and nutrient homeostasis[J]. Comptes Rendus Biologies, 2016, 339(11-12): 462-474. DOI:10.1016/j.crvi.2016.08.002 |
| [15] |
LIU H, ZHANG Y, CHAI T, et al. Manganese-mitigation of cadmium toxicity to seedling growth of Phytolacca acinosa Roxb. is controlled by the manganese/cadmium molar ratio under hydroponic conditions[J]. Plant Physiology and Biochemistry, 2013, 73(6): 144-153. |
| [16] |
CARVAIHO M E A, PIOTTO A F, FRANCO M R, et al. Relationship between Mg, B and Mn status and tomato tolerance against Cd Toxicity[J]. Journal of Environmental Management, 2019, 240(5): 84-92. |
| [17] |
BERTOLI A, GABRIEL C M, Carvalho R, et al. Lycopersicon esculentum submitted to Cd-stressful conditions in nutrition solution: nutrient contents and translocation[J]. Ecotoxicology and Environmental Safety, 2012, 86(19): 176-181. |
| [18] |
RIVELLI A R, PUSCHENREITER M, DE M S. Assessment of cadmium uptake and nutrient content in sunflower plants grown under Cd stress[J]. Plant Soil and Environment, 2014, 60(2): 80-86. DOI:10.17221/520/2013-PSE |
| [19] |
ZORNOZA P, VAZQUEZ S, ESTEBAN E, et al. Cadmium stress in nodulated white lupin: strategies to avoid toxicity[J]. Plant Physiology and Biochemistry, 2002, 40(12): 1003-1009. DOI:10.1016/S0981-9428(02)01464-X |
| [20] |
KUDO H, KUDO K, AMBO H, et al. Cadmium sorption to plasma membrane isolated from barley roots is impeded by copper association onto membranes[J]. Plant Science, 2011, 180(2): 300-305. DOI:10.1016/j.plantsci.2010.09.008 |
| [21] |
PENG J S, WANG Y J, DING G, et al. A pivotal role of cell wall in cadmium accumulation in the Crassulaceae hyperaccumulator sedum plumbizincicola[J]. Molecular Plant, 2017, 10(5): 771-774. DOI:10.1016/j.molp.2016.12.007 |
| [22] |
SHARMA S S, DIETZ K J, MIMURA T. Vacuolar compartmentalization as indispensable component of heavy metal detoxification in plants[J]. Plant, Cell&Environment, 2016, 39(5): 1112-1126. |
| [23] |
HAN Z, WEI X, WAN D, et al. Effect of molybdenum on plant physiology and Cadmium uptake and translocation in rape (Brassica napus L.) under different levels of Cadmium stress[J]. International Journal of Environmental Research and Public Health, 2020, 17(7): 2355. DOI:10.3390/ijerph17072355 |
| [24] |
GALLEGO S M, PENA L B, BARCIA R A, et al. Unravelling cadmium toxicity and tolerance in plants: insight into regulatory mechanisms[J]. Environmental and Experimental Botany, 2012, 83(12): 33-46. |
| [25] |
KUPPER H, KOCHIAN L V. Transcriptional regulation of metal transport genes and mineral nutrition during acclimatization to cadmium and zinc in the Cd/Zn hyperaccumulator, Thlaspi caerulescens (Ganges population)[J]. New Phytologist, 2009, 185(1): 114-129. |
| [26] |
CARVALHO M E A, PIOTTO F A, GAZIOLA S A, et al. New insights about cadmium impacts on tomato: plant acclimation, nutritional changes, fruit quality and yield[J]. Food and Energy Security, 2018, 7(2): e00131. DOI:10.1002/fes3.131 |
| [27] |
CHOU T S, CHAO Y Y, HUANG W D, et al. Effect of magnesium deficiency on antioxidant status and cadmium toxicity in rice seedlings[J]. Journal of Plant Physiology, 2011, 168(10): 1021-1030. DOI:10.1016/j.jplph.2010.12.004 |
| [28] |
BAH A M, DAI H, ZHAO J, et al. Effects of Cadmium, Chromium and lead on growth, metal uptake and antioxidative capacity in typha angustifolia[J]. Biological Trace Element Research, 2010, 142(1): 77-92. |
| [29] |
ROSA G D L, ALEJANDRO M M, PELAYO H, et al. Production of low-molecular weight thiols as a response to cadmium uptake by tumbleweed(Salsola kali)[J]. Plant Physiology & Biochemistry, 2005, 43(5): 491-498. |
| [30] |
王树凤, 施翔, 孙海菁, 等. 镉胁迫下杞柳对金属元素的吸收及其根系形态构型特征[J]. 生态学报, 2013, 33(19): 6065-6073. WANG S F, SHI X, SUN H J, et al. Metal uptake and root morphological changes for two varieties of Salix integra under cadmium stress[J]. Acta Ecologica Sinica, 2013, 33(19): 6065-6073. |
| [31] |
张圆圆, 窦春英, 姚芳, 等. 氮素营养对重金属超积累植物东南景天吸收积累锌和镉的影响[J]. 浙江林学院学报, 2010, 27(6): 831-838. ZHANG Y Y, DOU C Y, YAO F, et al. Nitrogen application to enhance zinc and cadmium uptake by the hyperaccumulator Sedum alfredii[J]. Journal of ZheJiang Forestry College, 2010, 27(6): 831-838. |
 2021, Vol. 40
2021, Vol. 40