文章信息
- 金艳, 傅增辉, 林再红, 姜岩, 刘晶, 杜姝, 张广萍, 陈团团
- JIN Yan, FU Zenghui, LIN Zaihong, JIANG Yan, LIU Jing, DU Shu, ZHANG Guangping, CHEN Tuantuan
- 白桦脂醇对老年痴呆模型大鼠海马神经元APH-1及PEN-2表达的影响
- Effect of betulin on the expression of APH-1 and PEN-2 in hippocampal neurons of Alzheimer's model rats
- 天津中医药大学学报, 2021, 40(3): 384-388
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(3): 384-388
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.03.22
-
文章历史
收稿日期: 2021-01-22
阿尔兹海默病(AD)是老年期痴呆症最常见的类型,是以进行性认知功能障碍和行为障碍为特征的中枢神经系统退行性病变[1-2]。AD发病机制复杂,至今没有特效的治疗药物,大大增加了社会的医疗费用支出。白桦脂醇是白桦提取物的主要活性成分,实验发现其生物活性多样,用量高的同时毒性非常低,白桦脂肪醇和白桦酸及其衍生物的研究成为最近天然有机药物的研究热点[3]。研究表明,白桦脂醇在延缓衰老等方面显示出巨大的潜力[4-6],特别是对痴呆大鼠模型显示出显著改善认知功能的作用[7]。本研究旨在观察白桦脂醇对老年痴呆模型大鼠认知功能的保护作用,探讨白桦脂醇对老年痴呆模型大鼠的干预作用及可能机制,为AD的治疗提供新的可能性。检测模型大鼠海马CA1区γ分泌酶活性及淀粉样前体蛋白(APP)、Tau、中前咽缺陷蛋白-1(APH-1)、缺氧诱导因子-1(HIF-1)、早老蛋白增强子-2(PEN-2)和环磷酸腺苷效应元件结合蛋白(CREB)的表达。
1 材料和方法 1.1 实验动物健康成年SD大鼠48只,SPF级,体质量(220±20)g,雌雄各半,均由齐齐哈尔医学院实验动物中心提供,注册号:SCXK(黑)2016-001。
1.2 主要仪器与试剂白桦脂醇,大兴安岭林格贝寒带生物产业公司提供;D-半乳糖,上海国药公司提供;Aβ25-35,美国Sigma公司提供;免疫荧光试剂盒,美国Focus公司提供;兔抗鼠多克隆抗体,美国Abbkine公司提供;Revert Aid First Strand cDNA synthesis、SYBR Premix Ex TaqTM、ROXReference DyeⅡ,美国Thermo Fisher公司提供。
1.3 实验分组及模型制备实验动物在标准环境适应性饲养1周后,随机分为对照组、模型组、白桦脂醇低、高剂量组,每组12只。模型组:皮下注射D-半乳糖150 mg/kg,每日1次,连续6周,第7周双侧海马注射4 nmol/L的Aβ25-35(生理盐水溶解);对照组:皮下注射等量生理盐水,连续6周,第7周双侧海马注射等量生理盐水;白桦脂醇低和高剂量组:皮下及双侧海马注射与模型组相同,第1天即开始按照1 kg体质量每天分别给予低剂量(25 mg/L)和高剂量(50 mg/L)白桦脂醇灌胃,连续8周,对照组和模型组每天给予等剂量的生理盐水灌胃,连续8周。各组动物每周记录1次体质量,调整注射剂量。
1.4 采用Morris水迷宫实验进行大鼠学习与记忆行为测试用药结束后,进行定位航行实验和空间探索实验。在训练期间,连续6 d每天进行4次实验,第7天进行1次试探实验。在试探实验期间,允许大鼠自由探索1 min,然后将平台从池的目标象限中移出。使用自动跟踪系统(Ethovision XT软件)监视这些数据以进行大鼠性能分析。
1.5 采用双荧光素酶报告基因系统检测γ分泌酶活性行为学实验结束后,每组剩余8只大鼠断颈处死,分离出海马CA1区,制成组织均浆,2 000 r/min离心15 min,离心半径为15 cm,离心后,吸取上清液制备组织匀浆。取组织匀浆100 μL加入250 μL的lxpassive lysis buffer,重悬细胞,2 000 r/min离心15 min,离心半径为15 cm,离心后,取上清加入100 μL的Luciferase Assay Buffer Ⅱ,再加入20 μL样品打均,读取luciferase值;再加100 μL的stop&Glo Buffer混匀,读取renilla值。
1.6 采用实时定量-聚合酶链反应(RT-PCR)法检测APH-1、HIF-1、PEN-2和CREB mRNA水平取“1.5”步骤中组织匀浆提取总RNA,按照Taraka试剂盒操作流程提取RNA,经Nanodrop1000分光光度计分析,A260/A280为1.8~2.0,即提取的RNA浓度和纯度合格。按逆转录试剂盒操作说明将提取RNA逆转录为cDNA,按SYBR Green说明进行。PCR扩增,模板为cDNA。PCR反应体系10 μL:2×SYBRGreen 5 μL,Forward Primer 0.3 μL,Reverse Primer 0.3 μL,cDNA 1 μL,ddH2O 3.4 μL;反应条件:95 ℃、10 min,94 ℃、20 s,60 ℃、60 s,40个循环。以β-actin为内参,采用2-ΔΔCT法计算CENPK相对水平。实验重复3次,以平均值作为最终结果。引物序列:PEN-2上游引物5’-ACACAGAGCAGAGCCAA-ATCAAAGG-3’,下游引物5’-CAGGGGAATGGTG- AAGGAGAGGTAG-3’;CREB上游引物5’-ACCA- TTGCCCCTGGAGTTGTTAT-3’,下游引物5’-CTC- TTGCTGCCTCCCTGTTCTTC-3’;APH-1上游引物5’-ATGCACCTTCGTCGCGTTCG-3’,下游引物5’-AGAAGGACAGAGACAGCAGCACCAA-3’;HIF-1上游引物5’-GATGAATCAAAAACAGAGACGAAGG-3’,下游引物5’-CTGATGCCTTAGCAGTGGTCGT-3’;β-actin上游引物5’-GCCTTCCTTCTTGGGTAT-3’,下游引物5’-GGCATAGAGGTCTTTACGG-3’。
1.7 采用蛋白免疫印迹(Western Blot)法检测APH-1、HIF-1、PEN-2和CREB蛋白水平取“1.5”步骤中组织匀浆提取总蛋白,在95 ℃下于2× buffe 5 min,10% SDS-PAGE分离30 μg总蛋白。然后将这些样品的蛋白质以100 V电泳1 h转移到PVDF膜上(Bio-Rad,美国)。用Tris buffe Saline-Tween 20及5%脱脂牛奶将膜封闭。清洗后,用1∶1 000稀释的兔抗鼠抗APH-1、HIF-1、PEN-2和CREB的一抗在4 ℃过夜,然后与兔抗鼠抗第二抗体一起孵育。用Syngene仪器(Syngene,USA)检测,使用Syngene Software对图像进行光密度分析。
1.8 统计学分析使用SPSS 22.0统计软件进行分析,计量资料采用均数±标准差(x±s)表示,多组间均数比较采用单因素方差分析,组间两两比较采用LSD检验,P<0.05表示差异具有统计学意义。
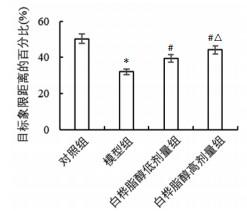
2 结果 2.1 白桦脂醇对大鼠学习与记忆行为的影响水迷宫实验结果发现,与对照组比较,模型组逃避潜伏期(EL)延长(P<0.01),且运动轨迹杂乱;与模型组比较,白桦脂醇低、高剂量组EL均减少(P<0.01),说明大鼠的空间学习能力较模型组有所改善;药物高剂量组较低剂量组EL亦缩短(P<0.05)。与模型组相比,各剂量药物组能明显改善大鼠搜寻策略,游泳运行轨迹接近正常的直线型。见表 1及图 1。
|
| 注:与对照组比较,*P<0.01;与模型组比较,#P<0.01;与白桦脂醇低剂量组比较,ΔP<0.05。 图 1 空间探索实验目标象限距离的百分比(x±s,n=12) |
与对照组比较,模型组γ分泌酶活性显著增高(P < 0.01);与模型组比较,白桦脂醇低、高剂量组的γ分泌酶活性显著降低(P < 0.05或P < 0.01);与白桦脂醇低剂量组比较,白桦脂醇高剂量组分泌酶活性增高显著(P<0.05)。见图 2。
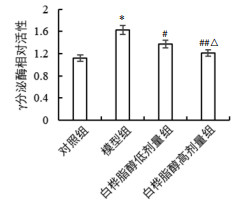
|
| 注:与对照组比较,*P<0.01;与模型组比较,#P<0.01;与白桦脂醇低剂量组比较,ΔP<0.05。 图 2 大鼠海马CA1区γ分泌酶活性(x±s,n=12) |
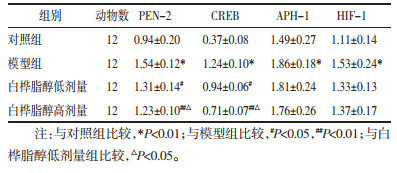
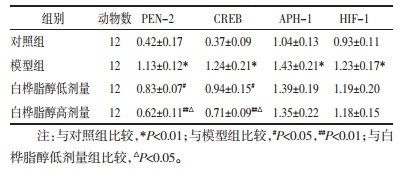
与对照组比较,模型组大鼠APH-l mRNA、PEN-2 mRNA、CREB mRNA及HIF-l mRNA水平均显著升高(P < 0.01);与模型组比较,白桦脂醇低、高剂量组APH-1 mRNA和HIF-l mRNA水平差异均无统计学意义(P > 0.05),PEN-2 mRNA和CREB mRNA水平显著升高(P < 0.05或P < 0.01);与白桦脂醇低剂量组比较,白桦脂醇高剂量组PEN-2 mRNA和CREB mRNA水平显著降低(P < 0.01),而APH-1 mRNA和HIF-l mRNA水平差异均无统计学意义(P > 0.05)。见表 2。
与对照组比较,模型组大鼠APH-l、PEN-2、CREB及HIF-1蛋白表达均显著升高(P < 0.01);与模型组比较,白桦脂醇低、高剂量组APH-1和HIF-l蛋白表达差异均无统计学意义(P > 0.05),PEN-2和CREB蛋白表达显著升高(P < 0.05或P < 0.01);与白桦脂醇低剂量组比较,高剂量组PEN-2和CREB蛋白表达显著降低(P < 0.01),而APH-1和HIF-l蛋白表达差异均无统计学意义(P > 0.05)。见表 3及图 3。
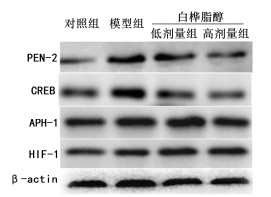
|
| 图 3 大鼠海马CA1区APH-1、HIF-1、PEN-2和CREB蛋白电泳图 |
AD发病机制最重要的假说是Aβ假说,Aβ的神经毒性损伤神经元的正常功能,导致神经元死亡,因此,阻碍Aβ和Tau蛋白的产生被认为是AD的潜在治疗策略[8-10]。转基因模型是目前研究AD的常见动物模型,通过转入不同的基因,可以从分子水平上模拟AD的发病,保证模型能够稳定地表达AD的症状和病理机制[11]。本实验采用双基因重组AD模型,比起单基因重组AD模型,可以表现AD自身的复杂性和病理范围的广泛性,而且与AD的病理变化相近,同时表达APP和PS1两种基因的转基因小鼠的淀粉样蛋白沉积加速,不仅脑内Aβ沉积加快,而且还伴随着相应的神经行为功能障碍[12-13]。γ分泌酶是决定Tau蛋白生成的关键剪切酶,γ分泌酶是一种天冬氨酸类蛋白水解酶,由早老素(PS)、单过性跨膜蛋白(NCT)和APH-1、PEN-2组成的复合体[14-17]。
PS是γ分泌酶的催化中心,PS1和PS2在第6位有两个保守的天冬氨酸残基[18]。PS1可以与Aph-1进行免疫共沉淀[19-21]。参与APP水解的分泌酶有α、β及γ 3类,通过两种代谢途径在内吞小体-溶酶体系统内进行,一种是非Tau蛋白生成途径,不难看出,γ分泌酶是Tau蛋白生成所必须的关键酶,是治疗AD的一个潜在靶点[22-23]。
研究结果显示,结合位点显著提高了APH-1的表达,增加了γ分泌酶的活性,导致Tau的产生增加而诱发AD,而且不参与γ分泌酶APH-1相关调控基因。老年痴呆模型大鼠脑海马组织PEN-2基因启动子CREB结合位点活化,提高PEN-2的表达,增加γ分泌酶活性,而且减低其对PEN-2基因启动子CREB结合位点的活性,降低了PEN-2的表达,抑制了γ分泌酶的活性,参与AD的发生发展。
本研究采用动物行为学、免疫荧光、RT-PCR、Western Blot等方法,研究了白桦脂醇对APH-1和PEN-2基因通路的调节作用。本研究证实,白桦蛋白能显著改善老年痴呆模型大鼠的行为,改善学习记忆能力和空间认知能力,显著降低老年痴呆模型大鼠PEN-2相关基因和蛋白表达,但对APH-1a相关基因和蛋白无显著影响,推测其作用机制可能与抑制γ-分泌酶活性、抑制CREB蛋白活性、下调PEN-2蛋白表达、抑制γ分泌酶活性有关。
| [1] |
KUMAR K, KUMAR A, KEEGAN R M, et al. Recent advances in the neurobiology and neuropharmacology of Alzheimer's disease[J]. Biomedicine & Pharmacotherapy, 2017, 20(98): 297-307. |
| [2] |
傅增辉, 姜岩, 刘晶, 等. 仙茅苷对局灶性脑缺血/再灌注大鼠轴突再生及Akt/GSK-3β/CRMP-2表达的影响[J]. 神经解剖学杂志, 2018, 34(1): 48-52. FU Z H, JIANG Y, LIU J, et al. Curculigoside regulates Akt/GSK-3β/CRMP-2 expression and axonal regeneration in MCAO rats[J]. Journal of Neuroanatomy, 2018, 34(1): 48-52. |
| [3] |
LATOCHA M, MERTAS A, CZUBA Z, et al. Novel triazole hybrids of betulin:synthesis and biological activity profile[J]. Molecules, 2017, 11(1): 11-22. |
| [4] |
MA C, LONG H. Protective effect of betulin on cognitive decline in streptozotocin(STZ)-induced diabetic rats[J]. Neurotoxicology, 2016, 57(11): 104-111. |
| [5] |
傅增辉, 金艳, 林再红, 等. 白桦脂醇对慢性应激抑郁模型大鼠行为及神经营养因子表达的影响[J]. 解剖学杂志, 2020, 43(3): 200-205. FU Z H, JIN Y, LIN Z H, et al. Effect of betula platyphylla on behavior and expression of neurotrophic factor in rats with chronic stress depression[J]. Journal of Anatomy, 2020, 43(3): 200-205. DOI:10.3969/j.issn.1001-1633.2020.03.005 |
| [6] |
傅增辉, 姜岩, 刘晶, 等. 白桦脂醇对Aβ25-35诱导的PC12细胞氧化应激和凋亡的影响[J]. 中国比较医学杂志, 2020, 30(6): 54-61. FU Z H, JIANG Y, LIU J, et al. Effects of Betula alcohol on oxidative stress and apoptosis induced by Aβ25-35 in PC12 cells[J]. Chinese Journal of Comparative Medicine, 2020, 30(6): 54-61. DOI:10.3969/j.issn.1671-7856.2020.06.008 |
| [7] |
CHO N, LEE H K, JEON B J, et al. The effects of Betula platyphylla bark on amyloid beta-induced learning and memory impairment in mice[J]. Food and Chemical Toxicology, 2014, 74(11): 156-163. |
| [8] |
张学君, 刘静, 林雨芳, 等. 针刺后海穴对血管性痴呆大鼠学习记忆能力及海马CA1区突触素蛋白表达和超微结构的影响[J]. 天津中医药大学学报, 2013, 32(2): 87-91. ZHANG X J, LIU J, LIN Y F, et al. The effect of the Houhai acupoint acupuncture on learning and memory ability as well as the synaptic protein expression and neuronal ultrastructure of the hippocampus CA1 region in vascular dementia rat[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2013, 32(2): 87-91. |
| [9] |
张亚新, 杜欢. Aβ诱导炎症反应在阿尔茨海默病的研究进展[J]. 天津中医药大学学报, 2014, 33(6): 378-380. ZHANG Y X, DU H. Research progress of Alzheimer's disease induced inflammation[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2014, 33(6): 378-380. |
| [10] |
DANSOKHO C, HENEKA M T. Neuroinflammatory responses in Alzheimer's disease[J]. Journal of Neural Transmission (Vienna), 2017, 22(11): 1831-1837. |
| [11] |
LOK K, ZHAO H, SHEN H, et al. Characterization of the APP/PS1 mouse model of Alzheimer's disease in senescence accelerated background[J]. Neurosci Lett, 2013, 55(7): 84-89. |
| [12] |
GALLA L, REDOLFI N, POZZAN T, et al. Intracellular calcium dysregulation by the Alzheimer's disease-linked protein presenilin 2[J]. Int J Mol Sci, 2020, 21(3): 770-771. DOI:10.3390/ijms21030770 |
| [13] |
SELKOE D J, HARDY J. The amyloid hypothesis of Alzheimer's disease at 25 years[J]. EMBO Mol Med, 2016, 8(6): 595-608. DOI:10.15252/emmm.201606210 |
| [14] |
JANKOWSKY J L, ZHENG H. Practical considerations for choosing a mouse model of Alzheimer's disease[J]. Molecular Neurodegeneration, 2017, 22(11): 89. |
| [15] |
GELMAN S, PALMA J, TOMBAUGH G, et al. Differences in synaptic dysfunction between RTg4510 and APP/PS1 mouse models of Alzheimer's disease[J]. Journal of Alzheimers Disease, 2018, 61(1): 195-208. |
| [16] |
HAAPASALO A, KOVACS D M. The many substrates of presenilin/gamma-secretase[J]. J Alzheimers Dis, 2011, 25(1): 23-28. |
| [17] |
HU C, XU J, ZENG L, et al. Pen-2 and presenilin are sufficient to catalyze notch processing[J]. Journal of Alzheimers Disease, 2017, 56(4): 1263-1269. DOI:10.3233/JAD-161094 |
| [18] |
SUN J, ROY S. The physical approximation of APP and BACE-1:a key event in alzheimer's disease pathogenesis[J]. Developmental Neurobiology, 2017, 6(11): 225-228. |
| [19] |
LEE J Y, FENG Z, XIE X Q, et al. Allosteric modulation of intact γ-Secretase structural dynamics[J]. Biophysical Journal, 2017, 113(12): 2634-2649. DOI:10.1016/j.bpj.2017.10.012 |
| [20] |
HU C, ZENG L, LI T, et al. Nicastrin is required for APP but not Notch processing, while Aph-1 is dispensable for processing of both APP and Notch[J]. Journal of Neurochemistry, 2015, 30(11): 3518-3522. |
| [21] |
SOGORB-ESTEVE A, GARCÍA-AYLLÓN M S, LLANSOLA M, et al. Inhibition of γ-Secretase leads to an increase in presenilin-1[J]. Molecular Neurobiology, 2017, 16(8): 705-710. |
| [22] |
SUNKARIA A, YADAV A, BHARDWAJ S, et al. Postnatal proteasome inhibition promotes amyloid-β aggregation in hippocampus and impairs spatial learning in adult mice[J]. Neuroscience, 2017, 26(11): 47-59. |
| [23] |
AMIRI S, AZADMANESH K, DEHGHAN S M. The Implication of androgens in the presence of protein kinase C to repair Alzheimer's disease-induced cognitive dysfunction[J]. Iranian Biomedical Journal, 2020, 24(2): 64-80. DOI:10.29252/ibj.24.2.64 |
 2021, Vol. 40
2021, Vol. 40