文章信息
- 冯京, 郑玉玲, 邢龄艺, 冉棋, 宋新波, 张丽娟, 李薇
- FENG Jing, ZHENG Yuling, XING Lingyi, RAN Qi, SONG Xinbo, ZHANG Lijuan, LI Wei
- 基于微流控技术的药敏实验方法在中药领域的应用概述及前景展望
- Overview and prospect of drug sensitivity test method based on microfluidic technology in traditional Chinese medicine
- 天津中医药大学学报, 2021, 40(3): 389-395
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(3): 389-395
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.03.23
-
文章历史
收稿日期: 2021-02-01
2. 天津现代创新中药科技有限公司, 天津 300191
2. Tianjin Modern Innovative Chinese Medicine Technology Co. Ltd., Tianjin 300191, China
药物敏感实验(简称药敏实验)是指在体外测定药物对细菌有无抑制或杀灭作用的实验。体外检测抗菌药物敏感性不仅能够指导临床合理用药,更重要的是可以初步判断潜在药物的抗菌效果,为新的抗菌药物的开发提供选择依据。随着细菌耐药性的出现,针对中药抑菌作用的研究开始得到广泛关注[1-3]。药敏实验是开发抗细菌感染中药的首要步骤,但由于中药的自身特性使常用的实验方法在应用中存在一定的局限性。而且现有的方法往往还具有用时较长、操作复杂、难于对药物作用过程实时监测的不足。因此寻找快速、准确的实验方法是高效筛选具有敏感性中药的核心,也是加快抗细菌感染中药研发的关键。
微流控技术是指将微小流体的分析实验室功能集成到芯片上的技术,又称芯片实验室或微全分析系统[4]。微流控技术具有分析速度快、低成本、高通量、高内涵、多功能集成等特点[5],已成为近年来备受关注的前沿分析技术之一,在生物化学、医药[6]、环境检测等领域广泛应用。将微流控技术应用于药敏实验不仅可以实时监测细菌在药物作用下的生长状态,还可以提高实验效率,减少试剂用量,缩短检测时间,更加自动化、便携化、集成化。
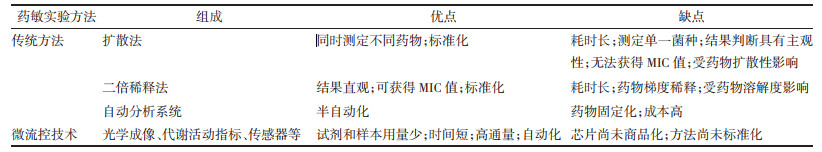
本文将微流控药敏实验方法与常见的传统方法进行比较,总结出各自的优缺点,见表 1。目前将微流控药敏实验方法应用到中药领域的研究较少,因此本文综述了基于微流控技术的药敏实验方法,并探讨了微流控药敏实验在中药领域中的应用与发展前景,为后续深入研究奠定基础。
应用于药敏实验的微流控芯片系统是在芯片上进行细菌培养与药敏实验,结合自动化检测设备收集细菌与药物之间作用的信号,判断细菌对药物的敏感性。该系统能够实时监测整个分析过程,装置微型化和集成化,实现了高灵敏的快速检测和高通量的药物筛选。芯片的材料和结构设计是实现细菌培养和药敏实验功能的关键。目前有机聚合物材料使用广泛,其中,聚二甲基硅氧烷(PDMS)是药敏实验中常用的材料之一,它具有较好的透光性、透气性和生物相容性,适合细菌的培养与观察;较强的弹性和变形性,便于将微泵和微阀直接集成到芯片上,以实现流体的驱动与控制[7]。近年来,许多研究提出将水凝胶和纸等新型材料用于微流控芯片,其独特的优势将会使其在细菌鉴别和药敏实验中得到广泛应用[8-10]。阵列式通道构型在药敏实验中使用广泛,可同时测定不同浓度的药物对菌株的作用,Jeon等[11]在芯片上设计出一种“圣诞树”结构的浓度梯度发生器,可实现多种浓度药物的多重高通量反应,缩短了样品的制备时间,成为经典的药物浓度梯度芯片。
微流控药敏实验是指利用微流控平台在较短时间内完成药敏实验,由于传统的肉眼观察或简单设备不能满足其单细胞检测或动态监测,大多数微流控研究都采用特定的设备、分析方法测定细菌生长以及对药物的敏感性。下文从3个方面总结了目前用于药敏实验的微流控方法(见表 2),并阐述了各自优缺点以及适用范围,以期为微流控技术应用于中药药敏实验提供参考。
荧光成像和无标记光学成像是常用的微流控光学成像检测方法,利用显微技术在微流体中观察细菌的生理和行为变化,从而判断细菌对药物是否敏感。许多研究者将绿色荧光蛋白(GFP)转化在目标细菌上,利用荧光强度与细菌密度之间的线性关系实时监测芯片上细菌的生长情况[12-16]。Mohan课题组利用基于荧光的微流控多复路平台在较短时间内考察了细菌对不同抗生素的耐药性以及多菌之间的相互作用,为多菌感染下的临床药敏实验提供了思路[17-18]。虽然这种荧光蛋白标记方法能够实时监测细菌生长,但需要菌株预处理,并且由于转化到细菌中的GFP质粒对一些抗生素具有耐药性,还需要添加抗生素以保持GFP表达质粒的稳定性,因此,该方法需要一定的技术要求以及荧光显微设备。SYTOX染料能够在死亡的细胞中与脱氧核糖核酸(DNA)结合产生荧光信号,但不会进入到活细胞中,该方法可以在显微镜下根据细菌死亡情况检测细菌耐药性[19-20],但想要得出诸如最低抑菌浓度这类量化的数据还需更进一步研究。
无标记光学成像是利用相差显微镜对细菌进行单细胞或灰度值分析的方法,操作简便,不需要菌株预处理[21-22]。Baltekin等[23]在显微镜下实时监测了大肠杆菌在不同抗生素作用下的生长变化,并完成了4种临床分离菌株耐药性的检测,为开发快速临床诊断技术提供了新的思路。基于灰度值的测定方法是通过显微图像(从黑到白)的灰度强度变化测定细菌浓度,与光学密度测定细菌的浊度原理相似[24-25]。Kim等[26]通过计算显微图像中特定位置的灰度值测定了5种抗生素的最低抑菌浓度,同时与传统的光学密度测定方法进行了比较,验证了该方法的可靠性。虽然这种方法需要相对较高的细菌浓度,但不需要细菌的预处理,并且图像处理简单,使用范围广。
1.2 代谢活动指标监测细菌代谢是一种间接测定细菌生长和对抗生素敏感性的方法。刃天青是一种常用的代谢标记物,当活细胞发生不可逆转代谢时,它被转化为间苯二酚,显示出强烈的荧光。因此,在微流控芯片上可通过细菌代谢物的荧光强度观察细菌生长过程并确定抗菌药物最低抑菌浓度以及最佳用药时间[27-30]。
在细菌培养过程中,培养基的pH值随着细菌代谢产物的积累降低,因此监测培养基变化的pH值是另一种常用的细菌代谢指标。将pH传感器与微流控芯片结合,可以实时监测微/纳升液体样品的pH变化,从而监测不同抗生素对细菌生长速率的抑制作用[31]。微流控pH传感器检测方法获得检测结果用时短,能在较短的细菌代谢时间内获得药敏值。也有研究者根据pH指示剂的颜色变化检测细菌生长,当有细菌存在时,指示剂颜色由红色变为黄色,根据颜色变化确定抗生素的最低抑菌浓度[32]。
1.3 传感器电化学传感器利用目标分析物的电化学性质,依赖特定的电极和电解液组合,以捕获特定的信号[33]。铜绿假单胞菌在生长过程中会产生一种蓝色的电活性分子——PYO,该分子可以进行氧化还原反应,从而被电化学传感器检测到。Webster等[34]利用电化学传感器监测芯片上铜绿假单胞菌在不同浓度的黏菌素下电信号的变化,确定其在抗生素影响下的生长状态。微流控与电化学生物传感器结合是一种快速高效、非破坏性的药敏实验方法,这种方法在低成本的抗生素筛选中具有应用价值。
等离子体共振(SPR)是金属表面的电子受电磁辐射影响产生共振的过程。因为电子振荡对折射率非常敏感,当生物分子附着在金属表面与电子层产生相互作用时,改变其折射率从而改变电子所需的波长[35-36]。Chiang等[37]首次利用SPR生物传感器,检测大肠埃希菌和表面葡萄球菌的耐药性。随着SPR向小型化、便携化方向发展,已有研究将其集成到微流控设备中[38-40]。在多通道微流控一体化SPR平台中,细菌样品与金属芯片结合后SPR角位移会发生变化,加入抗生素后,敏感菌株的折光率降低,而耐药菌株的折光率几乎不变,由此区分敏感或耐药菌株[41]。
2 微流控药敏实验方法在中药领域中的应用展望中药凭借其独特的优势在抗细菌感染方面发挥了重要的作用,寻找更多具有抵抗细菌、逆转细菌耐药性的中草药成为研究者们的焦点[42-44],因而也对中药药敏实验方法提出了更高的要求。实验室通常将抗生素药敏实验方法应用于中药的研究中,常用的方法有2倍稀释法、平板扩散法等,其结果较为理想,适用性强。中药药敏实验大多用于筛选具有抗菌作用的中药,其初始浓度的选择以及对细菌敏感性的判断均需参考现有抗生素的有效浓度。不同的是中药来源广泛、成分复杂,在实验中需要根据实际情况加以调整。例如,采用纸片扩散法进行药敏实验时,需要实验室自制含有中药的纸片,而尚未有标准的操作规范,因此实验结果可能出现偏差。当前的中药药敏实验同样存在费时费力的缺点,动力学研究较少。在细菌耐药现象愈演愈烈、新抗生素研发不足的背景下,如何在较短时间内找到更多抗细菌感染中药是当前急需解决的关键问题。因此,开发利用高效的中药药敏实验方法显得尤为重要,基于上述微流控技术在药敏实验中有较为成熟的应用与发展,本文初步提出利用高通量的微流控技术测定中药敏感性、筛选抗细菌感染中药的思路与建议,将微流控药敏实验引入中药领域,促使中药学与化学、流体物理、微电子、材料等学科交叉融合,以期提高实验室效率,使得中药在治疗感染性疾病上发挥更大的作用。
针对如何利用微流控技术进行中药体外药效学研究的问题,孟宪生课题组提出了构建中药复方、单体(组分)集成化微流控芯片的思路,对新药筛选尤其是抗肿瘤中药的筛选具有启示性[45-46]。该课题组制作了集成微阀的双层PDMS-玻璃复合芯片,用于花蕊石生品、制品水煎液对肝肿瘤细胞HepG2的凋亡坏死影响研究,该实验验证了在芯片上培养细胞和筛选抗肿瘤药物的可行性[47]。随后,该课题组对这种芯片进行改进与升级,分别考察了中药荆芥以及其活性成分橙皮苷的抗肿瘤作用,并将中药指纹图谱技术与微流控芯片技术相结合,为“谱与效关联”的质量控制模式提供数据支撑[48]。因此,对于抗细菌感染中药的筛选也可尝试微流控芯片技术,在芯片上完成细菌培养和药物浓度分配,从而考察中药体外抑菌活性,筛选出具有潜力的抗细菌感染中药。
上述研究表明,微流控芯片能够支持中药单体、成分甚至复方的流动与运输,且中药的特性并不会影响实验结果,如中药通常自身带有颜色,在传统方法中会带来一定的干扰。试管稀释法中各组需配制5~10 mL药液,尽管目前以96孔板为代表的微量容器成为主流,其每孔的试剂体积仍不少于100 μL,而微流控芯片仅需更少量的试剂,便可完成整个实验过程。王妮佳等[49]将芯片流速控制在0.2 mL/min,36 h后试剂的消耗总量未达到0.5 mL,大大降低了试剂用量,尤其适用于中药化合物和稀有中药的研究。为了找到中药的有效浓度,实验室需要将药物逐倍稀释,劳动力和试剂用量明显增加,而微流控芯片的“圣诞树”通道构型仅需要加入初始的药液浓度,便自动形成可控的浓度梯度,除了2倍稀释梯度还可以形成连续的浓度梯度,准确地找到有效浓度的转折点[50]。已有研究者设计出一种能够自动形成药物浓度梯度并进行病原体检测和药敏实验的微流控系统,在较短时间内检测了中药复方莪术油栓对白色念珠菌的抑菌效果,实验结果与传统方法结果相同[51]。该设备小巧便携、芯片成本低、试剂用量少,适用于细菌培养和药敏实验一体化研究。通常的药敏实验将细菌接种在有限的空间中,从而影响细菌的生长活动,而芯片的微通道网状结构更加接近人体内环境,能够模拟细菌在生理状态下的活动,同时持续稳定的液体流动能够及时补充营养成分并排出废液,有利于细菌代谢。Li等[52]采用Box-Behnken设计响应面方法对芯片培养条件进行优化,使其更加有利于细菌生长,并利用优化后的方法测定了黄芩素的最低抑菌浓度为92 μg/mL,同时发现黄芩素降低了青霉素-链霉素对大肠杆菌的最低抑菌浓度,结果表明黄芩素和抗生素的联合使用能够增加抗菌效果。
中药对细菌的抑菌曲线同样是判断中药有无抑菌作用的检测指标。将菌体与不同浓度的中药药液培养24 h,每隔2 h进行活菌计数或吸光度测定,绘制细菌在中药影响下的生长曲线。其中,不同时间段的取样给操作人员带来困难,通常需要过夜操作。光学成像检测方法能够利用显微技术在微流体中实时观察细菌在药物作用下的数量、形态变化等,不仅能够得到最终有效浓度值,还能提供整个过程的动态信息,补充中药药敏实验在动力学中的研究。为了实现药敏实验的自动化、智能化,张鹤林等[53]首次提出采用基于SPR生物传感器技术方法监测中药有效成分对细菌的作用过程,进而判断中药的抗菌效果。该传感器灵敏度、准确度高,为中药的抗菌作用提供实时数据。若将该传感器集成到微流控芯片中,构建多通道微流控一体化SPR平台,将可实现高效灵敏的抗细菌感染中药的快速筛选。
除了体外药敏实验,秀丽隐杆线虫微流控平台是研究中药体内抑菌活性的新思路。已有研究者设计出秀丽隐杆线虫模型筛选抗菌药物的新型微流控装置,将微流控芯片与蠕虫分配器集成,10 min内便完成线虫的均匀分配,可以同时产生多种浓度梯度,快速高效地进行中药体内抗菌活性检测[54]。Yang等[55]基于该装置开发了一种感染铜绿假单胞菌线虫模型,结果发现绞股蓝总皂苷在体外无明显作用,但在体内有较好的抑菌活性。开发药敏实验与秀丽隐杆线虫模型结合的微流控装置,在同一平台完成中药抗菌活性的体内外评价将会是一种既创新又有意义的方法。
3 总结微流控芯片技术在抗细菌感染研究领域具有巨大的发展空间,将其应用到抗细菌感染中药的筛选是一种具有潜力的研究方法。通过本文对微流控药敏实验检测方法的文献综述,可知微流控平台可将细菌培养、药物运输、浓度分配、药物与细菌作用以及检测器集于一体,同时获得静态与动态值,完成自动化、高通量的药敏实验,并且已有许多研究利用微流控技术在细胞水平上评价中药的生物活性[56]。对于中药药敏实验而言,可尝试结合高通量的先进技术,依据中药的独特性质,构建用于中药成分、单体以及复方等不同中药形式的微流控药敏平台,弥补传统方法的不足,以实现抗细菌感染中药的高通量筛选。近年来,有研究者提出了中药生物效应指纹图谱构建的新思路,指出中药指纹图谱技术已成为中药质量控制的重要手段,但很难直接反映各化学成分的生物活性,而微流控技术在生物检测中已成熟应用,因此分析了化学成分的指纹图谱技术与微流控芯片技术相结合的可能性[57]。就中药抗菌活性而言,在之后的研究中,若是将色谱技术与微流控技术在线耦合,快速检测各化学成分的抗菌活性,则可以实现分子抗菌活性的在线检测,从而建立一个更加全面、客观的中药质量评价体系。
目前将微流控技术应用到中药抑菌活性测定中仍会面临一些问题,如与抗生素相比,中药样品成分复杂、提取物混合度高,这会给微分析平台带来困难,同时微流控芯片存在易堵塞、易产生气泡、未能真正达到商品化的问题,且实验方法各有不同。但随着芯片技术的发展,新的制造技术如3D打印技术的出现,微流控技术将更加适用于药敏实验并有望在中药领域中取得卓越成果,将中药学与新兴学科接轨以促进中药现代化发展。
| [1] |
何彦峰, 王瑞楠, 张璐璐, 等. 胡芦巴叶挥发油的萃取工艺、成分分析及抗氧化和抑菌活性研究[J]. 中国中药杂志, 2020, 45(13): 3161-3168. HE Y F, WANG R N, ZHANG L L, et al. Extraction technology, composition analysis and antioxidant and antimicrobial activities of volatile oil from fenugreek leaves[J]. China Journal of Chinese Materia Medica, 2020, 45(13): 3161-3168. |
| [2] |
田程飘, 宋雅玲, 许海棠, 等. 超临界和水蒸气蒸馏提取沉香精油成分分析及抗氧化、抑菌活性对比研究[J]. 中国中药杂志, 2019, 44(18): 4000-4008. TIAN C P, SONG Y L, XU H T, et al. Composition analysis, antioxidative and antibacterial activities comparison of agarwood oils extracted by supercritical and steam distillation[J]. China Journal of Chinese Materia Medica, 2019, 44(18): 4000-4008. |
| [3] |
谢思露, 赵茂吉, 杨朝国. 水飞蓟宾及其同分异构体的抑菌谱及其与抗生素联合抑菌效应探讨[J]. 中草药, 2019, 50(7): 1641-1648. XIE S L, ZHAO M J, YANG C G. Antibacterial spectrum of silibinin and isomers and its antibacterial effect with antibiotics[J]. Chinese Traditional and Herbal Drugs, 2019, 50(7): 1641-1648. |
| [4] |
XU K, ZHU P, COLON T, et al. A microfluidic investigation of the synergistic effect of nanoparticles and surfactants in macro-emulsion-based enhanced oil recovery[J]. SPE Journal, 2017, 22(2): 459-469. DOI:10.2118/179691-PA |
| [5] |
KHANDURINA J, GUTTMAN A. Bioanalysis in microfluidic devices[J]. Journal of Chromatography A, 2002, 943(2): 159-183. DOI:10.1016/S0021-9673(01)01451-0 |
| [6] |
AI Y, ZHANG F, WANG L, et al. Recent progress in lab-on-a-chip for pharmaceutical analysis and pharmacologicaltoxicological test[J]. Trac-trends in Analytical Chemistry, 2019, 117(6): 215-230. |
| [7] |
YUAN Y, YALIKUN Y, OTA N, et al. Property investigation of replaceable PDMS membrane as an actuator in microfluidic device[J]. Actuators, 2018, 7(4): 18. |
| [8] |
SUN H, LIU Z Z, HU C, et al. Cell-on-hydrogel platform made of agar and alginate for rapid, low-cost, multidimensional test of antimicrobial susceptibility[J]. Lab on a Chip, 2016, 16(16): 3130-3138. DOI:10.1039/C6LC00417B |
| [9] |
LIU Z, SUN H, REN K. A multiplexed, gradient-based, full-hydrogel microfluidic platform for rapid, high-throughput antimicrobial susceptibility testing[J]. ChemPlusChem, 2017, 82(5): 792-801. DOI:10.1002/cplu.201600654 |
| [10] |
HE P J W, KATIS I N, KUMAR A J U, et al. Laser-patterned paper-based sensors for rapid point-of-care detection and antibiotic-resistance testing of bacterial infections[J]. Biosensors and Bioelectronics, 2020, 152(4): 112008. |
| [11] |
JEON N L, DERTINGER S K W, CHIU D T, et al. Generation of solution and surface gradients using microfluidic systems[J]. Langmuir, 2000, 16(22): 8311-8316. DOI:10.1021/la000600b |
| [12] |
DAI J, SUH S J, HAMON M, et al. Determination of antibiotic EC50using a zero-flow microfluidic chip based growth phenotype assay[J]. Biotechnology Journal, 2015, 10(11): 1783-1791. DOI:10.1002/biot.201500037 |
| [13] |
SABHACHANDANI P, SARKAR S, ZUCCHI P C, et al. Integrated microfluidic platform for rapid antimicrobial susceptibility testing and bacterial growth analysis using bead-based biosensor via fluorescence imaging[J]. Microchimica Acta, 2017, 184(12): 4619-4628. DOI:10.1007/s00604-017-2492-9 |
| [14] |
BUSCHE J F, MOLLER S, STEHR M, et al. Cross-flow filtration of escherichia coli at a nanofluidic gap for fast immobilization and antibiotic susceptibility testing[J]. Micromachines (Basel), 2019, 10(10): 691-694. DOI:10.3390/mi10100691 |
| [15] |
RAN M, WANG Y, WANG S, et al. Pump-free gradient-based micro-device enables quantitative and high-throughput bacterial growth inhibition analysis[J]. Biomed Microdevices, 2015, 17(4): 67-72. DOI:10.1007/s10544-015-9971-8 |
| [16] |
GOLCHIN S A, STRATFORD J, CURRY R J, et al. A microfluidic system for long-term time-lapse microscopy studies of mycobacteria[J]. Tuberculosis, 2012, 92(6): 489-496. DOI:10.1016/j.tube.2012.06.006 |
| [17] |
MOHAN R, MUKHERJEE A, SEVGEN S E, et al. A multiplexed microfluidic platform for rapid antibiotic susceptibility testing[J]. Biosensors and Bioelectronics, 2013, 49(6): 118-125. |
| [18] |
MOHAN R, SANPITAKSEREE C, DESAI A V, et al. A microfluidic approach to study the effect of bacterial interactions on antimicrobial susceptibility in polymicrobial cultures[J]. RSC Advances, 2015, 5(44): 35211-35223. DOI:10.1039/C5RA04092B |
| [19] |
KALASHNIKOV M, LEE J C, CAMPBELL J, et al. A microfluidic platform for rapid, stress-induced antibiotic susceptibility testing of Staphylococcus aureus[J]. Lab on a Chip, 2012, 12(21): 4523-4532. DOI:10.1039/c2lc40531h |
| [20] |
ZHANG X Y, SUN K, ABULIMITI A, et al. Microfluidic system for observation of bacterial culture and effects on biofilm formation at microscale[J]. Micromachines, 2019, 10(9): 606. DOI:10.3390/mi10090606 |
| [21] |
LI B, QIU Y, GLIDLE A, et al. Gradient microfluidics enables rapid bacterial growth inhibition testing[J]. Analytical Chemistry, 2014, 86(6): 3131-3137. DOI:10.1021/ac5001306 |
| [22] |
CHOI J, JUNG Y G, KIM J. Rapid antibiotic susceptibility testing by tracking single cell growth in a microfluidic agarose channel system[J]. Lab on a Chip, 2013, 13(2): 280-287. DOI:10.1039/C2LC41055A |
| [23] |
BALTEKIN Ö, BOUCHARIN A, TANO E, et al. Antibiotic susceptibility testing in less than 30 min using direct single-cell imaging[J]. Proceedings of the National Academy of Sciences, 2017, 114(34): 9170-9175. DOI:10.1073/pnas.1708558114 |
| [24] |
HOU Z, AN Y, HJORT K, et al. Time lapse investigation of antibiotic susceptibility using a microfluidic linear gradient 3D culture device[J]. Lab on a Chip, 2014, 14(17): 3409-3418. DOI:10.1039/C4LC00451E |
| [25] |
MALMBERG C, YUEN P, SPAAK J, et al. A novel microfluidic assay for rapid phenotypic antibiotic susceptibility testing of bacteria detected in clinical blood cultures[J]. PLoS One, 2016, 11(12): e0167356. DOI:10.1371/journal.pone.0167356 |
| [26] |
KIM S, LEE S, KIM J K, et al. Microfluidic-based observation of local bacterial density under antimicrobial concentration gradient for rapid antibiotic susceptibility testing[J]. Biomicrofluidics, 2019, 13(1): 1-10. |
| [27] |
AL-ADHAMI M, TILAHUN D, RAO G, et al. Rapid detection of microbial contamination using a microfluidic device[J]. Methods in Molecular Biology (Clifton, N.J.), 2017, 1571(11): 287-299. |
| [28] |
AVESAR J, ROSENFELD D, TRUMAN-ROSENTSVIT M, et al. Rapid phenotypic antimicrobial susceptibility testing using nanoliter arrays[J]. Proceedings of the National Academy of Sciences, 2017, 114(29): E5787-E5795. DOI:10.1073/pnas.1703736114 |
| [29] |
KAUSHIK A M, HSIEH K, CHEN L, et al. Accelerating bacterial growth detection and antimicrobial susceptibility assessment in integrated picoliter droplet platform[J]. Biosensors and Bioelectronics, 2017, 97(6): 260-266. |
| [30] |
AZIZI M, ZAFERANI M, DOGAN B, et al. Nanoliter-sized microchamber/microarray microfluidic platform for antibiotic susceptibility testing[J]. Analytical Chemistry, 2018, 90(24): 14137-14144. DOI:10.1021/acs.analchem.8b03817 |
| [31] |
TANG Y, ZHEN L, LIU J, et al. Rapid antibiotic susceptibility testing in a microfluidic pH sensor[J]. Analytical Chemistry, 2013, 85(5): 2787-2794. DOI:10.1021/ac303282j |
| [32] |
LEE W B, FU C Y, CHANG W H, et al. A microfluidic device for antimicrobial susceptibility testing based on a broth dilution method[J]. Biosensors and Bioelectronics, 2017, 87(7): 669-678. |
| [33] |
RACKUS D G, SHAMSI M H, WHEELER A R. Electrochemistry, biosensors and microfluidics: a convergence of fields[J]. Chemical Society Reviews, 2015, 44(15): 5320-5340. DOI:10.1039/C4CS00369A |
| [34] |
WEBSTER T A, SISMAET H J, CHAN P J, et al. Electrochemically monitoring the antibiotic susceptibility of Pseudomonas aeruginosa biofilms[J]. The Analyst, 2015, 140(21): 7195-7201. DOI:10.1039/C5AN01358E |
| [35] |
ARORA P, SINDHU A, DILBAGHI N, et al. Biosensors as innovative tools for the detection of food borne pathogens[J]. Biosens Bioelectron, 2011, 28(1): 1-12. DOI:10.1016/j.bios.2011.06.002 |
| [36] |
NGUYEN H, PARK J, KANG S, et al. Surface plasmon resonance: a versatile technique for biosensor applications[J]. Sensors, 2015, 15(5): 10481-10510. DOI:10.3390/s150510481 |
| [37] |
CHIANG Y L, LIN C H, YEN M Y, et al. Innovative antimicrobial susceptibility testing method using surface plasmon resonance[J]. Biosens Bioelectron, 2009, 24(7): 1905-1910. DOI:10.1016/j.bios.2008.09.020 |
| [38] |
WANG D S, FAN S K. Microfluidic surface plasmon resonance sensors: from principles to point-of-care applications[J]. Sensors (Basel), 2016, 16(8): 1175. DOI:10.3390/s16081175 |
| [39] |
LERTVACHIRAPAIBOON C, BABA A, EKGASIT S, et al. Microfluidic transmission surface plasmon resonance enhancement for biosensor applications[J]. Japanese Journal of Applied Physics, 2017, 56(1): 17002. DOI:10.7567/JJAP.56.017002 |
| [40] |
LERTVACHIRAPAIBOON C, KIYOKAWA I, BABA A, et al. Colorimetric determination of hydrogen peroxide based on localized surface plasmon resonance of silver nanoprisms using a microchannel chip[J]. Analytical Letters, 2019, 52(12): 1939-1950. DOI:10.1080/00032719.2019.1586913 |
| [41] |
UCAK O G, DURAK M Z, AKYAR I, et al. Antimicrobial susceptibility test for the determination of resistant and susceptible S. aureus and enterococcus spp. using a multi-channel surface plasmon resonance device[J]. Diagnostics (Basel), 2019, 9(4): 90-108. |
| [42] |
吴玉霞, 张铁焕, 奠佐红, 等. 13种中药材提取物体外抗菌活性筛选[J]. 中国医院药学杂志, 2020, 40(5): 481-487. WU Y X, ZHANG T H, DIAN Z H, et al. Screening of antibacterial activity of 13 kinds of Chinese herbal medicines[J]. Chinese Journal of Hospital Pharmacy, 2020, 40(5): 481-487. |
| [43] |
彭勤, 凌保东, 蔺飞, 等. 中药单体与抗菌药物联合应用对抗泛耐药鲍曼不动杆菌的作用研究[J]. 中药药理与临床, 2020, 36(2): 140-145. PENG Q, LING B D, LIN F, et al. Research on the effects of traditional Chinese medicine monomer combined with antibacterial drugs against extensively drug resistant acinetobacter baumannii[J]. Pharmacology and Clinics of Chinese Materia Medica, 2020, 36(2): 140-145. |
| [44] |
邢亚君, 杨伟峰, 孙娅楠, 等. 痰热清注射液与亚胺培南西司他丁联合对广泛耐药铜绿假单胞菌的抑菌作用[J]. 中国实验方剂学杂志, 2019, 25(11): 60-66. XING Y J, YANG W F, SUN Y N, et al. Effect of tanreqing injection combined with imipenem-cilastatin in inhibiting[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(11): 60-66. |
| [45] |
王乙同, 马立东, 孟宪生, 等. 基于微流控芯片技术研究水红花子复方抗肿瘤的作用[J]. 中国现代中药, 2014, 16(2): 100-105, 108. WANG Y T, MA L D, MENG X S, et al. Anti-tumor effect of polygoni orientalis fructus formula serum in vitro based on microfluidic technology[J]. Modern Chinese Medicine, 2014, 16(2): 100-105, 108. |
| [46] |
王鹤辰, 包永睿, 王帅, 等. 基于微流控芯片技术的中药小蓟诱导肺癌A549细胞凋亡用药部位精准分析[J]. 药物分析杂志, 2019, 39(3): 393-397. WANG H C, BAO Y R, WANG S, et al. Precise analysis of the apoptosis effect of medicinal parts of Cirsiumsetosum to lung cancer A549 cell based on m icrofluidic chip[J]. Chinese Journal of Pharmaceutical Analysis, 2019, 39(3): 393-397. |
| [47] |
庞磊, 包永睿, 孟宪生, 等. 药物筛选微流控芯片的构建及其在花蕊石抗肝癌研究中的应用[J]. 中南药学, 2015, 13(3): 241-245. PANG L, BAO Y R, MENG X S, et al. Construction of drug screening microfluidic chip and its application in anti-hepatoma ophicalcitum[J]. Central South Pharmacy, 2015, 13(3): 241-245. |
| [48] |
樊佳新, 王帅, 孟宪生, 等. 基于微流控芯片技术橙皮苷抗肺肿瘤作用机制研究[J]. 中国药理学通报, 2017, 33(9): 1260-1265. FAN J X, WANG S, MENG X S, et al. Study of mechanisms of hesperidin on anti-lung cancer effect based on microfluidic chip technology[J]. Chinese Pharmacological Bulletin, 2017, 33(9): 1260-1265. DOI:10.3969/j.issn.1001-1978.2017.09.015 |
| [49] |
王妮佳, 王嘉仡, 孟宪生, 等. 基于3D微流控芯片分析鸡血藤总鞣质对宫颈癌细胞HeLa的药理作用[J]. 中国实验方剂学杂志, 2019, 25(2): 103-108. WANG N J, WANG J Y, MENG X S, et al. Analysis of pharmacological effect of total tannins from Spatholobi Caulis on cervical cancer HeLa cells by 3D microfluidic chip[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(2): 103-108. |
| [50] |
SHI H, HOU Z, ZHAO Y, et al. Rapid and steady concentration gradient generation platform for an antimicrobial susceptibility test[J]. Chemical Engineering Journal, 2019, 359(7): 1327-1338. |
| [51] |
宋波, 宋永欣, 于秀文, 等. 使用微流控技术检测复方莪术油栓治疗念珠菌性阴道炎的研究[J]. 世界最新医学信息文摘, 2018, 18(86): 197. SONG B, SONG Y X, YU X W, et al. Study on the treatment of candidiasis vaginitis by using microfluidic technique[J]. World Latest Medicine Information, 2018, 18(86): 197. |
| [52] |
LI H, VAN D S, BUNGE F, et al. Optimization of on-chip bacterial culture conditions using the Box-Behnken design response surface methodology for faster drug susceptibility screening[J]. Talanta, 2019, 194(12): 627-633. |
| [53] |
张鹤林, 张国龙, 张康, 等. 基于SPR生物传感器的抗菌中药药效评价方法研究[J]. 电子器件, 2015, 38(1): 67-69. ZHANG H L, ZHANG G L, ZHANG K, et al. Research on efficacy evaluation methods of antibacterial Chinese medicine based on SPR Biosensor[J]. Chinese Journal of Electron Devices, 2015, 38(1): 67-69. DOI:10.3969/j.issn.1005-9490.2015.01.015 |
| [54] |
YANG J, CHEN Z, CHING P, et al. An integrated microfluidic platform for evaluating in vivo antimicrobial activity of natural compounds using a whole-animal infection model[J]. Lab on a Chip, 2013, 13(17): 3373-3382. DOI:10.1039/c3lc50264c |
| [55] |
YANG J, ZHENG M, YANG F, et al. Pseudomonas aeruginosa infected nematode-on-a-chip model array for antibacterials screening[J]. Sensors and Actuators B: Chemical, 2018, 275(8): 373-381. |
| [56] |
寇丽莎, 齐永红, 张璇, 等. 基于微流控芯片的牡丹籽粕低聚茋类化合物抗癌活性的研究[J]. 中国油脂, 2019, 44(2): 94-98. KOU L S, QI Y H, ZHANG X, et al. Anticancer activity of oligostilbenes from peony seed meal based on microfluidic chip[J]. China Oils and Fats, 2019, 44(2): 94-98. DOI:10.3969/j.issn.1003-7969.2019.02.022 |
| [57] |
史志兵, 蔡民民, 李建新. 中药生物效应指纹图谱构建新思路——与微流控芯片技术的结合[J]. 中国天然药物, 2010, 8(3): 162-166. SHI Z B, CAI M M, LI J X. New Insight on the construction of bioeffect fingerprint of traditional Chinese medicine: integration with microfluidic chip technique[J]. Chinese Journal of Natural Medicines, 2010, 8(3): 162-166. |
 2021, Vol. 40
2021, Vol. 40