文章信息
- 朱姗, 赵志月, 王子静, 杨益, 刘涛, 王翔, 夏庆梅, 张晗, 李楠
- ZHU Shan, ZHAO Zhiyue, WANG Zijing, YANG Yi, LIU Tao, WANG Xiang, XIA Qingmei, ZHANG Han, LI Nan
- 皮肤老化分子机制及中药防治皮肤老化研究进展
- Research progress of molecular mechanism of skin aging and prevention of skin aging with traditional Chinese medicine
- 天津中医药大学学报, 2021, 40(4): 431-439
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(4): 431-439
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.04.06
-
文章历史
收稿日期: 2021-03-10
衰老是一种正常而复杂的生物学过程,主要指生物体的组织结构和生理功能发生的进行性衰退[1]。皮肤位于机体最表层,是人体最大的器官,是阻止病原体入侵、调节水分和防止电解质流失的主要屏障,其衰老程度直接反映机体的老化水平[2]。皮肤老化受多种因素影响,包括遗传因素、环境污染、紫外线(UV)辐射等。由遗传因素决定的内源性老化又称为自然老化,它是皮肤衰老的自然过程,无法逆转。外源性老化主要由UV辐射引起,又称为光老化,通过有效的手段可防治光老化[3]。目前通常把暴露部位皮肤的老化作为光老化,非暴露部位皮肤的老化作为自然老化进行研究。皮肤在结构和功能上具有明显部位差异,部位不同,其临床及组织学特征也不相同[4]。暴露部位皮肤的老化发生在遗传基础之上,非暴露部位皮肤也无法完全免除外源性因素的影响,光老化与自然老化相互依存,光老化机制的研究对自然老化同样具有重要意义[5]。近年来,中药抗皮肤老化作用机制的研究进展迅速,多环节、多层次和多靶点作用的特点使其在防治皮肤老化方面具有较大优势[6]。
1 皮肤老化的临床及组织学特征皮肤是一个复杂的器官,由表皮层、真皮层及皮下组织3个部分组成。除了本身结构外,皮肤中还含有毛发、皮脂腺、汗腺、指甲等许多皮肤附属物[7]。表皮通过角质形成细胞的增殖分化完成自我更新。角质形成细胞由基底层产生并不断向表层迁移,分化形成富含角蛋白的角质细胞,最终从角质层脱落[8]。真皮主要由细胞外基质及成纤维细胞组成。成纤维细胞分泌合成胶原纤维、弹性纤维、网状纤维和基质成分以维持皮肤的弹性和韧性[9]。影响因素不同,皮肤老化的临床和组织学特征表现出明显区别,见表 1。
临床上自然老化的皮肤表现为萎缩变薄、干燥松弛、出现细微皱纹,偶发良性肿瘤[10]。组织学上表现为角质形成细胞增殖分化减少,表皮变薄;表皮中黑素细胞和朗格汉斯细胞减少;表皮与真皮结合处变平萎缩。真皮中成纤维细胞、肥大细胞等细胞数量减少,体积变小;胶原蛋白、弹性蛋白等细胞外基质含量减少,真皮层变薄[11-12]。随着年龄增加,皮肤血管逐渐减少,皮下脂肪层变薄,皮脂腺、汗腺等皮肤附属物数量变少[13]。
1.2 皮肤光老化的临床及组织学特征光老化的皮肤临床上表现为干燥粗糙呈皮革状外观,色素沉着异常,可见较深皱纹及明显的毛细血管扩张,可引起皮肤恶性肿瘤[14]。组织学特征为表皮不规则增厚致皮肤角化过度[15];黑素细胞合成黑色素异常增多致严重的色素沉着。真皮中成纤维细胞增殖能力降低;前胶原合成减少,胶原纤维组织缺失严重;胶原蛋白、弹性蛋白等细胞外基质变性并大量堆积,真皮层增厚[16-17]。光老化皮肤中的血管壁增厚,血管网排列紊乱,血管周围常有炎性细胞浸润[18]。
2 皮肤光老化的机制研究发现80%~90%的皮肤老化由外源性因素引起,其中UV辐射是加速皮肤衰老的最主要原因[19]。皮肤光老化涉及多种信号分子和多条信号转导通路,其分子机制主要包括DNA损伤、氧化应激、炎症反应、胶原结构改变以及细胞凋亡,UV诱导的光老化机制见开放科学(资源服务)标识码(OSID)。中药中含有丰富的蛋白质和各种氨基酸、脂类、多糖类、黄酮类、维生素、有机酸、生物碱、皂苷等营养物质,其作用机制有修复DNA损伤、抗氧化、抗炎、修复皮肤屏障功能和抗凋亡等,中药在防治和延缓皮肤光老化中起重要作用。
2.1 DNA损伤UV辐射可直接或间接对DNA造成损伤。根据波长UV辐射主要分为UVA(320~400 nm)、UVB(280~320 nm)和UVC(200~280 nm)3种类型,其中UVA和UVB可穿透大气层对皮肤造成损伤[20]。UVB可直接作用于DNA,形成环丁烷嘧啶二聚体(CPD)和6-4嘧啶酮(6-4PP)等光产物,破坏DNA双链结构,从而引起分子重排,最终造成DNA损伤。UVA与UVB通过产生活性氧(ROS)作用于DNA分子中的碱基,使其发生突变或修饰,继发性损伤细胞核及线粒体DNA。在腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)、胸腺嘧啶(T)这4种碱基中,G的氧化还原电势最低,最易被氧化,其氧化产物8-羟基鸟嘌呤(8-oxoG)常被作为DNA损伤的生物标志物[21]。
Britto等[22]研究发现从中药马鞭草中提取的黄酮类化合物芹菜素可通过切除CPD中的磷酸二酯键修复UV辐射诱导的DNA损伤,在UVB照射24 h后,经芹菜素处理的人皮肤成纤维细胞(HDF)与未处理的HDF细胞相比,CPD水平明显降低。Metral等人[23]在研究佛手瓜提取物(SEE)的光保护作用时发现,UV照射后,正常人角质细胞(NHK)中的CPD数量增加,而SEE预处理后的NHK细胞中CPD水平降低,提示SEE通过降低CPD含量从而减少UV辐射造成的DNA损伤发挥抗光老化作用。Feng等[24]发现生姜中的6-姜烯酚可通过上调OGG1的表达来减少UVB暴露下的HaCaT细胞中8-oxoG的形成,从而修复DNA氧化损伤,发挥其延缓皮肤光老化的作用。
2.2 氧化应激氧化应激是指机体内的高活性分子如ROS产生过多,超出了机体对其的清除能力,导致机体的抗氧化防御系统失衡,从而引发细胞或组织损伤[25]。ROS由内源和外源两种途径产生,分为两大类:自由基化合物,如超氧化物·O2-和羟基自由基·OH;非自由基化合物,如单态氧O2和过氧化氢H2O2[26]。内源性ROS主要来自线粒体,由分子氧经线粒体内膜呼吸链复合体传递产生。外源性途径中的ROS主要来自UV辐射,皮肤细胞内的发色基团如DNA、反式尿刊酸、芳香族氨基酸等吸收UV能量后,与氧分子相互作用,产生ROS[27-28]。机体本身存在酶和非酶两类抗氧化系统,超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(PRx)、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽(GSH)等组成酶类抗氧化系统;维生素C、维生素E、类胡萝卜素和多酚等为非酶类抗氧化系统[29-30]。生理条件下,机体内的氧化与抗氧化系统处于平衡状态,UV辐射产生的过多的ROS会打破这种平衡,导致机体发生氧化应激。氧化应激是皮肤光老化发生发展的重要原因,一方面,ROS破坏蛋白质、脂质和DNA等,直接损伤皮肤组织;另一方面,ROS作为第二信使启动下游一系列信号转导通路,激活核转录因子-κB(NF-κB)、激活蛋白-1(AP-1)等转录因子调节促炎性细胞因子及基质金属蛋白酶(MMPs)的表达,从而引发炎症反应及细胞外基质的降解[31]。
董文宾等[32]研究发现,杜仲中的黄酮类化合物具有明显的抗氧化作用,可直接清除UVB暴露下的HaCaT细胞中的·OH、·O2-、脂质和烷自由基,从而抑制MDA等有毒物质的生成,同时增加SOD、GSH-Px等抗氧化酶的活性。Choi等[33]在研究芦丁的抗衰老作用时发现,UV照射后,含芦丁乳霜可明显改善小鼠皮肤的密度及弹性,减少皱纹的数量和面积,同时降低了模型小鼠表皮中ROS及MMP-1的量,ROS及MMP-1的降低与给药剂量成正比,提示芦丁可通过抑制氧化应激的发生来发挥其光保护作用。研究发现,UVB照射前在小鼠皮肤局部涂抹甘草提取物能增加小鼠表皮中SOD活性,降低MDA含量,抑制促炎性细胞因子的表达[34]。
2.3 炎症反应UV辐射会刺激皮肤细胞分泌如白细胞介素IL-1α、IL-1β、IL-6、IL-8和肿瘤坏死因子(TNF-α)等多种促炎性细胞因子,激活NF-κB信号通路促进环氧合酶-2(COX-2)和前列腺素E2(PGE2)等的表达[35]。NF-κB是一种具有多向性调节作用的核转录因子,主要由p50/p65二聚体组成。生理条件下NF-κB与NF-κB抑制激酶(IκB)结合,以非活化状态存在于细胞质中[36]。UV辐射产生TNF-α与其受体家族成员TNF-RI结合,激活NF-κB抑制激酶激酶(IKK),引发IκB的泛素化和降解,释放NF-κB,使其移位入核,启动促炎性细胞因子基因的转录,诱发皮肤炎症损伤,最终导致光老化的发生[37]。
Afnan等[38]研究发现UVB照射后BALB/c小鼠的皮肤表面干燥粗糙且出现明显皱纹,小鼠表皮增生并出现弥漫性炎症,而用甘草酸处理小鼠后,显著抑制了UVB引起的TNF-α和IL-1β的过量产生,同时明显抑制了表皮上皮内炎症的增殖,改善了UVB辐射诱导的受损皮肤的状态,其作用机制与抑制炎性细胞因子的产生有关。马月丹等[39]研究发现HaCaT细胞在UVB照射后其COX-2的表达增加,而绞股蓝总皂苷干预后,COX-2表达显著下降。Tanaka等[40]发现白菊内酯可通过下调p65的表达及抑制IKK的活性阻断NF-κB信号通路的激活,提示其可作为NF-κB的抑制剂,阻断NF-κB信号通路的激活,发挥抗皮肤光老化的作用。
2.4 胶原结构改变UV辐射可激活表皮生长因子受体(EGFR)等细胞表面相关受体,影响丝裂原活化蛋白激酶(MAPK)、磷酸肌醇-3-激酶/蛋白激酶B(PI3K/Akt)等信号通路,上调AP-1的表达,进而诱导MMPs合成,导致胶原蛋白降解增加,同时转化生长因子-β(TGF-β)与其受体的结合被抑制,致使胶原蛋白合成受阻,皮肤最终出现松弛皱纹等衰老现象[41]。
2.4.1 胶原降解增加MMPs能特异性降解包括胶原蛋白在内的细胞外基质,使细胞外基质受损,最终导致皮肤光老化。MMPs是一类具锌离子依赖性的内源性蛋白酶,按作用底物不同主要分为间质胶原酶(MMP-1)、基质溶解酶1(MMP-3)和明胶酶B(MMP-9)等[42-43]。研究发现,MMPs的表达主要由MAPK信号转导通路调控,而MAPK信号转导通路的激活始于EGFR中酪氨酸(Tyr)残基的磷酸化[44]。EGFR由胞外区、跨膜区及胞内区3部分组成,UV辐射可使EGFR胞内区的Tyr残基磷酸化并结合接头蛋白Grb2,从而把鸟嘌呤核苷酸释放因子(SOS)从细胞质招募到细胞膜上,SOS使GTP活化并与小分子鸟苷酸结合蛋白Ras结合进而激活Rac、cdc42,最终启动MAPK激酶激酶(MKKK)-MAPK激酶(MKK)-MAPK信号级联,激活细胞外调节激酶(ERK)、c-Jun氨基末端激酶(JNK)和p38 MAPK 3条信号通路[45-46]。ERK通路具有激活c-Fos和促c-Fos表达的能力,JNK和p38 MAPK通路相互协同使c-Jun磷酸化并进入细胞核中与c-Fos结合形成活化的AP-1[47-48]。AP-1的活化可促进MMPs基因转录,使MMPs的合成增加,胶原蛋白降解增多[49]。此外,UV辐射还可通过激活NF-κB信号通路,诱导MMPs合成增加并上调如TNF-α及IL-1等促炎性细胞因子的表达,从而持续激活NF-κB信号通路,加速皮肤光老化的发生[50]。
Kwon等[51]发现鸡血藤茎乙醇提取物(SSE)可通过抑制胶原蛋白降解发挥其光保护作用,其主要机制是通过抑制JNK和p38 MAPK通路中c-Jun的磷酸化阻止AP-1的激活,从而抑制MMP-1和MMP-3的表达,减少胶原蛋白的降解。Wang等[52]发现人参皂苷Rgl可延缓细胞光老化进程,其作用机制可能是通过降低UVB照射后HDF细胞中MMP-1和MMP-3的表达,从而延缓胶原降解进程。
2.4.2 胶原合成减少UV辐射可抑制转化生长因子-β(TGF-β)/Smad信号通路,减少胶原蛋白的合成,降低体内胶原蛋白的水平,进而诱导皮肤光老化的发生[53]。TGF-β是维持胶原蛋白稳定的重要调节因子,可刺激I型和III型前胶原的合成,抑制MMPs的表达。生理条件下,TGF-β与细胞表面具有Ser/Thr激酶活性的TGF-β I型受体(TβRI)和TGF-β II型受体(TβRII)结合,使Smad蛋白磷酸化,激活的Smad2和Smad3与Smad4形成复合体后入核,调节包括I型胶原蛋白在内的细胞外基质的合成与分泌[54]。研究发现,UV辐射后EGFR磷酸化的Try残基会与PI3K相互作用产生磷脂酰肌醇(PI),PI通过募集激活磷脂酰肌醇依赖性激酶1(PDK1)进而激活Akt,Akt的激活可直接阻断Smad2/3的磷酸化从而负向调节TGF-β/Smad信号转导通路[55]。同时,UV辐射激活的AP-1会下调TβRII并诱导TGF-β/Smad信号转导抑制剂Smad-7表达,从而抑制下游Smad2/3的磷酸化,中断下游TGF-β/Smad信号转导[56]。此外,AP-1的激活可直接抑制编码I型前胶原和III型前胶原基因的转录减少前胶原蛋白的产生,从而影响胶原蛋白的合成[57]。
史飞等[58]研究发现,UV照射后,HDF细胞增殖能力明显降低,红景天中的红景天苷可提高HDF细胞中Smad2/3的表达水平,同时降低Akt的活性,从而使胶原蛋白含量增加。王鑫丽等[59]发现三七总皂苷可抑制AP-1可与Smad-7基因启动子中对应的增强子序列元件结合,使Smad-7的转录表达降低,从而促进TGF-β/Smad信号转导通路持续激活,使胶原蛋白合成增加,提示三七总皂苷具有抗皮肤光老化作用。Lee等[60]也发现在UVB照射后小鼠表皮中胶原蛋白合成减少,其机制可能是由于c-Jun和c-Fos基因的表达上调,导致AP-1的活性增加且Smad-7的表达升高,从而中断了TGF-β/Smad信号转导通路,黄芪提取液可提高TGF-β的合成,增强TGF-β/Smad信号转导,促进胶原蛋白合成,进而发挥其对皮肤光老化的保护作用[61]。
2.5 细胞凋亡细胞凋亡是指为维持内环境稳定,由基因控制的细胞发生自主、有序的死亡[62]。UV辐射诱导细胞凋亡的发生主要通过两种途径参与:一是具有受体依赖性的外源途径,二是通过线粒体介导的内源途径[63]。UV辐射诱导外源信号分子如TNF-α、Fas配体(Fas-L)与其受体结合,激活半胱氨酸天冬氨酸蛋白酶(Caspase)-8,进而激活其下游效应蛋白Caspase-3,最终诱发细胞凋亡[64]。内源途径中线粒体膜通透性的改变是凋亡发生的关键步骤,UV辐射刺激B淋巴细胞瘤-2基因(Bcl-2)家族中的抗凋亡蛋白Bcl-2与促凋亡蛋白Bax形成同型和异型二聚体,这使得线粒体膜的通透性增加,线粒体内的细胞色素C(Cyto C)被释放到细胞质中与凋亡酶激活因子(Apaf-1)结合形成多聚体,而后Apaf-1通过募集Caspase-9前体并与Caspase-9结合形成凋亡小体,从而激活Caspase-3,诱导细胞凋亡,最终导致皮肤衰老[65]。研究发现,发现NF-κB入核后会激活细胞凋亡抑制蛋白(IAP)的表达,IAP可通过抑制Caspase级联反应中位于下游的效应蛋白Caspase-3来阻断细胞凋亡[66]。肿瘤抑制因子p53在细胞凋亡中发挥重要作用。UV辐射刺激下,p53可作为转录因子激活促凋亡蛋白如Bax的转录,抑制抗凋亡蛋白如Bcl-2的转录,使Cyto C释放到细胞质中,进而引发凋亡级联反应,加速皮肤衰老[67]。
路璐等[68]研究了潞党参口服液对Fas/FasL在正常小鼠皮肤和光老化皮肤中表达的影响,发现Fas在光老化皮肤中的表达上调且功能增强,而潞党参能够下调小鼠皮肤组织中凋亡因子Fas、FasL的表达,减少了细胞凋亡状况,进而抑制了皮肤光老化的发生,提示潞党参口服液具有抗炎和抗光老化的作用。张伟等[69]发现广藿香醇可降低UVB辐射后HDF细胞的细胞质中Cyto C的含量,从而抑制Bax、Caspase-9及Caspase-3的mRNA和蛋白表达水平,提高Bcl-2的mRNA和蛋白表达,提示广藿香醇可通过抑制凋亡的发生来发挥其光保护作用。
3 自然老化和光老化共同的分子机制皮肤的自然老化和光老化虽在临床和组织学特征上差异明显,但光老化实际上是发生在皮肤自然老化的基础之上,自然老化同样无法避免UV辐射等的影响,光老化和自然老化之间具有共同的分子机制[70]。见图 1。
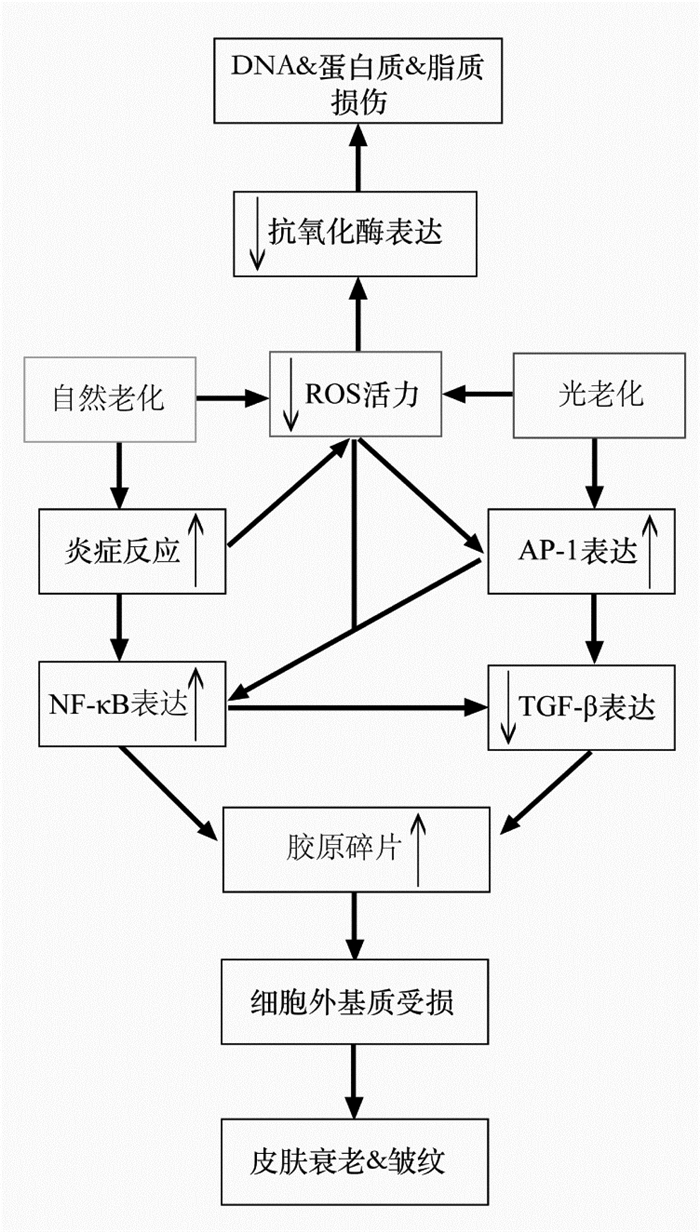
|
| 图 1 自然老化和光老化共同的分子机制 |
氧化应激是导致皮肤光老化发生的重要因素,而在自然老化的皮肤中同样存在氧化应激。随着机体年龄的增长,体内的ROS也随之不断累积增加,而体内各类抗氧化酶活性降低、数量减少,机体清除ROS的能力明显下降,从而引起体内氧化与抗氧化防御系统之间的稳态失调,机体发生氧化应激[71]。自然老化过程中堆积的大量ROS同样可启动与光老化相似的细胞信号级联反应,引起细胞损伤,最终导致皮肤在结构、功能和外观等方面发生一系列改变。研究发现,平贝母多糖能明显升高D-半乳糖所致的亚急性衰老小鼠皮肤SOD和GSH-Px活性,降低MDA含量,从而发挥延缓皮肤衰老的作用[72]。Tan等[73]发现木瓜黄酮能增加老年小鼠的皮肤组织中羟脯氨酸和SOD含量,降低MDA和脂褐质含量,维持皮肤正常的形态、结构和功能,具有明显的抗皮肤衰老作用。
自然老化的皮肤中皱纹的出现主要是由于真皮细胞外基质受损,其分子机制与光老化过程中胶原结构改变的机制相似[74]。Lephart等[75]发现老年皮肤中c-Fos的表达与年轻皮肤相比虽无明显变化,但c-Jun的mRNA和蛋白质的表达水平明显升高,AP-1的活性显著增加。AP-1的活化会抑制TGF-β/Smad信号转导,减少I型和III型前胶原蛋白mRNA的合成,抑制胶原蛋白的合成。AP-1的活化同样可调节MMPs的表达,老年人的皮肤中MMP-1、MMP-3和MMP-9的表达增加,胶原蛋白降解增多[76]。研究发现,六味地黄丸可使D-半乳糖所致的亚急性衰老小鼠皮肤中MMP-1和MMP-3含量增加,从而提高真皮中胶原蛋白的含量,提高老化表皮细胞的再生能力,延缓皮肤衰老[77]。MMPs在真皮中过度降解细胞外基质会导致皮肤老化过程中炎症反应的发生[78]。Choi等[79]发现老年小鼠中TNF-α、IL-6等促炎细胞因子的mRNA和蛋白质的表达增加,同时NF-κB的转录活性升高,而槐米提取物中7,8二羟基黄酮可降低促炎细胞因子的表达,减轻老年小鼠皮肤的炎症损伤,改善衰老症状。
真皮中成纤维细胞和细胞外基质相互黏附,为皮肤提供张力和弹性,胶原蛋白结构的完整性是保证这一作用的基础[80]。研究发现,降解的胶原蛋白会促进胶原蛋白碎片的形成,一方面,积累的胶原蛋白碎片会减弱成纤维细胞和细胞外基质之间的黏附力,破坏胶原蛋白结构的完整性,进而降低皮肤的张力和弹性;另一方面,胶原蛋白碎片的存在会导致细胞中MMP-1表达上调,使胶原蛋白合成减少,从而影响胶原蛋白的更新,这又使得胶原蛋白碎片进一步积累并由此形成一个恶性循环,使细胞外基质受损程度加深,最终导致皮肤弹性下降形成皱纹[81]。Kammeyer等[82]在光老化和自然老化的皮肤中都观察到了胶原蛋白碎片的存在,提示胶原蛋白碎片的累积可能是加速皮肤衰老的重要原因。许浩等[83]研究发现茯苓提取液可提高老年大鼠皮肤羟脯氨酸含量,进而提高胶原蛋白结构的完整性,增加皮肤的张力和弹性,延缓皮肤衰老。
4 小结与展望对于衰老机制的认识已由直观感受发展到了分子探索的层面,对于衰老机制的研究取得了巨大的突破。皮肤作为一个受内外多种因素影响的器官,研究其衰老机制对于机体的整体衰老研究具有特殊意义。皮肤光老化和自然老化在临床和组织学上具有不同的表现,但诱发两者发生的分子机制却具有许多相似之处。皮肤光老化中UV辐射诱导的大量ROS不仅会破坏蛋白质、脂质和DNA,还会刺激多种细胞表面受体,激活多条信号转导途径,导致细胞外基质受损、诱发炎症级联反应并诱导细胞凋亡。皮肤自然老化的分子机制主要由积累的ROS引发,它与光老化发生机制的高度相似性反映了氧化应激在皮肤老化中的核心作用。随着对皮肤老化机制研究的不断深入,人类对于中药抗皮肤老化的研究也取得了相应的进展,这些机制的深入研究使中药在抗皮肤老化领域能够发挥其独特作用。
| [1] |
RABE J H, MAMELAK A J, MCELGUNN P J, et al. Photoaging: mechanisms and repair[J]. Journal of the American Academy of Dermatology, 2006, 55(1): 1-19. DOI:10.1016/j.jaad.2005.05.010 |
| [2] |
CAVINATO M, JANSEN-DURR, PIDDER. Molecular mecha-nisms of UVB-induced senescence of dermal fibroblasts and its relevance for photoaging of the human skin[J]. Experimental Gerontology, 2017, 94(12): 78-82. |
| [3] |
DORAZIO J, JARRETT S, AMARO-ORTIZ A, et al. UV radiation and the skin[J]. International Journal of Molecular Sciences, 2013, 14(6): 12222-12248. DOI:10.3390/ijms140612222 |
| [4] |
FISHER G J, KANG S, VARANI J, et al. Mechanisms of photoaging and chronological skin aging[J]. Archives of Dermatology, 2002, 138(11): 1462-1470. |
| [5] |
PARK S H, LEE S S, BANG M H, et al. Protection against UVB-induced damages in human dermal fibroblasts: efficacy of tricin isolated from enzyme-treated Zizania latifolia extract[J]. Journal of the Agricultural Chemical Society of Japan, 2019, 83(3): 551-560. |
| [6] |
倪晨宁. 皮肤光老化的中医药治疗研究进展[J]. 名医, 2018, 18(2): 96-98. NI C N. Research progress of traditional Chinese medicine treatment of skin photoaging[J]. Famous Doctor, 2018, 18(2): 96-98. |
| [7] |
GRUBER F, KREMSLEHNER C, ECKHART L, et al. Cell aging and cellular senescence in skin aging-Recent advances in fibroblast and keratinocyte biology[J]. Experimental Gerontology, 2020, 130(18): 110780. |
| [8] |
ECKHART L, ZEEUWEN PLJM. The skin barrier: Epidermis versus environment[J]. Experimental Dermatology, 2018, 27(8): 805-806. DOI:10.1111/exd.13731 |
| [9] |
MUSSARD E, JOUSSELIN S, CESARO A, et al. Andrographis paniculata and its bioactive diterpenoids protect dermal fibroblasts against inflammation and oxidative stress[J]. Antioxidants, 2020, 9(5): 64-67. |
| [10] |
GILCHERST B A. A review of skin ageing and its medical therapy[J]. The British Journal of Dermatology, 1996, 135(6): 867-75. DOI:10.1046/j.1365-2133.1996.d01-1088.x |
| [11] |
TODOROVA K, MANDINOVA A. Novel approaches for managing aged skin and nonmelanoma skin cancer[J]. Advanced Drug Delivery Reviews, 2020, 153(12): 18-27. |
| [12] |
VARANI J, DAME M K, RITTIE L, et al. Decreased collagen production in chronologically aged skin: roles of age-dependent alteration in fibroblast function and defective mechanical stimulation[J]. The American Journal of Pathology, 2006, 168(6): 1861-1868. DOI:10.2353/ajpath.2006.051302 |
| [13] |
RITTIE L, SACHS D L, ORRINGER J S, et al. Eccrine sweat glands are major contributors to reepithelialization of human wounds[J]. The American Journal of Pathology, 2013, 182(1): 163-171. DOI:10.1016/j.ajpath.2012.09.019 |
| [14] |
HELFRICH Y R, SACHS D L, VOORHEES J J. Overview of skin aging and photoaging[J]. Dermatology Nursing, 2008, 20(3): 177-183. |
| [15] |
CHAIPRASONGSUK A, JANJETOVIC Z, KIM TK, et al. Protective effects of novel derivatives of vitamin D3 and lumisterol against UVB-induced damage in human keratinocytes involve activation of Nrf2 and p53 defense mechanisms[J]. Redox Biology, 2019, 2(4): 101206. |
| [16] |
VARANI J, WARNER R L, GHARAEE-KERMANI M, et al. Vitamin A antagonizes decreased cell growth and elevated collagen-degrading matrix metalloproteinases and stimulates collagen accumulation in naturally aged human skin[J]. The Journal of Investigative Dermatology, 2000, 114(3): 480-486. DOI:10.1046/j.1523-1747.2000.00902.x |
| [17] |
BRAVERMAN I M, FONFERKO E. Studies in cutaneous aging: I. The elastic fiber network[J]. The Journal of investigative dermatology, 1982, 78(5): 434-443. DOI:10.1111/1523-1747.ep12507866 |
| [18] |
ELIAS P M, GOERKE J, FRIENG D S. Mammalian epidermal barrier layer lipids: composition and influence on structure[J]. The Journal of Investigative Dermatology, 1977, 69(6): 535-546. DOI:10.1111/1523-1747.ep12687968 |
| [19] |
HUSSEIN M R. Ultraviolet radiation and skin cancer: molecular mechanisms[J]. Journal of cutaneous pathology, 2005, 32(3): 191-205. DOI:10.1111/j.0303-6987.2005.00281.x |
| [20] |
KANAKI T, MAKRANTONAKI E, ZOUBOULIS C C. Biom-arkers of skin aging[J]. Reviews in Endocrine & Metabolic Disorders, 2016, 17(3): 433-442. |
| [21] |
SACHW D L, VARANI J, CHUBB H, et al. Atrophic and hypertrophic photoaging: clinical, histologic, and molecular features of 2 distinct phenotypes of photoaged skin[J]. Journal of the American Academy of Dermatology, 2019, 81(6): 480-488. |
| [22] |
BRITTO S M, SHANTHAKUMARI D, AGILAN B, et al. Apigenin revents ultraviolet-B radiation induced cyclobutane pyrimidine dimers formation in human dermal fibroblasts[J]. Mutation research, 2017, 821(16): 28-35. |
| [23] |
METRAL E, RACHIDI W, DAMOUR O, et al. Long-term genoprotection effect of sechium edule fruit extract against UVA irradiation in keratinocytes[J]. Photochemistry and Photobiology, 2018, 94(5): 343-350. |
| [24] |
CHEN F, TANG Y, SUN Y, et al. 6-shogaol, a active constiuents of ginger prevents UVB radiation mediated inflammation and oxidative stress through modulating Nrf2 signaling in human epidermal keratinocytes[J]. Journal of Photochemistry and Photobiology B: Biology, 2019, 197(8): 111518. |
| [25] |
RINNERTHALER M, BISCHOF J, STREUBEL M K, et al. Oxidative Stress in Aging Human skin[J]. Biomolecules, 2015, 5(2): 545-589. DOI:10.3390/biom5020545 |
| [26] |
WOOLLEY J F, STANICKA J, COTTER T G. Recent advances in reactive oxygen species measurement in biological systems[J]. Trends in Biochemical Sciences, 2013, 38(11): 556-565. DOI:10.1016/j.tibs.2013.08.009 |
| [27] |
LEPHART E D. Skin aging and oxidative stress: equol's anti-aging effects via biochemical and molecular mecha-nisms[J]. Ageing Research Reviews, 2016, 3(1): 36-54. |
| [28] |
HSEU Y C, CHANG C T, GOWRISANKAR Y V, et al. Zerumbone exhibits antiphotoaging and dermatoprotective properties in ultraviolet a-irradiated human skin fibroblast cells via the activation of Nrf2/ARE defensive pathway[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019(18): 1-14. |
| [29] |
ROSETTE C, KARIN M. Ultraviolet light and osmotic stress: activation of the JNK cascade through multiple growth factor and cytokine receptors[J]. Science, 1996, 274(5290): 1194-1197. DOI:10.1126/science.274.5290.1194 |
| [30] |
BOUAAYED J, BOHN T. Exogenous antioxidants-Double-edged swords in cellular redox state: health beneficial effects at physiologic doses versus deleterious effects at high doses[J]. Oxidative Medicine and Cellular Longevity, 2010, 3(4): 228-237. DOI:10.4161/oxim.3.4.12858 |
| [31] |
RUSSELL E G, COTTER T G. New insight into the role of reactive oxygen species (ROS) in cellular signal-transduction processes[J]. International Review of Cell and Molecular, 2015, 319(14): 221-254. |
| [32] |
董文宾, 刘迪, 杨津. 杜仲叶树脂分离纯化产物体外抗氧化活性研究[J]. 食品科学, 2011, 32(1): 27-30. DONG W B, LIU D, YANG J. Study on in vitro antioxidant activity of Eucommia ulmoides leaves resin separation and purification products[J]. Food Science, 2011, 32(1): 27-30. |
| [33] |
CHOI S, LEE S N, KIM K, et al. Biological effects of rutin on skin aging[J]. International Journal of Molecular Medicine, 2016, 38(6): 357-63. |
| [34] |
边芳. 甘草等水提物对UVB诱导BALB/c小鼠皮肤光老化保护作用的初步探索[D]. 甘肃: 兰州大学, 2011. BIAN F. Preliminary study on the protective effect of Glycyrrhiza uralensis and other water extracts on skinphotoaging of BALB/c mice induced by UVB[D]. Gansu: Lanzhou University, 2011 |
| [35] |
HILL S, VAN REMMEN H. Mitochondrial stress signaling in longevity: a new role for mitochondrial function in aging[J]. Redox Biology, 2014, 48(2): 936-944. |
| [36] |
BOSCH R, PHILIPS N, SEAREZ-PEREZ J A, et al. Mechanisms of photoaging and cutaneous photocarcinogenesis, and photoprotective strategies with phytochemicals[J]. Antioxidants (Basel, Switzerland), 2015, 4(2): 248-268. |
| [37] |
SACHS D L, VARANI J, CHUBB H, et al. Atrophic and hypertrophic photoaging: clinical, histologic, and molecular features of 2 distinct phenotypes of photoaged skin[J]. Journal of the American Academy of Dermatology, 2019, 9(5): 11-17. |
| [38] |
AFNAN Q, KAISER P J, RAFIQ R A, et al. Glycyrrhizic acid prevents ultraviolet-B induced photodamage: a role for mitogenactivated protein kinases, nuclear factor kappa B and mitochondrial apoptotic pathway[J]. Experimental Dermatology, 2016, 25(6): 440-446. DOI:10.1111/exd.12964 |
| [39] |
马月丹. 绞股蓝总皂苷干预光老化HaCaT细胞对HSF细胞p38MAPK信号通路的影响[D]. 辽宁: 辽宁中医药大学, 2014. MA Y D. Effects of Gypenosides on p38MAPK signaling pathway of HSF cells after photoaging with HaCaT cells[D]. Liaoning: Liaoning University of Traditional Chinese Medicine, 2014. |
| [40] |
CHOI H J, ALAM M B, BAEK M E, et al. Protection against UVB-induced photoaging by nypa fruticans via inhibition of MAPK/AP-1/MMP-1 signaling[J]. Oxidative Medicine and, Cellular Longevity, 2020, 20(20): 1-14. |
| [41] |
WANG Y, YANG J, YI J. Redox sensing by proteins: oxidative modifications on cysteines and the consequent events[J]. Antioxidants & Redox Signaling, 2012, 16(7): 649-657. |
| [42] |
MCKY M M, MORRISON D K. Integrating signals from RTKs to ERK/MAPK[J]. Oncogene, 2007, 26(22): 3113-3121. DOI:10.1038/sj.onc.1210394 |
| [43] |
PITTAYAPRUEK P, MEEPANSAN J, PRAPAPAN O, et al. Role of matrix metalloproteinases in photoaging and photocarcinogenesis[J]. International Journal of Molecular Sciences, 2016, 17(6): 868. DOI:10.3390/ijms17060868 |
| [44] |
ZHAO P, ALAM M B, LEE S H. Protection of UVB-induced photoaging by fuzhuan-brick tea aqueous extract via MAPKs/Nrf2-mediated down-regulation of MMP-1[J]. Nutrients, 2018, 11(4): 60. |
| [45] |
RA H J, PARKS W C. Control of matrix metalloproteinase catalytic activity[J]. Matrix Biology: Journal of the International Society for Matrix Biology, 2007, 26(8): 587-596. DOI:10.1016/j.matbio.2007.07.001 |
| [46] |
MINDEN A, LIN A, CLARET F X, et al. Selective activation of the JNK signaling cascade and c-Jun transcriptional activity by the small GTPases Rac and Cdc42Hs[J]. Cell, 1995, 81(7): 1147-1157. DOI:10.1016/S0092-8674(05)80019-4 |
| [47] |
TURJANSKI A G, VAQUE J P, GUTKIND J S. MAP kinases and the control of nuclear events[J]. Oncogene, 2007, 26(22): 3240-3253. DOI:10.1038/sj.onc.1210415 |
| [48] |
BODE A M, DONG Z. The functional contrariety of JNK[J]. Molecular Carcinogenesis, 2007, 46(8): 591-598. DOI:10.1002/mc.20348 |
| [49] |
BOO Y C. Emerging strategies to protect the skin from ultraviolet rays using plant-derived materials[J]. Antioxidants, 2020, 9(7): 637. DOI:10.3390/antiox9070637 |
| [50] |
OLIVERIRA M M, RATTI B A, DARE R G, et al. Dihydrocaffeic acid prevents UVB-induced oxidative stress leading to the inhibition of apoptosis and MMP-1 expression via p38 signaling pathway[J]. Oxidative Medicine and Cellular Longevity, 2019, 20(19): 241-249. |
| [51] |
KWON K R, ALAM M, PARK J, et al. Attenuation of UVB-induced photo-aging by polyphenolic-rich spatholobus suberectus stem extract via modulation of MAPK/AP-1/MMPs signaling in human keratinocytes[J]. Nutrients, 2019, 11(6): 669-672. |
| [52] |
WANG X, BI Z G. UVB-irradiated human keratinocytes and interleukin-1 indirectly increase MAP kinase/AP-1 activation and MMP-1 production in UVA-irradiated dermal fibroblasts[J]. Chinese Medical Journal, 2006, 119(10): 827-831. DOI:10.1097/00029330-200605020-00006 |
| [53] |
SUN Z, PARK S Y, HWANG E, et al. Salvianolic acid B protects normal human dermal fibroblasts against ultraviolet B irradiation-induced photoaging through mitogen-activated protein kinase and activator protein-1 pathways[J]. Photochemistry and Photobiology, 2015, 91(4): 879-886. DOI:10.1111/php.12427 |
| [54] |
GONOS E. Proteasome activation as a novel anti-aging strategy[J]. Free Radical Biology & Medicine, 2014, 75(11): S7. |
| [55] |
WANG H Q, QUAN T, HE T, et al. Epidermal growth factor receptor-dependent, NF-kappaB-independent activation of the phosphatidylinositol 3-kinase/Akt pathway inhibits ultraviolet irradiation-induced caspases-3, -8, and-9 in human keratinocytes[J]. The Journal of Biological Chemistry, 2003, 278(46): 45737-45745. DOI:10.1074/jbc.M300574200 |
| [56] |
KAMMEYER A, LUITEN R M. Oxidation events and skin aging[J]. Ageing Research Reviews, 2015, 21(5): 16-29. |
| [57] |
QUAN T, FISHER G J. Role of age-associated alterations of the dermal extracellular matrix microenvironment in human skin aging: amini-review[J]. Gerontology, 2015, 61(5): 427-434. DOI:10.1159/000371708 |
| [58] |
史飞, 蔡庆, 王毅侠, 等. 红景天苷对UVA/UVB辐射的成纤维细胞中TNF-α和IL-β mRNA表达的影响[J]. 中国麻风皮肤病杂志, 2013, 29(7): 450-452. SHI F, CAI Q, WANG Y X, et al. Effect of salidroside on TNF-α and IL-β mRNA expression in UVA/UVB irradiated fibroblasts[J]. Chinese Journal of Dermatology of Leprosy, 2013, 29(7): 450-452. DOI:10.3969/j.issn.1009-1157.2013.07.012 |
| [59] |
王鑫丽, 农祥. 三七总皂苷的药理作用及其抗皮肤光老化的作用机制[J]. 皮肤病与性病, 2015, 37(3): 151-153. WANG X L, NONG X. Pharmacological effects of Panax notoginseng saponins and its mechanism of action against photoaging of skin[J]. Dermatology and Venereal Diseases, 2015, 37(3): 151-153. |
| [60] |
LEE H, SUNG J, KIM Y, et al. Protective effects of unsaponifiable matter from perilla seed meal on UVB-induced damages and the underlying mechanisms in human skin fibroblasts[J]. Antioxidants (Basel), 2019, 8(12): 644. DOI:10.3390/antiox8120644 |
| [61] |
MASSAGUE J. TGF-β signalling in context[J]. Nature Reviews Molecular Cell Biology, 2012, 13(10): 616-630. DOI:10.1038/nrm3434 |
| [62] |
RAJ D, BRASH D E, GROSSMAN D. Keratinocyte apoptosis in epidermal development and disease[J]. The Journal of Investigative Dermatology, 2006, 126(2): 243-257. DOI:10.1038/sj.jid.5700008 |
| [63] |
LAURI A, POMPILIO G, CAPOGROSSI M C. The mitochondrial genome in aging and senescence[J]. Ageing Research Reviews, 2014, 18(2): 1-15. |
| [64] |
KATIYAR S K. UV-induced immune suppression and photocarcinogenesis: chemoprevention by dietary botanical agents[J]. Cancer Letters, 2007, 255(1): 1-11. DOI:10.1016/j.canlet.2007.02.010 |
| [65] |
WANG P W, CHENG Y C, HUANG Y C, et al. Red raspberry extract protects the skin against UVB-induced damage with antioxidative and anti-inflammatory properties[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 9529676. |
| [66] |
WANG H Q, QUAN T, HE T, et al. Epidermal growth factor receptor-dependent, NF-kappaB-independent activation of the phosphatidylinositol 3-kinase/Akt pathway inhibits ultraviolet irradiation-induced caspases-3, -8, and-9 in human keratinocytes[J]. The Journal of Biological Chemistry, 2003, 278(46): 45737-45745. DOI:10.1074/jbc.M300574200 |
| [67] |
VIGNERON A, VOUSDEN K H. p53, ROS and senescence in the control of aging[J]. Aging, 2010, 2(8): 471-474. DOI:10.18632/aging.100189 |
| [68] |
路璐, 吴景东, 冯馨颖, 等. 潞党参口服液对光老化小鼠皮肤组织中Fas/FasL表达的影响[J]. 实用中医内科杂志, 2020, 34(7): 143-144. LU L, WU J D, FENG X Y, et al. Effect of ludangshen oral liquid on Fas/FasL expression in skin tissue of photoaging mice[J]. Journal of Practical Chinese Medicine, 2020, 34(7): 143-144. |
| [69] |
张伟, 张娟娟, 郭庆丰, 等. 广藿香醇药理作用研究进展[J]. 中国实验方剂学杂志, 2020, 26(3): 213-221. ZHANG W, ZHANG J J, GUO Q F, et al. Progress in pharmacological action of pogostemon cablin[J]. Chinese Journal of Experimental Prescriptions, 2020, 26(3): 213-221. |
| [70] |
VICTORELLI S, LAGNADO A, HALIM J, et al. Senescent human melanocytes drive skin ageing via paracrine telomere dysfunction[J]. The EMBO Journal, 2019, 38(23): e101982. |
| [71] |
HARMAN D. Aging: a theory based on free radical and radiation chemistry[J]. Journal of Gerontology, 1956, 11(3): 298-300. DOI:10.1093/geronj/11.3.298 |
| [72] |
刘春红, 金钟斗, 韩宝瑞. 平贝母多糖对D-半乳糖诱导衰老模型小鼠的抗氧化作用[J]. 食品科学, 2011, 32(23): 285-288. LIU C H, JIN Z D, HAN B R. Antioxidant effect of Fritillaria ussuriensis polysaccharide on D-galactose-induced aging model mice[J]. Food Science, 2011, 32(23): 285-288. |
| [73] |
TAN W B, LU Y H, TAN G. The anti-aging effect of papaya flavo-noids[J]. International Journal of Gerontology, 2012, 32(7): 5218-5219. |
| [74] |
POLJSAK B, DAHMANE R G, GODIC A. Intrinsic skin aging: the role of oxidative stress[J]. Acta Dermatovenerologica Alpina, Pannonica et Adriatica, 2012, 21(2): 33-36. |
| [75] |
LEPHART E D. Skin aging and oxidative stress: equol's anti-aging effects via biochemical and molecular mechanisms[J]. Ageing Research Reviews, 2016, 31(5): 36-54. |
| [76] |
PARKINSON L G, TORO A, ZHAO H, et al. Granzyme B mediates both direct and indirect cleavage of extracellular matrix in skin after chronic low-dose ultraviolet light irradiation[J]. Aging Cell, 2015, 14(1): 67-77. DOI:10.1111/acel.12298 |
| [77] |
戚秀中, 张田野, 苏永华. 具有抗紫外线皮肤损伤作用的常用中药[J]. 中国美容医学, 2010, 19(11): 1728-1730. QI X Z, ZHANG T Y, SU Y H. Traditional Chinese medicine with anti ultraviolet skin damage effect[J]. Chinese Journal of Cosmetic Medicine, 2010, 19(11): 1728-1730. DOI:10.3969/j.issn.1008-6455.2010.11.077 |
| [78] |
CUENDA A, ROUSSEAU S. p38 MAP-kinases pathway regulation, function and role in human diseases[J]. Biochimica Et Biophysica Acta, 2007, 1773(8): 1358-1375. DOI:10.1016/j.bbamcr.2007.03.010 |
| [79] |
CHOI J W, LEE J, PARK Y I. 7, 8-Dihydroxyflavone attenuates TNF-α-induced skin aging in Hs68 human dermal fibroblast cells via down-regulation of the MAPKs/Akt signaling pathways[J]. Biomedicine & Pharmacotherapy, 2017, 95: 1580-1587. |
| [80] |
FISHER G J, KANG S, VARANI J, et al. Mechanisms of photoaging and chronological skin aging[J]. Archives of Dermatology, 2002, 138(11): 1462-1470. |
| [81] |
KOHI E, STEINBAUER J, LANDTHALER M, et al. Skin ageing[J]. Journal of the European Academy of Dermatology and Venereology, 2011, 25(8): 873-884. DOI:10.1111/j.1468-3083.2010.03963.x |
| [82] |
KAMMEYER A, LUITEN RM. Oxidation events and skin aging[J]. Ageing Research Reviews, 2015, 21(6): 16-29. |
| [83] |
许浩, 卢静, 曲彩红. 茯苓多糖的药理作用研究概况[J]. 临床合理用药杂志, 2015, 8(16): 175-176. XU H, LU J, QU C H. Overview of pharmacological effects of Poria cocos polysaccharide[J]. Journal of Clinical Rational Drug Use, 2015, 8(16): 175-176. |
 2021, Vol. 40
2021, Vol. 40