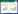文章信息
- 曹敏, 王丽, 刘海朝, 潘赞红, 刘建卫, 边育红
- CAO Min, WANG Li, LIU Haizhao, PAN Zanhong, LIU Jianwei, BIAN Yuhong
- 抗纤丸激活Nrf2信号通路抗小鼠慢性肝损伤的作用和机制研究
- Effect and mechanism of Kangxian Pills againstchronic liver injury in mice by activating Nrf2 signaling pathway
- 天津中医药大学学报, 2021, 40(4): 496-502
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(4): 496-502
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.04.19
-
文章历史
收稿日期: 2021-01-28
2. 天津市第二人民医院, 天津 300192
2. Tianjin Second People's Hospital, Tianjin 300192, China
肝脏是调节代谢稳态的重要器官,可以去除机体许多有害化学物质和药物,基于这些重要功能,肝脏也易被这些物质损伤[1]。研究表明,抗氧化防御系统紊乱是肝损伤的主要机制之一[2]。抗氧化剂的应用也被认为是防治氧化应激性肝病的一种合理治疗策略[3]。核因子相关因子2(Nrf2)是细胞氧化还原的主要调节因子,在肝脏、肾脏中表达较高[4]。经证实,活化后入核的Nrf2与抗氧化和解毒基因启动子区域的的抗氧化反应元件(AREs)结合进而激活下游血红素氧合酶1(HO-1)、谷氨酸半胱氨酸连接酶催化亚基(Gclc)和醌氧化还原酶1(NQO1)等Ⅱ相解毒酶或抗氧化基因的表达[5]。因此,激活Nrf2及其相关抗氧化酶可能在治疗慢性肝损伤中发挥重要作用。
抗纤丸是天津市第二人民医院刘作恩医师在多年临床实践中总结出的经验方。该方以“血府逐瘀汤”为底方,加入冬虫夏草、黄芪等补益药研制而成,具有扶正祛邪、活血化瘀的功效。临床上用于治疗肝损伤,肝纤维化等慢性肝病,疗效显著,但其具体作用机制尚未明确。研究表明,抗纤丸组方中当归[6]、川芎[7]和冬虫夏草[8]等中药均具有抑制氧化应激的作用。当归多糖通过抑制氧化应激并减少肝细胞凋亡缓解对乙酰氨基酚诱导的肝细胞损伤[9]。五味子醇提物主要活性成分之一的五味子酸性多糖通过降低丙二醛(MDA)水平,提高超氧化物歧化酶(SOD)活性改善乙醇诱导的氧化损伤[10]。此外,前期的研究表明抗纤丸通过调节肠道菌群,抑制肠上皮的通透性,减轻肝脏的炎症反应缓解四氯化碳(CCL4)诱导的慢性肝损伤[11]。为了探讨抗纤丸治疗慢性肝损伤的潜在机制,本文通过腹腔注射CCL4建立慢性肝损伤小鼠模型,基于Nrf2信号通路,初步探讨抗纤丸对模型小鼠肝细胞损伤的保护作用及潜在机制。
1 材料与方法 1.1 实验试剂抗纤丸由天津市第二人民医院提供;甘草酸二铵肠溶胶囊购自正大天晴药业集团;四氯化碳(CCL4,纯度≥99%)购自天津市凯通化学试剂有限公司;天冬氨酸转氨酶(AST)检测试剂盒(货号:C010-1-1);丙氨酸转氨酶(ALT)试剂盒(货号:C009-1-1);Masson三色染色液试剂盒(货号:G1340),DAB显色试剂盒(货号:DA1010)购自北京索莱宝科技有限公司;山羊抗鼠IgG(货号:bs-0296G-Bio)购自北京博奥森生物技术有限公司;抗α-SMA抗体(货号:ab7817)购自Abcam公司,抗-Nrf2抗体(货号:16396-1-AP),抗-HO-1抗体(货号:10701-1-AP),抗-NQO1抗体(货号:67240-1-lg),抗-Gclc抗体(货号:12601-1-AP)和抗-β-actin抗体(货号:20536-1-AP)都购自Proteintech公司;总蛋白定量测试盒(货号:A045-4-2)、超氧化物歧化酶(SOD)试剂盒(货号:A001-1-2);丙二醛(MDA)测试盒(货号:A003-1-2);谷胱甘肽过氧化物酶(GSH-Px)测试盒(货号:A005-1-2)均购自南京建成生物工程研究所;总RNA提取试剂盒(货号:DP419)、反转录试剂盒(货号:KR116)、荧光定量扩增试剂盒(货号:FP205)均购自天根生物科技有限公司。
1.2 实验分组及模型复制 1.2.1 实验分组雄性BALB/c小鼠40只,6周龄,体质量(20±2)g,购自斯贝福生物技术有限公司,动物许可证号:SCXK(京)2019-0010。适应性喂养一周后,采用随机数字表法分为正常组、模型组,甘草酸二铵组(阳性对照组)、抗纤丸组,每组10只。
1.2.2 动物模型复制正常组:腹腔注射橄榄油溶液(2 mL/kg),每周2次,连续6周;模型组、阳性对照组、抗纤丸组:腹腔注射20%的CCL4橄榄油溶液(2 mL/kg),每周2次,连续6周[12]。
1.3 给药方法持续造模6周后,每组随机取2只,收集血清和肝组织。检测血清中转氨酶水平,肝组织中SOD,GSH-Px以及MDA等氧化应激的标志物。苏木精-伊红(HE)染色观察肝组织的病理变化,确定造模是否成功。造模成功后,将慢性肝损伤模型小鼠随机分为模型组,甘草酸二铵组(阳性对照组)、抗纤丸组。正常组和模型组每日灌服生理盐水10 mL/kg,阳性对照组和抗纤丸组分别灌服甘草酸二铵水溶液60 mg/(kg·d)[13]和抗纤丸水溶液3 g/(kg·d),连续灌胃4周。
1.4 指标检测 1.4.1 小鼠的一般情况及肝指数造模给药期间观察小鼠的毛色及生活状况、隔日测量小鼠的体质量。末次给药后小鼠禁食12 h,腹腔注射10%的水合氯醛麻醉小鼠,记录小鼠体质量后脱颈处死小鼠。取小鼠的整个肝组织于生理盐水中清洗后用滤纸吸干水分,称质量,按照如下公式计算小鼠的肝指数:肝指数(%)=肝质量(g)/体质量(g)×100[13]。
1.4.2 血清AST、ALT水平检测各组小鼠目内眦取血后,室温静置30 min,离心半径8 cm,转速3 000 r/min离心5 min,收集血清。根据说明书检测血清中(ALT),AST的水平。
1.4.3 肝组织病理学检测取各组小鼠相同部位厚约5 mm的肝组织固定于4%的多聚甲醛溶液中。经石蜡包埋,切片(4 μm),H & E染色观察各组小鼠肝组织的病理改变。
1.4.4 肝组织Masson染色按说明书依次将蜡切片石脱蜡至水、苏木素染细胞核、丽春红染色、磷钼酸处理、苯胺蓝染色、1%冰醋酸分化后将切片依次放入95%酒精,无水乙醇,二甲苯中脱水透明后稍晾干,用中性树胶封片。光学显微镜观察肝组织胶原纤维的变化。
1.4.5 肝组织α-SMA免疫组化染色石蜡切片脱蜡至水,灭活内源性过氧化物酶,热修复抗原后滴加山羊血清封闭液,滴加一抗α-平滑肌动蛋白(α-SMA,1∶300)4 ℃孵育过夜,PBS清洗,滴加二抗,37 ℃孵育30 min,DAB显色,苏木素复染,脱水,透明、中性树胶封片后光学显微镜观察。
1.4.6 肝组织中SOD、GSH-Px和MDA含量的检测准确称取各组小鼠的肝组织取100 mg,加入900 μL的生理盐水于冰上超声匀浆,制备成10%的肝组织匀浆。离心(3 000×g,4 ℃,10 min)取上清,按说明书检测肝组织匀浆蛋白含量、SOD、GSH-Px的活性和MDA的含量。
1.4.7 肝组织Nrf2、HO-1及相关基因的表达取各组小鼠的肝组织,提取肝组织中的总RNA,反转录合成cDNA,采用SYBR Green Real-time PCR试剂盒扩增,以相对定量法检测小鼠肝脏组织中Nrf2,HO-1、Gclc和NQO1的mRNA表达水平,采用GAPDH做内参,见表 1。运用2-ΔΔCT方法计算对照组和给药组的mRNA的相对表达量。
取小鼠肝脏组织30 mg加入裂解液500 mL(RIPA∶PMSF=100∶1),匀浆离心后取上清,使用BCA蛋白测定试剂盒测定总蛋白浓度。制备8%的SDS-PAGE分离胶,取等量蛋白(20 μg)电泳后将分离的蛋白转移至PVDF膜上。5%脱脂奶粉室温封闭2小时后,分别加入抗Nrf2(稀释比例1∶1000)、抗HO-1(稀释比例1∶2 000)、抗Gclc(稀释比例1∶6 000)、抗NQO1(稀释比例1∶10 000)、抗β-actin(稀释比例1∶2 000)。4 ℃孵育过夜后加入二抗羊抗兔IgG(稀释比例1∶10 000),室温孵育1 h。TBST洗膜后使用ECL试剂,显影成像。使用image J对条带进行统计分析。
1.5 统计学方法采用SPSS 21.0软件统计分析数据,GraphPad Prism 7绘制统计分析图。所有计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P < 0.05为差异具有统计学意义。
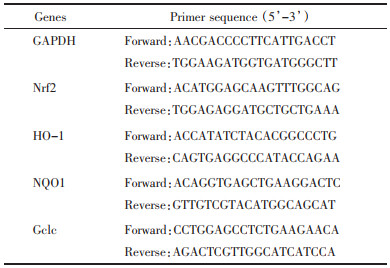
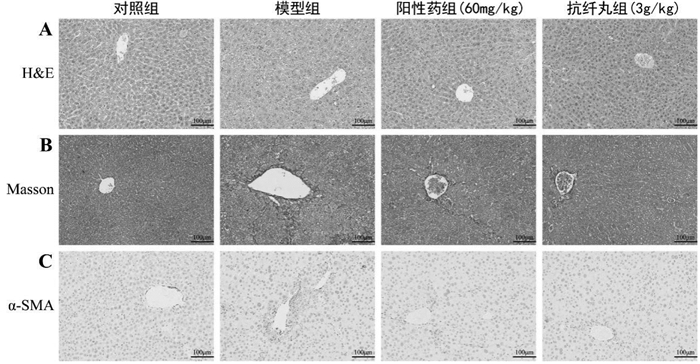
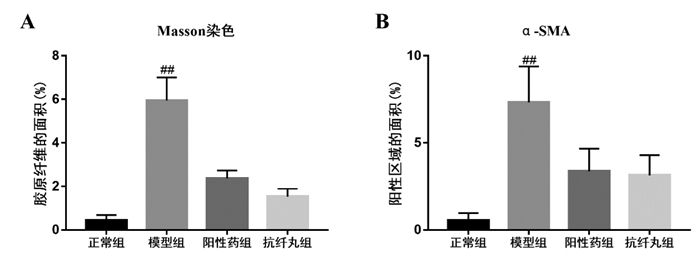
2 结果 2.1 抗纤丸对慢性肝损伤模型小鼠治疗作用的影响本研究通过检测血清AST和ALT的水平,计算肝指数以及观察肝组织的病理改变考察抗纤丸对CCL4诱导的慢性肝损伤模型小鼠的治疗作用。与正常组相比,模型组小鼠肝指数明显升高(P < 0.01);与模型组相比,阳性对照组与抗纤丸组的肝指数明显降低(P < 0.01),见表 2。与正常组相比,模型组小鼠AST与ALT活性均显著增加(P < 0.01);与模型组相比,阳性对照组与抗纤丸组血清中转氨酶活性明显降低(P < 0.01),见表 2。HE染色结果显示,正常组小鼠肝小叶结构正常,肝细胞呈条索状分布,肝细胞结构清晰;与正常组相比,模型组肝小叶结构紊乱,肝细胞广泛水肿并伴有坏死,而阳性对照组与抗纤丸组能显著的改善CCL4所致的肝组织病变,见图 1A。Masson染色结果显示,模型组胶原沉积明显增多,而阳性对照组与抗纤丸组胶原沉积的程度均有不同程度的改善,见图 1B,2A。免疫组化的结果显示,与正常组相比,模型组α-SMA的表达明显增加;与模型组相比,阳性对照组与抗纤丸组α-SMA的表达明显降低,见图 1C,2B。这些结果说明,抗纤丸能明显改善CCL4诱导的肝组织损伤,并且通过减少小鼠肝组织中胶原积累,降低α-SMA的表达明显抑制了CCl4诱导肝损伤向肝纤维化进展的趋势。
|
| 注:A.H & E染色;B. Masson染色;C.免疫组化观察α-SMA的表达(×20)。 图 1 小鼠肝组织H & E染色,Masson染色和α-SMA的表达 |
|
| 注:与正常组比较,##P<0.01;与模型组比较,**P<0.01。 图 2 各组小鼠肝组织中Masson染色和α-SMA免疫组化的分析 |
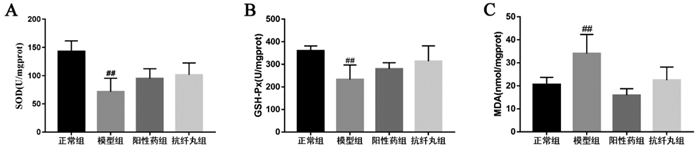
研究表明,过氧化/抗氧化系统与肝损伤的病理过程密切相关[14]。因此,本研究通过检测肝组织中SOD和GSH-Px的活性以及MDA的含量考察抗纤丸对CCL4诱导的慢性肝损伤模型小鼠氧化损伤的影响。与正常组相比,模型组小鼠肝组织中SOD,GSH-Px活性明显降低(P < 0.01),同时MDA的含量增加(P < 0.01);与模型组相比,给予甘草酸二铵和抗纤丸水溶液灌胃治疗后肝组织中SOD,GSH-Px活性增加(P < 0.05),MDA的含量也显著降低(P < 0.01),见图 3。这说明,抗纤丸能抑制氧化应激缓解CCL4诱导的慢性肝损伤。
|
| 注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;n=8。 图 3 抗纤丸对各组小鼠肝组织中SOD,GSH-Px和MDA含量的影响 |
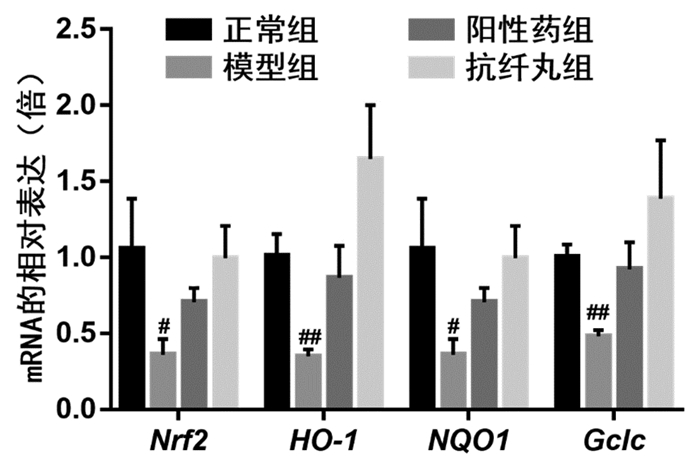
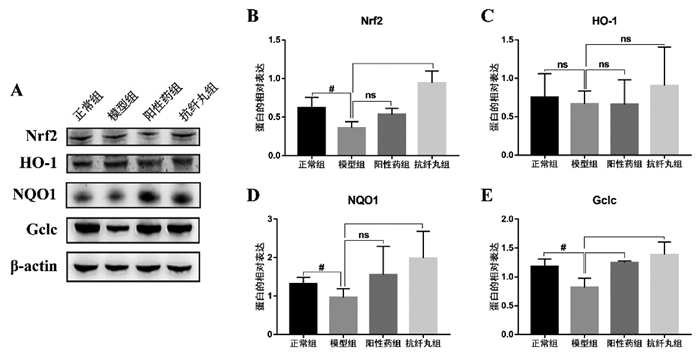
Nrf2相关通路被认为是细胞抗氧化应激最重要的机制[15]。为了验证抗纤丸是否通过激活Nrf2信号通路保护肝细胞氧化损伤,检测了肝组织中Nrf2通路相关基因和蛋白的表达水平。与正常组相比,慢性肝损伤模型组小鼠肝组织中Nrf2,HO-1,NQO1和Gclc的mRNA表达水平均显著下调(P<0.05或P<0.01);与模型组相比,阳性药对照组小鼠肝组织中Nrf2,HO-1,NQO1和Gclc和抗纤丸组小鼠肝组织中Nrf2,HO-1,NQO1和Gclc的mRNA表达水平均显著上调(P<0.05或P<0.01),见图 4。此外,WB的结果显示与正常组相比,慢性肝损伤模型组小鼠肝组织中Nrf2,NQO1和Gclc的蛋白表达水平均显著下调(P<0.05或P<0.01);与模型组相比,阳性药对照组小鼠肝组织中Gclc和抗纤丸组小鼠肝组织中Nrf2,NQO1和Gclc的蛋白表达水平均显著上调(P<0.05或P<0.01),见图 5。这些结果说明抗纤丸能激活Nrf2及下游相关抗氧化酶,从而缓解CCL4诱导的慢性肝损伤模型小鼠肝细胞氧化应激水平。
|
| 注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。 图 4 抗纤丸对各组小鼠Nrf2通路相关基因表达的影响 |
|
| 注:与正常组比较,#P<0.05;与模型组比较,*P<0.05,**P<0.01;ns:无统计学意义。 图 5 抗纤丸对各组小鼠Nrf2通路相关蛋白表达的影响 |
CCL4被广泛用于制备小鼠肝损伤模型。研究表明,CCL4可通过细胞色素P450酶代谢产生三氯甲烷自由基(·CCl3)或三氯甲烷过氧化物(·OOCCl3)自由基,诱导肝细胞氧化损伤[16]。本实验采用CCL4腹腔注射6周后,检测血清中AST,和ALT的水平均显著增高;此外,病理切片显示肝组织结构紊乱,肝细胞水肿且伴有坏死。这与前期报道的结果一致,说明模型复制成功[17]。
ALT、AST被认为是肝组织损伤的敏感指标[2],研究结果表明,抗纤丸能显著降低CCL4诱导的慢性肝损伤模型小鼠血清中转氨酶活性的升高。此外,HE染色结果也显示抗纤丸能显著抑制肝细胞损伤。研究表明,在慢性肝损伤过程中,细胞外基质(ECM)的合成与降解的平衡被破坏,导致肝ECM产生过多[18]。胶原是ECM的主要成分,正如Masson染色的结果显示抗纤丸能显著减少慢性肝损伤小鼠肝组织的胶原沉积。α-SMA是肌成纤维细胞活化的标志,在纤维形成过程中起关键作用[19]。免疫组化的结果显示,抗纤丸能显著减少α-SMA的表达,这说明抗纤丸能延缓慢性肝损伤进一步向肝纤维化进展。
研究表明,氧化应激在肝损伤的发生发展中具有重要作用。MDA是脂质过氧化的最终产物,可间接反映自由基对肝脏的损伤程度。相反,SOD和GSH-Px可保护肝细胞免受氧化剂的伤害,清除脂质过氧化物和氧自由基[20]。与预期的结果一致,抗纤丸组能明显逆转SOD,GSH-Px和MDA等氧化损伤相关参数的变化。Nrf2作为细胞氧化还原的主要调节因子,在抑制氧化应激缓解肝损伤的中起关键作用[21]。经证实,肝脏中特异性敲除Nrf2的基因小鼠比野生型小鼠更易诱发氧化应激导致肝损伤[22],而使用Nrf2激活剂可以缓解氧化损伤引发的疾病[23]。在生理条件下,Nrf2与Kelch样ECH相关蛋白1(Keap1)结合位于细胞质中,而在氧化或亲电应激时,Nrf2与Keap1解离并转位进入细胞核与sMaf蛋白等形成二聚体与抗氧化和解毒基因启动子区域的AREs结合激活下游II相解毒酶和抗氧化基因发挥抗氧化作用[5, 24]。结果显示,抗纤丸组能明显激活慢性肝损伤模型小鼠肝组织中Nrf2、HO-1、NQO1和Gclc的mRNA表达水平,以及肝组织中Nrf2、NQO1和Gclc的蛋白表达水平。
本研究结果表明抗纤丸能增加肝组织中SOD、GSH-Px的水平并且激活肝组织中Nrf2、HO-1、NQO1和Gclc等抗氧化酶活性,提示抗纤丸可能是通过抑制氧化应激保护肝细胞受损,这为抗纤丸的临床应用提供了基础理论依据。此外,本研究选用甘草酸二铵作为阳性药,结果显示抗纤丸对CCL4诱导的慢性肝损伤小鼠相关疗效指标与甘草酸二铵处理组无显著差异,但是抗纤丸在临床中能否替代甘草酸二铵还有待进一步研究。
| [1] |
LIU W, WANG Z, HOU J G, et al. The liver protection effects of Maltol, a flavoring agent, on carbon tetrachloride-induced acute liver injury in mice via inhibiting apoptosis and inflammatory response[J]. Molecules, 2018, 23(9): 2120. DOI:10.3390/molecules23092120 |
| [2] |
WU H T, ZHANG G, HUANG L S, et al. Hepatoprotective effect of polyphenol-enriched fraction from on oxidative stress and apoptosis in acetaminophen-induced liver injury in mice[J]. Oxidative Medicine and Cellular Longevity, 2017, 2017(16): 3631565. |
| [3] |
LI S, TAN H Y, WANG N, et al. The role of oxidative stress and antioxidants in liver diseases[J]. International Journal of Molecular Sciences, 2015, 16(5): 26087-124. |
| [4] |
BATAILLE A M, MANAUTOU J E. Nrf2:a potential target for new therapeutics in liver disease[J]. Clinical Pharmacology & Therapeutics, 2012, 92(13): 340-348. |
| [5] |
RAMOS-TOVAR E, MURIEL P. Free radicals, antioxidants, nuclear factor-E2-related factor-2 and liver damage[J]. Journal of Applied Toxicology, 2020, 40(6): 151-168. |
| [6] |
杨培树, 顾学宁, 安雅婷, 等. 当归等中药水提物体外抗氧化应激及抗炎作用研究[J]. 中国城乡企业卫生, 2018, 33(4): 71-72. YANG P S, GU X N, AN Y T, et al. Study on the antioxidant stress and anti-inflammatory effects of Angelica Aqueous extract in vitro[J]. Chinese Journal of Urban and Rural Enterprise Hygiene, 2018, 33(4): 71-72. |
| [7] |
汪刚, 刘莹, 侯雪峰, 等. 川芎提取物通过激活Nrf2通路对抗心肌缺血大鼠氧化应激损伤[J]. 中国中药杂志, 2017, 42(24): 4834-4840. WANG G, LIU Y, HOU X F, et al. Prevention effect of Ligusticum chuanxiong extraction against oxidative stress injury induced by myocardial ischemia through activation of Nrf2 signaling pathway[J]. China Journal of Chinese Materia Medica, 2017, 42(24): 4834-4840. |
| [8] |
罗胜勇, 栗原博, 乐智勇, 等. 冬虫夏草对氧化损伤小鼠抗氧化作用研究[J]. 食品研究与开发, 2019, 40(13): 63-67. LUO S Y, LI Y B, LE Z Y, et al. Study on the antioxidation effect of cordyceps sinensis for oxidative injury mice[J]. Food Research and Development, 2019, 40(13): 63-67. |
| [9] |
WANG L, CUI H T, LI Y T, et al. Kang-Xian Pills inhibit inflammatory response and decrease gut permeability to treat carbon tetrachloride-induced chronic hepatic injury through modulating gut microbiota[J]. Evidence-Based Complementary and Alternative Medicine, 2020, 2020(6): 1-14. |
| [10] |
CAO P, SUN J L, SULLIVAN M A, et al. Angelica sinensis polysaccharide protects against acetaminophen-induced acute liver injury and cell death by suppressing oxidative stress and hepatic apoptosis in vivo and in vitro[J]. International Journal of Biological Macromolecules, 2018, 111(7): 1133-1139. |
| [11] |
YUAN R S, TAO X, LIANG S, et al. Protective effect of acidic polysaccharide from Schisandra chinensis on acute ethanol-induced liver injury through reducing CYP2E1-dependent oxidative stress[J]. Biomedicine Pharmacotherapy, 2018, 99(13): 537-542. |
| [12] |
CUI H T, LIU Z, WANG L, et al. Icariin-treated human umbilical cord mesenchymal stem cells decrease chronic liver injury in mice[J]. Cytotechnology, 2017, 69(1): 19-29. DOI:10.1007/s10616-016-0034-7 |
| [13] |
JIN J, XIONG T Q, HOU X Y, et al. Role of Nrf2 activation and NF-κB inhibition in valproic acid induced hepatotoxicity and in diammonium glycyrrhizinate induced protection in mice[J]. Food and Chemical Toxicology, 2014, 73(8): 95-104. |
| [14] |
ZOU Y, XIONG J B, MA K, et al. Rac2 deficiency attenuates CCl4-induced liver injury through suppressing inflammation and oxidative stress[J]. Biomedicine Pharmacotherapy, 2017, 94(6): 140-149. |
| [15] |
ZHOU L L, ZHOU C, LIANG X W, et al. Self-protection against triptolide-induced toxicity in human hepatic cells via Nrf2-ARE-NQO1 pathway[J]. Chinese Journal of Integrative Medicine, 2017, 23(11): 929-936. |
| [16] |
MA J Q, LI Z, XIE W R, et al. Quercetin protects mouse liver against CCl4-induced inflammation by the TLR2/4 and MAPK/NF-κB pathway[J]. International Immunopharmacology, 2015, 28(6): 531-539. |
| [17] |
XIN Y, WEI J, CHUN H M, et al. Protective effects of Ginsenoside Rg1 against carbon tetrachloride-induced liver injury in mice through suppression of inflammation[J]. Phytomedicine, 2016, 23(6): 583-588. DOI:10.1016/j.phymed.2016.02.026 |
| [18] |
ZHANG B, LAI L, TAN Y J, et al. Hepatoprotective effect of total flavonoids of Mallotus apelta(Lour.) Muell.Arg. leaf against carbon tetrachloride-induced liver fibrosis in rats via modulation of TGF-β1/Smad and NF-κB signaling pathways[J]. Journal of Ethnopharmacology, 2020, 254(8): 112714. |
| [19] |
LU K H, WENG C Y, CHEN W C, et al. Ginseng essence, a medicinal and edible herbal formulation, ameliorates carbon tetrachloride-induced oxidative stress and liver injury in rats[J]. Journal of Ginseng Research, 2017, 41(4): 316-325. |
| [20] |
XU L, YU Y F, SANG R, et al. Protective Effects of Taraxasterol against ethanol-induced liver injury by regulating CYP2E1/Nrf2/HO-1 and NF-κB signaling pathways in mice[J]. Oxidative Medicine and Cellular Longevity, 2018, 2018(11): 8284107. |
| [21] |
CHEN Z Y, ZHAO Y M, SONG C L, et al. SanWeiGanJiang San relieves liver injury via Nrf2/Bach1[J]. Journal of Ethno-pharmacology, 2020, 251(8): 112445. |
| [22] |
LYU H, WANG H H, LI L, et al. Hepatocyte-specific deficiency of Nrf2 exacerbates carbon tetrachloride-induced liver fibrosis via aggravated hepatocyte injury and subsequent inflammatory and fibrogenic responses[J]. Free Radical Biology and Medicine, 2020, 150(9): 136-147. |
| [23] |
KIM J M, SU-HYUN S, YOUNG-EUN K, et al. HX-1171, a novel Nrf2 activator, induces NQO1 and HMOX1 expression[J]. Journal of Cellular Biochemistry, 2017, 118: 3372-3380. |
| [24] |
LI J, HU R, XU S F, et al. Xiaochaihutang attenuates liver fibrosis by activation of Nrf2 pathway in rats[J]. Biomedicine Pharmacotherapy, 2017, 96(8): 847-853. |
 2021, Vol. 40
2021, Vol. 40