文章信息
- 霍香香, 门伟婕, 杨莉, 张玥, 周昆
- HUO Xiangxiang, MEN Weijie, YANG Li, ZHANG Yue, ZHOU Kun
- 异补骨脂素在大鼠体内药代动力学的性别差异研究
- Study on gender differences in the pharmacokinetics of isopsoralen in rats
- 天津中医药大学学报, 2021, 40(4): 503-507
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(4): 503-507
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.04.20
-
文章历史
收稿日期: 2021-03-03
2. 天津市中药药理学重点实验室, 天津 301617
2. Tianjin Key Laboratory of Chinese Medicine Pharmacology, Tianjin 301617, China
异补骨脂素是呋喃香豆素类化合物,中国药典将其和补骨脂素作为补骨脂的质量控制成分[1]。异补骨脂素具有抗肿瘤、抗氧化、抗病毒和促进骨生成等多方面的药理作用[2-5];通过抑制NF-κB的活性减轻炎症反应并下调TGF-β1表达,缓解人正常肝细胞损伤,并改善非酒精性脂肪肝[6];能够增加人真皮成纤维(HDF)细胞TGF-β1、Smad3、COL1A1蛋白及mRNA表达,从而促进光老化HDF细胞胶原合成[7];异补骨脂素还可抑制肿瘤细胞增殖,并诱导细胞凋亡[8];还可通过上调表达雌激素ERα,显著减少脊髓损伤区域灰质前角运动神经元凋亡坏死面积,促进神经元细胞修复等[9];异补骨脂素可以促进骨形成,增加大鼠骨密度,改善骨组织微结构,有效提升骨生物力学性能[10]。有报道称,摄入异补骨脂素28 d可能会影响小鼠的新陈代谢和排泄[11]。前期已有异补骨脂素后药物在大鼠体内的代谢研究[12],发现异补骨脂素在大鼠体内代谢过程属于非线性药代动力学。但对异补骨脂素在不同性别大鼠血浆内的代谢过程是否存在差异尚不明确,为此,本实验进行了异补骨脂素单次灌胃给药后雌性和雄性大鼠体内的药代动力学比较研究。
1 材料与方法 1.1 实验材料 1.1.1 动物SPF级SD大鼠,体质量200~220 g,由北京维通利华实验动物技术有限公司提供。动物许可证号:SCXK(京)2016-0006。
1.1.2 药品与试剂异补骨脂素,批号:20150815,天津月牙湖生物科技有限公司;蛇床子素,批号:110822-201609,中国食品药品检定研究院;黄蓍树胶粉,北京Solarbio公司;甲醇、乙腈,赛默飞世尔科技(中国)有限公司。
1.1.3 仪器超高效液相色谱仪,美国Waters;低温高速离心机(LEAGENO MICRO 21 R),美国Thermo;离心浓缩仪,德国Eppendorf。
1.2 实验方法 1.2.1 色谱条件色谱具体条件如下:ACQUITY C18色谱柱(规格1.7 μm,2.1 mm×100 mm),流动相水(A)-乙腈(B),流速0.3 mL/min,进样体积10 μL,检测波长246 nm,洗脱梯度0~2 min,26%~34%B;2~4 min,34%~60%B;4~5 min,60%B;5~7 min,60%~26%B;7~9min,26%B。
1.2.2 分组、给药及样品采集按体质量随机将48只大鼠随机各分成4组,每组雌性和雄性各6只;分别单次灌胃给予7、14、28、56 mg/kg的异补骨脂素。在给药前和给药后的12个采血点,即0.25、0.5、0.75、1、1.5、2、4、6、12、16、24、36 h进行眼内眦穿刺取血,血液置于加有适当肝素钠溶液的1.5 mL离心管中,摇匀。以3 500 r/min离心10 min,分离血浆,储存于-20 ℃冰箱备用。
1.2.3 血浆样品的处理将血浆样品解冻,取100 μL于1.5 mL离心管中,加入10μL内标溶液(蛇床子素浓度50 μg/mL,涡旋30 s,加入900 μL甲醇,涡旋3 min,使蛋白质完全沉淀,8 000 rpm离心10 min,取上清液于新的1.5 mL离心管中,挥干溶剂,加入200 μL流动相复溶,12 000 rpm离心10 min,取上清液170 μL于液相小瓶中,进样。
1.2.4 对照品溶液的配制分别精密称取异补骨脂素和蛇床子素对照品1mg,加入甲醇,分别配成浓度为1mg/mL储备液,置于4℃冰箱中备用。
1.2.5 统计学处理用SPSS 19. 0统计软件进行分析,计量资料用均数±标准差(x±s)或均数±标准误(Mean±SEM)表示,组间比较采用独立样本t检验。采用DAS3. 0软件中的统计矩法计算药代动力学参数。
1.2.6 方法学考察 1.2.6.1 专属性取大鼠空白血浆,按“2.2血浆样品的处理”项下操作,得空白血浆色谱图;取大鼠空白血浆分别加入一定量的异补骨脂素和蛇床子素,按“2.2血浆样品的处理”项下操作,得血浆对照品色谱图;取给药后0.75 h大鼠血浆样本,按“2.2血浆样品的处理”项下操作,得血浆样品色谱图。
1.2.6.2 线性关系精密吸取适量浓度为1 mg/mL的异补骨脂素储备液,加入适量甲醇,稀释浓度为0.05、0.2、1、5、10和20 μg/mL一系列对照品溶液。分别吸取上述对照品溶液200 μL,挥干溶剂,加入100 μL空白血浆,按“2.2血浆样品的处理”项下操作,进样分析。以标准品峰面积与内标峰峰面积比值为纵坐标,标准品浓度为横坐标,作回归曲线,计算得线性回归方程。
1.2.6.3 日内精密度和日间精密度精密吸取大鼠空白血浆100 μL,加入标准品溶液,使异补骨脂素浓度分别为0.5、2、10 μg/mL,按“2.2血浆样品的处理”项下操作,将样品与内标峰面积的比值带入同一曲线中计算得到药物浓度。每个质量浓度重复进样3次测定日内精密度,连续进样3 d测定日间精密度。
1.2.6.4 回收率精密吸取大鼠空白血浆100 μL,加入标准品溶液,使异补骨脂素浓度分别为0.5、2、10 μg/mL,按“2.2血浆样品的处理”项下操作,每个质量浓度3个样品,测得相应峰面积为Aa;另精密吸取大鼠空白血浆100 μL,不加内标,按“2.2血浆样品的处理”项下,处理至挥干溶剂后,加入标准品溶液,使异补骨脂素浓度分别为0.5、2、10 μg/mL,加入内标溶液10 μL,每个质量浓度5个样品,测得相应峰面积为Ab;两次峰面积求比值,计算提取回收率。
1.2.6.5 稳定性精密吸取大鼠空白血浆100 μL,加入标准品溶液,使异补骨脂素浓度分别为0.5、2、10 μg/mL,按“2.2血浆样品的处理”项下操作。样品于-20 ℃冻存,复溶后24 h处理,3次冻融循环后处理,冻存10 d后处理,进样检测,评价样品稳定性。
2 结果 2.1 方法学验证 2.1.1 专属性空白血浆色谱图,血浆对照品色谱图,血浆样品色谱图,见图 1。异补骨脂素和蛇床子素的保留时间分别为2.8 min和5.5 min。

|
| 注:A.空白血浆;B.空白血浆加对照品;C.给药血浆样本(a.异补骨脂素;b.蛇床子素)。 图 1 大鼠血浆样品中异补骨脂素色谱图 |
以标准品浓度与内标浓度比值为横坐标(X),以标准品峰面积与内标峰峰面积比值为纵坐标(Y),绘制标准曲线,线性回归方程为
低、中、高3个浓度的日内精密度和日间精密度结果见表 1,RSD均小于5%。说明该方法的日内精密度和日间精密度均符合要求。
异补骨脂素低、中、高3个浓度的平均回收率分别为88.07%,70.42%和90.57%,均大于70%;RSD%分别为2.18%,4.28%和2.01%,回收率较高。
2.1.5 稳定性异补骨脂素在3次冻融循环后处理、样品复溶后上清液室温放置24 h后进行处理和样品于-20 ℃超低温冰箱中放置10 d后处理的状态下,低、中、高3个浓度的测定结果为0.51±0.02,2.08±0.08和10.62±0.6;RSD%分别为3.76%,3.48%和5.65%,均显示出较好的稳定性。
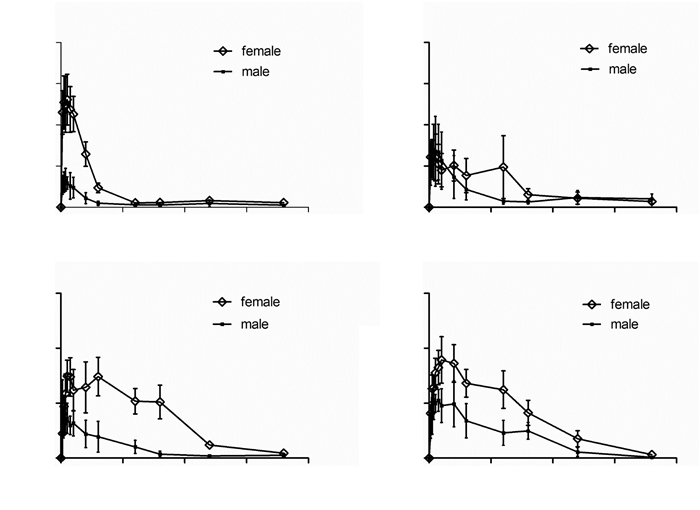
2.2 血药浓度-时间曲线给予大鼠单次灌胃4个不同浓度异补骨脂素后,雌性体内血药浓度明显高于雄性大鼠,尤其7、28和56 mg/kg剂量下,不同性别大鼠血药浓度曲线间距较大,见图 2。
|
| 注:A.灌胃给予7 mg/kg异补骨脂素后平均血浆浓度-时间曲线;B.灌胃给予14 mg/kg异补骨脂素后平均血浆浓度-时间曲线;C.灌胃给予28 mg/kg异补骨脂素后平均血浆浓度-时间曲线;D.灌胃给予56 mg/kg异补骨脂素后平均血浆浓度-时间曲线。 图 2 SD大鼠灌胃给予异补骨脂素后平均血浆浓度-时间曲线(n=6,Mean±SEM) |
结果显示,7 mg/kg和28 mg/kg剂量给药后,雌性大鼠的AUC0-t,AUC0-∞和Cmax显著高于雄性大鼠;而14 mg/kg和56 mg/kg剂量下,也是雌性大鼠高于雄性大鼠,但无显著统计学差异。雄性大鼠CLz/ F明显高于雌性大鼠,同样是7 mg/kg和28 mg/kg剂量时,雌雄之间有统计学差异。
3 讨论给予大鼠不同剂量的异补骨脂素后,Cmax与AUC都未与剂量呈比例关系,与前期研究[12]结果一致,在此实验研究计量范围内,给予异补骨脂素后药物在大鼠体内的过程属于非线性药代动力学。给予异补骨脂素剂量为7 mg/kg后,雌性大鼠的AUC0-t为(6 303.48±2 993.49)μg/(L·h),约是雄性大鼠的5.2倍,剂量为28 mg/kg雌性大鼠的AUC0-t为(5 2456.10±21 248.85)μg/(L·h),约是雄性大鼠的4倍,且7 mg/kg及28 mg/kg剂量组存在统计学差异(P < 0.01)。由于动物个体具有差异性,药代动力学参数差异较大,故14 mg/kg及56 mg/kg剂量组雌性AUC0-t与雄性相比无统计学差异,但雌性大鼠AUC0-t均值也较雄性大鼠增大,异补骨脂素给药剂量为14 mg/kg时,雌性大鼠的AUC0-t为(16 070.48±7 293.76)μg/(L·h),约是雄性大鼠的1.4倍,剂量为56 mg/kg,雌性大鼠的AUC0-t为(57 012.07±32 584.51)μg/(L·h),约是雄性大鼠的2倍。异补骨脂素在雌鼠体内的清除率小于雄鼠,在7 mg/kg及28 mg/kg剂量时具有统计学差异(P < 0.05,P < 0.01)。此外,在雌鼠体内的达峰时间Tmax较雄鼠有所延长,其中28 mg/kg剂量组具有统计学差异(P < 0.05)。以上结果表明,异补骨脂素在雌性大鼠体内达峰浓度高和药物暴露量高于雄性大鼠,且药物的清除速率较低。这种体内处理过程的差异,可能与不同性别动物之间体内P450、SULT等药物代谢酶水平差异、转运蛋白和调节受体的差异有关[13-17],但其具体机制尚待研究。但无论如何,当前研究提示,异补骨脂素在雌性大鼠体内可能更容易出现蓄积,雌性大鼠对异补骨脂素毒性的敏感性高于雄性大鼠,这也可以帮助解释前期研究发现的补骨脂、异补骨脂素对雌鼠的毒性强于雄鼠的现象。
药物在体内代谢的差异是广泛存在的常见现象,不少药物在不同性别人群的作用强度也有所差异,研究显示近半药物的毒性存在性别差异,而这却常常被人们忽视。目前的研究已经提示,异补骨脂素的毒性、代谢存在一定性别差异,因此,进一步系统研究异补骨脂素在不同性别的吸收、分布及代谢途径的差异和毒性的相关性是十分必要的。这可以为提高临床补骨脂使用的安全性提供基础研究数据。
| [1] |
中国药典委员会. 中华人民共和国药典, 二部[S]. 北京: 中国医药科技出版社, 2020, 187-188. Chinese Pharmacopeia Commission. Pharmacopoeia of the People's Republic of China, part 2[S]. Beijing: Chinese Medicine Scienceand Technology Press, 2020, 187-188. |
| [2] |
RAHMAN M A, KIM N H, YANG H, et al. Angelicin induces apoptosis through intrinsic caspase-dependent pathway in human SH-SY5Y neuroblastoma cells[J]. Molecularand Cellular Biochemistry, 2012, 369(1-2): 95-104. DOI:10.1007/s11010-012-1372-1 |
| [3] |
冯春燕, 陈胜, 胡艳红, 等. 异补骨脂素对氧化损伤的Hlec线粒体超微结构的影响[J]. 福建中医药, 2016, 47(3): 18-19. FENG C Y, CHEN S, HU Y H, et al. Effect of isotopic lipids on the superstructage of Hlec mitochondrials with oxidative damage[J]. Fujian Journal of Traditional Chinese Medicine, 2016, 47(3): 18-19. |
| [4] |
CHO H J, JEONG S G, PARK J E, et al. Antiviral activity of angelicin against gammaherpesviruses[J]. Antiviral Research, 2013, 100(1): 75-83. DOI:10.1016/j.antiviral.2013.07.009 |
| [5] |
王剑, 陈天宇, 王钢, 等. 异补骨脂素对去卵巢骨质疏松小鼠骨髓间充质干细胞作用机制研究[J]. 中国骨质疏松杂志, 2016, 22(8): 980-984. WANG J, CHENT Y, WANG G, et al. The effects of isopsoralen on bone marrow mesenchymal stem cells of mice with ovariectomized osteoporosis and the relevant mechanisms[J]. Chinese Journal of Osteoporosis, 2016, 22(8): 980-984. DOI:10.3969/j.issn.1006-7108.2016.08.009 |
| [6] |
周俪姗, 鄢素琪, 熊小丽, 等. 补骨脂素和异补骨脂素下调NF-κB活性改善LO2细胞脂代谢紊乱的机制研究[J]. 中国中药杂志, 2019, 44(10): 2118-2123. ZHOU L S, YAN S Q, XIONG X L, et al. Psoralen and isopsoralen improve lipid metabolism disorder via inhibition of NF-κB activation in LO2 cells[J]. China Journal of Chinese Materia Medica, 2019, 44(10): 2118-2123. |
| [7] |
顾婷, 徐占玲, 朴成玉, 等. 异补骨脂素对光老化HDF细胞ER/TGF-β1/Smads信号通路的调控效应研究[J]. 中药材, 2017, 40(7): 1683-1686. GU T, XU Z L, PU C Y, et al. Isopsoralen on regulating effect of HDF cells ER/TGF-β1/Smads signaling pathway of photoaging[J]. Journal of Chinese Medicinal Materials, 2017, 40(7): 1683-1686. |
| [8] |
袁小芬, 孙亚梅, 张之勇, 等. 异补骨脂素对Hl-60细胞增殖和凋亡影响及其机制探讨[J]. 中华肿瘤防治杂志, 2015, 22(21): 1675-1679. YANG X F, SUN Y M, ZHAN G Z Y, et al. Molecular mechanism of apoptosis of HL-60 cells induced by angelicin[J]. Chinese Journal of Cancer Prevention and Treatment, 2015, 22(21): 1675-1679. |
| [9] |
李孝明. 异补骨脂素通过雌激素Α受体对脊髓的神经保护作用机制研究[D]. 上海: 第二军医大学, 2017. LI X M. Esteogen-like neuroprotection of ispsoralen against spinal cord injury through estrogen receptor ERα[D]. Shanghai: Second Military Medical University, 2017. |
| [10] |
刘锐, 杨小杰, 李鑫, 等. 异补骨脂素对去卵巢大鼠骨代谢的影响研究[J]. 中国骨质疏松杂志, 2017, 23(6): 807-811. LIU R, YANG X J, L IX, et al. Effects of isopsoralen on bone metabolism in ovariectomized rats[J]. Chinese Journal of Osteoporosis, 2017, 23(6): 807-811. |
| [11] |
WANG X, ZHANG A, HAN Y, et al. Urine metabolomics analysis for biomarker discovery and detection of jaundice syndrome in patients with liver disease[J]. Molecular& Cellular Proteomics, 2012, 11(8): 370-380. |
| [12] |
张盼阳, 王琴, 袁晓美, 等. 异补骨脂素单次给药在大鼠体内的药代动力学研究[J]. 中国临床药理学杂志, 2018, 34(14): 1689-1692. ZHANG P Y, WANG Q, YUANX M, et al. Study of isopsoralin on pharmacokinetics in a single dose in rats[J]. The Chinese Journal of Clinical Pharmacology, 2018, 34(14): 1689-1692. |
| [13] |
FRANCONI F, BRUNELLESCHI S, STAERDO L, et al. Gender differences in drug responses[J]. Pharmacological Research, 2007, 55(2): 81-95. |
| [14] |
WAXMAN D J, HOLLOWAY M G. Sex differences in the expression of hepatic drug metabolizing enzymes[J]. Molecular Pharmacology, 2009, 76(2): 215-228. |
| [15] |
ZANGER U M, SCHWAB M. Cytochrome P450 enzymes in drug metabolism: regulation of gene expression, enzyme activities, and impact of genetic variation[J]. Pharmacology & Therapeutics, 2013, 138(1): 103-141. |
| [16] |
LU Y F, JIN T, XU Y, et al. Sex differences in the circadian variation of cytochrome P450 genes and corresponding nuclear receptors in mouse liver[J]. Chronobiology International, 2013, 30(9): 1135-1143. |
| [17] |
KLAASSEN C D, LIU L, DUNN R N. Regulation of Sulfotransferase mRNA expression in male and female rats of various ages[J]. Chemico-Biological Interactions, 1998, 109(1-3): 299-313. |
 2021, Vol. 40
2021, Vol. 40