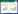文章信息
- 苏敏, 江瑜, 范兰兰, 汪小莉, 洪燕, 吴德玲, 韩燕全
- SU Min, JIANG Yu, FAN Lanlan, WANG Xiaoli, HONG Yan, WU Deling, HAN Yanquan
- 炮制与配伍对干姜-五味子药对11种成分含量和指纹图谱的影响
- Effects of processing and compatibility on the content of 11 components and fingerprints of dried ginger-schisandra
- 天津中医药大学学报, 2021, 40(4): 517-523
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(4): 517-523
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.04.22
-
文章历史
收稿日期: 2021-04-10
2. 安徽中医药大学, 合肥 230031
2. Anhui University of Chinese Medicine, Hefei 230031, China
干姜为姜科植物姜(Zingiber officinale Rosc.)的干燥根茎,五味子为木兰科植物五味子[Schisandra chinensis(Turcz.)Baill.]的干燥成熟果实,两者临床常配伍使用。《伤寒论》和《金匮要略》中也有多个方剂均使用两者配伍,如苓甘五味姜辛汤、小青龙汤等。干姜-五味子药对始载于《施今墨对药》,方中取干姜辛散温通,逐寒邪而发表温经,燥脾湿而止呕消痰之功;五味子酸涩收敛,善敛肺气而滋肾水,两药合用,一散一收,一开一阖,互制其短,而展其长,利肺气,平喘咳,化痰饮,治咳嗽效果甚妙,主治肺寒咳喘等病症[1]。经典方剂中干姜和炮姜均可与五味子配伍使用,不同炮制品配伍的药对其功效亦有不同,课题组前期的研究表明干姜炮制前后成分及药效作用有明显差异,炮制引起的成分改变可能是临床功效差异的主要原因之一[2-3]。
目前对干姜炮制前后[4-8],五味子的[9-12]化学成分及药理作用均已有较深入的研究。课题组前期对干姜、五味子配伍后姜的化学成分进行了初步研究[13-14],发现不同复方中的姜在含量上存在差别。但是炮制-配伍对干姜-五味子药对的协同影响研究,作者目前尚未见报道。本论文选择不同批号的干姜,按照均一工艺炮制成炮姜,分别与五味子配伍成药对,采用UPLC法比较干姜炮制前后对干姜-五味子药对11种指标性成分含量及指纹图谱的变化,以期能明确炮制-配伍对该药对成分变化的影响,为其临床应用和炮制品选择提供依据。
1 仪器与试药 1.1 仪器WatersAcquity H-Class超高液相色谱仪,主要元件包括二极管阵列检测器、四元梯度泵自动进样器、柱温箱和Empower 2色谱工作站(美国Waters公司);BP211D电子天平(德国Sartorius公司);KQ3200D超声波清洗仪(昆山市超声仪器有限公司)。
1.2 试药对照品6-姜酚(MUST-13012303)、8-姜酚(MUST-13070101)、10-姜酚(MUST-13091608)、姜酮(DST170323-032)、6-姜烯酚(MUST-12121803)、8-姜烯酚(DST191204-031)、10-姜烯酚(DST190911-044)、五味子甲素(DST161117-008)、五味子乙素(DST161115-009)、五味子醇甲(110857-201010)、五味子醇乙(DW0013)均购买于成都德思特生物科技有限公司;乙腈、色谱甲醇购买于SIGMA公司;磷酸、甲醇等试剂均为分析纯;蒸馏水购自于屈臣氏;0.22 μm聚醚砜水系针孔滤膜购于天津市津腾实验设备有限公司。五味子、干姜产地与批号信息见表 1,经安徽中医药大学第一附属医院韩燕全主任药师鉴定为五味子和干姜,符合2020版《中国药典》(一部)项下的性状特征。
根据课题组前期对炮姜炮制工艺的优化[15],采用砂烫法制得炮姜。取10批干姜各10 g备用。武火将洁净河砂炒至滑利状态时,放入备用干姜炒至终点颜色,去砂晾凉备用,10批不同批号的干姜均按上述方法制备为炮姜。
2.2 色谱条件Waters Acquity BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);柱温:30 ℃;流动相乙腈(A)-0.1%磷酸水溶液(B),进行梯度洗脱;0~3 min,3.0%~20.0%A;3~4 min,20.0%~35.0%A;4~5 min,35.0%~40.0% A;5~6 min,40.0%~46.0% A;6~7 min,46.0%~55.0% A;7~8 min,55.0%~60.0% A;8~13 min,60.0%~60.0% A;13~18 min,60.0%~90.0% A;23 min,3.0% A;25 min,3.0% A;检测波长:280 nm;流速:0.2 mL/min;进样量1 μL。
2.3 对照品溶液的制备精密称取对照品6-姜酚、8-姜酚、10-姜酚、姜酮、6-姜烯酚、8-姜烯酚、10-姜烯酚、五味子甲素、五味子乙素、五味子醇甲、五味子醇乙分别加甲醇配制成对照品母液冷藏备用;使用前吸取一定量对照品母液加甲醇稀释为1 mL分别含6-姜酚0.035 7 mg、8-姜酚0.007 125 mg、10-姜酚0.0301mg、姜酮0.003 31 mg、6-姜烯酚0.021 mg、8-姜烯酚0.005 112 mg、10-姜烯酚0.005 352 mg、五味子甲素0.110 5 mg、五味子乙素0.015 16 mg、五味子醇甲0.006 03 mg、五味子醇乙0.014 36 mg的混合对照品溶液。
2.4 供试品溶液的制备分别取各批次干姜、炮姜饮片以及五味子适量,粉碎过筛,取过筛粉末0.25 g,精密称定后置具塞锥形瓶,加入20 mL甲醇,加热超声(150 W,40 Hz)40 min,放冷、称质量,加入甲醇补重,摇匀、静置,测定前12 000 r/min离心10 min,吸取上清过0.22 μm滤膜供UPLC分析。
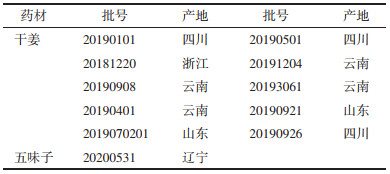
2.5 方法学考察 2.5.1 线性关系考察分别精密吸取混合对照品溶液0.5、1、2、3、4、5 μL按“2.2”项方法依次进样检测,测定峰面积。分别以6-姜酚、8-姜酚、10-姜酚、姜酮、6-姜烯酚、8-姜烯酚、10-姜烯酚、五味子甲素、五味子乙素、五味子醇甲、五味子醇乙的浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归,绘制标准曲线,计算回归方程。结果表明11种成分线性关系良好。见表 2。
精密吸取混合对照品溶液2 μL,按“2.2”项方法重复进样6次,测定各成分峰面积。结果6-姜酚、8-姜酚、10-姜酚、姜酮、6-姜烯酚、8-姜烯酚、10-姜烯酚、五味子甲素、五味子乙素、五味子醇甲、五味子醇乙的RSD分别为0.45%、0.34%、0.46%、0.47%、0.18%、1.04%、0.27%、0.05%、0.22%、0.28%、0.18%,表明仪器的精密度良好。
2.5.3 稳定性实验精密吸取3号炮姜-五味子药对样品溶液1 μL,按“2.2”项方法分别在0、4、8、12、16、24 h定时进样,记录峰面积,计算RSD值,结果6-姜酚、8-姜酚、10-姜酚、姜酮、6-姜烯酚、8-姜烯酚、10-姜烯酚、五味子甲素、五味子乙素、五味子醇甲、五味子醇乙峰面积的RSD分别为0.34%、2.75%、0.81%、1.81%、0.32%、2.31%、1.63%、1.81%、0.27%、0.82%、0.55%,表明供试品溶液至少在24 h内稳定性良好。
2.5.4 重复性实验取4号炮姜-五味子药对样品一定量,共6份,按“2.4”项方法制备供试品溶液,精密吸取1μL,按“2.2”项色谱条件进样,记录峰面积,计算RSD值,结果6-姜酚、8-姜酚、10-姜酚、姜酮、6-姜烯酚、8-姜烯酚、10-姜烯酚、五味子甲素、五味子乙素、五味子醇甲、五味子醇乙峰面积的RSD分别为0.15%、0.54%、0.40%、2.32%、0.33%、2.00%、1.40%、1.46%、0.29%、0.91%、0.31%结果表明供试品溶液的稳定性良好。
2.5.5 加样回收率实验根据“2.1”和“2.4”项下的方法制备样品及供试品溶液,取6号炮姜-五味子药对样品溶液6份,每份吸取0.5 mL,分别精密加入与样品中成分含量接近的对照品,均匀混合,0.22 μm微孔滤膜过滤,按“2.2”项条件进样,进样量1 μL,计算回收率。结果6-姜酚、8-姜酚、10-姜酚、姜酮、6-姜烯酚、8-姜烯酚、10-姜烯酚、五味子甲素、五味子乙素、五味子醇甲、五味子醇乙的平均回收率分别为101.4%、98.49%、98.91%、99.12%、97.88%、100.67%、98.21%、97.95%、97.55%、98.63%和99.65%,RSD分别为2.15%、2.24%、2.33%、2.56%、1.75%、2.10%、3.46%、2.52%、1.26%、1.48%和2.43%。表明方法加样回收率结果良好。
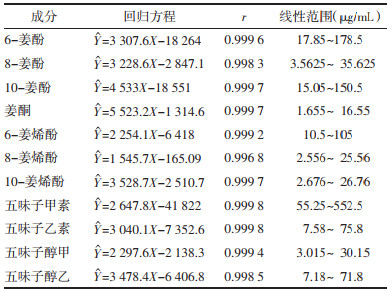
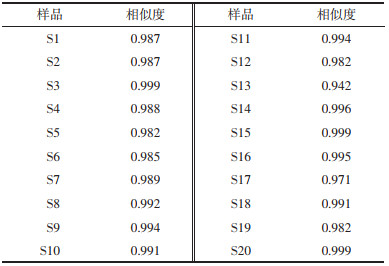
2.6 含量测定分别精密吸取供试品溶液1 μL,按“2.2”方法进样,如图 1所示,11种指标性成分与其他成分分离度较好,计算各成分的含量结果见表 3。并由表 4可知干姜炮制前后制得的干姜-五味子药对与炮姜-五味子药对中指标性成分含量存在明显差异,主要表现为炮制以后姜酮、6-姜烯酚、10-姜烯酚、五味子甲素、五味子醇乙的含量分别上升了201.53%、77.70%、110.56%、0.17%、2.57%,而在炮姜-五味子药对中6-姜酚、8-姜酚、10-姜酚以及五味子乙素、五味子醇甲分别下降了24.79%、18.10%、17.08%、1.2%和0.17%,并且在炮制后的炮姜-五味子药对中检出了指标性成分8-姜烯酚,可知干姜炮制前后对干姜-五味子药对指标性成分含量有明显的影响。
|
| 注:S1干姜-五味子药对;S2炮姜-五味子药对;S3干姜单味;S4炮姜单味;S5五味子单味;S6混合对照品溶液(1.姜酮;2.6-姜酚;3.五味子醇甲;4.五味子醇乙;5.8-姜酚;6.6-姜烯酚;7.10-姜酚;8.五味子甲素;9.8-姜烯酚;10.五味子乙素;11.10-姜烯酚)。 图 1 对照品与样品UPLC指纹图谱 |
样品制备、对照品溶液制备、供试品溶液制备的制备方法同“2.1”“2.3”“2.4”项。
3.2 数据分析本实验采用中药色谱指纹图谱相似度评价系统和中药色谱指纹图谱相似度评价系统2012(A版)生成共有模式的指纹图谱以及完成相似度评价。应用化学计量学中经典的模式识别方法评价UPLC指纹图谱的效能,包括聚类分析(CA)、无监督模式识别方法主成分分析(PCA)和偏最小二乘判别分析(PLS-DA),本实验所有数据分析均使用SIMCA软件完成。
3.3 方法学考察 3.3.1 精密度实验精密吸取制备的样品溶液1 μL,按“2.2”项下的条件重复进样6次,考察色谱峰的峰面积和保留时间的一致性。结果表明各成分色谱峰峰面积和保留时间基本一致,在同一台仪器测定的指纹图谱与其共有模式的图谱的相似性大于0.999(中位数),符合指纹图谱要求,表明仪器的精密度较好。
3.3.2 稳定性实验精密吸取干姜-五味子样品溶液1 μL,按“2.2”项方法分别在0、4、8、12、16、24 h定时进样。以选定的色谱峰为观测指标,考察色谱峰保留时间的一致性,各指标性成分色谱峰的保留时间和峰面积基本一致,在同一台仪器测定的指纹图谱与其共有模式的图谱的相似性大于0.999(中位数),结果表明供试品溶液至少在24 h内稳定性良好。
3.3.3 重复性实验取6份炮姜、五味子药材,按“2.4”项的方法制备供试品溶液,并按照“2.2”项的色谱条件进样,使用“中药色谱指纹图谱相似度评价软件2012(A版)”考察所得指纹图谱色谱峰的保留时间的一致性,计算其相似度,结果表明6份样品的相似度均大于0.999(中位数),该结果符合指纹图谱的要求。
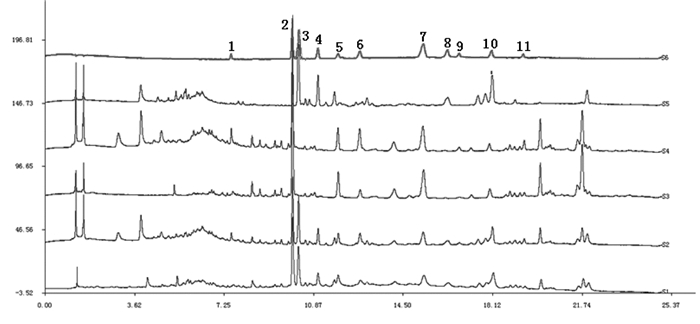
3.4 干姜-五味子药对指纹图谱中的共有峰取干姜-五味子药对、炮姜-五味子药对各10批,按“2.2”项条件依次进样,根据检测出的指纹图谱,将指纹图谱导入“中药色谱指纹图谱相似度评价软件2012版”,生成干姜-五味子药对共有模式的指纹图谱(图 2),结果表明共有色谱峰26个,指认了其中的11个色谱峰。
|
| 注:4.姜酮;10.6-姜酚;11.五味子醇甲;12.五味子醇乙;14.8-姜酚;15.6-姜烯酚;17.10-姜酚;18.五味子甲素;19.8-姜烯酚;21.五味子乙素;22.10-姜烯酚。 图 2 干姜-五味子药对指纹图谱(S1)和混合对照品图谱(S2) |
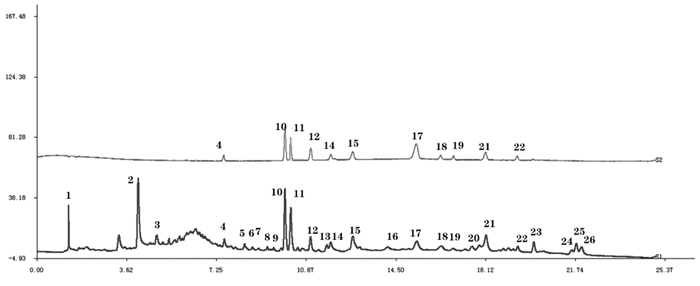
将所得到的干姜-五味子药对与炮姜-五味子药对的10批样品UPLC图谱依次导入“中药色谱指纹图谱相似度评价软件2012(A版)”,得到指纹图谱叠加图(图 3)以及指纹图谱相似度评价表(表 4)。
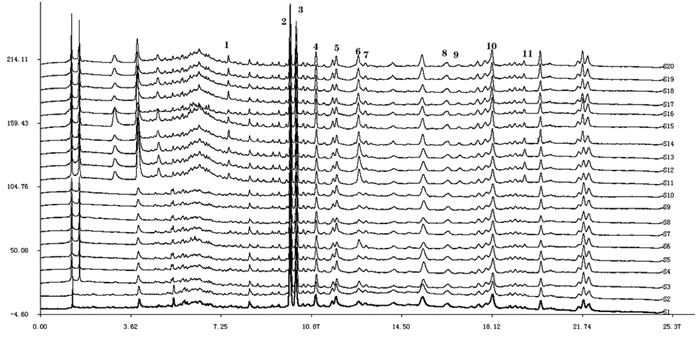
|
| 注:1.姜酮;2.6-姜酚;3.五味子醇甲;4.五味子醇乙;5.8-姜酚;6.6-姜烯酚;7.10-姜酚;8.五味子甲素;9.8-姜烯酚;10.五味子乙素;11.10- 姜烯酚。 图 3 干姜-五味子药对(S1-S10)和炮姜-五味子药对(S11- S20)指纹图谱叠加图 |
以26个共有峰的峰面积为变量,利用SIMCA软件对干姜-五味子药对与炮姜五味子药对的各10批样品进行聚类分析,结果如图 4所示,可以看出干姜-五味子药对与炮姜五味子药对可以被很好地分开,各自聚为一类。
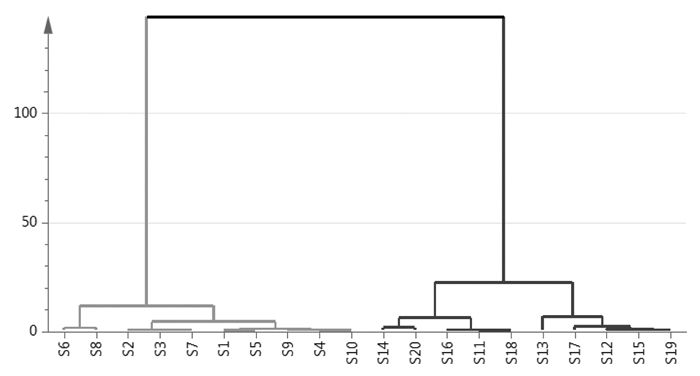
|
| 注:S1-S10代表干姜-五味子药对;S11-S20代表炮姜-五味子药对。 图 4 20批干姜-五味子药对聚类分析结果 |
运用SIMCA软件对干姜-五味子药对与炮姜-五味子药对的各10批样品的26个共有峰的峰面积为数据源进行主成分分析,由图 5可知,S1-S10距离相近,S11-S20距离相近,图中20个样品清晰的被分为两类,结果与样品的聚类分析具有一致性。
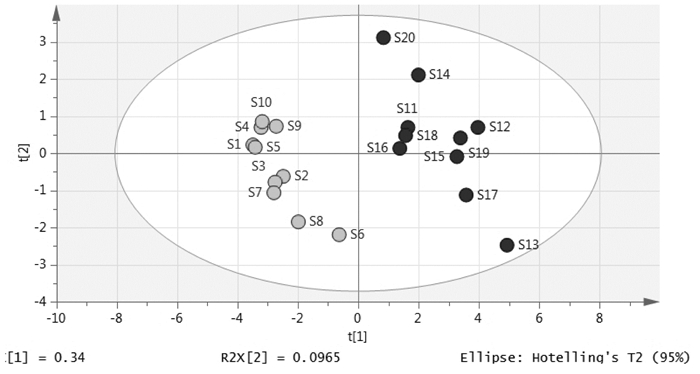
|
| 图 5 20批干姜-五味子药对主成分分析图 |
通过PLS-DA分析各色谱峰的VIP得分图(图 6)表明,色谱峰变量对样品分类的影响大小排序为19 > 3 > 4 > 22 > 2 > 1 > 13 > 15 > 10 > 20 > 5 > 26 > 17 > 14 > 12 > 25 > 23 > 16 > 8 > 6 > 24 > 18 > 21 > 11 > 7 > 9,其中VIP大于1的色谱峰有10个,分别为19、3、4、22、2、1、13、15、10、20,其中19(8-姜烯酚)、4(姜酮)、15(6-姜烯酚)、10(6-姜酚)、22(10-姜烯酚)为指标性成分峰,这些指标性成分的VIP得分图进一步说明了炮制-配伍对干姜-五味子药对的质量有一定的影响。并且VIP值大于1的这6个峰可能是干姜-五味子药对的潜在质量标志物,有待于课题组后期对其进行更深入的研究。
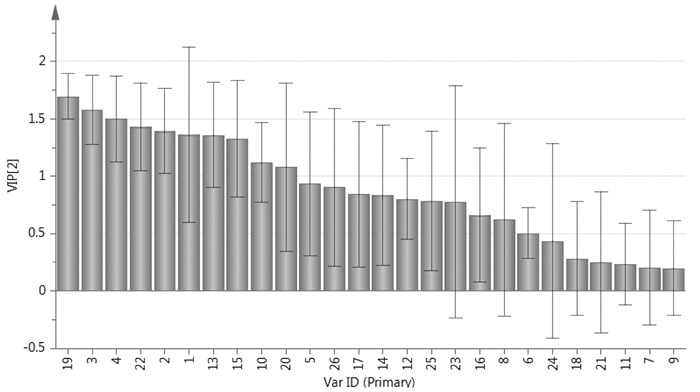
|
| 图 6 各色谱峰变量投影重要性分析得分图 |
炮制与配伍是中医临床用药的两大特色。中药材经过加工炮制成为中药饮片后方可入药,而复方是临床用药的主要形式,因此在中药复方中研究中药炮制更为符合临床实际[16-17]。实验比较了传统水煎煮与甲醇加热超声两种样品提取方法,结果表明甲醇加热超声提取的有效成分溶出率优于传统水煎煮,能较好的反映出炮制差异;且加热超声提取法操作较简便、稳定、易于重复实验。综合考虑,本实验采用甲醇加热超声法提取样品。实验中分别比较Waters Acquity UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm)、Waters Acquity UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm)两种色谱柱和柱温、流速等实验因素,经优化得到本实验的色谱条件。同时考察了240、254、280 nm三个波长,以及甲醇-水、乙腈-水、甲醇-0.1%磷酸水、乙腈-0.1%磷酸水四种流动相体系的梯度洗脱条件,结果表明在280 nm、乙腈-0.1%磷酸水作为流动相系统时,检测的图谱信息量较多、峰形较好,且各色谱峰的分离度较好、基线较平稳,有利于特征指纹的分析。
实验采用UPLC法测定炮制前后干姜-五味子药对和炮姜-五味子药对的指标性成分,发现药对之间含量差异较大,指纹图谱相似度较高,具有较好的相似性;并且指纹图谱共匹配出26个共有峰,共有峰的相对保留时间相似度高,符合程度好。聚类分析及主成分分析可以将20批样品成功的聚为两类,表明炮制前后的药对具有明显的差异性,更进一步验证了炮制-配伍会对干姜-五味子药对产生影响;VIP值大于1的10个色谱峰中有6个峰为指标性成分,这6个色谱峰可能就是潜在的质量标志物。本实验通过建立快速、稳定、重复性好的实验方法,对干姜-五味子药对的指标性成分进行含量测定,初步明确炮制-配伍对药对的指标性成分含量产生了影响,但是这些变化对药效学和临床应用的影响还是未知的需要进一步深入研究。
| [1] |
吕景山. 施今墨对药[M]. 人民军医出版社, 2010: 134-135. LYU J S. SHI Jinmo Duiyao[M]. The People's Military Medical Publishing House, 2010: 134-135. |
| [2] |
冉姗, 孙方方, 宋燕, 等. 姜不同炮制品对苓甘五味姜辛汤4种成分含量的影响[J]. 安徽中医药大学学报, 2017, 36(6): 93-96. RAN S, SUN F F, SONG Y, et al. Effect of different types of processed ginger on the content of four constituents in Ling gan Wuwei Jiangxin Decoction[J]. Journal of Anhui University of Chinese Medicine, 2017, 36(6): 93-96. |
| [3] |
HAN Y, LI Y, WANG Y, et al. Comparison of fresh, dried and stir-frying gingers in decoction with blood stasis syndrome in rats based on a GC-TOF/MS metabolomics approach[J]. Journal of Pharmaceutical and Biomedical Analysis, 2016, 129(6): 339-349. |
| [4] |
陈琛, 耿剑亮, 匡海学, 等. UHPLC-Oribtrap/HRMS技术分析干姜中非挥发性化学成分在炮制前后的变化[J]. 南京中医药大学学报, 2020, 36(3): 387-395. CHEN C, GENG J L, KUANG H X, et al. Study on variation of non-volatile compounds of raw ginger after processing by UHPLC-Orbitrap/HRMS[J]. Journal of Nanjing University of Traditional Chinese Medicine, 2020, 36(3): 387-395. |
| [5] |
龙全江, 金欣, 李文涛. 不同加工法干姜片制炮姜、姜炭中挥发油成分GC-MS分析[J]. 现代中药研究与实践, 2017, 31(5): 34-36. LONG Q J, JIN X, LI W T. GC-MS analysis on the essential oil from roasted ginger and ginger gharcoal processed by Zingiberis Rhizoma with different processing methods[J]. Research and Practiceon Chinese Medicines, 2017, 31(5): 34-36. |
| [6] |
龙全江, 徐雪琴. 干姜化学成分、药理作用及加工炮制研究文献分析[J]. 现代中药研究与实践, 2015, 29(1): 82-83. LONG Q J, XU X Q. Analysis of literature on chemical constituents, pharmacological effects and processing of dried ginger[J]. Research and Practiceon Chinese Medicines, 2015, 29(1): 82-83. |
| [7] |
韩燕全, 洪燕, 姜蕾, 等. 姜的炮制、质控和药理研究进展[J]. 中国现代中药, 2011, 13(4): 48-51. HAN Y Q, HONG Y, JIANG L, et al. Research Progress on processing, quality control and pharmacology of ginger[J]. Modern Chinese Medicine, 2011, 13(4): 48-51. |
| [8] |
韩燕全, 夏伦祝, 洪燕, 等. 干姜和炮姜的质量比较及提高研究[J]. 中国民族民间医药, 2011, 20(4): 30-31, 33. HAN Y Q, XIA L Z, HONG Y, et al. Compare and improve the quality control standards of the Rhizoma zingiber and Processing Rhizoma zingiber[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2011, 20(4): 30-31, 33. |
| [9] |
向会, 蔡晓霞, 周巍. HPLC法同时测定不同产地五味子生品及醋炙品中5个主要活性成分的含量[J]. 中国药师, 2020, 23(1): 186-188, 192. XIANG H, CAI X X, ZHOU W. Simultaneous determination of Five Main active constituents in Schisandrae Chinensis fructus from different habitats before and after vinegar processing[J]. China Pharmacist, 2020, 23(1): 186-188, 192. |
| [10] |
刘杰, 徐剑, 郭江涛. 五味子活性成分及药理作用研究进展[J]. 中国实验方剂学杂志, 2019, 25(11): 206-215. LIU J, XU J, GUO J T. Review of active constituents and pharmacological activities of Schisandrae Chinensis Fructus[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(11): 206-215. |
| [11] |
黄妍, 刘秀, 陶薇, 等. 五味子化学成分及抗2型糖尿病活性研究进展[J]. 中草药, 2019, 50(7): 1739-1744. HUANG Y, LIU X, TAO W, et al. Advances in chemical constituents of Schisandra chinensis and activities of anti-type 2 diabetes[J]. Chinese Traditional and Herbal Drugs, 2019, 50(7): 1739-1744. |
| [12] |
翟欣然, 曲佳萌, 许华容, 等. UHPLC-DAD法同时测定五味子标准汤剂中4种木脂素类成分的含量[J]. 沈阳药科大学学报, 2019, 36(10): 882-886. ZHAI X R, QU J M, XU H R, et al. Simultaneous quantitative determination of four lignans in Schisandrae Chinensis Fructus standard decoction by UHPLC-DAD[J]. Journal of Shenyang Pharmaceutical University, 2019, 36(10): 882-886. |
| [13] |
孙方方. 姜炮制-配伍对苓甘五味姜辛汤化学成分和药效的影响研究[D]. 合肥: 安徽中医药大学, 2019. SUN F F. Effects of processing-compatibility of ginger on chemical constituents and efficacy of Ling gan Wuwei Jiangxin Decoction[D]. Hefei: Anhui University of Chinese Medicine, 2019. |
| [14] |
冉姗. 基于GC-MS代谢组学的姜炮制-配伍机理研究[D]. 合肥: 安徽中医药大学, 2019. RAN S. Study on the mechanism of ginger processing and compatibility based on GC-MS metaolomics[D]. Hefei: Anhui University of Chinese Medicine, 2019. |
| [15] |
韩燕全, 洪燕, 桂洁, 等. 不同产地生、干、炮姜的UPLC指纹图谱比较研究[J]. 中成药, 2013, 35(2): 356-359. HAN Y Q, HONG Y, GUI J, et al. UPLC fingerprint comparison among fresh, dried and processed ginger from different habitats[J]. Chinese Traditional Patent Medicine, 2013, 35(2): 356-359. |
| [16] |
王瑞敏. 中药饮片炮制技术的专利现状分析与发展策略研究[D]. 广州: 广州中医药大学; 2017. WANG R M. The study on patent protection and countermeasures of processing technology of Chinese Herbal pieces[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2017. |
| [17] |
潘新. 二神丸中药物炮制后增强"温肾暖脾·涩肠止泻"作用机理研究[D]. 成都: 成都中医药大学, 2015. PAN X. The mechanism research on processed ESW enhance the ESW of "warming the kidney and spleen, relieving diarrhea with astringents"[D]. Chengdu: Chengdu University of Traditional Chinese Medicine, 2015. |
 2021, Vol. 40
2021, Vol. 40