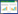文章信息
- 李承浩, 郑富香, 游广娇, 任晓亮, 邓雁如
- LI Chenghao, ZHENG Fuxiang, YOU Guangjiao, REN Xiaoliang, DENG Yanru
- 17种中药多糖提取物的理化性质研究
- Study on physicochemical properties of 17 polysaccharide extracts from traditional Chinese medicine
- 天津中医药大学学报, 2021, 40(5): 621-627
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(5): 621-627
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.05.19
-
文章历史
收稿日期: 2021-05-06
多糖又称多聚糖,是由糖苷键连接起来的醛糖或酮糖组成的高聚物,分子量为数万至数百万,用通式(C6H10O5)n表示[1-3]。多糖不仅在生物体生命活动中起着重要的营养作用,而且还在维持生物体的生命活动中发挥着重要生理功能,因此其与脂质、蛋白质、核酸一起被视为生物体中最重要的4种大分子物质[4-6]。
多糖是一种很好的佐剂,不仅可以作为一种能量物质和结构成分,还有一部分多糖可以参与细胞的代谢及生理调节。近年来,关于活性多糖生物功能的报道主要包括多糖的抗肿瘤、抗凝血、抗氧化、降血脂、抗病毒、提高免疫功能等,如牛膝多糖为水溶性的小分子多糖,具有调节免疫、保护肝脏、抑制肿瘤作用;如桑黄多糖具有抗肿瘤、调节免疫、治疗肝炎、抗炎、抗氧化、降血糖等生理活性。除了作为药物用于治疗,中药多糖在皮肤领域也具有延缓衰老、美白、晒后修复、祛痘抗炎、促进创伤愈合等功效,可以作为功效化妆品活性成分的天然来源,还可以作为凝固剂、润滑剂、增稠剂、絮凝剂、悬浮剂、凝胶剂、添加剂等广泛应用于化工、食品、石油、纺织印染、水处理和医药等行业。
中药多糖主要来源于植物、藻类和微生物类。其中植物类多糖种类最为繁多,且没有细胞毒性,应用于生物体毒副作用小,所以在医药和保健品行业得到了更好的推广及应用[7-8]。本文选用17种市面常售多糖研究其多糖含量与蛋白质含量、吸湿性、黏度、抗氧化活性,希望总结出多糖的共性,为以后的多糖应用提供依据[9-10]。
1 材料 1.1 药品与试剂黄芪多糖,批号:SJH17102201,购自西安四季生物科技有限公司;虫草多糖,批号:CC20170625,购自兰州百禾生物科技有限公司;大枣多糖,购自西安通泽生物科技有限公司;枸杞多糖,批号:20170725,购自西安通泽生物科技有限公司;白桦茸多糖,批号:TZ170810,购自西安通泽生物科技有限公司;灰树花多糖,批号:2017091204,购自西安万方生物科技有限公司;白术多糖,批号:BZ20170715,购自兰州百禾生物科技有限公司;刺五加多糖,批号:GN170606-SG,购自宁波金艾农生物科技有限公司;土茯苓多糖,购自陕西森弗天然制品有限公司;甘草多糖,批号:GCDT170714,购自陕西森弗天然制品有限公司;黄精多糖,购自西安美川生物科技有限公司;桑黄多糖,购自西安万方生物科技有限公司;党参多糖,购自西安维珍生物科技有限公司;猪苓多糖,批号:Virgin170301,购自西安维珍生物科技有限公司;海带多糖,批号:CY170901,购自陕西慈源生物技术有限公司;蒲公英多糖,批号:CY170807,购自陕西慈源生物技术有限公司;牛膝多糖,批号:QZ17-7-26,购自西安青芷生物技术有限公司;苯酚,分析纯,购自西陇科学股份有限公司;浓硫酸,分析纯,购自开封开化有限公司试剂厂;无水葡萄糖,批号:160824,纯度≥98%,购自上海融禾医药科技发展有限公司;蒸馏水,购自屈臣氏食品饮料有限公司;考马斯亮蓝G-250试剂,购自北京索莱宝科技有限公司;维生素C,批号:171204,纯度≥98%,购自上海融禾医药科技发展有限公司;FeCl3·6H2O,分析纯,购自上海麦克林生化科技有限公司;FeSO4·7H2O,分析纯,购自天津市风船化学试剂科技有限公司。
1.2 仪器与设备旋转黏度计(NDJ-79,上海平轩科学仪器有限公司);台式高速离心机(TG16-WS,长沙湘仪离心机仪器有限公司);十万分之一天平(Sartorius BT125D,赛多利斯科学仪器有限公司);pH计(PB-10,赛多利斯科学仪器有限公司);万分之一天平(FA2004A,上海精天电子仪器有限公司);电热鼓风干燥(WC-20,天津市中药机械厂);温湿计时表(WS-A6,上海天宇科技仪表有限公司);智能磁力加热搅拌器(SZCL-4B,巩义市予华仪器有限公司);紫外可见分光光度计(TU-1901,北京普析通用仪器有限责任公司);数显恒温水浴锅(HH-S8,金坛盛蓝仪器制造有限公司)。
2 方法 2.1 中药多糖的含量测定 2.1.1 标准曲线建立精密称定105 ℃干燥至恒质量的无水葡萄糖标准品2.00 mg于10 mL棕色容量瓶内,加蒸馏水稀释至刻度,得到0.2 mg/mL的葡萄糖标准品溶液。分别精密量取葡萄糖标准品溶液0.05、0.1、0.2、0.3、0.5、1.2、1.5 mL于10 mL具塞试管中,补水至2.0 mL,加入1 mL 5 %苯酚溶液后迅速加入浓硫酸5 mL,摇匀,室温放置5 min,置沸水浴中加热15 min,取出冰水浴5 min,冷却至室温,于490 nm波长处测定吸光度,以空白试剂为参照测定吸光度。
以对照品浓度X(mg/mL)为横坐标,吸光度Y(ΔAbs)为纵坐标绘制标准曲线。得到标准曲线回归方程为Y=12.421X+0.206 1(r=0.999 5),表明葡萄糖标准品在0.005~0.15 mg/mL线性关系良好。
2.1.2 精密度实验精密称取葡萄糖对照品溶液,连续测定6次,RSD为0.47 %,表明仪器精密度良好。
2.1.3 重复性实验精密称取白术多糖粉末0.2 g定容至100 mL容量瓶,从中精密量取2 mL于具塞试管中,平行6份,然后加入5 % 苯酚1 mL、浓硫酸5 mL,静置5 min,水浴15 min,冰浴5 min,放置室温后测定其吸光度。RSD为2.20%,表明重复性良好。
2.1.4 稳定性实验取“2.1.3”项下配制好的溶液,每隔10 min测定1次吸光度,RSD为0.98%,表明样品在1 h内稳定性良好。
2.1.5 加样回收率实验精密吸取白术多糖样品溶液6份,每份2 mL,分别精密加入一定量的葡萄糖标准品,按上述方法操作测定吸光度,计算得到加样回收率为98.06%,RSD为2.39%,符合方法学要求。
2.1.6 多糖含量测定分别精密称定多糖粉末2 g于100 mL棕色容量瓶中,加蒸馏水稀释至刻度,摇匀至溶解完全,4 000 r/min离心15 min(离心半径为10 cm),取上清,即得多糖溶液。精密量取适量多糖溶液,加蒸馏水稀释得到0.02 mg/mL的供试品溶液。精密吸取供试品溶液2.0 mL,按照“2.1.1”项下自“加入1 mL 5% 苯酚溶液”起依法操作,平行6份。根据回归方程及公式计算市售多糖样品的多糖含量。样品中多糖含量(%)=cdvm×1 000。其中,c为样品待测液中葡萄糖的质量浓度(mg/mL),d为待测液的稀释倍数,v为待测液的总体积(mL),m为称取的样品质量(g)。根据回归方程及公式计算得到17种市售多糖含量均较高[11-14]。
2.2 蛋白质含量测定 2.2.1 标准曲线的建立考马斯亮蓝试剂配置:称取100 mg考马斯亮蓝G-250溶于50 mL 95%的乙醇及加入100 mL 85 %的磷酸,加蒸馏水稀释至1 L,最终溶液含0.01%的考马斯亮G-250、4.7%的乙醇及8.5 %的磷酸,置于棕色试剂瓶中备用,4 ℃保存。蛋白标准液配置:精密称取牛血清白蛋白10 mg置于10 mL棕色容量瓶中,加蒸馏水稀释至刻度即得1.0 mg/mL的牛血清蛋白标准溶液,4 ℃储存(用后放入冰箱)。分别精密量取1.0 mg/mL的牛血清白蛋白溶液0.01、0.06、0.08、0.10、0.15、0.20、0.25、0.30 mL于10 mL具塞试管中,加水补足至1 mL,得到梯度浓度对照品溶液,向试管中加入考马斯亮蓝试剂5.0 mL混匀,室温放置10 min,用紫外可见分光光度计测定其于595 nm下的吸光度,以蒸馏水为空白对照,以牛血清白蛋白溶液X(mg/mL)为横坐标,吸光度Y(△Abs)为纵坐标绘制标准曲线。得到标准曲线回归方程为Y=4.597X+0.093(r=0.999 0),线性范围为0.01~0.3 mg/mL。
2.2.2 精密度实验精密量取浓度为0.06 mg/mL的标准牛血清白蛋白溶液1 mL,加入考马斯亮蓝G-250显色剂5.0 mL混匀,室温放置10 min后于595 nm测定吸光度,连续测定6次。RSD为0.40%,表明仪器精密度良好。
2.2.3 重复性实验精密称取500 mg灰树花多糖样品,稀释50倍得到浓度为10 mg/mL的样品溶液,从中量取1 mL,平行6份,按上述方法操作测定吸光度。RSD为2.22 %,表明稳定性良好。
2.2.4 稳定性实验精密量取10 mg/mL的灰树花多糖样品溶液1 mL,按上述方法操作,每隔10 min测定吸光度,RSD为2.0 %,1 h内其线性范围良好。
2.2.5 加样回收率实验取10 mg/mL的灰树花多糖样品溶液0.5 mL,加入浓度为0.4 mg/mL的牛血清白蛋白标准溶液0.5 mL,再加入5 mL考马斯亮蓝G-250显色试剂,混匀,室温放置10 min,于595 nm处测定吸光度,以0号试管为空白对照,根据标准曲线算出相应浓度,计算加入蛋白质量,并计算回收率,分别进行6次平行测定。RSD为2.98 %,提示线性范围良好。
2.2.6 蛋白质含量测定精密称定各多糖样品粉末0.1 g于10 mL棕色容量瓶中,加蒸馏水稀释至刻度,摇匀至完全溶解,得到浓度为10 mg/mL的多糖溶液。精密量取多糖溶液1 mL,按照本实验“2.2.1”项下自“向试管中加入考马斯亮蓝试剂5.0 mL”起依法操作,平行测定3次,并根据回归方程计算多糖粉末中蛋白质含量[15-18]。
2.3 多糖吸湿性测定在已恒质量的称量瓶底部分别加入1.5 g干燥多糖粉末,置玻璃干燥容器内备用;将底部含有氯化钠过饱和溶液的玻璃干燥器放入25 ℃烘箱中恒温24 h,此时干燥器内的相对湿度为50 %;将多糖粉末置于有氯化钠过饱和溶液的干燥箱中,于25 ℃恒温箱中保存,定时取样称取质量,重复3次,计算吸湿百分率。经观察,发现所有的多糖粉末随着时间的延长均呈现出不同程度的吸湿效果[19-22]。吸湿百分率=(吸湿后质量-吸湿前质量)/吸湿前质量×100%。
2.4 多糖黏度测定 2.4.1 多糖溶液浓度对黏度的影响将多糖溶液配置成0.02、0.05、0.10、0.15 g/mL不同浓度的多糖溶液,室温下磁力搅拌充分溶解,在剪切速率750 r/min条件下测定其黏度3次,取平均值。
2.4.2 温度对多糖溶液黏度的影响配置浓度为0.15 g/mL的多糖溶液,在剪切速率为750 r/min条件下,将多糖溶液分别在25、45、65、85 ℃搅拌,测定其黏度变化[23-24]。
2.5 总抗氧化能力测定 2.5.1 溶液制备FRAP试剂:1)300 mmol/L,pH=3.6的醋酸钠缓冲溶液:称取无水醋酸钠0.187 1 g,加入冰醋酸1.6 mL,加蒸馏水至100 mL。采用pH计测定其pH为3.6。2)10 mmol/L TPTZ(溶解在40 mmol/L盐酸溶液中):精确量取浓盐酸(36%~38%)0.333 mL,用水定容至100 mL容量瓶内,得到40 mmol/L盐酸溶液。精确称取TPTZ粉末31.23 mg于10 mL棕色容量瓶内,用40 mmol/L盐酸溶液稀释至刻度,得到10 mmol/L TPTZ溶液澄清透明。3)20 mmol/L FeCl3:精确称取FeCl3·6H2O固体粉末54.06 mg于10 mL棕色容量瓶内,加蒸馏水稀释至刻度,得到20 mmol/L FeCl3溶液。将醋酸钠缓冲溶液(300 mmol/L,pH =3.6)、TPTZ(10 mmol/L)和FeCl3(20 mmol/L)以体积比10∶1∶1比例混合,配成FRAP试剂(临用前新鲜配制)[25]。
对照品溶液:精密称取27.8 mg FeSO4·7H2O颗粒于10 mL棕色容量瓶内,加入蒸馏水稀释至刻度,得到10 mmol/L的FeSO4溶液。精密量取FeSO4溶液适量,加水逐级稀释,分别得到浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.8、1.0、1.2 mmol/L的对照品溶液。
样品溶液:精密称取多糖粉末25 g于50 mL棕色容量瓶内,加水稀释至刻度,混匀,水浴加热至溶解完全,放至室温,4 000 r/min离心15 min(离心半径为10 cm),取上清得到多糖溶液。分别精密量取适量中药多糖溶液,加蒸馏水稀释,得到5种不同浓度样品溶液。
阳性对照溶液:另精密称定维生素C对照品2 mg于10 mL棕色容量瓶内,加水稀释至刻度,混匀,得到浓度为0.2 mg/mL的维生素C溶液。取维生素C溶液适量,逐级稀释,得到6种不同浓度维生素C溶液。
2.5.2 标准曲线绘制分别精密量取0.2 mL不同浓度的对照品溶液于10 mL具塞试管内,迅速加入6 mL孵育的FRAP试剂,于37 ℃下水浴放置30 min,取出测定相应的吸光度值,检测波长为595 nm。以蒸馏水为空白对照。以FeSO4溶液的浓度(mmol/L)为横坐标X,吸光度为纵坐标Y(△Abs),绘制FeSO4溶液的标准曲线,进行回归分析。所得方程为Y=0.710 8X-0.007 1,相关系数r为0.999 8,线性范围为0.1~5.0 mmol/L。
2.5.3 样品测定分别精密量取0.2 mL各浓度样品溶液及维生素C溶液于5 mL具塞试管内,按照本实验“2.5.2”项下“迅速加入6 mL孵育的FRAP试剂”依法操作,测定吸光度。FRAP值是以1 mmol/L FeSO4为标准,通过FeSO4标准曲线计算,达到相同吸光度值所需FeSO4量,此值即为样品的FRAP值。以各样品溶液、维生素C溶液的FRAP值为纵坐标Y,溶液浓度(mg/mL)为横坐标X,绘制各样品总抗氧化能力图[26-29]。
3 实验结果 3.1 17种多糖的理化性质分析市售的17种中药多糖粉末中多糖含量、蛋白质含量如表 1所示,其中多糖含量较高,蛋白质含量较少,其中党参多糖中多糖含量最高,枸杞多糖中多糖含量最低。
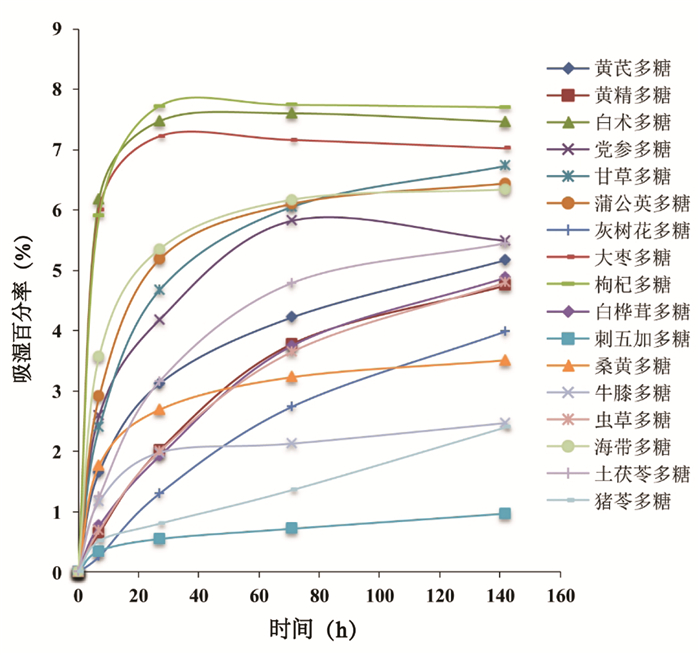
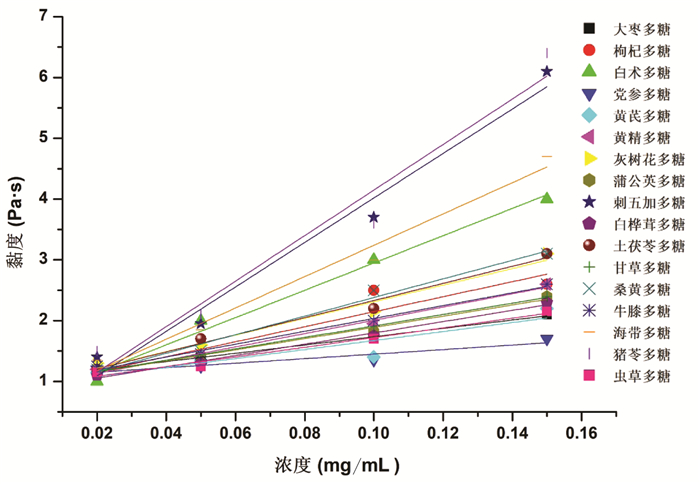
多糖的吸湿性测定结果如图 1所示,结果表明17种多糖均具有较好的吸湿性,其中刺五加多糖的吸湿性最低,枸杞多糖的吸湿性最高。如图 2所示,多糖黏度随溶液浓度升高而增强,可能是由于多糖浓度升高,多糖链之间的相互作用加强,导致多糖分子结构发生变化,从而使多糖溶液黏度变大。考察温度对多糖溶液黏度的影响,结果如图 3所示,多糖黏度随温度的升高而降低,这是由于温度升高导致多糖分解,生成了小分子的糖,使自身黏度下降[30-32]。
|
| 图 1 多糖吸湿曲线图 |
|
| 图 2 多糖黏度与浓度关系图 |

|
| 图 3 多糖黏度与温度关系图 |
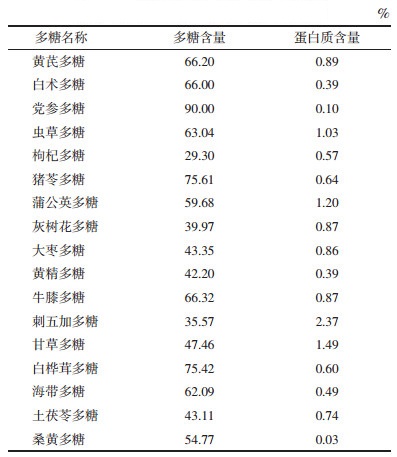
应用铁离子(Fe3+)还原法测定多糖的体外抗氧化活性,当Y值为1时所测得的X值为多糖对Fe3+还原能力浓度,可知每种多糖均具有抗氧化能力。其中刺五加多糖的抗氧化能力最强,黄精多糖抗氧化能力最弱。将17种多糖与维生素C对Fe3+还原能力的对比可知,17种中药多糖对Fe3+均具有还原能力,但其抗氧化活性低于维生素C。见表 2。
以往对中药有效成分的研究通常集中在小分子物质,多见生物碱、萜类、黄酮、挥发油及苷类等小分子化合物,而蛋白质、多糖、多肽等生物大分子物质相对较少。而实际上,生物大分子也是中药重要的有效成分,由于受到研究技术和方法的限制,且生物大分子本身的分离、纯化和结构测定难度较大,导致鲜有研究。
本实验首先采用苯酚-硫酸法测定17种中药多糖粉末中多糖含量,通过黏度计、紫外可见分光光度法等方法研究各多糖的黏度、吸湿性、蛋白含量等基本理化性质。研究结果表明,市售的17种中药多糖粉末中多糖含量均较高,且蛋白质含量非常低。多糖的吸湿性测定结果表明,多糖具有较好的吸湿性。多糖黏度测定结果表明,多糖黏度随溶液浓度升高而增大,可能是因为增大多糖浓度,使多糖链之间的相互作用加强,导致多糖分子结构发生变化,从而使多糖溶液黏度变大。多糖黏度随温度升高而降低,这是由于温度升高,导致多糖分解,生成了小分子的糖,使多糖结构发生了变化,从而黏度下降。应用铁离子还原法测定多糖的体外抗氧化活性,将17种多糖与维生素C对Fe3+还原能力的比较可知,17种中药多糖对Fe3+的还原能力较弱,其中刺五加多糖在17种多糖中抗氧化能力最强,但也仅为维生素C的1/43。本文总结了17种多糖的理化性质,希望可以对日后多糖的研究提供理论性支持。
| [1] |
朱建华, 杨晓泉. 真菌多糖研究进展--结构、特性及制备方法[J]. 中国食品添加剂, 2005, 16(6): 75-80. ZHU J H, YANG X Q. Recent advances in fungis polysacchaomyces-survey on bioactive structure, functional propertirs and prepared methods[J]. China Food Additives, 2005, 16(6): 75-80. DOI:10.3969/j.issn.1006-2513.2005.06.018 |
| [2] |
冯学珍, 陈颖, 伍善广. 石莼多糖的单糖组成成分分析[J]. 食品工业科技, 2014, 35(7): 91-94. FENG X Z, CHEN Y, WU S G. Analysis of monosaccharide composition in Ulva LactucaL polysaccharides[J]. Food Industry Technology, 2014, 35(7): 91-94. |
| [3] |
陆兔林, 吴杨, 季德, 等. 五味子多糖提取分离和药理作用研究进展[J]. 中国中药杂志, 2014, 39(4): 751-754. LU T L, WU Y, JI D, et al. Research progress on extraction and separation of Schisandra Chinensis polysaccharide and its pharmacological action[J]. Chinese Journal of Traditional Chinese Medicine, 2014, 39(4): 751-754. |
| [4] |
柯乐芹, 张东旭, 肖建中. 杏鲍菇深加工残渣多糖酶法微波辅助提取工艺优化[J]. 农业工程学报, 2014, 30(21): 332-338. KE L Q, ZHANG D X, XIAO J Z. Optimization of microwave-assisted enzyme extraction process of polysaccharide from Pleurotus eryngii stalk residue after deep treatment[J]. Journal of Agricultural Engineering, 2014, 30(21): 332-338. DOI:10.3969/j.issn.1002-6819.2014.21.040 |
| [5] |
赵宁, 程玉钏, 李伟泽, 等. 以白芨多糖为骨架材料的沙棘油凝胶乳的制备及性质研究[J]. 中国油脂, 2016, 41(6): 79-82. ZHAO N, CHENG Y C, LI W Z, et al. Preparation and properties of seabuckthorn oil gel emulsion with Bletilla striata polysaccharide as skeleton material[J]. China Oils and Fats, 2016, 41(6): 79-82. DOI:10.3969/j.issn.1003-7969.2016.06.019 |
| [6] |
赵琳静, 王斌, 乔妍, 等. 香茅叶挥发油的化学成分及其体外抗氧化活性[J]. 中成药, 2016, 38(4): 841-845. ZHAO L J, WANG B, QIAO Y, et al. Chemical constituents and their antioxidant activities in vitro of volatile oil from leaves of Cymbopogon Citratus[J]. Chinese Patent Medicine, 2016, 38(4): 841-845. |
| [7] |
王灯节, 狄留庆, 康安, 等. 白及多糖配伍对三七总皂苷中10种成分药动学的影响[J]. 中草药, 2017, 48(4): 737-746. WANG D J, DI L Q, KANG A, et al. Effect of Bletilla striata polysaccharides on pharmacokinetics of 10 components in Panax notoginseng saponins[J]. Chinese Herbal Medicine, 2017, 48(4): 737-746. |
| [8] |
靳祎, 刘超, 范林林, 等. 刺五加多糖对人宫颈癌HeLa细胞体外增殖和凋亡作用的实验研究[J]. 中成药, 2014, 36(1): 162-164. JIN Y, LIU C, FAN L L, et al. Experimental study of Acanthopanax senticosus polysaccharide on the proliferation and apoptosis of human cervical cancer HeLa cells in vitro[J]. Chinese Patent Medicine, 2014, 36(1): 162-164. DOI:10.3969/j.issn.1001-1528.2014.01.040 |
| [9] |
李翠丽, 王炜, 张英, 等. 中药多糖提取、分离纯化方法的研究进展[J]. 中国药房, 2016, 27(19): 2700-2703. LI C L, WANG W, ZHANG Y, et al. Research progress on extraction, separation and purification methods of polysaccharides from traditional Chinese medicine[J]. China Pharmacy, 2016, 27(19): 2700-2703. DOI:10.6039/j.issn.1001-0408.2016.19.34 |
| [10] |
王金宏. 龙胆中植物多糖保肝、降血脂及免疫调节作用的研究[D]. 哈尔滨: 哈尔滨商业大学, 2012. WANG J H. Study on liver protection, reducing blood lipids and immune regulation effect of Gentiana polysaccharides[D]. Harbin: Harbin University of Commerce, 2012. |
| [11] |
孙晓燕, 蔡昌利, 徐丽莉, 等. 多糖含量测定方法的比较[J]. 现代中药研究与实践, 2015, 29(3): 58-62. SUN X L, CAI C L, XU L L, et al. Comparison of methods for determination of polysaccharide content[J]. Modern Chinese Medicine Research and Practice, 2015, 29(3): 58-62. |
| [12] |
聂凌鸿. 淮山活性多糖的分离纯化、结构与生物活性的研究[D]. 广州: 华南理工大学, 2004. NIE L H. Study on isolation, purification, structure and biological activity of active polysaccharides from Dioscorea. fordiiprain et burkill[D]. Guangzhou: South China University of Technology, 2004. |
| [13] |
杨贤庆, 刘名求, 戚勃, 等. 龙须菜中多糖含量测定方法的比较研究[J]. 食品工业科技, 2013, 34(22): 54-57. YANG X Q, LIU M Q, QI B, et al. Comparison of methods in determination of polysaccharide in Gracilaria lemaneiformis[J]. Science and Technology of Food Industry, 2013, 34(22): 54-57. |
| [14] |
万强, 吴学昊, 范华均, 等. HPLC衍生化法分析决明子多糖水解产物中单糖组分及其多糖组成特征的研究[J]. 分析测试学报, 2014, 33(11): 1231-1236. WAN Q, WU X H, FAN H J, et al. Derivative chromatographic analysis of monosaccharides in hydrolyzed polysaccharide from Cassia obtusifolia L. and their composition characteristics[J]. Chinese Journal of Analysis and Testing, 2014, 33(11): 1231-1236. DOI:10.3969/j.issn.1004-4957.2014.11.004 |
| [15] |
刘玉明, 钱甜甜, 蒋定文, 等. 凯氏定氮法和考马斯亮蓝法测定方格星虫多糖中蛋白质的含量[J]. 中国实验方剂学杂志, 2013, 19(19): 96-98. LIU Y M, QIAN T T, JIANG D W, et al. The comparison with Kjeldah and coomassie brilliant blue method on testing protein content of the polysaccharide from Sipunculus nudus[J]. Chinese Journal of Experimental Pharmacology, 2013, 19(19): 96-98. |
| [16] |
赵英永, 戴云, 崔秀明, 等. 考马斯亮蓝G-250染色法测定草乌中可溶性蛋白质含量[J]. 云南民族大学学报(自然科学版), 2006, 15(3): 235-237. ZHAO Y Y, DAI Y, CUI X M, et al. Determinationa of protein in cntect of Radix Aconiti Kusnezoffii using coomassie brilliant blue G-250 dye binding[J]. Journal of Yunnan Nationalities University (Natural Science Edition), 2006, 15(3): 235-237. DOI:10.3969/j.issn.1672-8513.2006.03.018 |
| [17] |
焦洁. 考马斯亮蓝G-250染色法测定苜蓿中可溶性蛋白含量[J]. 农业工程技术, 2016, 36(17): 33-34. JIAO J. Determination of soluble protein content in Alfalfa by coomassie brilliant blue G-250 dye binding[J]. Agricultural Engineering Technology, 2016, 36(17): 33-34. |
| [18] |
王孝平, 邢树礼. 考马斯亮蓝法测定蛋白含量的研究[J]. 天津化工, 2009, 23(3): 40-42. WANG X P, XING S L. Determination of protein quantitation using the method of coomassie brilliant blue[J]. Tianjin Chemical Industry, 2009, 23(3): 40-42. DOI:10.3969/j.issn.1008-1267.2009.03.016 |
| [19] |
李小芳, 何倩灵, 耿桂香, 等. 防潮辅料对黄芪多糖吸湿性的影响[J]. 中成药, 2011, 33(5): 800-803. LI X F, HE Q L, GENG G X, et al. Effects of moisture-proof excipients on the hygroscopicity of Astragalus Polysaccharide[J]. Chinese Traditional Patent Medicine, 2011, 33(5): 800-803. DOI:10.3969/j.issn.1001-1528.2011.05.019 |
| [20] |
李小芳, 何倩灵, 向永臣, 等. 黄芪多糖颗粒防潮辅料的研究[J]. 中国实验方剂学杂志, 2011, 17(9): 11-14. LI X F, HE Q L, XIANG Y C, et al. Study on damp-proofing excipients of APS granules[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17(9): 11-14. DOI:10.3969/j.issn.1005-9903.2011.09.004 |
| [21] |
刘涛, 于晓红, 吴宪玲, 等. 西洋参多糖胶囊制备工艺研究[J]. 农产品加工, 20180, 17(5): 40-42. LIU T, YU X H, WU X L, et al. Preparation process of Panax quinquefolium L. polysaccharide capsule[J]. Agricultural Products Processing, 20180, 17(5): 40-42. |
| [22] |
张晓玲. 细菌胞外多糖的制备及特性研究[D]. 大连: 大连工业大学, 2012. ZHANG X L. Research on preparation and characteristics of bacterial extracellular polysaccharide[D]. Dalian: Dalian University of Technology, 2012. |
| [23] |
李庄. 大豆水溶性多糖的提取与应用研究[D]. 上海: 华东师范大学, 2005. LI Z. Extraction of water-soluble soybean polysaccharidesand its applications[D]. Shanghai: East China Normal University, 2005. |
| [24] |
张力妮. 麦冬多糖的修饰、抗氧化活性以及结构的研究[D]. 西安: 陕西师范大学, 2014. ZHANG L N. Study on antioxidant activity and structure of Ophiopogon japonicus polysaccharide with chemical modified[D]. Xi'an: Shaanxi Normal University, 2014. |
| [25] |
郭长江, 杨继军, 李云峰, 等. FRAP法测定水果不同部分抗氧化活性[J]. 中国公共卫生, 2003, 12(7): 85-87. GUO C J, YANG J J, LI Y F, et al. Antioxidant capacity of different parts of fruits determined by FRAP assay[J]. Chinese Public Health, 2003, 12(7): 85-87. |
| [26] |
韦献雅, 殷丽琴, 钟成, 等. DPPH法评价抗氧化活性研究进展[J]. 食品科学, 2014, 35(9): 317-322. WEI X Y, YIN L Q, ZHONG C, et al. Advances in the DPPH radical scavenging assay for antioxidant activity evaluation[J]. Food Science, 2014, 35(9): 317-322. |
| [27] |
刘秋云. 不同波长光源对β-胡萝卜素抗氧化能力影响的研究[D]. 长沙: 湖南农业大学, 2015. LIU Q Y. Research on anti-oxidative capacity change of β-carotene under different wavelength of light treatment[D]. Changsha: Hunan Agricultural University, 2015. |
| [28] |
汪瑞敏, 朱秋劲, 张春花, 等. 不同提取方法对天麻多糖抗氧化活性的影响[J]. 食品科技, 2015, 40(3): 208-213. WANG R M, ZHU Q J, ZHANG C H, et al. Effect of different extraction method on antioxidant activity of polysaccharides from Gastrodia elata Blume[J]. Food Science and Technology, 2015, 40(3): 208-213. |
| [29] |
罗莉. 大枣生物活性多糖分离及抗氧化活性研究[D]. 郑州: 河南工业大学, 2012. LUO L. Isolation, purification antioxidant activity and chemical modification of Zizyphus Jujuba polysaccharides[D]. Zhengzhou: Henan University of Technology, 2012. |
| [30] |
高春燕. 枸杞多糖的提取分离技术及其特性研究[D]. 西安: 陕西师范大学, 2006. GAO C Y. Study on extraetion and separation technology and charaeteristics of Ch. Wolfberry polysaccharide[D]. Xi'an: Shaanxi Normal University, 2006. |
| [31] |
李泽秀. 红稗多糖的分离纯化及其生物活性的探究[D]. 贵阳: 贵州大学, 2016. LI Z X. Study on separation, purification and bioactivity of polysaccharides from Bacca Sedge[D]. Guiyang: Guizhou University, 2016. |
| [32] |
张晶晶. 六地区黑木耳产品的综合评价及其多糖特性的研究[D]. 武汉: 华中农业大学, 2013. ZHANG J J. The study on six Auricularia auricula commodity evaluation and their polysaccharides characteristics[D]. Wuhan: Huazhong Agricultural University, 2013. |
 2021, Vol. 40
2021, Vol. 40