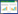文章信息
- 周南, 张志强, 周永康, 闫晓鑫, 程立伟, 董晨红
- ZHOU Nan, ZHANG Zhiqiang, ZHOU Yongkang, YAN Xiaoxin, CHENG Liwei, DONG Chenhong
- 麸炒苍术标准汤剂的质量评价
- Quality evaluation of bran-processed Atractylodis Rhizoma standard decoction
- 天津中医药大学学报, 2021, 40(5): 634-639
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(5): 634-639
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.05.21
-
文章历史
收稿日期: 2021-04-22
2. 北京市中药配方颗粒工程技术研究中心, 北京 101300
2. Beijing Engineering Technology Research Center for Chinese Medicinal Composition Granules, Beijing 101300, China
麸炒苍术为菊科植物茅苍术Atractylodes lancea(Thunb.)DC.或北苍术Atractylodes chinensis(DC.)Koidz.的干燥根茎经麸炒炮制后所得。苍术中含有较高的挥发油,性味辛温苦燥,具有燥湿健脾、祛风散寒、明目等功效,临床多用于治疗湿阻中焦、脘腹胀满、风湿痹痛、泄泻水肿等病症[1]。苍术经麸炒后辛燥之性得以缓和,且与麦麸共制,更增强了健脾和胃的作用[2-3],用于治疗脾胃虚弱、食欲不佳、恶心呕吐、腹泻等。目前关于麸炒苍术的报道主要集中在饮片的炮制和炮制前后挥发性成分的变化,而对麸炒苍术标准汤剂的制备及质量评价尚属空白。
中药标准汤剂是以中医理论为指导,以临床应用为基础,参考现代提取方法,经标准化工艺制备而成的单味中药饮片水煎剂,其规范了工艺参数和质量标准的建立原则[4-5]。标准汤剂作为一种参照物,能够用于标准化临床用药,规范目前临床广泛使用的包括配方颗粒在内的新型饮片形式,保障用药的准确性和剂量的一致性,解决目前饮片形式多样性带来的监管困境[6]。
本研究按照标准汤剂制备方法,收集北苍术道地产区和主产地药材18批,参照2020年版《中华人民共和国药典》[7]苍术项下“麸炒苍术”制备方法进行炮制,以18批麸炒苍术饮片为原料制备标准汤剂,建立指标成分含量和指纹图谱的检测方法,并对共有峰的结构进行指认,从定量和整体定性的角度对标准汤剂的质量进行评价,为麸炒苍术标准汤剂质量标准的制定提供参考,并为以麸炒苍术标准汤剂为基础的其他形式制剂的质量控制和规范临床用药提供依据。
1 实验材料 1.1 仪器Waters ACQUITY UPLC H-Class超高效液相色谱仪,TUV Detector紫外检测器,Empower 3色谱工作站,Agilent 1290系列超高效液相色谱仪,Agilent 6530系列四级杆-飞行时间质谱仪,Waters ACQUITY UPLC HSS T3 1.8 μm(2.1 mm×100 mm)色谱柱,KQ-500DB超声波清洗器(昆山市超声仪器有限公司),ME104E电子天平[梅特勒·托利多仪器(上海)有限公司],JY20002电子天平(上海舜宇恒平科学仪器有限公司)。
1.2 试药与试剂5-羟甲基糠醛对照品(批号:Q-042-180112,成都瑞芬思生物科技有限公司),咖啡酸对照品(批号:110885-201703,中国食品药品检定研究院),绿原酸对照品(批号:110573-201716,中国食品药品检定研究院),乙腈(默克)、甲酸(Fisher Scientific)为色谱纯,甲醇为色谱纯,水为蒸馏水。
1.3 麸炒苍术饮片按照2020年版《中华人民共和国药典》苍术项下“麸炒苍术”方法“取苍术片,照麸炒法(通则0213)炒至表面深黄色”制备。产地及批号信息见表 1。
以国家中医药管理局发布的《医疗机构中药煎药室管理规范》和国家药典委员会发布的《中药配方颗粒质量控制与标准制定技术要求》[8]为依据,考察麸炒苍术标准汤剂工艺条件,以制备“麸炒苍术标准汤剂”。取麸炒苍术饮片,煎煮2次。第1次加入9倍量水,浸泡30 min,煎煮30 min,滤过;第2次加入7倍量水,煎煮20 min,滤过,合并滤液,50 ℃减压浓缩至料液比约1∶1的流浸膏,置于不锈钢盘中冷冻干燥,即得标准汤剂冻干粉。标准汤剂出膏率的计算取标准汤剂干燥粉末质量(m2)与麸炒苍术饮片质量(m1)之比值,即出膏率=m2/m1×100%,结果见表 2。
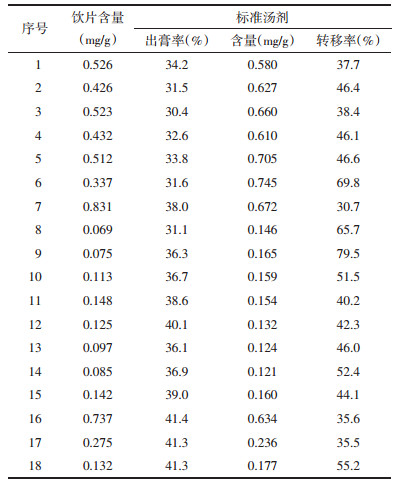
以十八烷基硅烷键合硅胶为填充剂,Waters ACQUITY UPLC HSS T3色谱柱(柱长100 mm,柱内径2.1 mm,粒径1.8 μm);以乙腈为流动相A,0.1%甲酸为流动相B,按表 3中的规定进行梯度洗脱;检测波长0-8.5 min为284 nm;8.5-45 min为336 nm,流速为0.4 mL/min,柱温为30 ℃,进样量5 μL。理论板数按绿原酸峰计算应不低于5 000。
取绿原酸对照品适量,精密称定,加入10%甲醇制成每1 mL含绿原酸20 μg的溶液。
2.2.3 供试品溶液的制备取供试品0.5 g,精密称定,置50 mL具塞锥形瓶中,精密加入10%甲醇20 mL,密塞,称定质量,超声处理(功率250 W,频率40 kHz)40 min,取出,放凉,以10%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.2.4 方法学考察 2.2.4.1 线性关系考察分别精密吸取不同浓度(1.0、5.0、10.0、20.0和50.0 μg/mL)的绿原酸对照品溶液5 μL,按“2.2.1”所述条件进行分析,以绿原酸的峰面积值为纵坐标,对照品浓度值为横坐标,制作标准曲线。结果表明,绿原酸浓度在1.116~55.817 μg/mL范围内,线性回归方程为Y=34 014 647.918 5X+298.612 1,R2=1.00,表明线性关系良好。
2.2.4.2 精密度考察取供试品0.5 g,精密称定,按“2.2.3”所述方法制备供试品溶液,连续进样6针,测定绿原酸峰面积的RSD值为0.2%,结果表明精密度良好。
2.2.4.3 稳定性实验取供试品0.5 g,精密称定,按“2.2.3”所述方法制备供试品溶液,分别于0、2、4、6、8、10、12和24 h测定绿原酸含量。经计算,各样品中绿原酸峰面积的RSD值为2.8%,说明24 h内此样品溶液稳定。
2.2.4.4 重复性实验取供试品6份,每份0.5 g,精密称定。按“2.2.3”所述方法处理标准汤剂样品,按“2.2.1”所述条件进样测定,计算供试品中绿原酸含量。6份供试品中绿原酸含量的RSD值为0.9%,表明该方法重复性良好。
2.2.4.5 加样回收率实验取供试品9份,每份0.25 g,精密称定,每3份为1组。于每组中精密加入绿原酸对照品,相当于麸炒苍术标准汤冻干粉中所含绿原酸的50%、100%、150%,置于具塞锥形瓶中,按“2.2.1”所述条件进样5 μL进行测定,结果显示绿原酸平均加样回收率为98.2%,加样回收率RSD值为2.2%,表明本方法的准确度良好。
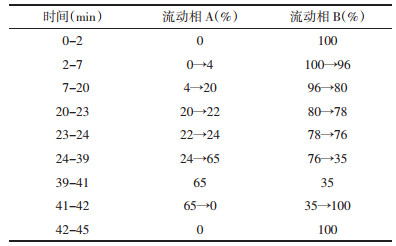
2.3 标准汤剂指纹图谱方法的建立通过查阅文献[9]及与对照品色谱图的比对,得知3号峰5-羟甲基糠醛为苍术经炮制后含量显著增加的成分,且在指纹图谱中分离度好、含量高、稳定,故选择该峰为参照峰(S),计算麸炒苍术标准汤剂指纹图谱主要特征峰的相对保留时间、相对峰面积RSD。
2.3.1 色谱条件同“2.2.1”项。
2.3.2 对照品溶液的制备取5-羟甲基糠醛对照品适量,精密称定,加10%甲醇制成1 mL含5-羟甲基糠醛3 μg的溶液,即得。
2.3.3 供试品溶液的制备同“2.2.3”项。
2.3.4 方法学考察 2.3.4.1 精密度实验取供试品0.5 g,精密称定,按“2.2.3”项制备供试品溶液,按“2.2.1”项色谱条件检测,连续进样6次,结果各特征峰的相对保留时间在0%~0.5%,表明该指纹图谱的精密度良好。
2.3.4.2 稳定性实验取供试品0.5 g,精密称定,按“2.2.3”制备供试品溶液,按“2.2.1”项色谱条件检测,分别在0、2、4、6、8、10、12和24 h进行测定,结果各特征峰的相对保留时间在0%~1.0 %,表明本实验采用的指纹图谱分析方法稳定、可靠、重现性好。
2.3.4.3 重复性实验取供试品6份,每份0.5 g,精密称定,按“2.2.3”制备供试品溶液,按“2.2.1”项色谱条件检测,结果各标识峰的相对保留时间在0%~0.7%,表明重复性良好。
2.3.4.4 中间精密度分别考察了不同分析人员、不同日期、不同设备对精密度的影响,以5-羟甲基糠醛峰为参照,对各图谱共有峰的相对保留时间进行计算。结果不同影响因素下各图谱共有峰相对保留时间的RSD值在0%~0.9%,各主要色谱峰的相对保留时间无明显变化,表明该方法精密度良好,随机变动因素不影响该方法的精密度。
2.4 质谱成分指认质谱条件:Agilent jet stream ESI源,干燥气流速:11 L/min,干燥气温度:350 ℃,鞘气温度:400 ℃,鞘气流速:11 L/min,雾化器压力:35 psi,Fragmentor电压:130 V。正模式采集,喷嘴电压:500 V,毛细管电压:4 000 V;负模式采集,喷嘴电压:1 000 V,毛细管电压:3 500 V。
3 结果 3.1 标准汤剂含量测定取18批麸炒苍术饮片及相应标准汤剂冻干粉,按照“2.2.3”项方法制备供试品溶液,按照“2.2.1”项方法检测,结果见表 2。18批麸炒苍术标准汤剂出膏率为30.4%~41.4%,均值为36.2%;标准汤剂中绿原酸含量为0.121~0.754 mg/g,均值为0.378 mg/g;绿原酸含量转移率为30.7%~79.5%,均值为48.0%。含量转移率=(标准汤剂含量×出膏率)÷饮片含量×100%。
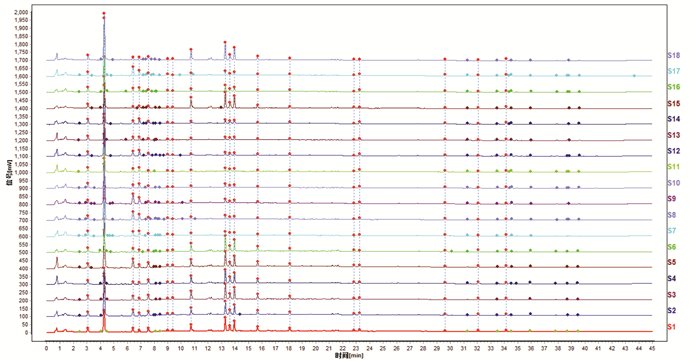
3.2 标准汤剂冻干粉指纹图谱 3.2.1 标准汤剂冻干粉指纹图谱检测取18批麸炒苍术标准汤剂冻干粉,按照“2.3”项方法制备供试品和对照品溶液,按照“2.2.1”项方法检测。将18批供试品液相指纹图谱导入相似度评价系统软件中分析,结果见图 1。18批供试品共呈现18个共有特征峰,以3号峰5-羟甲基糠醛为参照峰,计算18个共有色谱峰的相对保留时间及相对峰面积,结果见开放科学(资源服务)标识码(OSID)。
|
| 注:S1~S18分别为麸炒苍术标准汤剂冻干粉液相图谱1~18批。 图 1 18批麸炒苍术标准汤剂液相图谱 |
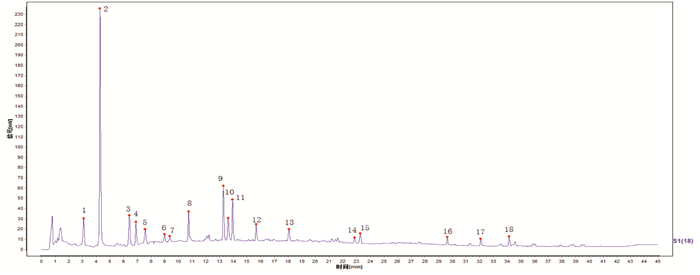
由18批麸炒苍术标准汤剂冻干粉指纹图谱可知,各特征峰相对保留时间的RSD均在±10%范围内,符合质量控制要求,选择相对保留时间的平均值作为测定值;规定值为:0.48(峰1)、0.67(峰2)、1.00(峰3)、1.08(峰4)、1.18(峰5)、1.40(峰6)、1.46(峰7)、1.67(峰8)、2.07(峰9)、2.12(峰10)、2.18(峰11)、2.44(峰12)、2.82(峰13)、3.56(峰14)、3.63(峰15)、4.62(峰16)、5.00(峰17)、5.33(峰18),允许误差:±10%。而相对峰面积的RSD差异较大,范围为33.2%~109.1%,说明不同批次的样品所含成分的比例差异较大,因此相对峰面积不进行限定。18批麸炒苍术标准汤剂冻干粉指纹图谱共有模式图见图 2。
|
| 图 2 共有模式图 |
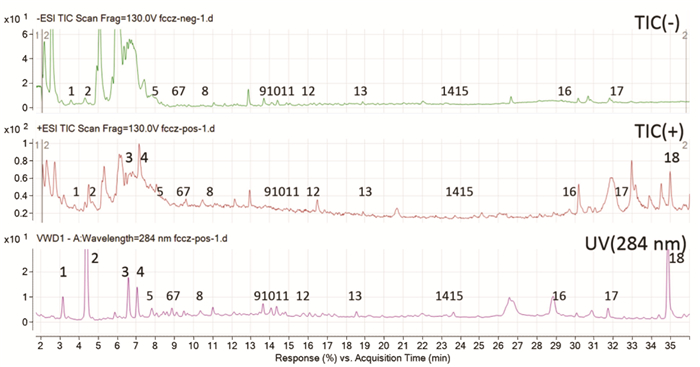
结合对照品色谱峰比对结果,参考麸炒苍术化学成分研究相关文献[10-13]对麸炒苍术中的主要化学成分结构进行推测,结果见表 4、图 3。
|
| 图 3 麸炒苍术标准汤剂质谱图 |
本研究对麸炒苍术标准汤剂的质量从以下3个方面加以控制:1)样品来自苍术的主产区及主要药材市场,按照2020年版《中华人民共和国药典》中麸炒苍术的炮制方法进行规范化炮制,所得饮片质量均符合规定。2)标准汤剂的制备过程遵循统一及标准化操作流程。3)标准汤剂的质量控制采取指纹图谱及指标成分含量相结合的模式,对主要共有峰进行了结构指认,可为麸炒苍术标准汤剂的制备和质量控制提供参考。
2020年版《中华人民共和国药典》中麸炒苍术饮片以苍术素作为质量控制指标,苍术素为小极性脂溶性成分,见光不稳定,经水煎煮后成分损失严重,含量和转移率均偏低,不适合作为汤剂及其衍生品的质量控制指标。因此,麸炒苍术汤剂的质量评价选择以绿原酸为指标成分。
本研究采用超高效液相色谱(UPLC)法建立了麸炒苍术饮片标准汤剂的指纹图谱,为了更加全面地反映标准汤剂中多成分的整体面貌,色谱条件以更换波长的方式对指纹图谱进行检测。洗脱时间在0-8.5 min时,检测波长选择284 nm,可对极性较大的糖苷类、糠醛类成分有较好分离效果;洗脱时间在8.5-45 min时,检测波长选择336 nm,可实现对有机酸、黄酮等其他类成分进行良好的分离分析。结果显示,更换波长后特征峰的呈现较多,指纹图谱基线平稳,特征峰比例适中。
采用UPLC法建立麸炒苍术标准汤剂的指纹图谱,克服了单一成分信息量不足的缺点,更加全面可靠地控制麸炒苍术水煎剂的质量,为麸炒苍术标准汤剂的质量评价和临床用药提供依据和多角度研究思路,同时为麸炒苍术配方颗粒及其他剂型的生产、质量控制提供了切实可行的参考数据。
| [1] |
王艳秋, 刘向前, 才谦. 麸炒对苍术中β-桉叶油醇含量的影响[J]. 亚太传统医药, 2016, 12(12): 24-26. WANG Y Q, LIU X Q, CAI Q. The effects of processing to the content of β-eudesmol in Atractylodis Rhizoma[J]. Asia-Pacific Traditional Medicine, 2016, 12(12): 24-26. DOI:10.11954/ytctyy.201612011 |
| [2] |
李时珍. 本草纲目[M]. 北京: 人民卫生出版社, 2004: 595. LI S Z. Compendium of materia medica[M]. Beijing: People's Medical Publishing House, 2004: 595. |
| [3] |
龚千锋. 中药炮制学[M]. 北京: 中国中医药出版社, 2016: 145. GONG Q F. Processing of Chinese materia medica[M]. Beijing: China Press of Traditional Chinese Medicine, 2016: 145. |
| [4] |
戎立保. 巴戟天多糖提取工艺比较[J]. 内蒙古中医药, 2009, 28(12): 30. RONG L B. Comparison of extraction process of polysaccharides from Morinda officinalis[J]. Nei Mongol Journal of Traditional Chinese Medicine, 2009, 28(12): 30. |
| [5] |
陈士林. 中药饮片标准汤剂[M]. 北京: 科学出版社, 2018: 7. CHEN S L. Standard decoction of Chinese Herbal Pieces[M]. Beijing: Science Press, 2018: 7. |
| [6] |
张红梅, 宋景政, 谭红胜, 等. 从汤剂到颗粒剂: 中药配方颗粒20年回顾与展望[J]. 世界科学技术-中医药现代化, 2012, 14(4): 1740-1753. ZHANG H M, SONG J Z, TAN H S, et al. From traditional decoction to modern granule: perspectives and prospects of Chinese medicine dispensing granules[J]. World Science and Technology/Modernization of Traditional Chinese Medicine and Materia Medica, 2012, 14(4): 1740-1753. DOI:10.3969/j.issn.1674-3849.2012.04.001 |
| [7] |
国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2020. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[M]. Beijing: China Medical Science and Technology Publishing House, 2020. |
| [8] |
国家药典委员会. 中药配方颗粒质量控制与标准制定技术要求(征求意见稿)[M]. 北京: 人民卫生出版社, 2016. National Pharmacopoeia Commission. Technical requirements for quality control and standard-setting of Chinese Medicine Dispensing Granules (draft for comments)[M]. Beijing: People's Medical Publishing House, 2016. |
| [9] |
季光琼, 刘艳菊, 王萍, 等. HPLC法测定苍术及麸炒苍术中5-羟甲基糠醛的含量[J]. 湖北中医杂志, 2014, 36(2): 73-74. JI G Q, LIU Y J, WANG P, et al. To determine the content of 5-hydroxymethyl acetaldehyde in Rhizoma Atractylodis and products roasted with bran by HPLC[J]. Hubei Journal of Traditional Chinese Medicine, 2014, 36(2): 73-74. |
| [10] |
于艳, 袁媛, 贾天柱, 等. 苍术炮制前后化学成分及药理作用研究近况[J]. 时珍国医国药, 2016, 27(1): 189-191. YU Y, YUAN Y, JIA T Z, et al. Recent research on chemical constituents and pharmacological effects from Atractylodes lancea before and after processing[J]. Lishizhen Medicine and Materia Medica Research, 2016, 27(1): 189-191. |
| [11] |
刘苗苗, 陈祥胜, 陈琪瑶, 等. 苍术麸炒过程中5-羟甲基糠醛的转化机制研究[J]. 中草药, 2016, 47(8): 1327-1331. LIU M M, CHEN X S, CHEN Q Y, et al. Conversion mechanism of 5-hydroxymethylfurfural in process of bran-fried Atractylodes lancea[J]. Chinese Traditional and Herbal Drugs, 2016, 47(8): 1327-1331. |
| [12] |
李水清, 许康, 刘艳菊, 等. 苍术及麸炒苍术高效液相图谱对比分析[J]. 湖北中医药大学学报, 2011, 13(4): 28-30. LI S Q, XU K, LIU Y J, et al. Comparative analysis of Rhizoma atractylodis and products roasted with bran[J]. Journal of Hubei University of Chinese Medicine, 2011, 13(4): 28-30. DOI:10.3969/j.issn.1008-987X.2011.04.010 |
| [13] |
刘玉强, 才谦, 贾天柱. 麸炒前后苍术中3种成分的HPLC测定[J]. 中成药, 2013, 35(1): 131-135. LIU Y Q, CAI Q, JIA T Z. Determination of three components in stir-frying Atractylodis Rhizoma with and without bran by HPLC[J]. Chinese Traditional Patent Medicine, 2013, 35(1): 131-135. |
 2021, Vol. 40
2021, Vol. 40