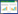文章信息
- 王隽, 李萍, 刘靖, 卓虹伊, 李维, 宋雨
- WANG Jun, LI Ping, LIU Jing, ZHUO Hongyi, LI Wei, SONG Yu
- 清热消肿止痛膏的制备及其皮肤安全性评价研究
- Study on preparation and skin safety evaluation of Qingre Xiaozhong Zhitong Ointment
- 天津中医药大学学报, 2021, 40(5): 640-646
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(5): 640-646
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.05.22
-
文章历史
收稿日期: 2021-06-29
2. 成都大学食品与生物工程学院, 成都 610106;
3. 成都大学医学院, 成都 610106
2. College of Food and Bioengineering, Chengdu University, Chengdu 610106, China;
3. College of Medicine, Chengdu University, Chengdu 610106, China
清热消肿止痛散由黄柏、大黄、黄芩、栀子、郁金、香附、甘草7味药材组成,主要包括生物碱类、蒽醌类、苷类、环烯醚萜类等药效学成分[1-3],具有清热解毒[4]、消肿止痛[5-6]、祛风除湿[1, 7]等功效,是用于缓解痛风性关节炎症导致的关节疼痛、肿胀、活动功能障碍等症状的经验方,具有几十年临床用药经验,疗效极佳。然而散剂具有易结块、品相差、微生物超标、质量不易控制[8]、有刺激性、吸湿性、质量不稳定、生物利用度低、用药不方便、易弄脏衣物、患者顺应性差等缺点[9-10],很大程度限制了其应用。贴膏制剂具有载药量大、药效持久、无首过效应、生物利用度高、对皮肤刺激性小、使用方便、患者顺应性良好等优点[11]。为解决清热消肿止痛散剂型上的不足,本研究采用现代制剂工艺,将清热消肿止痛散开发为清热消肿止痛膏,同时进行安全性评价,以便于在临床应用中提高患者用药的依从性和方便性,提高药物生物利用度及临床疗效。
本研究采用高效液相色谱(HPLC)法,建立了同时测定盐酸小檗碱和盐酸黄柏碱含量的方法[12],结合薄层色谱(TLC)法,共同控制清热消肿止痛膏的中间体质量,然后基于前期单因素考察的结果和相关文献报道情况,筛选出对提取影响较大的因素料液比、乙醇浓度、提取时间、提取次数设计正交实验,以指标成分含量和浸出物收率作为考察指标,综合评价优化提取工艺[13]。进一步,采用现代制剂技术,以基质的选择、稠膏密度的考察、外观成型性筛选成型工艺,制备清热消肿止痛膏。以日本大耳白兔和豚鼠为动物模型,采用单次、多次给药和主动皮肤过敏实验,考察其刺激性和安全性。本研究解决了消肿止痛散剂型上的不足,并进行了安全评价,为本品的临床应用提供了数据支持,对于提高患者用药的依从性和用药方便性,提高药物的生物利用度和临床疗效提供了参考,也为医院制剂的产品开发提供了思路。
1 仪器与材料 1.1 仪器TY15电子分析天平(d=0.1 mg),北京海富达科技有限公司;LC-20AT高效液相色谱仪,岛津企业管理(中国)有限公司;ACS-011电子秤,上海乾峰电子仪器有限公司;SZ-3自动三重纯水蒸馏器,上海沪西分析仪器厂;CPA225D电子分析天平(d=0.01 mg),德国赛多利斯公司;MH14628芬兰雷勃连续可调移液器。
1.2 试药黄柏、大黄、黄芩、栀子、香附、郁金、甘草饮片均购自四川省中药饮片有限责任公司;清热消肿止痛膏(批号:170601、170602、170603),由四川厚生天佐药业有限公司提供;黄柏、大黄、黄芩、栀子、香附、郁金、甘草对照药材购自中国食品药品检定研究院;盐酸小檗碱(批号:110713-201212,含量86.70%)、盐酸黄柏碱对照品(批号:111520-200504,含量94.90%)购自中国食品药品检定研究院;甲醇、乙腈购自美国Sigma Aldrich公司,色谱纯;十二烷基磺酸钠(SDS)、乙醇、硫化钠、2,4-二硝基氯苯购自成都科隆化工有限公司,均为分析纯。
1.3 实验动物日本大耳白兔12只,雌兔与雄兔数目各半,体质量为1.7~2.3 kg;豚鼠30只,雌鼠与雄鼠数目各半,体质量为250~300 g。实验动物均购自成都达硕实验动物有限公司,生产许可证号为SCXK(川)2014-028。
2 实验方法 2.1 中间体质量控制方法的建立 2.1.1 高效液相色谱(HPLC)色谱条件色谱柱:十八烷基硅烷键合硅胶为填充剂,安捷伦ZORBAX-SB C18色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇∶35%乙腈水[每1 L含2 g十二烷基硫酸钠(SDS)与2 mL磷酸]=54∶46;检测波长:284 nm;柱温:30 ℃;进样量:10 μL。
2.1.2 对照品溶液的制备取盐酸黄柏碱、盐酸小檗碱对照品适量,精密称定,分别加甲醇溶解并定容,制成0.10 mg/mL的盐酸黄柏碱和0.30 mg/mL的盐酸小檗碱对照品储备液。精密量取各储备液2 mL,置10 mL容量瓶中,加流动相定容,制成黄柏碱30 μg/mL和盐酸小檗碱60 μg/mL的混合对照品溶液。
2.1.3 供试品溶液的制备按处方量称取药材,加入6倍量的60%乙醇溶液回流提取2次,每次提取时间为1.5 h,将两次滤液合并,浓缩至相对密度为1.22~1.27(80 ℃)的浸膏。取浸膏45 mg,精密称定,加流动相溶解并定容至10 mL容量瓶中,过0.45 μm微孔滤膜,取续滤液即得供试品溶液。
2.1.4 阴性溶液的制备除黄柏外,其余药材按处方量称取后,按照“2.1.3”项下步骤操作,即可制得黄柏阴性样品溶液。
2.1.5 方法学考察 2.1.5.1 专属性考察分别精确吸取上述制备的混合对照品、供试品及黄柏阴性样品溶液各10 μL,进样测定,记录色谱图,考察专属性。
2.1.5.2 线性与范围精密量取盐酸小檗碱和盐酸黄柏碱对照品储备液适量,流动相稀释制备成浓度分别为193.860 0、145.400 0、96.930 0、48.470 0、9.690 0、3.390 0 μg/mL与101.920 0、76.440 0、50.960 0、25.480 0、10.190 0、3.570 0 μg/mL的系列对照品溶液。按上文中所述色谱条件分别进行进样、测定,并记录各峰面积值。以盐酸小檗碱和盐酸黄柏碱浓度(μg/mL)对各自峰面积进行线性回归,考察线性与范围。
2.1.5.3精密度实验:取混合对照品溶液,按拟定的色谱条件进样,同时重复6次,考察仪器的精密度。
2.1.5.4重复性实验:取浸膏,按照“2.1.3”项下操作平行制备供试品溶液6份,按拟定的色谱条件进行进样,测定盐酸小檗碱和盐酸黄柏碱的含量,分别计算出RSD值,考察方法的重复性。
2.1.5.5准确度实验:采用加样回收法考察方法的准确度。取已知含量的浸膏22.5 mg,共9份,每3份为1组,分别加入盐酸小檗碱126.01、222.94和339.26 μg,盐酸黄柏碱86.64、173.27和219.13 μg,按照“2.1.3”项下操作制备回收率溶液,进样、测定,计算回收率,考察方法的准确度。
2.2 提取工艺 2.2.1 实验设计与结果在单因素基础上,筛选出对提取率影响较大的4个因素,设计正交实验,以浸膏收率、盐酸小檗碱和盐酸黄柏碱含量之和为评价指标[13-14],优选最佳提取工艺,实验因素水平表见开放科学(资源服务)标识码(OSID)。
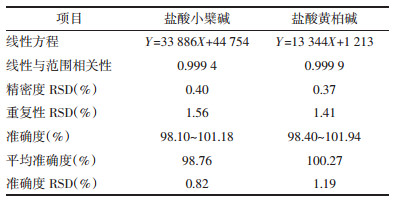
2.2.2 验证实验按照正交实验结果优选的最终工艺条件操作,平行制备3批供试品,以验证最佳提取工艺。
2.2.3 薄层鉴别研究采用薄层色谱法,参考《中华人民共和国药典》相关药材薄层鉴别方法以及相关指导原则,对处方中各药材进行鉴别,提高提取物的控制质量。各药材具体鉴别方式见OSID。
2.3 制剂成型工艺研究 2.3.1 稠膏密度研究为减少产品批次间质量差异,减少生产成本,以流动性为指标,考察稠膏的流动性。
2.3.2 基质材料选择研究通过比较橡胶膏和压敏胶的特点,以粘着力、过敏性、剥离性、稳定性和外观等指标结合查询相关文献选择基质材料[15]。
2.3.3 基质的制备研究实验取BC-1型医用压敏胶适量,加入不同量的乙酸乙酯混匀,制成基质,以涂布性和乙酸乙酯挥发性为指标,考察压敏胶与乙酸乙酯的混合比例。
2.3.4 稠膏用量考察基于稠膏的收率波动,以患者的舒适度和载药量与药效的关系为指标,考察稠膏与基质的用量和比例。
2.4 皮肤安全性研究参考《中药、天然药物刺激性和溶血性研究的技术指导原则》和《中药、天然药物免疫毒性(过敏性、光过敏反应)研究的技术指导原则》以及季荣进等学者的相关研究资料来进行[16-18],主要进行的实验包括刺激性实验、多次给药刺激性实验和主动皮肤过敏实验。
2.4.1 单次给药刺激性研究取日本大耳白兔4只,实验前24 h剔除背部两侧各约5 cm×10 cm大小毛发,温水擦洗干净备用。采用同体左、右侧对照进行实验,左侧为对照组,涂抹0.5 mL生理盐水,右侧为给药组,涂抹1 g清热消肿止痛膏,给药1次,使用纱布和保鲜膜包裹给药区,并用胶带固定。24 h后,去掉包裹材料和药物,以温水洁净大耳白兔皮肤。以自然光线下给药区域皮肤有无肉眼可见的出血点、水肿、红斑为观察指标,以去除药物后第1、24、48、72 h为观察时间点,观察并记录各观察指标的出现时间和消退时间,同时记录皮肤浅薄或皮肤粗糙情况[16]。空气耳缘静脉注射处死动物,取左、右侧脱毛皮肤,甲醛-冰醋酸-乙醇固定液(FAA液)固定,用不同浓度乙醇梯度脱水,甲苯透明处理,石蜡包埋,5 μm切片,苏木精-伊红(HE)染色,光学显微镜下观察并拍照,记录各样本病理变化。
2.4.2 多次给药刺激性研究日本大耳白兔4只,实验前24 h剔除动物背部两侧各约5 cm×10 cm大小毛发,温水擦洗干净备用。采用同体左、右侧对照进行实验,左侧为对照组,涂抹0.5 mL生理盐水,右侧为给药组,涂抹1 g清热消肿止痛膏,给药7次,每日1次。使用纱布和保鲜膜包裹给药区,并采用胶带固定,6 h后取下包裹材料和药物,以温水洁净大耳白兔皮肤。以自然光线下给药区域有无肉眼可见的出血点、水肿、红斑为观察指标,以每次去除药物后1 h、药前和末次去除药物后第1、24、48、72 h为观察点,观察并记录各观察指标的出现时间和消退时间,同时记录皮肤浅薄或皮肤粗糙情况[16, 19]。HE染色操作同“2.4.1”项。
2.4.3 主动皮肤过敏研究豚鼠30只,随机分为对照组10只、清热消肿止痛膏组10只和2,4-二硝基氯苯组10只。实验之前24 h剔除豚鼠背部两侧各约3 cm×3 cm大小毛发,用温水擦洗干净备用。对照组豚鼠于左侧去毛区皮肤上涂抹0.1 mL生理盐水,清热消肿止痛膏组豚鼠于左侧去毛区皮肤上涂抹0.1 g清热消肿止痛膏,2,4-二硝基氯苯组豚鼠于左侧去毛区皮肤上涂抹0.1 mL 1%的2,4-二硝基氯苯,共3次致敏接触,第7、14天同法涂抹给药1次,医用纱布和保鲜膜包裹,胶带固定6 h后取下包裹材料和药物,温水清洗干净。并于给药前、第1次涂抹受试药物后的第7、14、21、28天称取动物质量。于末次涂抹后14 d,在各组动物右侧去毛区皮肤分别激发给药,医用纱布和保鲜膜包裹,胶带固定6 h后取下包裹材料和药物,观察实验动物皮肤水肿、红斑和其他异常反应情况。主要过敏反应观察指标为动物是否出现休克、哮喘、站立不稳等严重的全身性过敏反应,并于激发给药后6、24、48和72 h观察各指标情况,计算过敏反应的发生率[19]。
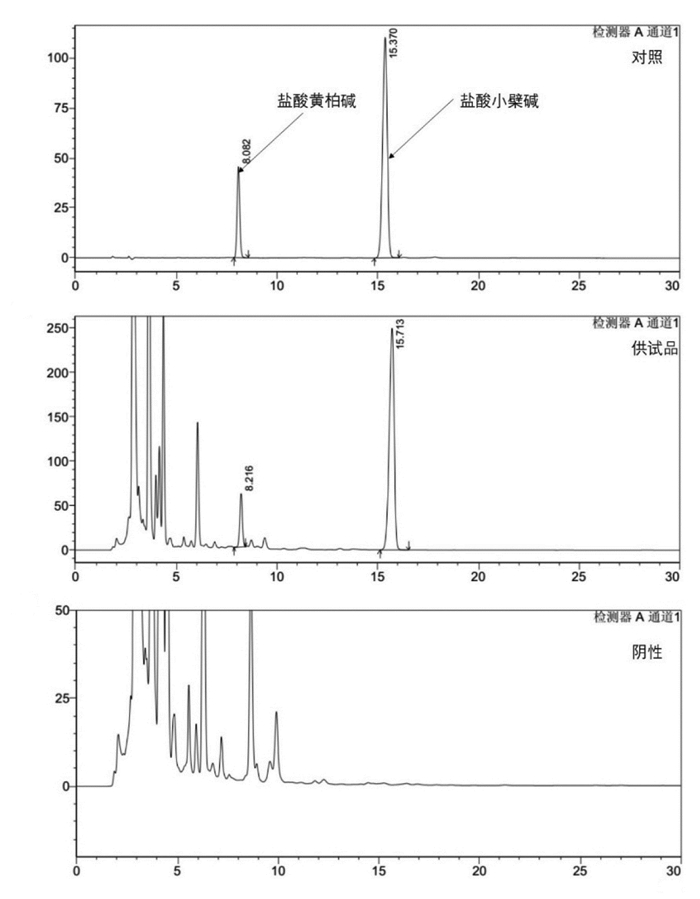
3 实验结果 3.1 中间体含量测定方法学研究供试品溶液色谱图中出现和对照品色谱图中特征峰保留时间一致的色谱峰,黄柏阴性样品溶液色谱图中无特征峰。供试品溶液色谱图中的特征峰分离度好,与相邻峰均能有效分离,且峰形对称,拖尾因子符合规定,理论塔板数以盐酸小檗碱计不少于4 000,方法专属性良好,结果见图 1。盐酸小檗碱在3.390 0~193.860 0 μg/mL线性关系良好,盐酸黄柏碱在3.570 0~101.920 0 μg/mL线性关系良好;仪器精密度、方法重复性、准确度均符合要求,详情见表 1。
|
| 图 1 专属性考察 |
提取工艺正交实验设计、实验结果及方差分析见OSID。
结果显示,最优提取工艺参数为料液比6∶1,乙醇浓度60%,提取次数2次,每次提取时间1.5 h。由于中药材在提取前期药材需浸润,同时实验中每个因素对工艺没有显著性影响,因此综合极差分析以及成本考虑,在第2次提取时采用5倍量溶媒提取,即加入6倍量的60%乙醇回流1.5 h,再加入5倍量的60%乙醇回流1.5 h,合并滤液即得。
3.2.2 验证实验结果表明,该提取工艺能最大化提取处方中盐酸小檗碱和盐酸黄柏碱的含量,且含量均一,工艺较稳定,重复性好,验证实验结果见表 2。
结果显示,黄柏、大黄、栀子鉴别过程中,供试品在与对照品或对照药材相应位置出现相同斑点,且阴性无斑点,结果见图 2。基于含量测定和薄层鉴别实验共同表明该提取工艺合理,能够最大化提取处方中各药材的有效成分。
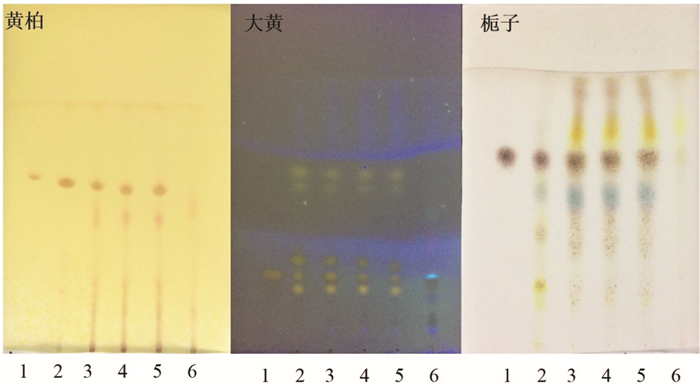
|
| 注:1.对照品,黄柏中对照为盐酸小檗碱,大黄中对照为大黄酸,栀子中对照为栀子苷;2.对照药材;3~5.供试品;6.阴性对照。 图 2 薄层色谱鉴别 |
实验结果表明,稠膏相对密度在1.22~1.27(80 ℃)时不附着容器,稠膏相对密度在1.28(80 ℃)时虽可与基质混合,但开始附着容器。因此,控制本品稠膏相对密度为1.22~1.27(80 ℃)。
3.3.2 基质材料选择研究压敏胶相较于橡胶膏,具有黏着力强、易剥离、稳定、外观佳、极少发生过敏反应等特点,因此选择BC-1型医用压敏胶作为基质材料。
3.3.3 基质的制备研究研究结果确定BC-1型医用压敏胶粘剂:乙酸乙酯比例为10∶1(g/g),此比例制备的基质易混合均匀,易涂布,乙酸乙酯用量少,且能快速挥发完全。
3.4 皮肤安全性研究 3.4.1 单次给药刺激性研究结果表明,4只大耳白兔在停止给药72 h内均未出现红斑、水肿等情况,故该批清热消肿止痛膏单次给药对兔皮肤未见明显肉眼可见的刺激反应发生,安全性良好,结果见图 3。
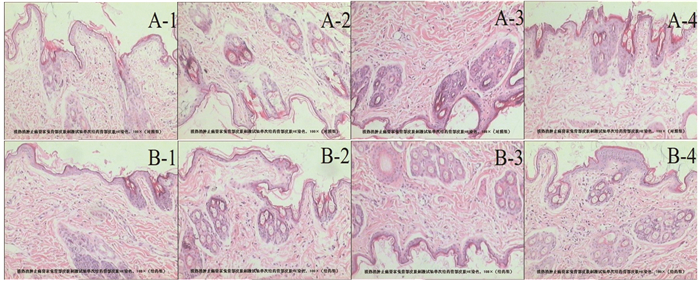
|
| 注:A.对照组;B.给药组。 图 3 单次给药刺激性实验HE染色结果(×100) |
结果表明,多次给药后4只大耳白兔在去除药物72 h内均未出现红斑、水肿等情况,因此该批清热消肿止痛膏多次给药对兔皮肤无明显肉眼可见的刺激反应,安全性良好,详见图 4。
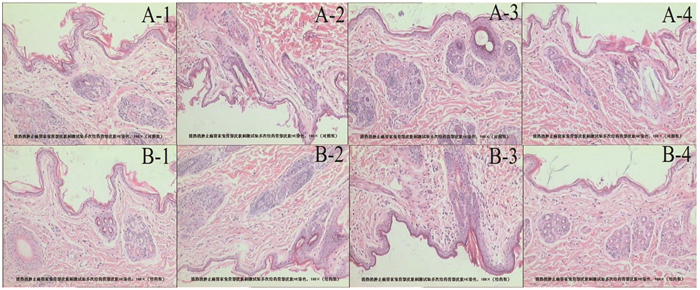
|
| 注:A.对照组;B.给药组。 图 4 多次给药刺激性实验HE染色结果(×100) |
结果表明,所有组别中的豚鼠均无休克、哮喘或站立不稳等严重的全身性过敏反应发生,体质量无显著增长;2,4-二硝基氯苯组激发给药6 h后,3只豚鼠出现轻度红斑,5只出现中度红斑,2只出现严重红斑,过敏反应发生率100%;激发给药24 h后观察,过敏反应的发生率达100%:发生中度红斑4只,发生严重红斑4只,发生水肿性红斑2只;激发给药48 h后观察,过敏反应的发生率达100%:发生轻度红斑4只,发生中度红斑2只,发生严重红斑4只,发生水肿性红斑2只;激发给药72 h后观察,过敏反应的发生率达80%:红斑情况消失2只,发生轻度红斑2只,发生中度红斑4只,发生严重红斑2只。清热消肿止痛膏组和生理盐水组均无任何过敏反应,过敏发生率为0。
4 结论中医认为急性痛风性关节炎属于“热痹”“历节”“痛风”范畴[20],中药治疗痛风性关节炎方法多样,疗效显著,有独特优势。其中,贴敷疗法最为常见,药物经皮肤可直达病灶,透过性好,起效快,使用快捷,可有效避免西医疗法给患者带来的毒副作用[21]。清热消肿止痛散历史悠久,在缓解关节疼痛和功能活动受限方面具有良好的临床疗效,碍于剂型的不足,极大限制了其临床应用。故本研究制备了清热消肿止痛膏,解决了其剂型的不足,建立了含量测定、薄层鉴别、含膏量、耐热性、黏附性、微生物限度等指标的质量标准,并进行了安全性评价,保证了成品质量和临床疗效的安全性。按本研究制备的清热消肿止痛膏有效成分含量高,膏面光泽度好,黏附性好,皮肤残留小,改善了原剂型药物释放不完全、使用不便等不足。新剂型制剂产品在加速实验条件下进行6个月稳定性考察,各项指标无明显变化,表明此制备工艺科学可靠,剂型性能稳定。
本研究基于中药在风湿、炎症等领域的优势,结合现代制剂技术,将临床效果较好的经验方开发成制剂产品,提高了本品的疗效,同时也为患者用药带来了方便,具有一定的社会效益,对于相关产品的开发具有一定的参考作用。
| [1] |
傅兴圣, 陈菲, 刘训红, 等. 大黄化学成分与药理作用研究新进展[J]. 中国新药杂志, 2011, 20(16): 1534-1538, 1568. FU X S, CHEN F, LIU X H, et al. Progress in research of chemical constituents and pharmacological actions of Rhubarb[J]. Chinese Journal of New Drugs, 2011, 20(16): 1534-1538, 1568. |
| [2] |
肖学凤, 乔晓莉, 高岚, 等. 黄柏中盐酸小檗碱的药代动力学研究[J]. 天津中医药大学学报, 2008, 27(4): 263-265. XIAO X F, QIAO X L, GAO L, et al. Pharmacokinetic study of berberine hydrochloride of cortex phellodendri in rat plasma[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2008, 27(4): 263-265. |
| [3] |
牧丹, 苏日那, 格根塔娜, 等. 栀子的化学成分与药理作用研究[J]. 中国疗养医学, 2015, 24(1): 34-36. MU D, SU R N, GE G T N, et al. Study on chemical constituents and pharmacological action of Gardenia Jasminoides Ellis[J]. Chinese Journal of Convalescent Medicine, 2015, 24(1): 34-36. |
| [4] |
王玉, 杨雪, 夏鹏飞, 等. 大黄化学成分、药理作用研究进展及质量标志物的预测分析[J]. 中草药, 2019, 50(19): 4821-4837. WANG Y, YANG X, XIA P F, et al. Research progress on chemical composition and pharmacological effects of Rhei Radix et Rhizoma and predictive analysis on quality markers[J]. Chinese Traditional and Herbal Drugs, 2019, 50(19): 4821-4837. DOI:10.7501/j.issn.0253-2670.2019.19.033 |
| [5] |
杨滢. 大黄药效成分及其药理活性研究进展[J]. 中医临床研究, 2018, 10(5): 142-144. YANG Y. A review on pharmacodynamic components and pharmacological activities of Rhei Radix et Rhizoma[J]. Clinical Journal of Chinese Medicine, 2018, 10(5): 142-144. DOI:10.3969/j.issn.1674-7860.2018.05.065 |
| [6] |
邢宇, 刘鑫, 林园, 等. 小檗碱药理作用及其临床应用研究进展[J]. 中国药理学与毒理学杂志, 2017, 31(6): 491-502. XING Y, LIU X, LIN Y, et al. Progress in pharmacological effects and clinical applications of berberine[J]. Chinese Journal of Pharmacology and Toxicology, 2017, 31(6): 491-502. DOI:10.3867/j.issn.1000-3002.2017.06.001 |
| [7] |
周松, 刘永刚, 张国祥, 等. 黄柏化学成分及质量控制研究进展[J]. 中国药房, 2012, 23(39): 3740-3742. ZHOU S, LIU Y G, ZHANG G X, et al. Research progress on chemical constituents and quality control of Phellodendron chinensis[J]. China Pharmacy, 2012, 23(39): 3740-3742. DOI:10.6039/j.issn.1001-0408.2012.39.33 |
| [8] |
项丽玲, 苗明三. 中药散剂的现代研究及思考[J]. 时珍国医国药, 2019, 30(11): 2720-2723. XIANG L L, MIAO M S. Modern Research and consideration on traditional Chinese medicine powder[J]. Lishizhen Medicine and Materia Medica Research, 2019, 30(11): 2720-2723. |
| [9] |
周欣欣, 罗贤强, 张俊清, 等. 中药散剂研究的现状[J]. 海南医学, 2019, 30(3): 392-394. ZHOU X X, LUO X Q, ZHANG J Q, et al. Present status of research on traditional Chinese medicine powder[J]. Hainan Medical Journal, 2019, 30(3): 392-394. DOI:10.3969/j.issn.1003-6350.2019.03.037 |
| [10] |
王海英, 陈永财, 周斌. 如意金黄散巴布剂制备及临床观察[J]. 中国医院药学杂志, 2010, 30(10): 876-877. WANG H Y, CHEN Y C, ZHOU B. Preparation and clinical observation of Ruyi Jinhuang powder Cataplasm[J]. Chinese Journal of Hospital Pharmacy, 2010, 30(10): 876-877. |
| [11] |
王法龙, 庞保珍, 庞清洋, 等. 中药巴布剂的研究概况与展望[J]. 光明中医, 2014, 29(4): 876-882. WANG F L, PANG B Z, PANG Q Y, et al. Research situation and prospect of cataplasm[J]. Guangming Journal of Chinese Medicine, 2014, 29(4): 876-882. DOI:10.3969/j.issn.1003-8914.2014.04.120 |
| [12] |
刘江亭, 李慧芬, 崔伟亮. 川黄柏、关黄柏饮片和水煎液中3种生物碱含量的比较研究[J]. 山东中医药大学学报, 2013, 37(5): 437-438, 441. LIU J T, LI H F, CUI W L. Comparison of three kinds of alkaloid in decocting pieces and decoction of Phellodendri Chinensis Cortex and Phellodendri Amurensis Cortex[J]. Journal of Shandong University of Traditional Chinese Medicine, 2013, 37(5): 437-438, 441. |
| [13] |
徐玉玲, 吴南轩, 李鹏程, 等. 基于化学成分临床利用量的不同产地黄柏质量评价[J]. 中国测试, 2016, 42(12): 45-48. XU Y L, WU N X, LI P C, et al. Study on quality evaluation for Cortex Phellodendri from different habitats based on the clinical dosage of chemical composition[J]. China Measurement & Test, 2016, 42(12): 45-48. DOI:10.11857/j.issn.1674-5124.2016.12.010 |
| [14] |
李卿, 梁旭明, 杜洪飞, 等. 正交试验法优化痛风消颗粒水提醇沉工艺[J]. 中国药房, 2016, 27(4): 518-521. LI Q, LIANG X M, DU H X, et al. Optimization of water extraction and alcohol precipitation technology of Tongfengxiao Granules by orthogonal test[J]. China Pharmacy, 2016, 27(4): 518-521. |
| [15] |
张青青, 余胜民, 黄琳芸, 等. 壮药香花护乳凝胶剂皮肤刺激性实验研究[J]. 时珍国医国药, 2013, 24(2): 300-301. ZHANG Q Q, YU S M, HUANG L Y, et al. Experimental study on skin irritation of Zhuangyao Xianghua Hufu Gel[J]. Lishizhen Medicine and Materia Medica Research, 2013, 24(2): 300-301. DOI:10.3969/j.issn.1008-0805.2013.02.020 |
| [16] |
季荣进, 魏伟, 李万红. 温面散对兔皮肤刺激性试验研究[J]. 临床合理用药杂志, 2013, 6(35): 82-83. JI R J, WEI W, LI W H. Experimental study on skin irritation of Wenmian Power in rabbits[J]. Chinese Journal of Clinical Rational Drug Use, 2013, 6(35): 82-83. |
| [17] |
《中药、天然药物免疫毒性(过敏性、光过敏反应)研究的技术指导原则》课题研究组. 中药、天然药物免疫毒性(过敏性、光过敏反应)研究的技术指导原则[M]. 北京: 国家食品药品监督管理局药品审评中心, 2005: 11. Research group of |
| [18] |
《中药、天然药物局部刺激性和溶血性-研究技术指导原则》课题研究组. 中药、天然药物刺激性和溶血性研究的技术指导原则[M]. 北京: 国家食品药品监督管理局药品审评中心, 2005: 11-20. Research group of |
| [19] |
雷静. 动物源胶原蛋白免疫原性清除及其医学应用[D]. 广州: 暨南大学, 2015. LEI J. Mmunogenicity clearanceof animal-based collagen and preclinical applications[D]. Guangzhou: Jinan University, 2015. |
| [20] |
王诗源, 孟庆岩, 颜培正, 等. 中药复方治疗急性痛风性关节炎临床研究进展[J]. 山东中医药大学学报, 2019, 43(1): 107-109. WANG S Y, MENG Q Y, YAN P Z, et al. Clinical research progress of traditional Chinese medicine in the treatment of acute gouty arthritis[J]. Journal of Shandong University of Traditional Chinese Medicine, 2019, 43(1): 107-109. |
| [21] |
熊阳春, 何克剑, 侯晓强. 如意金黄散穴位贴敷治疗痛风性关节炎(湿热蕴结证)的临床疗效[J]. 中国中医急症, 2018, 27(10): 1835-1837. XIONG Y C, HE K J, HOU X Q. Clinical effect of Ruyi Jinhuang powder Acupoint Application on gouty arthritis (damp heat accumulation syndrome)[J]. Journal of Emergency in Traditional Chinese Medicine, 2018, 27(10): 1835-1837. DOI:10.3969/j.issn.1004-745X.2018.10.044 |
 2021, Vol. 40
2021, Vol. 40