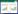文章信息
- 李丽, 孙立丽, 任晓亮, 刘亚男, 窦志英, 刘虹
- LI Li, SUN Lili, REN Xiaoliang, LIU Yanan, DOU Zhiying, LIU Hong
- 基于关联分析的吴茱萸与8味甘味药配伍作用规律研究
- Study on the compatibility of Euodia rutaecarpa with 8 sweet-taste herbs based on association analysis
- 天津中医药大学学报, 2021, 40(6): 770-777
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(6): 770-777
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.06.20
-
文章历史
收稿日期: 2021-08-20
2. 天津中医药大学中医药研究院天津市现代中药重点实验室, 天津 301617
2. Tianjin State Key Laboratory of Modern Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
吴茱萸始载于《神农本草经》,列为中品,有小毒,为芸香科植物吴茱萸Euodia rutaecarpa(Juss.)Benth.、石虎吴茱萸 Euodia rutaecarpa(Juss.)Benth. var officinalis(Dode)Huang或疏毛吴茱萸Euodia rutaecarpa(Juss.)Benth. var. bodinieri(Dode)Huang的干燥近成熟果实[1]。研究表明,吴茱萸具有良好的镇痛、抗炎、抗肿瘤等多种药理学活性[2-4]。吴茱萸中含有生物碱类、苦味素类、挥发油类等多种化学成分,其中生物碱类成分是其主要有效成分[5-8],发挥作用的同时,本身也具有一定的毒副作用。近年来,临床上关于吴茱萸不良反应的报道日益增多,蔡雪映[9]等曾报道过服用吴茱萸过量致死的个案,并在该患者血中检测出了吴茱萸生物碱。Wen Bo[10]等通过体外实验发现,吴茱萸碱、吴茱萸次碱能够抑制人肝微粒体CYP3A4,是肝毒性的潜在物质。
鉴于对吴茱萸毒性的认识,明代《景岳全书》曾记载“……然其性苦善降,若气陷而元气虚者,当以甘补诸药制而用之”。故吴茱萸常与甘草、人参、大枣等配伍,以甘缓之,防气虚气陷[11]。本研究通过关联规则分析,获取常与吴茱萸配伍使用的甘味中药,通过高效液相色谱法分析配伍过程中吴茱萸3种主要成分吴茱萸碱、吴茱萸次碱、柠檬苦素的含量变化,以期为吴茱萸配伍机制研究提供参考。
1 材料Agilent 1260高效液相色谱仪(美国Agilent公司);Waters XSelect HSS T3色谱柱(美国Waters公司);DV215CD十万分之一天平(奥豪斯仪器有限公司);FA2004万分之一天平(上海舜宇恒平科学仪器有限公司);Mili-Q Advantage A10超纯水仪(美国Miliqore公司);H2016D高速离心机(上海知信实验仪器技术有限公司);KDM调温电热套(北京永兴精佳仪器有限公司)。
吴茱萸(产地:江西),购自安国市兴华中药材有限公司,并经天津中医药大学李天祥教授鉴定为芸香科植物吴茱萸Euodia rutaecarpa(Juss.)Benth.,本实验所使用的药材为当归、甘草、炙甘草、生地黄、熟地黄、人参、茯苓、黄芪均购于北京同仁堂药店;吴茱萸碱(批号:1222B024,≥98%)、吴茱萸次碱(批号:831A023,≥98%)购于北京索莱宝科技有限公司;柠檬苦素(批号:D1216AS,>98%)购于大连美仑生物技术有限公司。色谱级甲醇、乙腈购自美国Sigma公司,色谱级甲酸购于天津科密欧化学试剂有限公司。
2 方法与结果 2.1 基于关联分析的吴茱萸药对配伍规律研究 2.1.1 关联分析关联分析是一种频繁模式的数据挖掘分析方法,在中药用药规律分析中具有广泛应用[12-13]。Apriori算法是关联分析中最经典的原创性算法,通过逐层扫描计算、分类等步骤,从大量数据中分析寻找事务之间存在的潜在关联和规律[14],并以“X→Y”关系式的形式展示,X与Y分别称为关联规则的前项和后项[15]。
将《中华人民共和国药典》2015版及部分古籍(包括伤寒论、金匮要略、妇人良方、千金方、景岳全书、太平惠民和剂局方、直指附遗方论、丹溪心法)中收载的含有吴茱萸的处方作为数据来源,并结合中药方剂数据库整理统计吴茱萸及其配伍的中药,其中配伍药物的生品和炮制品均分别使用生品名称和炮制品名称分开统计。以IBM SPSS Modeler 18.0作为分析软件,采用Apriori算法以吴茱萸为关联后项进行关联分析。将最低条件支持度设置为10,最小规则置信度设置为95%,关联得到21个吴茱萸药对,如表 1所示。表中21味中药均可以与吴茱萸关联为药对配伍使用,经统计发现上述药物总频次占所统计的配伍药物(不包含吴茱萸)总频次的37.82%。
采用模糊聚类分析统计方法,对可与吴茱萸关联为药对的21味配伍中药的组分类型进行规律挖掘分析,以期从药物组分水平对吴茱萸配伍规律进行阐述。表 2描述了配伍中药的组分信息。依托SPSS Statistic 19.0统计软件,选用Euclidean Distance为测度,以Ward法为类间距离计算方法,采用层次聚类法对样本进行聚类分析,树状图如图 1所示,当以16为界限时,21味配伍中药聚为2类,一类为甘味中药(除白芍、醋延胡索之外),其主要成分为多糖、皂苷等;另一类为非甘味中药。“甘”为中药五味之一,具有能补、能缓、能和等功效,在中药配伍中具有重要地位,基于聚类分析结果,本研究开展了当归、甘草、炙甘草、生地黄、熟地黄、人参、茯苓、黄芪8味甘味中药在配伍过程中对吴茱萸的作用规律研究。
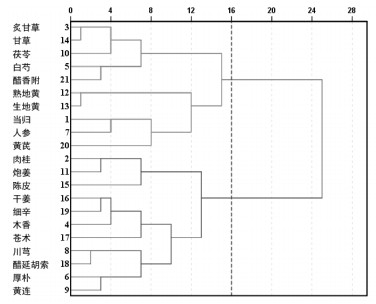
|
| 图 1 配伍药物聚类分析树状图 |
单味药供试品溶液的制备:称取吴茱萸药材约2 g,料液比为10,加水浸泡30 min后,回流提取1 h,过滤,4 ℃冰箱环境中静置24 h,8 000 r/min离心15 min,沉淀物中加入2 mL乙醇并超声20 min溶解,0.45 μm微孔滤膜过滤,取续滤液,即得。
配伍药对供试品溶液的制备:称取吴茱萸药材和甘味中药各约2 g,料液比为10(另加甘味中药的吸水量),浸泡30 min,加热回流1 h,过滤,4 ℃冰箱环境中静置24 h,8 000 r/min离心15 min,沉淀物中加入2 mL乙醇并超声20 min溶解,0.45 μm微孔滤膜过滤,取续滤液,即得。
2.2.2 对照品溶液的制备分别取柠檬苦素、吴茱萸碱和吴茱萸次碱适量,精密称定,置于容量瓶中,甲醇溶解,分别配置成浓度为0.94、1.12、0.46 mg/mL的对照品储备液。
2.2.3 色谱条件色谱柱:Waters XSelect® HSS T3(4.6 mm×250 mm,5 μm);流动相:0.1%甲酸水溶液(A)-乙腈(B);等度洗脱:A:B=43:57;检测波长:215 nm;柱温:35 ℃;流速:1 mL/min;进样量:10 μL;色谱图见图 2。
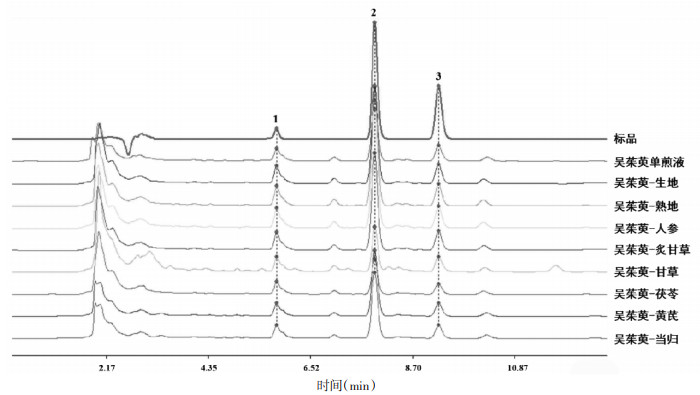
|
| 图 2 吴茱萸及其配伍药对高效液相色谱图 |
分别称取柠檬苦素、吴茱萸碱和吴茱萸次碱对照品适量,精密称定,置容量瓶中,甲醇溶解定容,得到浓度分别为0.94、1.12、0.46 mg/mL的对照品储备液。取对照品储备液适量,用甲醇逐级稀释成一系列不同浓度的对照品溶液。按“2.2.3”项下色谱条件,进样分析。以对照品浓度(mg/mL)为横坐标(X)、峰面积(mAU×s)为纵坐标(Y)进行线性回归分析,得到回归方程、相关系数及线性范围。结果显示柠檬苦素的标准曲线为Y=2 996.10X-34.27(r=0.999 8;0.094~0.0147 mg/mL);吴茱萸碱的标准曲线为Y=22 130.10X+318.11(r= 0.999 6;1.12~0.008 7 mg/mL);吴茱萸次碱的标准曲线为Y=21 922.53X-9.05(r=1;0.46~0.007 1 mg/mL),表明3种成分在其线性范围内线性关系良好。
2.3.2 精密度考察取同一个吴茱萸样本溶液按“2.2.3”项下色谱条件,连续进样6针,记录色谱图,计算成分峰的相对保留时间和相对峰面积。柠檬苦素、吴茱萸碱和吴茱萸次碱的相对保留时间RSD值分别为0.00%、0.003%、0.004%;相对峰面积RSD值分别为0.00%、0.45%、0.29%,表明仪器精密度良好。
2.3.3 重复性考察取同一个吴茱萸样本,按“2.2.1”项下吴茱萸供试品溶液的制备方法平行制备6份吴茱萸溶液,按“2.2.3”项下色谱条件,检测3种成分在提取物中的含有量,并计算RSD值。柠檬苦素、吴茱萸碱和吴茱萸次碱含有量的RSD值分别为2.33%、3.53%、3.06%,表明方法重复性良好。
2.3.4 稳定性考察取同一个吴茱萸样本,照“2.2.3”项下色谱条件,分别与0、2、4、8、12和24 h进样,记录色谱图,并计算成分峰的相对保留时间和相对峰面积。柠檬苦素、吴茱萸碱和吴茱萸次碱的相对保留时间RSD值分别为0.00%、0.06%、0.12%;相对峰面积RSD值分别为0.00%、1.68%、1.62%,表明样品在24 h内稳定性良好。
2.3.5 加样回收率实验分别称取6份吴茱萸样品各约2 g,精密称定,置于圆底烧瓶中,分别加入一定量的对照品,按照“2.2.1”项下方法制备供试品溶液进行检测并计算各成分的加样回收率。柠檬苦素、吴茱萸碱和吴茱萸次碱的平均回收率±SD(RSD)分别为101.31% ±0.03%(2.74%)、99.60% ±0.03%(2.60%)、102.50%±0.01%(0.61%),表明该方法准确度良好。
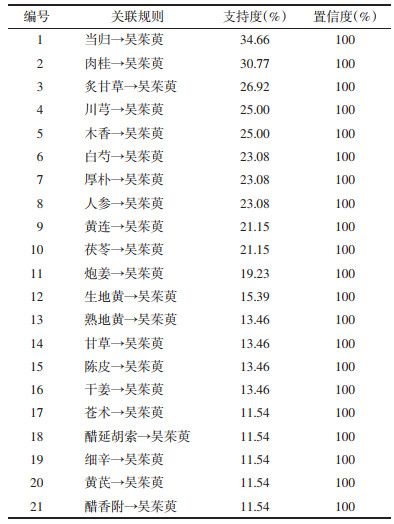
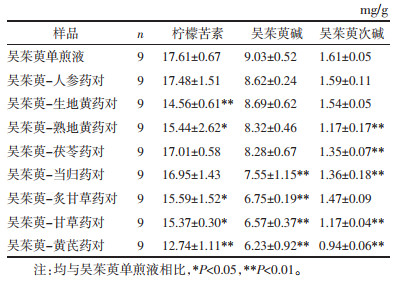
2.4 提取物中含量检测结果检测了与甘味中药配伍前后吴茱萸中柠檬苦素、吴茱萸碱、吴茱萸次碱3种化学成分在提取物中含量的变化,结果见表 3。方差分析结果P < 0.05,各组数据之间具有统计学差异。由表 3得到3种成分平均含量比例转换表,并绘制雷达图,见表 4和图 3。结果显示,在配伍过程中,8味甘味中药可不同程度地降低柠檬苦素、吴茱萸碱和吴茱萸次碱3种主要成分在提取物中的含量。其中,黄芪使3种有效成分的含量明显下降;甘草较大程度地降低了吴茱萸碱和吴茱萸次碱的含量,但对柠檬苦素的作用较小。
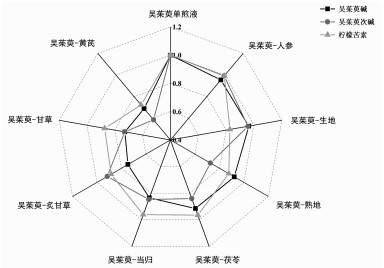
|
| 图 3 吴茱萸单煎液及药对3种成分平均含量雷达图 |
本实验通过关联分析和聚类分析结合含量测定,探讨吴茱萸与甘味中药配伍前后吴茱萸中3种主要成分柠檬苦素、吴茱萸碱和吴茱萸次碱在提取物中含量的变化。结果显示,8种甘味中药均可不同程度的降低吴茱萸提取物中3种主要成分的含量;黄芪使提取物3种有效成分的含量明显下降,甘草可明显地降低提取物中吴茱萸碱和吴茱萸次碱的含量但对柠檬苦素的作用较小。
《素问· 藏气法时论》记载:“肝苦急,急食甘以缓之;脾欲缓,急食甘以缓之,用苦泻之,甘补之”,甘味药具有缓急、佐制的作用,可缓和药物峻烈之性,缓解药物毒性。《本草正义》也提出“解毒者,甘为土之正味,凡毒得土则化,故大甘之味可以解毒”[44-45]。研究发现,甘味药中带有多个极性基团,能与复方中其他药物的相关基团发生氢键键合、络合与缔合,共价键缩合,形成更大的超分子集团,使这些药物的特性基团结构形态发生改变,到达病灶后通过缓慢分解,放出有效的功能基与病灶作用,进而降低与病灶作用的强度,或者抑制其副作用,或使药物疗效保持更长的时间。吴茱萸中含有大量的生物碱,可与甘味药中的极性基团结合形成糖苷,以降低生物碱的毒性[46]。
| [1] |
国家药典委员会. 中华人民共和国药典(一部)[S]. 北京: 中国医药科技出版社, 2015: 171-172. National Pharmacopoeia Commission. The Pharmacopoeia of the People's Republic of China (Part One)[S]. Beijing: China Medical Science and Technology Press, 2015: 171-172. |
| [2] |
ZHANG T, QU S, SHI Q, et al. Evodiamine induces apoptosis and enhances TRAIL-induced apoptosis in human bladder cancer cells through mTOR/S6K1-mediated downregulation of Mcl-1[J]. International Journal of Molecular Sciences, 2014, 15(2): 3154-3171. DOI:10.3390/ijms15023154 |
| [3] |
龚慕辛, 王智民, 张启伟, 等. 吴茱萸有效成分的药理研究进展[J]. 中药新药与临床药理, 2009, 20(2): 183-187. GONG M X, WANG Z M, ZHANG Q W, et al. The pharmacological research progress of the effective ingredients of Evodia edulis[J]. Chinese New Drugs and Clinical Pharmacology, 2009, 20(2): 183-187. DOI:10.3321/j.issn:1003-9783.2009.02.029 |
| [4] |
战光绪, 吴大正, 胡之璧. 吴茱萸有效成分的药理研究进展[J]. 上海中医药杂志, 2006, 40(2): 62-64. ZHAN G X, WU D Z, HU Z B. Advancement of pharmacological research on the effective components in Fructus evodiae[J]. Shanghai Journal of Traditional Chinese Medicine, 2006, 40(2): 62-64. DOI:10.3969/j.issn.1007-1334.2006.02.028 |
| [5] |
罗丹, 颜行. 吴茱萸次碱: 一种多靶点天然化合物的药理学作用研究进展[J]. 天然产物研究与开发, 2018, 30(12): 2207-2213. LUO D, YAN X. Pharmacological effects of Rutaecarpine as multi-targets nature compound[J]. Natural Product Research and Development, 2018, 30(12): 2207-2213. |
| [6] |
余奇, 郭澄, 程泽能. 吴茱萸次碱的研究进展[J]. 药学实践杂志, 2007, 25(6): 353-357. YU Q, GUO C, CHENG Z N. Current advances in the study on Rutaecarpine[J]. Journal of Pharmaceutical Practice, 2007, 25(6): 353-357. DOI:10.3969/j.issn.1006-0111.2007.06.001 |
| [7] |
龙明立, 张毅民, 贺丽平, 等. 吴茱萸次碱的药理学研究进展[J]. 解放军药学学报, 2008, 24(6): 528-531. LONG M L, ZHANG Y M, HE L P, et al. The pharmacological research progress of evodiaceine[J]. Pharmaceutical Journal of Chinese People's Liberation Army, 2008, 24(6): 528-531. |
| [8] |
黄伟, 赵燕, 孙蓉. 吴茱萸不同组分对小鼠急性毒性试验比较研究[J]. 中国药物警戒, 2010, 7(3): 129-134. HUANG W, ZHAO Y, SUN R. Experimental comparis on study on mice's acute toxicity of different composition in Evodia fructus[J]. Chinese Pharmacovigilance, 2010, 7(3): 129-134. DOI:10.3969/j.issn.1672-8629.2010.03.001 |
| [9] |
蔡雪映, 孟楠, 杨冰. 服用吴茱萸过量致中毒1例分析[J]. 北京中医, 2006, 25(3): 171-172. CAI X Y, MENG N, YANG B. Analysis of 1 case of poisoning caused by overdose of Evodia fructus[J]. Beijing Journal of Traditional Chinese Medicine, 2006, 25(3): 171-172. |
| [10] |
WEN B, ROONGTA V, LIU L, et al. Metabolic activation of the indoloquinazoline alkaloids evodiamine and rutaecarpine by human liver microsomes: dehydrogenation and inactivation of cytochrome P450 3A4[J]. Drug Metabolism and Disposition, 2014, 42(6): 1044-1054. DOI:10.1124/dmd.114.057414 |
| [11] |
张智华, 韩晗, 吴晓丰, 等. 吴茱萸常用药对及其配伍增效减毒[J]. 湖北中医药大学学报, 2018, 20(3): 51-54. ZHANG Z H, HAN H, WU X F, et al. Couplet medicines, compatibility synergism and detoxification of Wu Zhuyu[J]. Journal of Hubei University of Traditional Chinese Medicine, 2018, 20(3): 51-54. DOI:10.3969/j.issn.1008-987x.2018.03.13 |
| [12] |
孙梅, 闵丽, 孙瑶, 等. 基于数据挖掘的6种疼痛病方剂用药规律比较研究[J]. 中国中药杂志, 2019, 44(8): 1682-1688. SUN M, MIN L, SUN Y, et al. Medication regularities of traditional Chinese medicine formulas for six kinds of pains by data-mining approach[J]. Chinese Journal of Chinese Materia Medica, 2019, 44(8): 1682-1688. |
| [13] |
刘保松, 彭孟凡, 冯素香, 等. 基于数据挖掘分析槐花用药配伍规律[J]. 中药材, 2019, 42(6): 1454-1459. LIU B S, PENG M F, FENG S X, et al. Analyzing the compatibility law of Sophora japonica based on data mining[J]. Chinese Materia Medica, 2019, 42(6): 1454-1459. |
| [14] |
刘花. 基于Apriori算法的关联分析[J]. 信息与电脑(理论版), 2019, 31(19): 132-133. LIU H. Association analysis based on Apriori algorithm[J]. Information and Computer (Theory Edition), 2019, 31(19): 132-133. |
| [15] |
齐卓操, 唐德才, 尹刚, 等. 基于数据挖掘的古今医方辨治消化系统肿瘤用药规律研究[J]. 中草药, 2019, 50(22): 5632-5638. QI Z C, TANG D C, YIN G, et al. Research on drug use rules of ancient and modern medical prescriptions for differentiation and treatment of digestive system tumors based on data mining[J]. Chinese Herbal Medicine, 2019, 50(22): 5632-5638. DOI:10.7501/j.issn.0253-2670.2019.22.034 |
| [16] |
董晴, 陈明苍. 当归化学成分及药理作用研究进展[J]. 亚太传统医药, 2016, 12(2): 32-34. DONG Q, CHEN M C. Chemical composition and pharmacological research progress of Angelica[J]. Asia-Pacific Traditional Medicine, 2016, 12(2): 32-34. |
| [17] |
牛莉, 于泓苓. 中药当归的化学成分分析与药理作用研究[J]. 中西医结合心血管病电子杂志, 2018, 6(21): 90-92. NIU L, YU H L. Chemical constituents and pharmacological effects of Angelica sinensis[J]. Electronic Journal of Integrated Traditional Chinese and Western Medicine Cardiovascular Diseases, 2018, 6(21): 90-92. DOI:10.3969/j.issn.2095-6681.2018.21.067 |
| [18] |
陈旭, 刘畅, 马宁辉, 等. 肉桂的化学成分、药理作用及综合应用研究进展[J]. 中国药房, 2018, 29(18): 2581-2584. CHEN X, LIU C, MA N H, et al. Research progress of chemical components and pharmacological acticities of Cinnamomum cassia leaves[J]. China Pharmacy, 2018, 29(18): 2581-2584. DOI:10.6039/j.issn.1001-0408.2018.18.29 |
| [19] |
张笮晦, 童永清, 黄广智, 等. 肉桂叶化学成分及药理作用研究进展[J]. 广州化工, 2019, 47(1): 20-22. ZHANG Z H, TONG Y Q, HUANG G Z, et al. Research progress on chemical components and pharmacological acticities of Cinnamomum cassia leaves[J]. Guangzhou Chemical Industry, 2019, 47(1): 20-22. DOI:10.3969/j.issn.1001-9677.2019.01.010 |
| [20] |
马鸿雁, 邓雨娇, 马倩, 等. 甘草的研究概况[J]. 中药与临床, 2018, 9(1): 59-62. MA H Y, DENG Y J, MA Q, et al. Research overview of licorice[J]. Pharmacy and Clinics of Chinese Materia Medica, 2018, 9(1): 59-62. |
| [21] |
唐亚芳, 杨岸新. 中药川芎的有效成分及其药理作用研究[J]. 中国现代药物应用, 2018, 12(10): 219-220. TANG Y F, YANG A X. Study on the effective ingredients and pharmacological effects of the traditional Chinese medicine Chuanxiong[J]. China Modern Medicine Application, 2018, 12(10): 219-220. |
| [22] |
韩炜. 川芎的化学成分与药理作用研究进展[J]. 中国现代中药, 2017, 19(9): 1341-1349. HAN W. Advances in chemical constituents and pharmacological effects of Ligusticum chuanxiong[J]. China Modern Chinese Medicine, 2017, 19(9): 1341-1349. |
| [23] |
徐珍珍, 樊旭蕾, 王淑美. 木香化学成分及挥发油提取的研究进展[J]. 广东化工, 2017, 44(3): 77-78. XU Z Z, FAN X L, WANG S M. Chemical components and advances in research progress of extracting volatile oil from Aucklandiae Lappa Decne[J]. Guangdong Chemical Industry, 2017, 44(3): 77-78. DOI:10.3969/j.issn.1007-1865.2017.03.035 |
| [24] |
李岩. 白芍及其化学成分的药理研究进展[J]. 职业与健康, 2015, 31(15): 2153-2156. LI Y. Progress of pharmacological research on Radix Paeoniae Alba and its chemical constituents[J]. Occupation and Health, 2015, 31(15): 2153-2156. |
| [25] |
杨晓帆. 白芍有效成分的研究进展[J]. 广州化工, 2015, 43(20): 50-51. YANG X F. Research progress on effective constituents of Radix Paeoniae Alba[J]. Guangzhou Chemical Industry, 2015, 43(20): 50-51. DOI:10.3969/j.issn.1001-9677.2015.20.018 |
| [26] |
荆文光, 杜杰, 王继永, 等. 厚朴化学成分研究进展[J]. 中国现代中药, 2018, 20(6): 764-774. JING W G, DU J, WANG J Y, et al. Review on the chemical constituents of Magnolia Officinalis Cortex[J]. Modern Chinese Materia Medica, 2018, 20(6): 764-774. |
| [27] |
宋齐. 人参化学成分和药理作用研究进展[J]. 人参研究, 2017, 29(2): 47-54. SONG Q. Research progress on the chemical constituents of Panax ginseng and their pharmacological effects[J]. Ginseng Research, 2017, 29(2): 47-54. |
| [28] |
姚梦杰, 吕金朋, 张乔, 等. 人参化学成分及药理作用研究[J]. 吉林中医药, 2017, 37(12): 1261-1263. YAO M J, LYV J P, ZHANG Q, et al. Study on the chemical constituents and pharmacological effects of ginseng[J]. Jilin Journal of Traditional Chinese Medicine, 2017, 37(12): 1261-1263. |
| [29] |
盖晓红, 刘素香, 任涛, 等. 黄连的化学成分及药理作用研究进展[J]. 中草药, 2018, 49(20): 4919-4927. GE X H, LIU S X, REN T, et al. Research progress on the chemical constituents of Coptis Rhizoma and its pharmacological activities[J]. Chinese Herbal Medicine, 2018, 49(20): 4919-4927. DOI:10.7501/j.issn.0253-2670.2018.20.032 |
| [30] |
陈瑞, 吴云, 田维毅. 黄连化学成分及其影响相关代谢途径的研究进展[J]. 湖南中医杂志, 2016, 32(4): 190-192. CHEN R, WU Y, TIAN W Y. Research progress on the chemical constituents of Coptis and its influence on related metabolic pathways[J]. Hunan Journal of Traditional Chinese Medicine, 2016, 32(4): 190-192. |
| [31] |
崔鹤蓉, 王睿林, 郭文博, 等. 茯苓的化学成分、药理作用及临床应用研究进展[J]. 西北药学杂志, 2019, 34(5): 694-700. CUI H R, WANG R L, GUO W B, et al. Research advances in chemical components, pharmacological activities and clinical application of Poria cocos[J]. Northwest Pharmaceutical Journal, 2019, 34(5): 694-700. DOI:10.3969/j.issn.1004-2407.2019.05.029 |
| [32] |
卢传坚. 姜的化学成分分析研究概述[J]. 中药新药与临床药理, 2003, 14(3): 215-217. LU C J. Overview of the research on the analysis of chemical components of Zingiber offcinale Roscoe[J]. Chinese New Drugs and Clinical Pharmacology, 2003, 14(3): 215-217. DOI:10.3321/j.issn:1003-9783.2003.03.028 |
| [33] |
张科卫, 马彩霞, 缪六舒. 干姜、炮姜中成分的比较[J]. 中成药, 2014, 36(6): 1254-1260. ZHANG K W, MA C X, MIAO L S. Determination of several compounds in dried ginger and processed ginger from different habitats[J]. Chinese Patent Medicine, 2014, 36(6): 1254-1260. DOI:10.3969/j.issn.1001-1528.2014.06.031 |
| [34] |
黄桢, 朱俏峭, 戚进, 等. 地黄的化学成分研究[J]. 海峡药学, 2016, 28(7): 34-36. HUANG Z, ZHU Q Q, QI J, et al. Chemical constituents of Radix Rehmannia[J]. Strait Pharmacy, 2016, 28(7): 34-36. DOI:10.3969/j.issn.1006-3765.2016.07.013 |
| [35] |
杨洁. 陈皮化学成分的研究[D]. 长春: 吉林大学, 2013. YANG J. Study on the chemical composition from Citri Reticulatae Pericarpium[D]. Changchun: Jilin University, 2013. |
| [36] |
亓雪, 张颖颖. 干姜的化学、药理研究进展[J]. 山东化工, 2018, 47(14): 41-42. QI X, ZHANG Y Y. Progress in chemistry and pharmacological research of Ginger[J]. Shandong Chemical Industry, 2018, 47(14): 41-42. DOI:10.3969/j.issn.1008-021X.2018.14.015 |
| [37] |
邓爱平, 李颖, 吴志涛, 等. 苍术化学成分和药理的研究进展[J]. 中国中药杂志, 2016, 41(21): 3904-3913. DENG A P, LI Y, WU Z T, et al. Advances in studies on chemical compositions of Atractylodes lancea and their biological activities[J]. Chinese Journal of Chinese Materia Medica, 2016, 41(21): 3904-3913. |
| [38] |
冯自立, 赵正栋, 刘建欣. 延胡索化学成分及药理活性研究进展[J]. 天然产物研究与开发, 2018, 30(11): 2000-2008. FENG ZI L, ZHAO ZH D, LIU J X. Research progress on chemical components and pharmacological effects of Corydalis yanhusuo[J]. Natural Products Research and Development, 2018, 30(11): 2000-2008. |
| [39] |
唐逸丰. 延胡索化学成分与药理作用研究概况[J]. 中医临床研究, 2018, 10(23): 144-146. TANG Y F. A study on chemical composition and pharmacological action of Yanhusuo[J]. Clinical Research of Traditional Chinese Medicine, 2018, 10(23): 144-146. DOI:10.3969/j.issn.1674-7860.2018.23.069 |
| [40] |
王晓丽, 金礼吉, 续繁星, 等. 中草药细辛研究进展[J]. 亚太传统医药, 2013, 9(7): 68-71. WANG X L, JIN L J, XU F X, et al. Research progress of Chinese herbal-Asarum[J]. Asia-Pacific Traditional Medicine, 2013, 9(7): 68-71. DOI:10.3969/j.issn.1673-2197.2013.07.031 |
| [41] |
孙政华, 邵晶, 郭玫. 黄芪化学成分及药理作用研究进展[J]. 中医临床研究, 2015, 7(25): 22-25. SUN Z H, SHAO J, GUO M. A review on chemical components and pharmacological effects of Huangqi[J]. Clinical Research of Traditional Chinese Medicine, 2015, 7(25): 22-25. DOI:10.3969/j.issn.1674-7860.2015.25.009 |
| [42] |
聂娟, 谢丽华, 马港圆, 等. 中药黄芪的化学成分及药理作用研究进展[J]. 湖南中医杂志, 2018, 34(7): 228-231. NIE J, XIE L H, MA G Y, et al. Research progress on chemical constituents and pharmacological effects of astragalus, a traditional Chinese medicine[J]. Hunan Journal of Traditional Chinese Medicine, 2018, 34(7): 228-231. |
| [43] |
陈志坚, 璇胡, 刘国道. 香附的化学成分及药理作用研究进展[J]. 安徽农业科学, 2017, 36(45): 113-115. CHEN Z J, XUAN H, LIU G D. Research progress on chemical constituents and pharmacological activities of Cyperus rotundus[J]. Journal of Anhui Agricultural Sciences, 2017, 36(45): 113-115. |
| [44] |
严永清, 吴建新. 药物的甘味与归经、作用及化学成分的关系[J]. 中药通报, 1988, 13(5): 52-55. YAN Y Q, WU J X. The relationship between the sweet taste of the drug and its meridian, function and chemical composition[J]. Chinese Materia Medica Bulletin, 1988, 13(5): 52-55. |
| [45] |
杨熠文, 杨柏灿. 甘草甘缓实质探究[J]. 中医药信息, 2019, 36(6): 55-59. YANG Y W, YANG B C. Exploration research on the essence of the mitigatory property of Licorice by its sweet flavor[J]. Information on Traditional Chinese Medicine, 2019, 36(6): 55-59. DOI:10.3969/j.issn.1005-5304.2019.06.012 |
| [46] |
洪宗国, 程望元. 甘味药的疗效及其化学基础[J]. 中医药学刊, 2003, 21(9): 1594-1595. HONG Z G, CHENG W Y. The curative effect of sweet medicine and its chemical basis[J]. Journal of Traditional Chinese Medicine, 2003, 21(9): 1594-1595. DOI:10.3969/j.issn.1673-7717.2003.09.108 |
 2021, Vol. 40
2021, Vol. 40