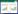文章信息
- 夏娟, 张书春, 代紫阳, 王亚
- XIA Juan, ZHANG Shuchun, DAI Ziyang, WANG Ya
- 姜黄素通过抑制NF-κB信号通路减轻高糖致H9C2心肌细胞损伤的实验研究
- Circumin attenuates high glucose-induced H9C2 cardiomyocyte injury via NF-κB signaling pathway
- 天津中医药大学学报, 2021, 40(6): 778-782
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(6): 778-782
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.06.21
-
文章历史
收稿日期: 2021-08-08
2. 华北理工大学, 唐山 063000
2. North China University of Science and Technology, Tangshan 063000, China
高血糖通过加重炎症反应和氧化应激程度在糖尿病心肌损害病理过程中起重要作用[1]。姜黄素是从中药姜黄中提取的一种黄色酸性酚类物质,具有抗氧化、抗炎等作用,诸多研究表明姜黄素降低血糖、防治糖尿病并发症的药理作用明确[2-3],同时对心血管有保护作用[4-5]。在前期动物实验中发现姜黄素可以明显减轻糖尿病大鼠心肌损伤程度,然而糖尿病心肌损伤病理过程复杂,姜黄素减轻高血糖致心肌细胞损害的作用机制仍需进一步探讨。本研究以高糖诱导的H9C2心肌细胞损伤模型为研究对象,给予姜黄素干预,观察姜黄素对心肌细胞的保护作用,并从炎症反应指标肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6),氧化应激相关指标丙二醛(MDA)、超氧化物歧化酶(SOD),以及核转录因子κB(NF-κB)信号通路探讨其作用机制。
1 材料与方法 1.1 细胞株H9C2大鼠心肌细胞株购买于中国科学院上海生科院细胞资源中心。
1.2 用药及试剂姜黄素粉末(#C1386)、胰蛋白酶(#59429C)购自SIGMA公司;胎牛血清(#16000044)、低糖培养基(#12320032)、高糖培养基(#11965092)购自GIBCO公司;TNF-α(#H052)、IL-6(#H007)、乳酸脱氢酶(LDH)(#A020-2-2)、MDA(#A003-4-1)、SOD(#A001-3-2)酶联免疫吸附(ELISA)检测试剂盒购自南京建成生物工程研究所;兔抗大鼠第一抗体IκB激酶β(IKKβ)(#8943S)、NF-κB(#8242S)、p-NF-κB(#3031S),小鼠抗大鼠第一抗体GAPDH(#51332S)购自Cell Signaling公司;MTT试剂盒(#ST316),BCA蛋白浓度测定试剂盒(#P0012),辣根过氧化物酶标记山羊抗兔第二抗体IgG(#A0208)、辣根过氧化物酶标记山羊抗小鼠第二抗体IgG(#A0216)购自碧云天生物技术研究所。
1.3 仪器超净工作台(苏州净化设备有限公司);二氧化碳培养箱(上海易亮医疗器械有限公司);BS224S精密电子天平(SARTORIUS);ST 16R高性能通用台式冷冻离心机(美国Thermo Scientific Sorvall);M200PRO酶标仪(奥地利TECAN公司);电泳仪,半干转运系统,蛋白分析系统(BIO-RAD公司)。
2 方法 2.1 细胞培养给予10% FBS DMEM低糖培养基,置于细胞培养箱(37 ℃、5% CO2)培养,待细胞约铺满培养皿底面积80%时进行传代。
2.2 MTT法检测细胞活性对数生长期H9C2心肌细胞进行消化、重悬、计数后,接种于96孔细胞培养板(2 000个细胞/孔),培养48 h。吸原培养基,按照说明书加入100 μL新培养基及10 μL MTT溶液,将96孔板放置细胞培养箱内4 h。每孔加入二甲基亚砜(DMSO)150 μL,继续置于细胞培养箱15 min,使用酶标仪在波长570 nm测定吸光度OD值,根据说明书中的计算公式判断细胞活性。
2.3 姜黄素配制使用分析级天平称取姜黄素粉剂,DMSO溶解、配制成母液1 mmol/L,0.22 μm滤膜过滤除菌,-20 ℃避光保存。
2.4 高糖孵育建立心肌细胞损伤模型根据文献及本实验的预实验结果采用含有葡萄糖不同浓度的培养基(5.5、11.1、22.2、33.3、44.4 mmol/L)分别孵育H9C2心肌细胞12、24、48 h。由于在葡萄糖浓度33.3 mmol/L的培养基培养下H9C2心肌细胞随着培养时间延长细胞存活率不断下降且存活率趋近50%,因此选用高糖(33.3 mmol/L)培养基培养H9C2心肌细胞24 h建立心肌细胞损伤模型[6]。
2.5 分组及给药无血清低糖培养基培养细胞24 h,使细胞生长同步化后进行分组。实验分为正常对照组、高糖对照组和姜黄素各剂量组(2.5、5、10、20 μmol/L)。正常对照组给予低糖培养基培养;高糖对照组给予高糖培养基培养;姜黄素各剂量组先给予相应剂量姜黄素预处理6 h,再给予高糖培养基培养。
2.6 ELISA法检测TNF-α、IL-6,MDA、SOD,LDH的含量收集培养基作待测标本,按照试剂盒说明书进行操作,测定出细胞培养液中TNF-α、IL-6,LDH的含量水平;收集细胞,加入提取液后超声波破碎细胞,离心取上清作为待测样本,按照试剂盒说明书进行操作,测定出细胞中MDA、SOD的含量水平。实验重复5次。
2.7 Western Blot检测蛋白表达水平吸弃各组培养皿中的培养基,加入细胞裂解液,放置冰上裂解30 min后收集细胞,4 ℃,12 000 rpm离心15 min离心半径10 cm。使用BCA法测定蛋白浓度。制备分离胶和浓缩胶,SDS-PAGE电泳分离各蛋白。半干法将蛋白转移至PVDF膜上。封闭液封闭后,将PVDF膜放置于对应的一抗液中孵育,4 ℃过夜。洗膜后室温孵育对应的第二抗体2 h。再次洗膜后,ECL显色,暗室内曝光。利用Image J软件计算蛋白条带灰度值,目的蛋白条带灰度值/内参蛋白条带灰度表示相对蛋白表达水平。
2.8 统计学方法本研究计量资料采用均数±标准差(x±s)表示。采用SPSS 22.0统计软件对数据进行单因素方差分析,以P < 0.05为差异有统计学意义。
3 结果 3.1 姜黄素对细胞活性的影响MTT结果显示,高糖对照组H9C2细胞活性较正常对照组明显降低(P < 0.05);姜黄素各剂量组H9C2细胞活性较高糖对照组均提高(P < 0.05)。姜黄素提高H9C2细胞活性的效果呈剂量依赖性,随着姜黄素剂量的增加,H9C2细胞的活性越高,以姜黄素20 μmol/L剂量组细胞活性最高。见表 1。
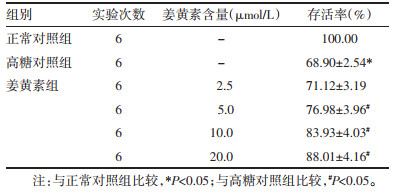
与正常对照组比较,高糖对照组细胞培养液上清TNF-α、IL-6和LDH的含量均明显增加(P < 0.05);与高糖对照组比较,姜黄素各剂量组细胞培养液上清TNF-α、IL-6和LDH的含量均有所降低(P < 0.05),且降低效果呈姜黄素剂量依赖性,随着姜黄素剂量的增加,上述指标含量降低越明显,以姜黄素20 μmol/L剂量组最为显著。见表 2。
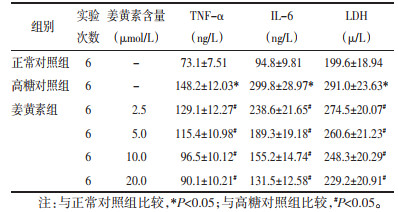
与正常对照组比较,高糖对照组心肌细胞MDA含量明显增加(P < 0.05),SOD含量明显降低(P < 0.05);与高糖对照组比较,姜黄素各剂量组心肌细胞MDA含量均有所降低(P < 0.05),SOD含量均有所增加,且干预效果呈姜黄素剂量依赖性,随着姜黄素剂量的增加,上述指标含量改变越明显,以姜黄素20 μmol/L剂量组最为明显。见表 3。
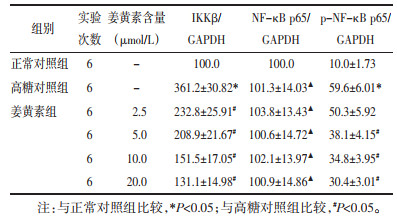
与正常对照组比较,高糖对照组心肌细胞IKKβ、p-NF-κBp65蛋白表达明显增加(P < 0.05),但NF-κB p65蛋白表达无明显变化(P>0.05);与高糖对照组比较,姜黄素各剂量组IKKβ、p-NF-κB p65蛋白表达明显降低(P < 0.05),且蛋白表达的变化呈现姜黄素剂量依赖性,以姜黄素20 μmol/L剂量组最为明显(P < 0.05)。见表 4、图 1。
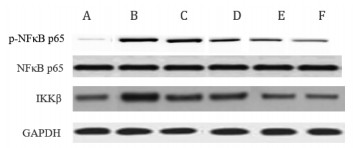
|
| 注:A.正常对照组;B.高糖对照组;C.2.5 μmol/L姜黄素组;D. 5 μmol/L姜黄素组;E. 10 μmol/L姜黄素组;F. 20 μmol/L姜黄素组。 图 1 姜黄素对IR H9C2细胞IKKβ,NF-κB p65,p-NF-κB p65蛋白表达的影响 |
糖尿病心肌损害的病理过程复杂[7],是心肌细胞面对高血糖应激表现出来的病理改变。LDH是心肌细胞内的一种酶,细胞损伤时会被大量释放出来。本实验中高糖孵育H9C2心肌细胞24 h,细胞活力明显下降,细胞培养液上清中LDH含量增加,提示心肌细胞存在损伤,成功建立高糖致心肌损伤模型。H9C2心肌细胞经过姜黄素预处理6 h,其活力明显增强,释放至细胞培养液上清中的LDH含量明显降低,提示姜黄素可以保护心肌细胞,减轻高糖所致损伤。
炎症反应是高糖致心肌损伤的重要机制[8],众多研究显示在糖尿病心肌损伤相关动物、细胞模型中存在大量炎症细胞因子如IL-6、TNF-α的分泌[9-10],持续存在的炎症反应最终导致心肌损伤。由于糖脂代谢紊乱,糖尿病机体的供能物质由葡萄糖转为脂肪酸或酮体,心肌细胞耗氧增加,加之糖尿病机体微血管病变常见,造成心肌细胞处于缺氧状态,低氧应激导致心肌组织TNF-α的分泌增多,进而启动炎症过程。此外,最新研究证实高血糖/高浓度葡萄糖在胞外与血清蛋白形成的糖基化终末产物(AGEs)可以直接结合细胞膜上的髓样分化蛋白2,从而激活模式识别受体TLR4,形成的三者复合物激活炎症信号通路[11]。氧化应激也是高糖致心肌损伤的一个重要因素[12],心肌细胞是高耗能单元,线粒体是其能量代谢的中心,高血糖造成的低氧状态使线粒体产生大量的活性氧(ROS),ROS直接损伤心肌细胞[13]。MDA和SOD是氧化应激系统中两个重要的指标[14],其中MDA反应脂质过氧化程度,其含量过高说明细胞受氧自由基损伤程度较严重,SOD含量直接反应细胞清除氧自由基的能力。本实验中高糖对照组细胞培养液上清炎症因子TNF-α、IL-6水平明显升高,提示高糖致心肌损伤模型细胞存在炎症反应过度;细胞内MDA含量增加、SOD含量降低,提示模型细胞存在过高的氧化应激水平。姜黄素预处理H9C2心肌细胞6 h可以明显降低细胞培养液上清TNF-α、IL-6含量,降低细胞内MDA含量并增加SOD含量,说明姜黄素可以降低高糖致心肌损伤细胞模型的炎症反应和氧化应激水平。
NF-κB是一种与炎症反应和氧化应激密切相关的核转录因子[15]。当细胞受到多种因素刺激后,IκB激酶复合体(IKK)激活NF-κB[16],后者转移至细胞核内,与特定靶基因结合并调控靶基因转录,释放IL-6、TNF-α等相关炎症因子;并上调诱导型一氧化氮合酶的表达,增加过氧化物的形成。而TNF-α、IL-6等炎症因子的释放可反馈性作用于NF-κB;过氧化物可导致心肌中糖基化终末产物(AGEs)积累增多,而AGEs与其受体结合可以激活NF-κB,进而持续又不断加重的炎症反应和氧化应激状态造成心肌损伤[18]。IKKβ是炎症因子激活NF-κB所必需的IKK复合物活性亚基。NF-κB p65是NF-κB家族中的重要成员之一,可与NF-κB p50构成最为广泛的异源二聚体,NF-κB p65磷酸化后从胞浆进入胞核,从而激活相关基因转录。本实验中高糖致心肌损伤细胞模型中IKKβ蛋白表达增加,NF-κB磷酸活化水平加强,提示模型细胞内IKK/NF-κB通路过度激活。姜黄素预处理H9C2心肌细胞6 h可以明显降低细胞IKKβ蛋白表达,下调NF-κB磷酸活化水平,抑制IKK/NF-κB信号通路过度激活。
综上所述,高糖刺激诱导的持续且不断加重的炎症反应、氧化应激状态以及IKK/NF-κB信号通路过度激活参与糖尿病心肌损伤的病理过程。姜黄素对糖尿病心肌损害具有较好的防治作用,其机制可能与抑制IKK/NF-κB通路的过度激活,继而降低了炎症反应水平及氧化应激程度有关。此外,本研究中各项异常指标的改善情况显示姜黄素的干预作用具有剂量依赖性,随着姜黄素剂量的增加,异常指标的改善越明显,以姜黄素20 μmol/L剂量组最为显著。
| [1] |
潘利亚, 张晓卉, 尹新华. 糖尿病心肌病发病机制的研究进展[J]. 中国心血管杂志, 2017, 22(2): 143-146. PAN L Y, ZHANG X H, YIN X H. Advance of mechanisms of diabetic cardiomyopathy[J]. Chinese Journal of Integrative Medicine, 2017, 22(2): 143-146. DOI:10.3969/j.issn.1007-5410.2017.02.015 |
| [2] |
陈洁, 刘一然. 姜黄素对2型糖尿病大鼠脂肪细胞葡萄糖转运及PI3K/Akt信号通路的影响[J]. 中国比较医学杂志, 2019, 29(5): 90-97. CHEN J, LIU Y R. Effect of curcumin on glucose transport and PI3K/Akt signaling pathway in adipocytes of type 2 diabetes mellitus rats[J]. Chinese Journal of Comparative Medicine, 2019, 29(5): 90-97. DOI:10.3969/j.issn.1671-7856.2019.05.014 |
| [3] |
杨敏, 翟光喜. 姜黄素对糖尿病及其并发症的作用及机制研究进展[J]. 中国新药与临床杂志, 2019, 38(2): 65-70. YANG M, ZHAI G X. Advances in research on effects and mechanisms of curcumin on diabetes and related complications[J]. Chinese Journal of New Drugs and Clinical Remedies, 2019, 38(2): 65-70. |
| [4] |
孙萌, 徐琨, 郭敏, 等. 姜黄素对心肌细胞缺血再灌注损伤的作用及机制研究[J]. 中西医结合心脑血管病杂志, 2018, 16(2): 147-152. SUN M, XU K, GUO M, et al. Effect of curcumin on myocardial ischemia/reperfusion injury and its mechanism[J]. Chinese Journal of Integrative Medicine on Cardio-/Cerebrovascular Disease, 2018, 16(2): 147-152. |
| [5] |
梁桂诚, 夏豪. 姜黄素的心血管保护作用及其机制的研究进展[J]. 医学综述, 2019, 25(2): 362-369. LIANG G C, XIA H. Research progress in cardiovascular and mechanisms of curcumin[J]. Medical Recapitulate, 2019, 25(2): 362-369. DOI:10.3969/j.issn.1006-2084.2019.02.030 |
| [6] |
胡丽贞, 李雅杰, 薛宏凤, 等. 莱菔硫烷对高糖诱导心肌细胞线粒体损伤的保护作用[J]. 哈尔滨医科大学学报, 2013, 47(3): 197-200. HU L Z, LI Y J, XUE H F. Sulforaphane prevents high glucose-induced mitochondrial impairment of myocardial cell in vitro[J]. Journal of Harbin Medical University, 2013, 47(3): 197-200. DOI:10.3969/j.issn.1000-1905.2013.03.001 |
| [7] |
张静, 李刚. 糖尿病心肌病病理机制研究[J]. 医学信息, 2020, 33(2): 43-46. ZHANG J, LI G. Research on pathological mechanism of diabetic cardiomyopathy[J]. Journal of Medical Information, 2020, 33(2): 43-46. DOI:10.3969/j.issn.1006-1959.2020.02.012 |
| [8] |
韦之富, 雷自立, 郭姣. 高血糖症的炎症机制研究进展[J]. 今日药学, 2017(5): 358-360. WEI Z F, LEI Z L, GUO J. Research progress of the inflammation mechanism in hyperglycemia[J]. Pharmacy Today, 2017(5): 358-360. |
| [9] |
张晓琴, 董卫锋, 张海成, 等. 甘草酸对糖尿病大鼠心肌细胞凋亡和炎症反应的影响[J]. 现代生物医学进展, 2016, 16(33): 6424-6428. ZHAGN X Q, DONG W F, ZHANG H C, et al. Effect of glycyrrhizin on apoptosis and inflammation in myocardial tissue of diabetic rats[J]. Progress in Modern Biomedicine, 2016, 16(33): 6424-6428. |
| [10] |
张驰, 王珣, 王丽岳, 等. 葛根素联合阿托伐他汀对2型糖尿病心肌病大鼠脂联素, 炎症因子及心肌纤维化的影响[J]. 现代中西医结合杂志, 2020, 29(11): 1167-1171, 1207. ZHANG C, WANG X, WANG L Y, et al. Effects of puerarin combined with atorvastatin on adiponectin, inflammatory factors and myocardial fibrosis in rats with type 2 diabetic cardiomyopathy[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2020, 29(11): 1167-1171, 1207. DOI:10.3969/j.issn.1008-8849.2020.11.007 |
| [11] |
WAND Y, LUO W, HAN J, et al. MD2 activation by direct AGE interaction drives inflammatory diabetic cardiomyopathy[J]. Nature Communications, 2020, 11(1): 1-16. DOI:10.1038/s41467-019-13993-7 |
| [12] |
孙奇林, 鞠婧, 王浩, 等. 黄芪多糖干预糖尿病心肌氧化应激的实验研究[J]. 中国中西医结合杂志, 2020, 40(2): 196-203. SUN Q L, JU J, WANG H, et al. Effect of astragalus polysaccharides in inhibiting myocardial oxidative stress of diabetes mellitus[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2020, 40(2): 196-203. |
| [13] |
卓凤巧, 黄占红, 刘宇捷. 甘草素对高糖诱导心肌细胞凋亡的影响及机制[J]. 中国临床药理学与治疗学, 2019, 24(2): 147-151. ZHUO Q F, HUAGN Z H, LIU Y J. Protective effect of liquiritigenin on H9C2 cardiomyocytes apoptosis induced by high glucose[J]. Journal of Clinical Pharmacy and Therapeutics, 2019, 24(2): 147-151. |
| [14] |
AMIN M M, RAFIEI N, POURSAFA P, et al. Association of benzene exposure with insulin resistance, SOD, and MDA as markers of oxidative stress in children and adolescents[J]. Environmental Science and Pollution Researcht, 2018, 25(34): 34046-34052. DOI:10.1007/s11356-018-3354-7 |
| [15] |
杨洋, 董敏, 韩滨, 等. 溪黄草水提物对高糖诱导的大鼠HBZY-1细胞炎症反应和氧化应激的抑制作用以及对TLR4/NF-κB/NLRP3通路的作用[J]. 中国医院药学杂志, 2019, 39(21): 2157-2161. YANG Y, DONG M, HAN B, et al. Inhibitory effects of water extract of rhizome cassia on inflammatory response and oxidative stress induced by high glucose in rat HBZY-1 cells and the potential machnismon TLR4/NFκB/NLRP3 signaling pathway[J]. Chinese Journal of Pharmaceuticals, 2019, 39(21): 2157-2161. |
| [16] |
赵运旺. NF-κB信号通路研究进展[J]. 甘肃科技, 2016, 32(21): 117-123. ZHAO Y W. Research progress of NFκB signaling pathway[J]. Gansu Science and Technology, 2016, 32(21): 117-123. DOI:10.3969/j.issn.1000-0952.2016.21.048 |
 2021, Vol. 40
2021, Vol. 40