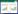文章信息
- 姚明鹤, 闫海峰, 王静, 徐宗佩, 李玉红
- YAO Minghe, YAN Haifeng, WANG Jing, XU Zongpei, LI Yuhong
- 基于网络药理学探讨荷丹片治疗高脂血症的作用机制
- Network pharmacology-based molecular mechanisms of Hedan Tablets for hyperlipidemia regression
- 天津中医药大学学报, 2021, 40(6): 783-789
- Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(6): 783-789
- http://dx.doi.org/10.11656/j.issn.1673-9043.2021.06.22
-
文章历史
收稿日期: 2021-08-10
2. 天津中医药大学第一附属医院, 天津 300381
2. First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300381, China
高脂血症是指血液中总胆固醇、三酰甘油和低密度脂蛋白胆固醇浓度升高或高密度脂蛋白胆固醇浓度降低,是血栓形成、动脉粥样硬化、心血管疾病、中风和肝损伤的重要危险因素[1]。近30年来,中国人群的血脂水平逐步升高,血脂异常患病率明显增加。中国成人血脂异常总体患病率高达40%,人群血清胆固醇水平的升高将导致2010—2030年期间中国心血管病事件约增加920万,预示未来中国成人血脂异常患病及相关疾病负担将继续加重[2]。目前临床上广泛使用的调节血脂药物有纤维酸盐、他汀类、贝特类、烟酸类、胆汁酸螯合剂和胆固醇吸收抑制剂等药物,这类药物使用方便,起效快,但部分患者有耐受缺乏现象,出现不同程度的肝肾功能损伤、胃肠道明显不适、横纹肌溶解等而终止治疗[3-8]。因此,研制安全有效治疗高脂血症的药物显得尤为重要。
中医药治疗高脂血症历史悠久,早在《黄帝内经》时期就有“膏”“脂”等关于高脂血症的记载。中药能多途径、多靶点发挥调节血脂的作用,不良反应少,在治疗高脂血症及相关疾病方面优势明显。近年来,荷丹片作为他汀类药物耐受缺乏患者的替代治疗或与他汀类药物联合使用,以达到调节血脂的效果。荷丹片已被证实可明显降低胆固醇、三酰甘油和体质量,同时可升高高密度脂蛋白和提高卵磷脂胆固醇酰基转移酶的活性,另外还能减少动脉粥样斑块的发生率。然而,由于荷丹片中化合物及其作用靶点的复杂性,难以从整体上对中药的有效物质及药理作用机制进行剖析。网络药理学可以在基因、蛋白、疾病、药物等数据库信息的基础上,融合系统生物学、多向药理学、计算机生物学和网络分析等多学科技术,综合构建“药物-靶点-基因-疾病”之间的复杂网络关系,揭示具有多靶点性质的多组分药物的作用机制。本研究基于网络药理学的方法,把荷丹片中的类药成分通过相关数据库筛选出来,搜索得到高脂血症疾病靶点,构建“成分-靶标-疾病”网络,探究荷丹片治疗高脂血症的可能作用机制,以期为该药的进一步的深入研究提供理论基础。
1 材料与方法 1.1 荷丹片类药成分和对应靶标的获取应用中药系统药理学分析平台(TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php)搜索荷丹片中荷叶、丹参、番泻叶、山楂、补骨脂的化学成分。以口服生物利用度(OB)≥ 30%、血脑屏障(BBB)≥-0.3、类药性(DL)≥0.18为筛选条件,得到荷丹片的生物活性成分及其相关靶标蛋白,将TCMSP筛选出的成分靶点全称输入DrugBank获取基因简称和Uniprot ID。中药系统药理学数据库(TCMSP)未收录的药物在中医药百科全书(ETCM)(http://www.nrc.ac.cn:9090/ETCM/index.php/Home/Index/index.html)数据库中搜索得到。
1.2 高脂血症疾病靶点的获取登录DisGeNET(http://www.disgenet.org/web/DisGeNET/menu/search)数据库,设置检索词为“hyperlipidemia”,搜索得到高脂血症的疾病靶点。
1.3 药物与疾病共同靶点筛选及互作网络构建将高脂血症疾病靶点与荷丹片类药活性成分的作用靶点在线绘制韦恩图(https://www.omicshare.com/),获得药物与疾病的共同靶点,在STRING数据平台(https://string-db.org/)在线输入共同作用靶点,构建靶点互作(PPI)网络,选择物种为“Homo sapiens”,设置最低相互作用阈值为“medium confidence”,根据分析结果统计靶点关联频次获取蛋白相互作用信息,从而得到关键靶点。
1.4 构建中药-活性成分-疾病-靶点互作网络将中药化学成分的预测靶点与高脂血症相关靶点取交集,所得交集靶点即为荷丹片作用于高脂血症的预测靶点。构建中药-活性成分-疾病-靶点互作网络,利用Cytoscape3.7.1软件中的“Network Analyzer”功能对中药-活性成分-疾病-作用靶点网络进行分析,节点(node)代表荷丹片中所含药物化学成分与潜在作用靶点,边(edge)展现了中药成分和其作用靶点之间的联系,根据化合物与靶点连接情况筛选出荷丹片作用于高脂血症的关键化合物。
1.5 GO生物学过程富集分析和KEGG通路富集分析将荷丹片- 高脂血症基因数据集导入DAVID6.8数据库(https://david.ncifcrf.gov/)进行GO和KEGG通路富集分析,从而得到基因的功能水平分析结果。
2 结果 2.1 荷丹片中类药活性成分通过TCMSP、ETCM数据库对荷丹片中5味中药进行检索,得到类药活性成分61个,其中荷叶7个、丹参41个、番泻叶2个、山楂4个、补骨脂7个,见开放科学(资源服务)标识码表 1。
2.2 高脂血症疾病靶点的筛选及共同靶点PPI网络构建通过检索DisGeNET数据库获得高脂血症相关的疾病靶点231个。将231个疾病靶点与281个中药类药活性成分的作用靶点在线绘制韦恩图(https://www.omicshare.com/),结果显示,高脂血症与荷丹片类药成分共同作用靶点20个,分别为CYP19A1、PPARA、CYP2D6、CYP2C19、F2、CYP2C9、ALB、PTGS1、CYP27A1、NR1I2、ADRB2、ESRRA、AKR1B1、SOAT1、ACHE、PPARG、NOS3、MTTP、ABCB1、AHR,此即荷丹片治疗高脂血症具有重要意义的作用靶点。在STRING数据平台(https://string-db.org/)在线输入20个共同作用靶点,选择物种为“homo sapiens”,检索获得蛋白相互作用网络,设置置信度蛋白质参数评分值>0.4,分析后得到PPI作用网络图,在网络中,1个节点的度(degree)表示网络中和节点相连的路线的条数,degree越高,说明在PPI中起着更为关键的作用,结果提示degree值较高的潜在靶点分别是CYP2C19、CYP2C9、F2、ALB、PTGS1、PPARA、ESRRA、CYP2D6、ADRB2,见开放科学(资源服务)标识码图 1。
2.3 构建中药-活性成分-疾病-靶点互作网络在Cytoscape3.6.0软件中导入中药、活性成分、疾病、作用靶点的信息进行拓扑分析,得到荷丹片中药-活性成分-疾病-靶点可视化网络图,此网络包括67个节点、196条边(黄色方形节点代表中药,黄色圆形节点代表疾病,绿色节点代表化合物,红色节点代表靶蛋白)。由图 2可见,不同的靶点可对应同一个的活性成分,单个靶点也可与不同的活性成分相对应,由此可见荷丹片治疗高脂血症具有多成分、多靶点的作用特点。通过Degree值的大小,荷丹片中发挥调节血脂作用的中药主要是丹参、山楂、补骨脂,其中关键的化合物为Ergosterol、Guercetol、Corylinal、(X {2212})-Epicatechin,Epicatechin,Epicatechin,Epicatechol,Epigallocatechin、neocryptotanshinone、Isoneobavachalcone等,关键的作用靶点为PTGS1、ADRB2、F2、PPARG等。
|
| 图 2 中药-化合物-核心靶点-疾病的网络构建 |
利用DAVID数据库对荷丹片-高脂血症潜在靶点进行动态GO富集分析,荷丹片和高脂血症的交集靶基因共20个,影响了199个生物学过程,筛选得到P-value < 0.05的GO条目33个,其中细胞组分(CC)条目10个,分子功能(MF)条目6个、生物过程(BP)条目17个,见开放科学(资源服务)标识码图 3。P-value越小的通路,与荷丹片治疗高脂血症关系越为密切。GO分析结果显示,富集比例较高,P值较小的在CC分析,开放科学(资源服务)标识码图 4中为内膜系统(endomembrane system)、内质网(endoplasmic reticulum)、细胞内膜结合细胞器(intracellularmembrane-boundedorganelle)、膜结合细胞器(membrane-bounded organelle)、细胞质部分(cytoplasmic part)、高尔基体(Golgi apparatus)等;MF分析,开放科学(资源服务)标识码图 5中为氧化还原酶活性(oxidoreductase activity)、脂质结合(lipid binding)、离子结合(ion binding)、信号转导活性(signal transducer activity)、核酸结合转录因子活性(nucleic acid binding transcription factor activity)等;BP分析,开放科学(资源服务)标识码图 6中为脂质代谢过程(lipid metabolic process)、单细胞代谢过程(single-organism metabolic process)、小分子代谢过程(small molecule metabolic process)、细胞增殖(cell proliferation)、有机物代谢过程(organic substance metabolic process)等。
2.5 KEGG通路富集分析利用DAVID数据库对荷丹片治疗高脂血症的潜在靶点进行KEGG通路富集分析,见开放科学(资源服务)标识码图 7,得到52条信号通路,显著性较大的前20条信号通路见开放科学(资源服务)标识码图 8,其中P-value≤ 0.05的信号通路有13条,结果显示荷丹片治疗高脂血症的靶标主要与含血清素的神经突触(Serotonergic synapse)、PPAR信号通路(PPAR signaling pathway)、药物代谢细胞色素P450(Drug metabolism cytochrome P450)、花生四烯酸代谢(Arachidonic acid metabolism)、亚油酸的新陈代谢(Linoleic acid metabolism)、胆固醇代谢(Cholesterol metabolism)、脂肪细胞脂解的调节(Regulation of lipolysis in adipocyte),细胞色素P450对外源性药物代谢的影响(Metabolism of xenobiotics by cytochrome P450)、精氨酸生物合成(Arginine biosynthesis)、类固醇生物合成(Steroid biosynthesis)、初级胆汁酸生物合成(Primary bile acid biosynthesis)、血小板激活(Platelet activation)、叶酸生物合成(Folate biosynthesis)、PKG信号通路戊糖和葡萄糖醛酸盐相互转化(cGMP-PKG signaling pathway Pentose and glucuronate interconversions)、cAMP信号通路(cAMP signaling pathway)、果糖和甘露醇代谢(Fructose and mannose metabolism)、半乳糖代谢(Galactose metabolism)、钙信号通路(Calcium signaling pathway)关系较为密切。
3 讨论荷丹片由荷叶、丹参、山楂、番泻叶、补骨脂5味药物配伍而成,具有化痰降浊、活血祛瘀之功效,用于高脂血症属痰浊挟瘀证者。方中荷叶祛湿降浊、升发清阳、健脾行气,为君药;山楂活血消积,行瘀通络助荷叶清化湿热,为臣药;丹参活血祛瘀,凉血除烦,用补骨脂以温补脾肾,扶正纳气,共为佐药;番泻叶为使药,清热利湿,行滞通便,全方升清降浊,补泻兼施,合活血、行气、化湿、利水、扶正于一方,共奏清热化湿,健运脾阳,祛瘀活络,暖肝益肾之功[9-10],见图 9。徐丽瑛等[11]研究发现,荷丹片可降低NAFLD模型大鼠血脂和肝脂,改善肝脏病理组织学改变。周玉娟等[12]报道荷丹片可降低APOE-/- 小鼠血脂和TNF-α、hs-CRP水平,升高脂联素水平,从而抑制动脉粥样硬化的发生、发展。Tian等[13]发现高脂血症和肥胖症患者使用荷丹片治疗12周后TG和LDL-C水平明显降低。徐瑞霞等[14]研究发现荷丹片能使患者血清低密度脂蛋白胆固醇(LDL-C)水平轻度下降,总胆固醇(TC)、三酰甘油(TG)、前蛋白转化酶枯草溶菌素9(PCSK9)浓度无变化。荷丹片治疗提高了高脂血症患者高密度脂蛋白胆固醇(HDL-C)的大颗粒亚型的浓度和大颗粒亚型的比例,HDL -C小颗粒亚型的浓度及比例减少,但HDL-C的血浆水平无变化。
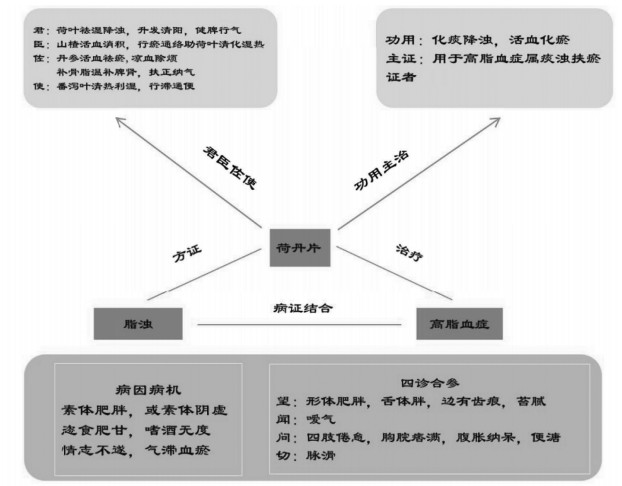
|
| 图 9 荷丹片治疗痰浊瘀阻证高脂血症思维导图 |
本研究所收集的荷丹片治疗高脂血症的主要类药活性成分61个,包括荷叶碱、环阿屯醇、丹参酮ⅡA、新隐丹参酮、丹参新酮、二氢丹参酮、丹参醇A、丹参醇B、香紫苏醇、紫丹参素C、柳杉酚、异欧前胡素、多孔甾醇、谷甾醇、豆甾醇、丁二酸、麦角固醇、补骨脂异黄酮醛、补骨脂呋喃查耳酮等。Li等[15]将分离的SD大鼠脂肪组织悬浮于含三羧酸溶液的器官浴中,观察了荷叶水提取物对游离脂肪酸(FFA)释放的影响,结果表明荷叶水提物能有效促进游离脂肪组织中FFA释放;体内实验中,荷叶水提物大大提高PPAR-γ和瘦素的表达,可促进脂质动员和分解,显著降低实验性肥胖大鼠的体质量和血脂。Chao等[16]研究发现荷叶碱通过PPAR/PGC1信号通路减轻STZ诱导的高脂饮食糖尿病小鼠肝脏脂代谢紊乱。Lim等[17]观察了丹参甲醇提取物对高脂饮食诱导高脂血症小鼠的影响,研究表明丹参甲醇提取物对高脂血症小鼠体质量增加无显著影响,但能显著降低血液TG含量,发现在DNA复制中起关键作用的微小脂质体维持(Mcm)家族蛋白是改善高脂血症的分子靶点。二氢丹参酮I通过抑制胆固醇酯转移蛋白(CETP)降低高脂血症大鼠血清和肝脏中TC和TG[18]。植物甾醇破坏胶束中胆固醇的增溶作用,并能抑制NPC1L1和HMG-CoA还原酶在小肠中的表达,减少胆固醇进入肠细胞,进而降低血浆胆固醇浓度[19]。山楂醇提物可以显著下调胆固醇生物合成中的限速酶HMGCR,上调胆固醇7-羟化酶(CYP7A1),催化胆固醇代谢转化为胆汁酸[20]。常燕琴等[21]研究发现补骨脂水煎剂可改善去卵巢肥胖大鼠的脂代谢紊乱,清除过多的自由基,提高脂质抗氧化能力。Zhou等[22]研究数据表明补骨脂(PC)能显著改善非酒精性脂肪肝/非酒精性脂肪性肝炎(NAFLD/NASH)小鼠的肝功能异常、肝脏TG、TC积累和胰岛素抵抗。PC还缓解了肝脂肪变性,炎性细胞浸润和门脉区域的纤维化。另外,PC抑制NF-κB的活化和炎性因子的mRNA表达,同时增强肝组织中的PI3K/Akt信号传导。PC还可以降低肝脏中的超氧阴离子水平,肝组织中NADPH氧化酶的活性以及p47phox蛋白的表达和PKCα的活化。因此PC可有效治疗幼年小鼠NASH,其机制可能与通过PKC-α/NADPH氧化酶信号传导途径减轻肝氧化应激有关。
荷丹片治疗高脂血症的中药-活性成分-疾病-靶点可视化网络图推测发挥调节血脂作用的中药主要是丹参、山楂、补骨脂,其中关键的化合物为Ergosterol、Guercetol、Corylinal、(X{2212})-Epicatechin,Epicatechin,Epicatechin,Epicatechol,Epigallocatechin、neocryptotanshinone、Isoneobavachalcone等,关键的作用靶点为PTGS1、ADRB2、F2、PPARG等。荷丹片中关键成分是否可通过作用于PTGS1、ADRB2、F2、PPARG调节相关通路达到改善血脂的作用仍需相关实验研究进一步证实与探讨。
通过GO生物学富集分析发现,荷丹片的活性成分可能通过改善氧化还原酶活性(oxidoreductase activity)、脂质结合(lipid binding)、离子结合(ion binding)、信号转导活性(signal transducer activity)、核酸结合转录因子活性(nucleic acid binding transcription factor activity)、脂质代谢过程(lipid metabolic process)、单细胞代谢过程(single-organism metabolic process)、小分子代谢过程(small molecule metabolic process)、细胞增殖(cell proliferation)、有机物代谢过程(organic substance metabolic process)等生物学过程发挥调节血脂的作用。
KEGG通路富集分析结果表明,荷丹片关键基因靶点富集的主要通路涉及含血清素的神经突触(Serotonergic synapse),PPAR信号通路(PPAR signaling pathway),药物代谢细胞色素P450(Drug metabolism cytochrome P450),花生四烯酸代谢(Arachidonic acid metabolism),亚油酸的新陈代谢(Linoleic acid metabolism),胆固醇代谢(Cholesterol metabolism),脂肪细胞脂解的调节(Regulation of lipolysis in adipocyte)等。含血清素的神经突触(Serotonergic synapse)以多种方式对大脑功能进行调节,涉及睡眠-觉醒周期、食欲、情绪和心理健康等关键方面。既往研究表明,通过刺激含血清素的神经突触(Serotonergic synapse)把血清素(5-羟色胺)释放到大脑突触中,通过直接刺激突触后血清素受体,抑制其再摄取到突触前神经元。根据控制食欲的血清素假说,这些效应可以减少食物摄入量,从而减轻体质量[23]。过氧化物酶体增殖激活受体信号通路(PPAR signaling pathway)被认为是治疗代谢综合征及其相关危险因素的潜在治疗靶点。PPAR是一类由配体激活的核转录因子,分为PPARα、PPARβ、PPARγ 3种亚型。PPARα和PPARγ主要参与调节脂质代谢、胰岛素敏感性和葡萄糖稳态,其激动剂用于治疗高脂血症和2型糖尿病。而PPARβ的功能是调节脂质代谢,葡萄糖稳态,抗炎和脂肪酸氧化,其激动剂用于治疗代谢综合征和心血管疾病[24]。细胞色素P450(Cytochrome P450)是肝微粒体混合功能氧化酶中最重要的一族,是一组由多种同工酶组成的超家族,能够介导多种内源性和外源性物质的代谢,在这些物质的氧化性代谢中起到重要作用[25]。花生四烯酸代谢(Arachidonic acid metabolism)通路在心血管疾病和代谢性疾病的病理生理学中起着至关重要的作用。花生四烯酸及其衍生物将营养代谢与免疫、炎症联系起来,在肥胖、糖尿病、非酒精性脂肪肝和心血管疾病等常见疾病的发生和发展中发挥着关键作用[26]。脂肪三酰甘油脂肪酶(ATGL)是主要介导三酰甘油分解代谢的酶,膳食中适量的花生四烯酸可以下调ATGL的表达,改善脂质代谢和抗氧化反应,保持脂类分解与生成的平衡[27]。
综上所述,本研究通过网络药理学的技术与方法,发现荷丹片中的主要药效成分Ergosterol、Guercetol、Corylinal、(X{2212})-Epicatechin,Epicatechin,Epicatechin,Epicatechol,Epigallocatechin、neocryptotanshinone、Isoneobavachalcone可通过PTGS1、ADRB2、F2、PPARG等多个靶点参与,涉及含血清素的神经突触、PPAR信号通路、药物代谢细胞色素P450、花生四烯酸代谢、亚油酸的新陈代谢、胆固醇代谢、脂肪细胞脂解的调节等信号通路,初步清晰地阐述了荷丹片的主要药效成分及其作用靶点和相关通路在高脂血症治疗中具有重要的研究价值,结论虽然尚有待于后续的实验验证,但为更多的基础研究及临床研究提供了理论基础。
| [1] |
MACH F, BAIGENT C, CATAPANO A L, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk[J]. European Heart Journal, 2020, 41(1): 111-188. DOI:10.1093/eurheartj/ehz455 |
| [2] |
诸骏仁, 高润霖, 赵水平, 等. 中国成人血脂异常防治指南(2016年修订版)[J]. 中华心血管病杂志, 2016, 44(10): 833-853. ZHU J R, GAO R L, ZHAO S P, et al. Chinese standard guidelines for the prevention and treatment of dyslipidemia in adults (2016 Revision)[J]. Chinese Journal of Cardiovascular Disease, 2016, 44(10): 833-853. DOI:10.3760/cma.j.issn.0253-3758.2016.10.005 |
| [3] |
JELLINGER P S, HANDELSMAN Y, ROSENBLIT P D, et al. American association of clinical endocrinologists and american college of endocrinology: guidelines for the management of dyslipidemia and the prevention of cardiovascular disease[J]. Endocrine Practice, 2017, 23(Suppl 2): 1-87. |
| [4] |
LIU A, WU Q, GUO J, et al. Statins: adverse reactions, oxidative stress and metabolic interactions[J]. Pharmacology & Therapeutic, 2019, 195(5): 54-84. |
| [5] |
SAXON D R, ECKL R H. Statin intolerance: a literature review and management strategies[J]. Progress in Cardiovascular Diseases, 2016, 59(2): 153-164. DOI:10.1016/j.pcad.2016.07.009 |
| [6] |
BACKS J M, RUISINGER J F, GIBSON C A, et al. Statin-associated muscle symptoms-managing the highly intolerant[J]. Journal of Clinical Lipidology, 2017, 11(1): 24-33. DOI:10.1016/j.jacl.2017.01.006 |
| [7] |
SERBAN M C, COLANTONIO L D, MANTHRIPRAGADA A D, et al. Statin intolerance and risk of coronary heart events and all-cause mortality following myocardial infarction[J]. Journal of the American College of Cardiology, 2017, 69(11): 1386-1395. |
| [8] |
他汀类药物安全性评价专家共识[J]. 中华心血管病杂志, 2014, 42(11): 890-894. Experts' consensus on safety evaluation of statins[J]. Chinese Journal of Cardiovascular Disease, 2014, 42(11): 890-894. |
| [9] |
赵晰, 王耀光, 张志奎. 荷丹片治疗肾病综合征高脂血症的临床疗效观察[J]. 中西医结合心脑血管病杂志, 2016, 14(20): 2456-2457. ZHAO X, WANG Y G, ZHANG Z K. Clinical efficacy of Hedan Tablet in the treatment of hyperlipidemia in nephrotic syndrome[J]. Journal of Integrated Chinese and Western Medicine, 2016, 14(20): 2456-2457. DOI:10.3969/j.issn.1672-1349.2016.20.042 |
| [10] |
潘美香, 孙斌. 荷丹片临床应用进展[J]. 中国妇幼健康研究, 2016, 27(S1): 296-297. PAN M X, SUN B. Progress on the clinical application of Hedan Tablet[J]. Chinese Maternal and Child Health Research, 2016, 27(S1): 296-297. |
| [11] |
徐丽瑛, 黎砚书, 郑国安, 等. 荷丹片对慢性非酒精性脂肪性肝病模型大鼠的影响[J]. 实验动物与比较医学, 2008, 38(5): 382-386. XU L Y, LI Y S, ZHENG G A, et al. Effects of Hedan Tablet on rat model of chronic non-alcoholic fatty liver disease[J]. Experimental Animals and Comparative Medicine, 2008, 38(5): 382-386. |
| [12] |
周玉娟, 于柏青, 刘春颖, 等. 荷丹片对APOE-/-小鼠血脂、炎症因子及形态学变化的影响[J]. 中成药, 2015, 37(3): 497-500. ZHOU Y J, YU B Q, LIU C Y, et al. Effects of hedan tablet on lipids, inflammatory factors, and morphological changes in APOE-/- mice[J]. Chinese Patent Medicine, 2015, 37(3): 497-500. DOI:10.3969/j.issn.1001-1528.2015.03.007 |
| [13] |
TIAN Q, GU S Y, LIU Y F. Effect of Hedan Tablet on lipid profile in patients with hyperlipidemia[J]. Chinese Journal of Integrative Medicine, 2013, 11(4): 1290-1291. |
| [14] |
XU R X, WU N Q, LI S, et al. Effects of Hedan Tablet on lipid profile, proprotein convertase subtilisin/Kexin type 9 and high-density lipoprotein subfractions in patients with hyperlipidemia: A primary study[J]. Springer Berlin Heidelberg, 2016, 22(9): 660-665. |
| [15] |
LI M M, HUANG X Y, LIANG Q K, et al. Effects and mechanisms of lotus leaf water extract on lipid metabolism of adult experimental obesity rats[J]. Chinese Journal of Applied Physiology, 2017, 33(5): 476-480. |
| [16] |
ZHANG C, DENG J, LIU D, et al. Nuciferine ameliorates hepatic steatosis in high-fat diet/streptozocin-induced diabetic mice through a PPARα/PPARγ coactivator-1α pathway[J]. British Journal of Pharmacology, 2018, 175(22): 4218-4228. DOI:10.1111/bph.14482 |
| [17] |
LIM C, LIM S, LEE B, et al. Effect of methanol extract of Salviae miltiorrhizae Radix in high-fat diet-induced hyperlipidemic mice[J]. Chinese Medicine, 2017, 12(2): 29. |
| [18] |
林肖惠, 徐为人, 刘鹏, 等. 二氢丹参酮Ⅰ的降血脂作用研究[J]. 中草药, 2008, 39(9): 1378-1380. LIN X H, XU W R, LIU P, et al. 2-H tanshinone Ⅰ fall hematic fat action researh[J]. Chinese Herbal Medicine, 2008, 39(9): 1378-1380. DOI:10.3321/j.issn:0253-2670.2008.09.032 |
| [19] |
JESCH E D, SEO J M, CARR T P, et al. Sitosterol reduces messenger RNA and protein expression levels of Niemann-Pick C1-like 1 in FHs 74 Int cells[J]. Nutrition Research, 2009, 29(12): 859-866. DOI:10.1016/j.nutres.2009.10.016 |
| [20] |
HU H J, LUO X G, DONG Q Q, et al. Ethanol extract of Zhongtian hawthorn lowers serum cholesterol in mice by inhibiting transcription of 3-hydroxy-3-methylglutaryl-CoA reductase via nuclear factor-kappa B signal pathway[J]. Experimental Biology and Medicine, 2016, 241(6): 667-674. DOI:10.1177/1535370215627032 |
| [21] |
常燕琴, 岳嘉, 蔺美玲, 等. 补骨脂对去卵巢肥胖大鼠血脂和丙二醛的影响[J]. 辽宁中医杂志, 2013, 40(3): 572-574. CHANG Y Q, YUE J, LIN M L, et al. Effects of psoraleae on lipid and malondialdehyde in ovariectomized obese rats[J]. Liaoning Journal of Traditional Chinese Medicine, 2013, 40(3): 572-574. |
| [22] |
ZHOU L, TANG J, XIONG X, et al. Psoralea corylifolia L. attenuates nonalcoholic steatohepatitis in juvenile mouse[J]. Frontiers in Pharmacology, 2017, 8(2): 876. |
| [23] |
DAVIS R, FAULDS D. Dexfenfluramine an updated review of its therapeutic use in the management of obesity[J]. Drugs, 1996, 52(5): 696-724. DOI:10.2165/00003495-199652050-00007 |
| [24] |
MONSALVE F A, PYARASANI R D, DELGADO-LOPEZ F, et al. Peroxisome proliferator-activated receptor targets for the treatment of metabolic diseases[J]. Mediators Inflamm, 2013, 2013(6): 549627. |
| [25] |
孙宇鹏. 基于细胞色素P450代谢酶的间尼索地平代谢转化及药物-药物相互作用(DDI)研究[D]. 石家庄: 河北医科大学, 2016. SUN Y P. Study on the biotransformation and drug-drug interaction (DDI) of mesodipine on cytochrome P450 metabolizing enzymes[D]. Shijiazhuang: Hebei Medical University, 2016. |
| [26] |
SONNWEBER T, PIZZINI A, NAIRZ M, et al. Arachidonic acid metabolites in cardiovascular and metabolic diseases[J]. International Journal of Molecular Sciences, 2018, 19(11): 3285. DOI:10.3390/ijms19113285 |
| [27] |
MA H N, JIN M, ZHU T T, et al. Effect of dietary arachidonic acid levels on growth performance, fatty acid profiles and lipid metabolism of juvenile yellow catfish (Pelteobagrus fulvidraco)[J]. Aquaculture, 2017, 486(10): 31-41. |
 2021, Vol. 40
2021, Vol. 40