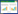文章信息
- 顾瑛媛, 普晓佳, 殷娜, 万春平
- GU Yingyuan, PU Xiaojiao, YIN Na, WAN Chunping
- 复方黄芪口服液联合化疗药物抗肿瘤效应机制研究
- The study on mechanism of the anti-tumor effect of Fufang Huangqi Oral Solution combined chemotherapy
- 天津中医药大学学报, 2022, 41(1): 85-89
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(1): 85-89
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.01.18
-
文章历史
收稿日期: 2021-10-18
2. 云南中医药大学, 昆明 650500;
3. 云南中医药大学第一附属医院, 昆明 650021
2. Yunnan University of Traditional Chinese Medicine, Kunming 650500, China;
3. The NO.1 Affiliated Hospital of Yunnan University of Traditional Chinese Medicine, Kunming 650021, China
化疗是恶性肿瘤综合治疗的重要手段之一,但是由于化疗药物的毒性及非选择性,往往对肿瘤患者造成严重的毒副作用。复方黄芪口服液是依据孟河医派学术思想总结出来的治疗肿瘤的院内制剂,该制剂主要由黄芪、黄精、人参和陈皮4味药物组成,具有扶正祛邪、益气固表和补虚益损等功效。现代药理研究表明本方具有改善心、脑、肾血液循环及调节免疫功能等药理作用,临床被广泛用于提高肿瘤患者扶正抗邪能力与人体免疫力。复方黄芪口服液已在常州市中医医院应用25年余,近3年来治疗患者13 000余人次,具有较好的临床疗效,深受广大患者欢迎。然而迄今为止,复方黄芪口服液的抗肿瘤免疫效应尚未明确,因此有必要进一步深入研究。
机体抗肿瘤免疫的主要方式是细胞免疫,其中T淋巴细胞是最主要的效应细胞。CD4+辅助性T细胞(Th细胞)可分别识别肿瘤细胞内外的抗原肽分子,在一系列辅助信号的参与下,被诱导激活并介导抗肿瘤免疫反应。肿瘤组织中浸润的Ⅰ型辅助性T细胞(Th1细胞)通过分泌干扰素-γ(IFN-γ)诱导巨噬细胞、CD8+T细胞等浸润到肿瘤部位,从而对肿瘤细胞产生杀伤作用[1]。调节性T细胞(Treg细胞)在肿瘤组织高表达,具有免疫抑制性,能够介导肿瘤免疫耐受。本研究以常州市中医医院院内制剂复方黄芪口服液为研究对象,以T细胞亚群为切入点,研究复方黄芪口服液联合化疗药物抗肿瘤的免疫效应及作用机制,以期解释中医“正气”的科学内涵并使复方黄芪口服液更好地应用于临床。
1 材料与方法 1.1 实验动物BALB/c小鼠,7~8周龄,体质量(20~22) g,雌性,购自辽宁长生生物技术股份有限公司,合格证号: SCXK(辽)2015-0001。上述动物饲养于动物实验屏障系统,饲养至少1周后开始实验。温度(22±1) ℃,湿度(55±5)%,12 h光暗循环。饲料和水均在消毒后自由摄取。
1.2 药物与试剂复方黄芪口服液由常州市中医医院提供。RPMI-1640培养基购自GibcoBRL公司;胎牛血清(FBS)购自Hyclone公司;APC-小鼠白细胞介素-17A(IL-17A)抗体、FITC-小鼠IFN-γ抗体、PE-Cy7小鼠CD4抗体购自美国Biolegend公司;PE-小鼠叉头样/翼状螺旋转录因子3(Foxp3)抗体购自BD PharMingen公司;Foxp3/Transcription Factor Staining Buffer Set购自eBioscience公司。
1.3 主要仪器设备血液分析系统购自日本Sysmex公司;离心机购自德国Thermo Scientific Heraeus公司;3111二氧化碳培养箱购自美国Thermo-fisher公司;流式细胞仪购自美国BD公司。
1.4 细胞株H22鼠源小鼠细胞购自中国科学院昆明动物研究所。
2 实验方法与评价 2.1 H22荷瘤小鼠模型的建立、分组和给药选取接种8 d的H22鼠源小鼠,腹部皮肤消毒后抽取腹水,离心(1 200 r/min,4 ℃,5 min,离心半径25 cm)后弃上清,磷酸缓冲盐溶液(PBS)调整细胞浓度为1×106个/mL,每次于小鼠右侧腋部皮下接种0.2 mL,次日将接种的小鼠随机分为4组,分别为荷瘤模型组、复方黄芪口服液组、环磷酰胺组和联合用药组,每组8只。肿瘤接种后第2天开始给药,环磷酰胺组腹腔注射环磷酰胺(30 mg/kg),复方黄芪口服液组以100 mg/kg剂量灌胃给药,联合用药组在腹腔注射环磷酰胺(30 mg/kg)基础上灌胃复方黄芪口服液(100 mg/kg)。荷瘤模型组灌胃等体积的生理盐水。以上各组每日给药1次,连续16 d。末次给药24 h后,脱颈椎方式处死小鼠,剥离肿瘤组织,称取质量并计算肿瘤抑制率。肿瘤抑制率(%)=[(对照组平均肿瘤质量-治疗组平均肿瘤质量)÷对照组平均肿瘤质量]×100%。
2.2 脾淋巴细胞的制备小鼠脱脊椎处死后无菌取其脾脏,将脾脏用玻璃片磨碎,过膜,离心(1 200 r/min,4 ℃,5 min,离心半径25 cm)。弃去上清,沉淀加入红细胞裂解液(每个脾脏约1 mL),混匀,静置1 min,加入PBS,离心(1 200 r/min,4 ℃,5 min,离心半径25 cm)。再加入PBS,过膜,离心(1 200 r/min,4 ℃,5 min,离心半径25 cm)。将所剩细胞洗涤1~2次后,用含10%FBS的RPMI-1640将细胞调至所需浓度。
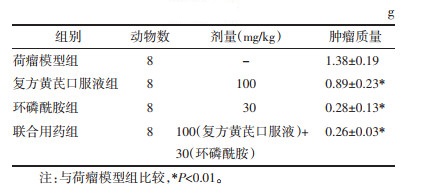
2.3 脾淋巴细胞增殖功能的检测各组脾淋巴细胞接种于96孔板(4×105个/孔),同时加入2.5 μg/mL刀豆蛋白A(ConA)进行刺激,细胞于含5%CO2培养箱中培养48 h,四甲基偶氮唑蓝(MTT)法测定各组脾淋巴细胞的增殖情况。
2.4 流式细胞术(FACS)检测对于细胞内细胞因子染色: 分离各组小鼠脾淋巴细胞,与乙酰肉豆蔻佛波酯(PMA)、离子霉素(ionomycin)及布雷菲德菌素A(BFA)于5%CO2培养箱中共培养4 h,结束后收集细胞,冼液洗涤2次,加入免疫球蛋白G(IgG)抗体封闭氟达拉滨+环磷酰胺+利妥昔单抗(FCR),4 ℃作用10 min以封闭Fcγ受体(FcγR),FACS洗液洗涤1次后,加入PE-Cy7小鼠CD4抗体,进行表面标志染色。完毕后,固定液中固定,FACS洗液洗涤1次,将细胞悬于穿膜液中,加入抗IL-17A和IFN-γ荧光染料,流式细胞仪检测分析。对于细胞内特异转录因子Foxp3的检测,无需上述刺激,进行细胞内细胞因子染色,流式细胞仪检测,flowjo软件分析。
2.5 统计学分析数据统计分析采用SPSS 17.0统计软件包。所有实验数据以均数±标准差(x±s)表示,组间比较采用t检验或单因素方差分析,P < 0.05为差异有统计学意义。
3 实验结果 3.1 复方黄芪口服液对H22荷瘤小鼠抗肿瘤效应的影响结果显示,与荷瘤模型组比较,复方黄芪口服液组、环磷酰胺组、联合用药组肿瘤质量较低(P<0.01)。与环磷酰胺组比较,联合用药组肿瘤质量无统计学差异(P>0.05)。见表 1。
MTT检测结果显示,复发黄芪口服液组、环磷酰胺组、联合用药组A值显著高于荷瘤模型组,差异具有统计学意义(P < 0.05或P < 0.01);与环磷酰胺组比较,联合用药组A值显著增加,差异具有统计学意义(P < 0.01)。见表 2。
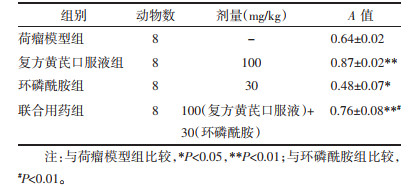
药物干预16 d后眼眶取血进行血常规检测,结果显示,与荷瘤模型组小鼠比较,环磷酰胺组小鼠外周血白细胞数、中性粒细胞数降低,差异具有统计学意义(P < 0.01);与环磷酰胺组比较,联合用药组白细胞数和中性粒细胞数增加,差异有统计学意义(P < 0.05或P < 0.01)。见表 3。
FACS检测结果表明,与荷瘤模型组比较,环磷酰胺组能够显著抑制H22荷瘤小鼠Th1细胞(CD4+IFN-γ+T细胞)比例(P<0.01)。与环磷酰胺组比较,联合用药组Th1细胞比例升高(P < 0.05)。见图 1。
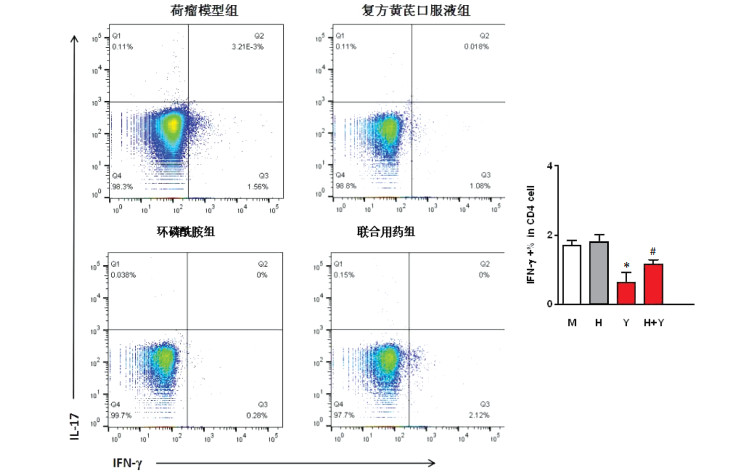
|
| 注:M表示荷瘤模型组,H表示复方黄芪口服液组,Y表示环磷酰胺组,H+Y表示联合用药组;与荷瘤模型组比较,*P < 0.01;与环磷酰胺组比较,#P < 0.05。 图 1 复方黄芪口服液对H22荷瘤小鼠Th1细胞(IFN-γ)表达的影响(x±s,n=8) |
Treg细胞是机体维持自身内环境稳定的主要免疫调节机制。CD4+Foxp3+Treg细胞具有天然的免疫抑制力,在肿瘤发生发展过程中发挥重要作用。FACS检测结果表明,与荷瘤模型组比较,环磷酰胺组Treg细胞表达水平增加,降低了机体抗肿瘤的免疫反应。与环磷酰胺组比较,联合用药组小鼠体内具有免疫抑制作用的CD4+Foxp3+Treg细胞比例下调(P<0.05),提示复方黄芪口服液联合环磷酰胺能够下调Treg细胞比例,进而增强机体抗肿瘤的免疫效应。见图 2。
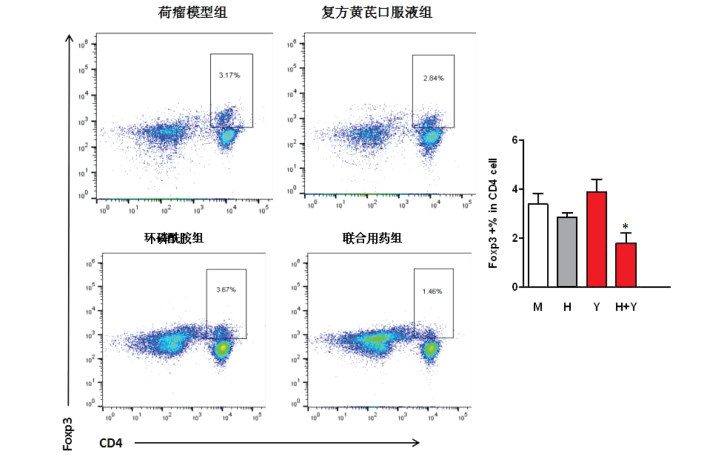
|
| 注:M表示荷瘤模型组,H表示复方黄芪口服液组,Y表示环磷酰胺组,H+Y表示联合用药组;与环磷酰胺组比较,*P < 0.05。 图 2 复方黄芪口服液对H22荷瘤小鼠Treg细胞表达的影响(x±s,n=8) |
复方黄芪口服液依据孟河医派学术思想,运用现代制剂工艺,制成口服制剂[2-3]。虚证多指正气虚弱,现代研究表明虚证患者常表现为细胞免疫功能低下、体液免疫功能紊乱,可见“正气”是机体免疫能力的一种中医表达方式[4]。化疗是治疗肿瘤的一个重要手段,肿瘤化疗最常见的问题是化疗药对骨髓干细胞的毒性作用,从而导致白细胞、中性粒细胞数量减少,使治疗中断,肿瘤得不到控制。由化疗所致的白细胞减少症,临床上表现为头目昏眩、神疲乏力、面色无华,可归为中医虚证。环磷酰胺是常用的肿瘤化疗药物,其应用广泛,能杀死有丝分裂和进入循环周期的细胞,且无选择性,对骨髓干细胞产生毒性作用,从而导致白细胞、中性粒细胞数量减少。同时对机体免疫功能具有较强的抑制作用,导致机会性感染[5]。
本研究通过构建H22荷瘤小鼠模型,从抗肿瘤疗效、白细胞数、中性粒细胞数、淋巴细胞增殖、T细胞亚群表达等多个层面揭示复方黄芪口服液联合化疗药物环磷酰胺抗肿瘤的免疫效应及机制,为复方黄芪口服液的进一步研究和临床推广奠定理论基础。结果显示,与单用环磷酰胺相比,复方黄芪口服液联合环磷酰胺对肿瘤的抑制效应无显著影响,然而其能够显著增加白细胞数和中性粒细胞数,提高荷瘤小鼠淋巴细胞的增殖功能。
肿瘤免疫治疗遵循免疫识别、免疫活化和免疫效应3个基本过程,T淋巴细胞是这一过程中的主要实施者[6]。未致敏的CD4 T细胞经抗原刺激活化后成为CD4+T淋巴细胞,CD4+T淋巴细胞在不同因素作用下,进一步向Th1、Ⅱ型辅助性T细胞(Th2)、Treg细胞等功能性细胞类型分化。Th1类细胞主要分泌IFN-γ、白细胞介素-2(IL-2)、白细胞介素-12(IL-12),在细胞介导的免疫应答反应中起重要作用[7]。Th2细胞主要分泌白细胞介素-4(IL-4),主要介导机体的体液免疫反应。Treg细胞主要在胸腺产生,可以诱导免疫耐受,通过分泌细胞因子,包括白细胞介素-10(IL-10)和转化生长因子-β(TGF-β)发挥免疫负调节作用,是机体维持自身内环境稳定的主要免疫调节机制,这些T淋巴细胞亚群的平衡与抗肿瘤免疫密切相关[8]。FACS检测结果表明,复方黄芪口服液联合环磷酰胺能够提高H22荷瘤小鼠Th1细胞(IFN-γ)比例,下调具有免疫负调控作用的Treg细胞比例,提示复方黄芪口服液可能通过促进Th1的激活,下调Treg细胞介导的免疫负调控机制,从而增强抗肿瘤免疫效应。
| [1] |
HOEPNER S, LOH J M, RICCADONNA C, et al. Synergy between CD8 T cellsand Th1 or Th2 polarised CD4 T cells for adoptive immunotherapy of brain tumours[J]. PLoS One, 2013, 8(5): e63933. DOI:10.1371/journal.pone.0063933 |
| [2] |
华丰. 复方黄芪口服液薄层鉴别[J]. 时珍国医国药, 2001, 12(1): 12. HUA F. TLC identification of compound huangmao oral liquid[J]. LiShiZhen Medicine and Materia Medica Research, 2001, 12(1): 12. DOI:10.3969/j.issn.1008-0805.2001.01.035 |
| [3] |
杨洪元, 周小斌, 王裕盛. 复方黄芪口服液中总皂苷含量测定[J]. 亚太传统医药, 2013, 9(12): 26-27. YANG H Y, ZHOU X B, WANG Y S. Determination of total saponins infufanghuangqi oral liquid[J]. Asia-Pacific Traditional Medicine, 2013, 9(12): 26-27. |
| [4] |
孙理军, 杨宗林. 论扶正祛邪治疗的现代免疫机制[J]. 陕西中医学院学报, 2002, 25(2): 4-6. SUN L J, YANG Z L. On the modern immune mechanism of fuzhengquxie treatment[J]. Journal of Shaanxi College of Traditional Chinese Medicine, 2002, 25(2): 4-6. DOI:10.3969/j.issn.1002-168X.2002.02.002 |
| [5] |
赵弋清, 罗霞, 陈东辉, 等. 不同剂量环磷酰胺诱导正常小鼠免疫抑制的对比研究[J]. 免疫学杂志, 2005, 21(z1): 122-124, 128. ZHAO Y Q, LUO X, CHEN D H, et al. Comparison of immunosuppression induced by different doses of cyclophosphamide in normal mice[J]. Immunological Journal, 2005, 21(z1): 122-124, 128. |
| [6] |
储以微. 基于T淋巴细胞的肿瘤免疫综合治疗[J]. 上海医学, 2019, 42(7): 431-432. CHU Y W. Tlymphocyte-based tumor immunotherapy[J]. Shanghai Medical Journal, 2019, 42(7): 431-432. |
| [7] |
ANSEL K M, LEE D U, RAO A. An epigenetic view of helper T cell differentiation[J]. Nature Immunology, 2003, 4(7): 616-623. DOI:10.1038/ni0703-616 |
| [8] |
KING C, TANGYE S G, MACKAY C R. T follicular helper (TFH) cells in normal and dysregulated immune respo- nses[J]. Annual Review of Immunology, 2008, 26: 741-766. DOI:10.1146/annurev.immunol.26.021607.090344 |
 2022, Vol. 41
2022, Vol. 41