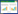文章信息
- 刘海帆, 崔洁, 王文全
- LIU Haifan, CUI Jie, WANG Wenquan
- 甘草地上部分黄酮类成分的代谢物及药代动力学参数研究概述
- Overview of study on metabolites and pharmacokinetic parameters of flavonoids in theaerial part of Glycyrrhiza uralensis
- 天津中医药大学学报, 2022, 41(1): 90-101
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(1): 90-101
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.01.19
-
文章历史
收稿日期: 2021-10-17
2. 中药材规范化生产教育部工程研究中心, 北京 100102
2. Engineering Research Center of Good Agricultural Practice for Chinese Crude Drugs, Ministry of Education, Beijing 100102, China
黄酮类化合物,是指具有两个芳香环并成C6-C3-C6形式联结的一系列化合物,是自然界分布较广泛的一类次生代谢产物[1]。它具有多方面的药理活性,如抗氧化自由基[2]、抗肿瘤[3]、抗菌、抗病毒[4]、抗炎镇痛[5]、保护心脑血管和保护肝脏[6]等。甘草地上部分为甘草(Glycyrrhiza uralensis Fisch.)的干燥茎叶,据文献报道,其总黄酮含量可达5.64%[7]。现代研究表明甘草地上部分黄酮具有较多药理活性。二氢黄酮乔松素是光果甘草叶中主要的黄酮类物质,董怡[7]对其进行活性评价,结果表明乔松素具有良好的抗氧化能力和亚硝酸盐清除能力。李红丽[8]对甘草地上部分水溶性黄酮类成分进行富集工艺考察,研究表明脂溶性较大的梯度抗慢性非细菌性前列腺炎活性最好。康雪芳[9]富集甘草地上部分脂溶性成分,证实了甘草地上部分脂溶性黄酮类成分具有抗氧化和抗慢性非细菌性前列腺炎的活性。杨玉梅等[10]研究发现甘草叶总黄酮有较好的抗凝血作用。董菁等[11]通过体外细胞毒性实验研究甘草叶总黄酮对小鼠骨髓巨噬细胞(BMC)及腹腔巨噬细胞(PEC)的作用,结果表明其能诱导BMC和PEC产生具有杀伤作用的细胞毒因子。傅乃武等[12]将胀果甘草叶中提取的6种黄酮进行混合,并验证了其具有抗促癌和抑制促癌物诱发的脂质过氧化作用。据以上内容可知甘草地上部分黄酮类成分具有显著的药理活性,且应用广泛。
药物代谢动力学(PK)是应用动力学的原理与数学处理方法,定量地描述药物通过各种给药途径进入机体后的吸收、分布、代谢和排泄等过程的动态变化规律,并提出解释这些动态规律数学关系式的学科[13]。黄酮类化合物的生物活性除了其潜在的内在作用机制外,还依赖于其代谢物由于快速和广泛的生物转化而产生的活性。所以体内代谢物出现的信息,对适当评估其生物活性至关重要。
为了充分开发利用甘草的药用资源,完善甘草地上部分研究,笔者拟以甘草地上部分的黄酮类成分为研究对象,综述甘草地上部分主要黄酮类物质的PK参数及代谢特征,为其药效物质基础研究、临床应用和药用资源的合理开发利用提供理论支持。
1 甘草地上部分黄酮类成分概述甘草地上部分黄酮类物质主要有黄酮、黄酮苷、黄酮醇、黄酮醇苷、二氢黄酮、异黄酮、二氢异黄酮、异黄烷等种类。目前甘草地上部分黄酮类化合物研究多以乌拉尔甘草为主,周彪[14]研究表明,乌拉尔甘草与光果甘草地上部分具有很多相同的化学结构,但汪一飞等[15]研究表明,光果甘草与乌拉尔甘草和胀果甘草相比,叶中的总黄酮含量较高,提示光果甘草可以作为重点研究对象。董怡[16]研究表明,光果甘草叶与茎中的黄酮类化学成分相似,但茎中含量明显较少,有显著差异。根据统计信息可知,甘草地上部分黄酮类物质以苷元为主,其中二氢黄酮为其主要化学成分,且多由异戊二烯基取代。光果甘草与乌拉尔甘草叶中主要成分为乔松素[7],提示在研究甘草地上部分黄酮类成分时可多关注光果甘草叶中的二氢黄酮类成分,且乔松素可作为甘草地上部分的主要研究对象之一。
笔者主要统计了甘草地上部分分离鉴定的73种黄酮类成分,包括黄酮苷3个、黄酮醇苷4个、黄酮9个、黄酮醇11个、异黄酮9个、异黄酮醇1个、二氢黄酮22个、二氢异黄酮6个、二氢黄酮醇2个、异黄烷6个[16-33],具体信息见表 1。
20世纪90年代,黑龙江中医药大学王喜军教授[3]认为入血成分才是中药的有效成分,但是有些成分生物利用度很低,未能达到最低有效浓度,或者消除、排泄太快,这类成分很难被认为是有效成分。因此,对于这些成分有必要进行PK特征分析,获得具有适宜的PK特征的入血成分和达靶成分(包括原形药物及其代谢产物),即PK标志物,才可能明确是中药的药效成分[4]。掌握药物代谢规律,对于设计更合理的给药途径、给药方法、给药剂量均具有重要意义。因此,作者对近年来甘草地上部分黄酮类成分的体内代谢产物研究进行了总结归纳[31, 34-35, 39, 45-47, 54-61],见表 2。
黄酮类化合物在体内存在2个主要的代谢部位,一是肝脏,在肝脏细胞色素P450作用下逐渐发生羟化反应或脱甲基反应,然后在Ⅱ相酶催化下发生葡萄糖醛酸化、硫酸化等结合反应,生成水溶性更高的代谢物排出体外;二是肠道,该过程黄酮苷经肠道菌群的代谢转变为苷元,肠道菌群也会使黄酮环裂解产生多种酚酸,这些代谢产物也能被再次吸收,最后经肾脏排出。
2.1 黄酮苷类成分的代谢特征甘草地上部分黄酮苷类成分主要包括黄酮苷、黄酮醇苷类化合物。研究表明,他们在肠道与肝脏中的代谢具有共性特征。
2.1.1 黄酮苷类成分在肠道中的代谢特征黄酮苷在肠道菌群作用下会发生糖基水解反应,之后进入肠上皮细胞的成分会发生进一步代谢。Liu等[34]发现夏佛塔苷在肠道菌群中主要有脱糖及氧化等代谢产物,大鼠灌胃给予夏佛塔苷后,可在粪便中检测到水解、乙酰化、甲基化等产物,说明夏佛塔苷经过肠道菌群初步代谢后,进入肠上皮细胞的成分会在细胞酶的作用下发生进一步代谢。伍明江等[35]发现芦丁在粪便中主要有水解和硫酸化等代谢产物,Jaganath等[36]让健康志愿者和回肠造口术患者摄入含芦丁的西红柿汁后,在健康志愿者血液和尿液中检测出芦丁代谢物,而回肠造口术患者中未检测到,说明芦丁在大肠中被吸收。Jin等[37]也发现人体肠道细菌可以将葛根素转为大豆苷元,提示黄酮苷类成分在经过胃和小肠后,未被吸收的成分还可能在肠道菌群的作用下被人体吸收。研究表明,只有少部分黄酮苷被小肠吸收,大部分糖基化黄酮类化合物将到达结肠,在结肠微生物菌群作用下,将其分解成酚酸或其他可被机体吸收的代谢产物[38]。
2.1.2 黄酮苷类成分在肝脏中的代谢特征小肠中的空肠和回肠细胞主要将黄酮以苷的形式从肠腔面转运到门静脉,且黄酮苷类成分经肠道菌群水解后的代谢产物从门静脉进入肝脏后继续被代谢转化,在肝脏中的Ⅰ相代谢主要为水解和氧化反应,氧化代谢主要由肝脏细胞色素P450酶(CYPs)介导;肝脏中发生的Ⅱ相代谢主要为葡萄糖醛酸化、硫酸化及甲基化反应,葡萄糖醛酸化产物最后多由肾脏排出。崔升淼等[39]研究发现葛根素在肝微粒体中发生水解反应,代谢产物为大豆苷元。Gradolatto等[40]发现芹菜素的代谢产物主要为葡萄糖醛酸结合产物和硫酸结合产物,但没有检测到氧化产物木犀草素及其衍生物,说明黄酮苷类化合物参与肝脏代谢的主要途径是结合反应。
2.2 黄酮苷元类成分的代谢特征甘草地上部分黄酮苷元类成分主要包括黄酮、黄酮醇、二氢黄酮、异黄酮、二氢异黄酮、异黄烷类化合物。研究表明,黄酮醇类化合物主要是以被动扩散的方式吸收,二氢黄酮类、异黄酮类、二氢异黄酮类化合物的吸收方式有被动扩散、主动转运和载体介导[41],异黄酮类化合物的吸收显著强于黄酮类化合物[42]。
2.2.1 黄酮苷元类成分在肠道中的代谢特征研究表明,浓度较高的黄酮苷元类成分可直接被机体吸收,浓度较低的化合物可进入循环系统。A或B环上含有甲氧基的黄酮类成分在粪便菌丛中较难降解,如香叶木素[43]。王俊等[44]考察了槲皮素、山柰素和异鼠李素3种主要苷元在大鼠体内的肠吸收动力学特征,结果表明此3种成分在大鼠肠道内的吸收呈现一级吸收动力学特征,其吸收机制为被动扩散,易被吸收。黄酮苷元类成分在肠道中可发生Ⅰ相代谢,Griffiths等[45]研究发现山奈酚在肠道中发生羟基化,覃小丽等[46]发现槲皮素在肠道中发生羟基化、脱氧等Ⅰ相代谢,但黄酮苷元类化合物在肠道中主要发生Ⅱ相代谢,主要有羟基化、葡萄糖醛酸化、甲基化等反应。Shimoi等[31]研究发现,木犀草素在小肠菌群中检测到葡萄糖醛酸化产物,杨琳[47]在大鼠粪便中也检测到葡萄糖醛酸化产物。黄酮苷元类成分在肠道中较易发生裂环反应,肠菌水解生成的黄酮苷元物质一部分被大肠直接吸收,另外一部分可被进一步裂解,产生小分子酚酸类成分吸收入血。裂环类型大致可分为4种: 1)黄酮和黄烷酮类,生成C6-C3型酚酸。2)黄酮醇类,生成C6-C2型酚酸。3)黄烷醇类,经苯基-B-戊酸内酯中间体生成C6-C3型酚酸。4)异黄酮类,生成乙基酚衍生物[48]。
2.2.2 黄酮苷元类成分在肝脏中的代谢特征黄酮苷元类成分较黄酮苷类成分更容易被肝脏吸收,Vacek等[49]用原代培养的肝细胞悬液温孵法研究了槲皮素、芦丁、异槲皮苷的代谢,结果发现他们主要的代谢产物是甲基化黄酮醇和葡萄糖苷酸化产物,槲皮素比芦丁、异槲皮苷更易发生代谢。且黄酮苷元类成分的代谢多发生于肝脏中,肠道参与部分代谢。于红宇等[50]研究2种重组人源化葡萄糖醛酸转移酶UGT1A9(主要存在于肝脏)和UGT1A10(主要存在于肠道)对染料木素的代谢作用,发现随着浓度增加,UGT1A9呈现出更快的代谢速率,提示染料木素的主要代谢部位在肝脏,肠道参与部分代谢。
黄酮苷元类成分在肝微粒体中主要发生氧化及结合代谢,但结合代谢(葡萄糖醛酸化、甲基化等)强于氧化代谢。研究发现,在人肝细胞的细胞质中,高良姜素主要经葡萄糖醛酸化作用,其次是硫酸化作用[51]。而CYPs介导的氧化反应很弱。Otake等[51]研究了人肝微粒体中高良姜素的代谢,发现高良姜素在人肝微粒体中易于在B环4′位发生氧化代谢,且结合代谢远强于氧化代谢。大鼠肝细胞及亚细胞制备物中,山柰酚的代谢主要为A环7位羟基葡萄糖醛酸化[52]。Boersma等[53]分析了人、鼠肝肠微粒体孵育液中木犀草素和槲皮素的代谢产物,结果表明两者葡萄糖苷酸化发生的主要位置是7、3、3'或4'位羟基部分,这就使得木犀草素和槲皮素的结合代谢尤其显著。
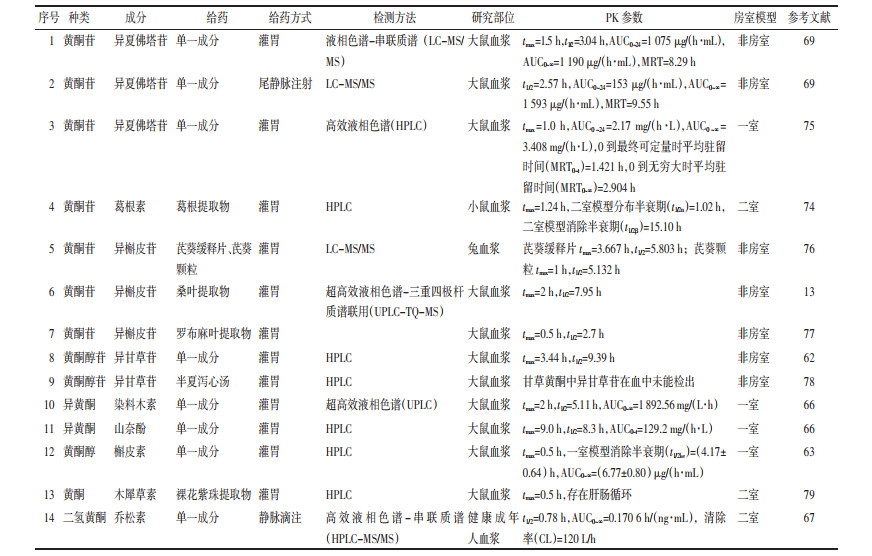
3 甘草地上部分黄酮类成分PK参数概述PK利用动力学原理,研究药物在体内吸收、分布、代谢和排泄与时间关系,为临床个体化给药的实现奠定基础。近年来,黄酮类成分的体内PK过程研究日渐成为热点,作者对近年来甘草地上部分黄酮类成分体内PK参数研究进行总结归纳。
3.1 不同成分对PK参数的影响对黄酮类成分而言,黄酮苷与黄酮苷元之间PK参数差异很大,苷类成分的血药浓度远大于苷元类成分,但其半衰期(t1/2)、平均驻留时间(MRT)远小于苷元类成分。王杰等[62]研究发现异甘草苷灌胃给药后达峰时间(tmax)=3.44 h,t1/2=9.39 h,0到无穷大时药时曲线下面积(AUC0~∞)=(1.51±0.54) (ng·h)/mL,0~24 h药时曲线下面积(AUC0~24)=(0.96±0.38) (ng·h)/mL,最大血药浓度(Cmax)=(0.10±0.02) mg/mL。朱红岗等[63]研究发现槲皮素灌胃给药后tmax=0.5 h,t1/2=(4.17±0.64) h,AUC0~∞=(6.77±0.80)(μg·h)/mL,AUC0~24=(6.72±0.88)(μg·h)/mL,Cmax=(2.03±0.41) μg/mL,推测黄酮苷类成分灌胃后达到Cmax较长、t1/2较长,而黄酮苷元类成分达到Cmax较短,故与代谢物结合分析可知黄酮苷口服生物利用率低,其相对分子质量大,极性强,在胃肠道转运过程中难以溶解。
研究表明,黄酮苷元类成分的药时曲线较易出现双峰现象,张颖等[64]在研究中发现槲皮素有二次达峰现象。王大力等[65]的研究同样发现槲皮素约2/3在灌流过程中被吸收进入肠壁,但同时又有52%以葡萄糖醛酸苷或硫酸苷结合物的形式重新分泌入肠,从而出现双峰现象。
药物进入体内后,机体各部位的药物量不断变化,隔室模型的研究有利于更好地描述这种复杂的变化过程。黄酮苷体内分布基本呈二室开放模型,少量实验显示呈一室开放模型,结合黄酮苷的代谢产物研究,可以推测黄酮苷在体内是以次苷或苷元的形式发挥药效作用。而甘草地上部分苷元类成分大多符合一室模型[63, 66],少量呈二室模型[67],说明部分苷元类成分在体内各部位分布速度没有显著差异。朱红岗等[63]考察灌胃后大鼠体内槲皮素的血药浓度及PK特点,按赤池信息准则(AIC)最小原则,结合相关指标选择房室模型,拟合的口服给药药时曲线符合一室模型。
3.2 不同剂型、剂量对PK参数的影响Wojciki等[68]研究3种黄酮类成分--槲皮素、山柰酚和异鼠李素的不同剂型对PK参数的影响,18位健康受试者单剂量交叉口服同剂量的胶囊、滴丸、片剂,以胶囊为参比处方,测定了3种黄酮苷的tmax及药时曲线下面积(AUC)。其中胶囊的tmax较滴丸和片剂明显推后,滴丸的AUC在三者中最大,但无显著差异。梁枫等[69]研究发现夏佛塔苷6 mg/kg灌胃给药后t1/2=3.04 h,而以0.5 mg/kg剂量尾静脉注射后t1/2=2.57 h,表明经灌胃与静脉注射后PK参数相差较大,静脉注射较灌胃达到最大血药浓度所用时间较短,且静脉注射较灌胃剂量小。
自微乳给药系统是中药难溶性活性成分的优良载体,可显著促进肠道吸收,提高中药口服生物利用度,如葛根素、银杏叶总黄酮自微乳等[70]。Nicolau等[71]报道至少有70多种中药活性成分及提取物已制成脂质体,其PK行为明显改善,表现为吸收明显加快,生物利用度提高,如姜黄素脂质体口服液在大鼠体内的tmax=18.90 min,小于姜黄素混悬液(36.42 min),吸收半衰期(t1/2ka)=5.84 min,同样小于混悬液(20.13 min)[72]。可知给药剂型对各成分在体内的分布时间与生物利用度有影响,提示在研究甘草地上部分药效时,需考虑剂型及给药方式的影响。
Uchida等[73]进行了小柴胡汤在健康男性受试者体内的PK研究,受试者间隔两周分别服用5 g或10 g的小柴胡汤后,测定其PK参数和用药前后的免疫情况。黄芩苷AUC和Cmax随剂量增加而增大,AUC从(316.9±1.4) ng/(h·mL)增加到(896.1±316.1) ng/(h·mL),与治疗作用呈非线性关系(r=0.759,P=0.080),Cmax则从(55.6±14.7) ng/mL增加到(100.5±38.7) ng/mL,其Cmax与治疗作用相关但不显著(r=0.808,P=0.052)。从给药前后免疫指标看,小柴胡汤的药效无剂量依赖关系。甘草地上部分一些黄酮类成分易受其他物质影响,如大鼠口服槲皮素50 mg/kg后,可在血浆中被检测到[63],但葛根提取物需口服10 g/kg才可检测到槲皮素[74],提示在同时检测甘草地上部分多个有效成分的PK特征时,需考虑增加灌胃剂量以达到个别成分的检测标准。具体见表 3[13, 62-63, 66-67, 69, 74-79]。
甘草在历代本草中均有记载,是中医临床常用药,在民间也被广泛使用。近年来,甘草地上部分在治疗生殖系统疾病方面有较好的效果,甘草地上部分化学成分分析及PK研究成为国内研究的焦点。在体内PK研究中发现,甘草地上部分中,部分成分并非仅以原型进入人体血液发挥作用。因此,积极寻找适宜的指标性成分并开展相关的PK研究,对其药效学物质基础研究具有重大意义。
目前国内外对黄酮类化合物的PK研究尚处于初期阶段,关于甘草地上部分药理活性有效成分、作用机制及有效成分PK的研究较少。鉴于黄酮为甘草地上部分的主要有效物质,有必要进一步丰富和提高黄酮化合物的体内分析方法,深入研究其中重要黄酮类物质的体内PK和代谢情况,提示研究者今后可将这些方面作为研究重点,对于挖掘中医药宝藏,提高植物新药的开发潜力,推动植物药走向世界具有特殊的重要意义。
| [1] |
郭忠军, 麻常娟. 甘草地上部分黄酮研究概况[J]. 航空航天医药, 2005, 16(1): 62-64. GUO Z J, MA C J. An overview of studies on flavonoids in the aerial parts of Glycyrrhiza uralensis[J]. Aerospace Medi- cine, 2005, 16(1): 62-64. DOI:10.3969/j.issn.2095-1434.2005.01.058 |
| [2] |
黄雨婷, 迟宗良, 王姝梅, 等. 甘草中的黄酮类成分及其抗肿瘤活性研究进展[J]. 中国新药杂志, 2017, 26(13): 1532-1537. HUANG Y T, CHI Z L, WANG S M, et al. Research progress on Licorice flavonoids and their antitumor activities[J]. Chinese Journal of New Drugs, 2017, 26(13): 1532-1537. |
| [3] |
王喜军. 中药及中药复方的血清药物化学研究[J]. 世界科学技术, 2002, 4(2): 1-4. WANG X J. Study on serum pharmacochemistry of traditional Chinese medicine and its compound[J]. World Science and Technology, 2002, 4(2): 1-4. DOI:10.3969/j.issn.1674-3849.2002.02.001 |
| [4] |
LU T, YANG J, GAO X, et al. Plasma and urinary tanshinol from Salvia miltiorrhiza (Danshen) can be used as pharmacokinetic markers for cardiotonic pills, a cardiovascular herbal medicine[J]. DrugMetabolism & Disposition, 2008, 36(8): 1578-1586. |
| [5] |
CHENG T, SHENG T, YI Y, et al. Metabolism profiles of icariin in rats using ultra-high performance liquid chromat- ography coupled with quadrupole time-of-flight tandem mass spectrometry and in vitro enzymatic study[J]. Journalof ChromatographyB, Analytical Technologies in the Biomedi- caland Life Sciences, 2016, 103(3): 353-360. |
| [6] |
李红丽, 康雪芳, 侯俊玲, 等. 甘草地上部分水提液总黄酮纯化工艺研究[J]. 辽宁中医药大学学报, 2016, 18(8): 60-63. LI H L, KANG X F, HOU J L, et al. Purification of total flavonoids of water extract from the aerial parts of licorice[J]. Journalof Liaoning Universityof Traditional Chinese Medicine, 2016, 18(8): 60-63. |
| [7] |
董怡. 光果甘草叶黄酮的分离纯化、活性研究及应用[D]. 广州: 华南理工大学, 2016. DONG Y. Purification of flavonoids from Glycyrrhiza Glabra L. Leaf and their biological activities and applications[D]. Guangzhou: South China University of Technology, 2016. |
| [8] |
李红丽. 甘草地上部分水溶性成分的抗氧化及抗CNP活性研究[D]. 北京: 北京中医药大学, 2016. LI H L. Study on antioxidation and CNP activity of water soluble components in the aerial parts of Glycyrrhiza uralensis[D]. Beijing: Beijing University of Traditional Chinese Medicine, 2016. |
| [9] |
康雪芳. 甘草地上部分脂溶性成分抗氧化及抗CNP活性研究[D]. 北京: 北京中医药大学, 2016. KANG X F. Study on antioxidation and anti-CNP activity of liposoluble components in the aerial parts of Glycyrrhiza uralensis[D]. Beijing: Beijing University of Traditional Chinese Medicine, 2016. |
| [10] |
杨玉梅, 覃建民, 徐继辉, 等. 甘草总黄酮对大鼠血栓形成和凝血时间的影响[J]. 包头医学院学报, 2003, 19(2): 90-91. YANG Y M, QIN J M, XU J H, et al. Effect of total flavonoids of licorice on thrombosis and coagulation time in rats[J]. Journal of Baotou Medical College, 2003, 19(2): 90-91. DOI:10.3969/j.issn.1006-740X.2003.02.002 |
| [11] |
董菁, 王秀梅, 杨棉华, 等. 甘草叶中黄酮成分体外诱生细胞毒因子的实验研究[J]. 汕头大学医学院学报, 1994, 11(2): 9-11. DONG J, WANG X M, YANG J H, et al. Experimental study on cytotoxic factors induced by flavonoids from Glycyrrhiza uralensis Leaves in vitro[J]. Journal of Shantou University Medical College, 1994, 11(2): 9-11. |
| [12] |
傅乃武, 刘朝阳, 张如意. G9315抗促癌和抑制促癌物诱发的脂质过氧化作用[J]. 中草药, 1995, 26(8): 411-413. FU N W, LIU Z Y, ZHANG R Y. G9315 Anticancer and inhibition of lipid peroxidation induced by cancer promoters[J]. Chinese Traditional and Herbal Drugs, 1995, 26(8): 411-413. DOI:10.3321/j.issn:0253-2670.1995.08.008 |
| [13] |
张立雯, 季涛, 宿树兰, 等. 桑叶黄酮类和生物碱类成分在正常和糖尿病大鼠体内的药代动力学研究[J]. 中国中药杂志, 2017, 42(21): 4218-4225. ZHANG L W, JI T, SU S L, et al. Pharmacokinetics of Mori Folium flavones and alkaloids in normal and diabetic rats[J]. China Journal of Chinese Materia Medica, 2017, 42(21): 4218-4225. |
| [14] |
周彪. 乌拉尔甘草与胀果甘草地上部分化学成分研究[D]. 阿拉尔: 塔里木大学, 2015. ZHOU B. Chemical constituents from the aerial parts of Glycyrrhiza uralensis and Glycyrrhiza inflata[D]. Alear City: Tarim University, 2015. |
| [15] |
汪一飞, 左小博, 刘相真, 等. 不同品种甘草叶的化学组分比较研究[J]. 食品安全质量检测学报, 2016, 7(5): 2075-2080. WANG Y F, ZUO X B, LIU X Z, et al. Comparison of chemical components of Glycyrrhiza leaves originated from different varieties[J]. Journal of Food Safety Quality Testing, 2016, 7(5): 2075-2080. |
| [16] |
贾世山, 马超美, 王建民. 甘草叶中黄酮类成分的化学研究[J]. 药学学报, 1990, 25(10): 758-762. JIA S S, MA C M, WANG J M. Chemical study on flavonoids in licorice leaves[J]. Acta Pharmaceutica Sinica, 1990, 25(10): 758-762. |
| [17] |
白虹. 栽培乌拉尔甘草和直立白薇的化学成分研究[D]. 沈阳: 沈阳药科大学, 2005. BAI H. Studies on constituents of cultivated Glycyrrhiza uralensis Fisch. and Cynanthum Bge[D]. Shenyang: Shenyang Pharmaceutical University, 2005. |
| [18] |
YE R, FAN Y H, MA C M. Identification and enrichment of alpha-Glucosidase-inhibiting dihydrostilbene and flavonoids from glycyrrhiza uralensis leaves[J]. Journal of Agricultural and Food Chemistry, 2017, 65(2): 510-515. DOI:10.1021/acs.jafc.6b04155 |
| [19] |
曾小英. 新疆胀果甘草叶化学成分研究及湖北省不同生态区烟草质量评价[D]. 武汉: 中南民族大学, 2010. ZENG X Y. Studies on chemical constituents of leaf of Glycyrrhiza Inflata Bat. and the quality evaluation of tobacoo from different areas[D]. Wuhan: South-Central University for Nationalities, 2010. |
| [20] |
范靖然. 乌拉尔甘草地上部分的化学成分与生物活性研究[D]. 北京: 北京中医药大学, 2019. FAN J R. Study on chemical constituents and biological activities of the aerial parts of Glycyrrhiza uralensis Fisch.[D]. Beijing: Beijing University of Chinese Medicine, 2019. |
| [21] |
FAAN J R, KUANG Y, DONG Z Y, et al. Prenylated phenolic compounds from the aerial parts of Glycyrrhiza uralensis as PTP1B and alpha-Glucosidase Inhibitors[J]. Journal of Natural Products, 2020, 83(4): 814-824. DOI:10.1021/acs.jnatprod.9b00262 |
| [22] |
汤以佳. 洋甘草叶的化学成分[J]. 国外医药(植物药分册), 1989, 4(3): 134. TANG Y J. Chemical constituents from leaves of Glycyrrhiza uralensis[J]. Foreign medicine (Botanicals), 1989, 4(3): 134. |
| [23] |
贾世山, 马超美, 李英和, 等. 甘草叶中酚酸和黄酮甙类成分的分离鉴定[J]. 药学学报, 1992, 27(6): 441-444. JIA S S, MA C M, LI Y H, et al. Isolation and identification of phenolic acids and flavonoids in licorice leaves[J]. Acta Pharmaceutica Sinica, 1992, 27(6): 441-444. |
| [24] |
范宇红. 甘草叶化学成分的分离鉴定、定量分析及生物活性研究[D]. 呼和浩特: 内蒙古大学, 2018. FAN Y H. Isolation, identification, quantification and bioactivity assessment of the chemical constituents in Glycyrrhiza uralensis leaves[D]. Hohhot: Inner Mongolia University, 2018. |
| [25] |
贾世山, 刘冬, 郑秀萍, 等. 甘草叶中两个新异戊烯基黄酮类化合物[J]. 药学学报, 1993, 28(1): 28-31. JIA S S, LIU D, ZHENG X P, et al. Two new isopentenyl flavonoids from licorice leaves[J]. Acta Pharmaceutica Sinica, 1993, 28(1): 28-31. DOI:10.3321/j.issn:0513-4870.1993.01.011 |
| [26] |
HAYASHI H, ZHANG S L, NAKAIZUMI T, et al. Field survey of Glycyrrhiza plants in central Asia(2). Characterization of phenolics and their variation in the leaves of Glycyrrhiza plants collected in Kazakhstan[J]. Chem Pharm Bull (Tokyo), 2003, 51(10): 1147-1152. DOI:10.1248/cpb.51.1147 |
| [27] |
MANFREDI K P, VALLURUPALLI V, DEMIDOVA M, et al. Isolation of an anti-HIV diprenylated bibenzyl from Glycyrrhiza lepidota[J]. Phytochemistry, 2001, 58(1): 153-157. DOI:10.1016/S0031-9422(01)00177-7 |
| [28] |
贾世山, 马超美, 王建民. 甘草叶中黄酮类成分的化学研究[J]. 药学学报, 1990, 25(10): 758-762. JIA S S, MA C M, WANG J M. Studies on flavonoid constituents isolated from the leaves of Glycyrrhiza uralensis Fisch[J]. Acta Pharmaceutica Sinica, 1990, 25(10): 758-762. |
| [29] |
ZHOU B, WAN C X. Phenolic constituents from the aerial parts of Glycyrrhiza inflata and their antibacterial activities[J]. Journal of AsianNatural Products Research, 2015, 17(3): 256-261. |
| [30] |
CHANG G H, BO Y Y, CUI J, et al. Main chemical constituents in aerial parts of Glycyrrhiza uralensis by UPLC-Q-Exactive Orbitrap-MS[J]. China Journal of Chinese Materia Medica, 2021, 46(6): 1449-1459. |
| [31] |
SHIMOI K, OKADA H, FURUGORI M, et al. Intestinal absorption of luteolin and luteolin 7-O-beta-glucoside in rats and humans[J]. FEBS Letters, 1998, 438(3): 220-224. DOI:10.1016/S0014-5793(98)01304-0 |
| [32] |
HIROAKI H, MIYAKO Y, NOBORU H, et al. Flavonoid variation in the leaves of Glycyrrhiza glabra[J]. Phytochemistry, 1996, 42(3): 701-704. DOI:10.1016/0031-9422(96)89776-7 |
| [33] |
INGHAM J L. An isoflavan phytoalexin from leaves of Glycyrrhiza glabra[J]. Phytochemistry, 1977, 16(9): 1457-1458. DOI:10.1016/S0031-9422(00)88812-3 |
| [34] |
LIU R, MENG C, ZHANG Z, et al. Comparative metabolism of schaftoside in healthy and calcium oxalate kidney stone rats by UHPLC-Q-TOF-MS/MS method[J]. Analytical Biochemistry, 2020, 59(7): 1136. |
| [35] |
伍明江, 吴晓磊, 张德芹, 等. UPLC-Q-TOF/MS鉴定芦丁在大鼠体内的代谢产物[J]. 中国实验方剂学杂志, 2017, 23(17): 91-97. WU M J, WU X L, ZHANG D Q, et al. Identification of Metabolites of rutin in rats by UPLC-Q-TOF/MS[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(17): 91-97. |
| [36] |
JAGANATH I B, MULLEN W, EDWARDS C A, et al. The relative contribution of the small and large intestine to the absorption and metabolism of rutin in man[J]. FreeRadicalResearch, 2006, 40(10): 1035-1046. |
| [37] |
JIN J S, NISHIHATA T, KAKIUCHI N, et al. Biotransformation of C-glucosylisoflavone puerarin to estrogenic (3S)-equol in co-culture of two human intestinal bacteria[J]. Biological and Pharmaceutical Bulletin, 2008, 31(8): 1621-1625. DOI:10.1248/bpb.31.1621 |
| [38] |
WILLIAMSON G, CLIFFORD M N. Role of the small intestine, colon and microbiota in determining the metabolic fate of polyphenols[J]. Biochemical Pharmacology, 2017, 13(9): 24-39. |
| [39] |
崔升淼, 赵春顺, 高坤, 等. 大鼠肝微粒体中葛根素的液相色谱-质谱测定法及药物代谢动力学[J]. 沈阳药科大学学报, 2007, 24(1): 32-36. CUI S M, ZHAO C S, GAO K, et al. Determination and pharmacokinetics of puerarin in rat liver microsomes by liquid chromatography-mass spectrometry[J]. Journal of Shen- yang Pharmaceutical University, 2007, 24(1): 32-36. DOI:10.3969/j.issn.1006-2858.2007.01.009 |
| [40] |
GRADOLATTO A, CANIVENC-LAVIER M C, BASLY J P, et al. Metabolism of apigenin by rat liver phase I and phase ii enzymes and by isolated perfused rat liver[J]. Drug Metabolism & Disposition, 2004, 32(1): 58-65. |
| [41] |
周乐, 赵晓莉, 狄留庆, 等. 黄酮类化合物口服吸收与代谢特征及其规律分析[J]. 中草药, 2013, 44(16): 2313-2320. ZHOU L, ZHAO X L, DI L Q, et al. Oral absorption of flavonoids and analysis of their metabolism characteristics and law[J]. Chinese Traditional and Herbal Drugs, 2013, 44(16): 2313-2320. |
| [42] |
MUROTA K, SHIMIZU S, MIYAMOTO S, et al. Unique uptake and transport of isoflavone aglycones by human intestinal caco-2 cells: comparison of isoflavonoids and flavonoids[J]. Journalof Nutrition, 2002, 132(7): 1956-1961. |
| [43] |
LIN Y T, HSIU S L, HOU Y C, et al. Degradation of flavonoid aglycones by rabbit, rat and human fecal flora[J]. Biological and Pharmaceutical Bulletin, 2003, 26(5): 747-751. DOI:10.1248/bpb.26.747 |
| [44] |
王俊, 任飞亮, 裴元英. 银杏总黄酮苷在大鼠体内的肠吸收动力学特征[J]. 中国临床药学杂志, 2005, 14(2): 91-94. WANG J, REN F L, PEI Y Y. Studies on absorption kinetics of Ginkgo blioba extract in rats' intestinc[J]. Chinese Journal of Clinical Pharmacy, 2005, 14(2): 91-94. DOI:10.3969/j.issn.1007-4406.2005.02.008 |
| [45] |
GRIFFITHS L A, SMITH G E. Metabolism of apigenin and related compounds in the rat metabolite formation in vivo and by the intestinal microflora in vitro[J]. Biochemical Journal, 1972, 128(4): 901-911. DOI:10.1042/bj1280901 |
| [46] |
覃小丽, 孙慧园, 杨武, 等. UPLC-ESI-Q-TOF-MS/MS分析槲皮苷在大鼠肠道菌群中的代谢[J]. 中国中药杂志, 2017, 42(2): 357-362. QIN X L, SUN H Y, YANG W, et al. Analysis of metabolites of quercitrin in rat intestinal flora by using UPLC-ESI-Q-TOF-MS/MS[J]. China Journal of Chinese Materia Medica, 2017, 42(2): 357-362. |
| [47] |
杨琳. 基于HPLC-MS/MS研究木犀草素在大鼠体内的代谢行为[D]. 大连: 大连理工大学, 2016. YANG L. Research on the metaboliteidentification of luteolin in rats by HPLC-MS/MS[D]. Dalian: Dalian University of Technolog, 2016. |
| [48] |
ZHANG Y B, YANG X W. Tissue distribution study of columbianadin and its active metabolite columbianetin in rats[J]. Biomedical Chromatography, 2016, 30(2): 256-262. DOI:10.1002/bmc.3543 |
| [49] |
VACEK J, PAPOUSKOVA B, KOSINA P, et al. Biotransformation of flavonols and taxifolin in hepatocyte in vitro systems as determined by liquid chromatography with various stationary phases and electrospray ionization-quadrupole time-of-flight mass spectrometry[J]. Journal of ChromatographyB, Analytical Technologies in the Biomedicaland Life Sciences, 2012, 899(5): 109-115. |
| [50] |
于红宇, 廖景光, 陈历雄, 等. 2种重组人源化葡糖醛酸化转移酶对染料木素代谢的作用研究[J]. 中国药房, 2009, 20(13): 976-978. YU H Y, LIAO J G, CHEN L X, et al. Effects of two recom-binant human glucuronytransferases enzymes on the metabolism of genistein[J]. China Pharmacy, 2009, 20(13): 976-978. |
| [51] |
OTAKE Y, WALLE T. Oxidation of the flavonoids galangin and kaempferide by human liver microsomes and CYP1A1, CYP1A2 and CYP2C9[J]. Drug Metabolism & Disposition, 2002, 30(2): 103-105. |
| [52] |
YODAGAWA S, ARAKAWA T, SUGIHARA N, et al. Glucurono and sulfo-conjugation of kaempferol in rat liver subcellular preparations and cultured hepatocytes[J]. Biological and Pharmaceutical Bulletin, 2003, 26(8): 1120-1124. DOI:10.1248/bpb.26.1120 |
| [53] |
BOERSMA M G, VANDER W H, BOGAARDS J, et al. Regioselectivity of phase Ⅱ metabolism of luteolin and quercetin by UDP-glucuronosyl transferases[J]. Chemical ResearchinToxicology, 2002, 15(5): 662-670. |
| [54] |
SCHLUPPER D, GIESA S, GEBHARDT R. Influence of biotransformation of luteolin, luteolin 7-O-glucoside, 3', 4'-dihydroxyflavone and apigenin by cultured rat hepatocytes on antioxidative capacity and inhibition of EGF receptor tyrosine kinase activity[J]. Planta Medicaqingj, 2006, 72(7): 596-603. DOI:10.1055/s-2006-931555 |
| [55] |
ZHENG L, ZHU L, ZHAO M, et al. In vivoexposure of kaempferol is driven by phase Ⅱ metabolic enzymes and efflux transporters[J]. AAPSJournal, 2016, 18(5): 1289-1299. |
| [56] |
CHEN Y, XIE S, CHEN S, et al. Glucuronidation of flavo- noids by recombinant UGT1A3 and UGT1A9[J]. Biochemical Pharmacology, 2008, 76(3): 416-425. DOI:10.1016/j.bcp.2008.05.007 |
| [57] |
NIELSEN S E, BREINHOLT V, JUSTESEN U, et al. In vitro biotransformation of flavonoids by rat liver microsomes[J]. Xenobiotica, 1998, 28(4): 389-401. DOI:10.1080/004982598239498 |
| [58] |
梁珊珊. 中药罗布麻质量控制及药效成分体内代谢研究[D]. 上海: 第二军医大学, 2012. LIANG S S. Study on quality control and metabolism of pharmacodynamic constituents in vivo for Apocynum venetum L.[D]. Shanghai: The Second Military Medical University, 2012. |
| [59] |
李元圆, 上官盈盈. UPLC-MS/MS快速鉴定乔松素在人肝微粒体中的代谢产物[J]. 中国现代应用药学, 2012, 29(2): 159-163. LI Y Y, SHANGGUAN Y Y. UPLC-MS/MS Analysis of the metabolites of pinocembrin in human liver microsome[J]. Chinese Journal of Modern Applied Pharmacy, 2012, 29(2): 159-163. |
| [60] |
李元圆, 赵婷, 徐冲, 等. 乔松素在大鼠体内外代谢产物的UPLC-MS/MS鉴定[J]. 中华中医药学刊, 2012, 30(4): 752-755. LI Y Y, ZHAO T, XU C, et al. UPLC-MS/MS analysis on metabolites of pinocembrin in vivo and in vitro[J]. Chinese Archives of Traditional Chinese Medicine, 2012, 30(4): 752-755. |
| [61] |
赵文靖, 梁耀月, 王子健, 等. UHPLC-LTQ-Orbitrap质谱法鉴定染料木素在大鼠体内的代谢产物[J]. 质谱学报, 2019, 40(2): 109-122. ZHAO W J, LIANG Y Y, WANG Z J, et al. Structural elucidation of genistein metabolites in rats based on UHPLC-LTQ-Orbitrap mass spectrometry[J]. Journal of Chinese Mass Spectrometry Society, 2019, 40(2): 109-122. |
| [62] |
王杰, 张振秋, 杨燕云, 等. HPLC法测定甘草提取物灌胃大鼠中4个成分的血药浓度及其药动学研究[J]. 中华中医药杂志, 2013, 28(4): 1110-1114. WANG J, ZHANG Z Q, YANG Y Y, et al. HPLC determination of four constituents in plasma of rats perfused with licorice extract and its pharmacokinetics[J]. Chinese Archives of Traditional Chinese Medicine, 2013, 28(4): 1110-1114. |
| [63] |
朱红岗, 凌明. 大鼠体内槲皮素的血药浓度测定及其药代动力学研究[J]. 中国药业, 2013, 22(2): 14-15. ZHU H G, LING M. Study on plasma concentration and pharmacokinetics of quercetin in rats by HPLC[J]. China Pharmaceuticals, 2013, 22(2): 14-15. DOI:10.3969/j.issn.1006-4931.2013.02.008 |
| [64] |
张颖, 刘建勋, 林力, 等. HPLC-ECD法测定大鼠血浆中银杏叶黄酮成分及药代动力学研究[J]. 药物分析杂志, 2011, 31(1): 10-14. ZHANG Y, LIU J X, LIN L, et al. HPLC-ECD determination of flavonols from Ginkgo Biloba leaf extracts in rat plasma and its pharmacokinetics study[J]. Chinese Journal of Pharmaceutical Analysis, 2011, 31(1): 10-14. |
| [65] |
王大力, 狄斌, 李龙, 等. 银杏叶片中银杏黄酮在Beagle犬体内的药动学研究[J]. 中国现代应用药学, 2012, 29(6): 483-486. WANG D L, DI B, LI L, et al. Pharmacokinetics of ginkgo flavones in ginkgo leaf tablets in beagle dogs[J]. Chinese Journal of Modern Applied Pharmacy, 2012, 29(6): 483-486. |
| [66] |
白永涛, 文红梅, 彭彬, 等. UPLC法测定大鼠血浆中染料木素浓度及其药代动力学参数[J]. 中药新药与临床药理, 2010, 21(5): 512-514. BAI Y T, WEN H M, PENG B, et al. Determination of genistein and its pharmacokinetics in rat plasma by UPLC[J]. Traditional Chinese Drug Research & Clinical Pharmacology, 2010, 21(5): 512-514. |
| [67] |
YAN B, CAO G, SUN T, et al. Determination of pinocembrin in human plasma by solid-phase extraction and LC/MS/MS: application to pharmacokinetic studies[J]. Biomedical Chromatography, 2014, 28(12): 1601-1606. DOI:10.1002/bmc.3186 |
| [68] |
WOJCIKI J, GAWRONSKA-SZKLARZ B, BIEGANOWSKI W, et al. Comparative pharmacokinetics and bioavailability of flavonoid glycosides of Ginkgo biloba after a single oral administration of three formulations to healthy volunteers[J]. Material Medicine Polonica, 1995, 27(4): 141-146. |
| [69] |
梁枫, 李多, 汪荣斌, 等. 基于LC-MS/MS研究异夏佛塔苷在大鼠体内药代动力学及其绝对生物利用度[J]. 中国药科大学学报, 2019, 50(1): 75-80. LIANG F, LI D, WANG R B, et al. Pharmacokinetics and absolute bioavailability of isoschaftoside in rat by LC-MS/MS[J]. Journal of China Pharmaceutical University, 2019, 50(1): 75-80. |
| [70] |
WANG J Y, CHEN Y, ZHANG Z H. Absorption characteristics in intestine of icaritin self-microemulsion via Caco-2 monolayer model[J]. Chinese Traditional and Herbal Drugs, 2019, 43(3): 476-481. |
| [71] |
NICOLAU C, TOSI P F, ARVINTE T, et al. CD4 inserted in red blood cell membranes or reconstituted in liposome bilayers as a potential therapeutic agent against AIDS[J]. Progress in Clinical and Biological Research, 1990, 34(3): 147-177. |
| [72] |
许汉林, 孙芸, 邵继征, 等. 姜黄素脂质体在大鼠体内药代动力学研究[J]. 湖北中医学院学报, 2007, 9(1): 42-43. XU H L, SUN Y, SHAO J Z, et al. Pharmacokinetic study of curcumin liposome in rats[J]. Journal of Hubei College Traditional Chinese Medicine, 2007, 9(1): 42-43. DOI:10.3969/j.issn.1008-987X.2007.01.022 |
| [73] |
UCHIDA E, FUKASAWA I, MATSUZAKI Y, et al. Pharmacokinetics and pharmacodynamics of TJ-9 after single administration in Japanese healthy male volunteers[J]. Jpn Pharmacol Ther, 1995, 23(7): 659-670. |
| [74] |
胥秀英, 郑一敏, 傅善权, 等. 小鼠血浆葛根素的含量及其药代动力学研究[J]. 时珍国医国药, 2007, 18(12): 2960-2961. XU X Y, ZHENG Y M, FU S Q, et al. Determination of peurarin and pharmacokinetic in mouse plasma[J]. Lishizhen Medicine and Materia Medica Research, 2007, 18(12): 2960-2961. DOI:10.3969/j.issn.1008-0805.2007.12.045 |
| [75] |
陈小新, 赖小平, 李耿, 等. 葛根素自微乳在大鼠体内的药代动力学研究[J]. 中成药, 2011, 33(7): 1220-1222. CHEN X X, LAI X P, LI G, et al. Pharmacokinetics of puerarin self-microemulsion in rats[J]. Chinese Traditional Patent Medicine, 2011, 33(7): 1220-1222. DOI:10.3969/j.issn.1001-1528.2011.07.034 |
| [76] |
顾和亚, 江静怡, 周洪亮, 等. 芪葵缓释片中6种活性成分在兔血浆中的药动学研究[J]. 中草药, 2019, 50(12): 2891-2898. GU H Y, JIANG J Y, ZHOU H L, et al. Pharmacokinetic study on six active ingredients of Qikui Sustained-release Tablets in rabbit plasma[J]. Chinese Traditional and Herbal Drugs, 2019, 50(12): 2891-2898. DOI:10.7501/j.issn.0253-2670.2019.12.022 |
| [77] |
周春玲. 罗布麻叶质量控制和相关成分药代动力学研究[D]. 沈阳: 沈阳药科大学, 2011. ZHOU C L. Study on quality control and pharmacokinetics of related components in Apocynum venetum Leaves[D]. Shenyang: Shenyang Pharmaceutical University, 2011. |
| [78] |
王莹, 袁瑾, 肖娟, 等. 大鼠口服半夏泻心汤及不同配伍组中甘草活性成分的药代动力学研究[J]. 药物分析杂志, 2012, 32(8): 1331-1338. WANG Y, YUAN J, XIAO J, et al. Pharmacokinetics of active ingredients of Radix Glycyrrhizae in rats with oral administration of Banxia Xiexin Decoction and its different compatibilities[J]. Chinese Journal of Pharmaceutical Analysis, 2012, 32(8): 1331-1338. |
| [79] |
李玲娜, 马婷, 王彬, 等. 大鼠口服裸花紫珠后木犀草素的体内药动学研究[J]. 海南医学院学报, 2012, 18(11): 1541-1543. LI L N, MA T, WANG B, et al. Pharmacokinetics of luteolin in rats after oral administration of nudiflora[J]. Journal of Hainan Medical University, 2012, 18(11): 1541-1543. |
 2022, Vol. 41
2022, Vol. 41