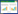文章信息
- 刘羿廷, 马旭彤, 王继林, 彭辉, 皮佳鑫, 刘志东
- LIU Yiting, MA Xutong, WANG Jilin, PENG Hui, PI Jiaxin, LIU Zhidong
- 黄芩苷-小檗碱复合物纳米晶的制备和在体肠吸收评价
- Preparation and in vivo intestinal absorption evaluation of baicalin-berberine complex nanocrystals
- 天津中医药大学学报, 2022, 41(1): 102-107
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(1): 102-107
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.01.20
-
文章历史
收稿日期: 2021-10-15
2. 天津中医药大学现代中药发现与制剂技术教育部工程中心, 天津 301617
2. Engineering Research Center of Modern Chinese Medicine Discovery and Preparation Technique, Ministry of Education, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
多数中药成分溶解度低,口服吸收效果差,严重制约了中药质量基础的科学解释和临床应用。目前,纳米晶已经成为提高中药难溶性成分口服吸收的重要途径,其具有增加药物溶解度和渗透性、提高生物利用度、减轻或避免毒副作用的优势。同时,较高载药量的特点满足了大剂量中药口服的需要,具有良好的应用前景。
中药汤剂中往往存在沉淀形式的具有生理活性的化合物[1],在临床使用中,这些沉淀因溶解度差等原因通常被舍弃,造成活性成分减少、药效降低。黄芩、黄连共煎会产生大量絮状沉淀[2],这是黄芩中的黄芩苷(BA)等黄酮类酸性成分和黄连中的小檗碱(Ber)等生物碱类成分在共同煎煮的过程中发生相互作用,生成BA-Ber复合物而产生的“自沉淀”现象[3]。初步药效学结果表明,BA-Ber复合物具有抗炎活性,对损伤的神经细胞有不同程度的保护修复功能,能够治疗溃疡性结肠炎和腹泻型肠易激综合征等疾病[4]。但是BA-Ber复合物溶解度低于BA和Ber,进而影响其在胃肠道内的吸收[5]。
本研究以“自沉淀”原理制备的BA-Ber复合物为模型药物,利用抗溶剂法结合高压均质法制备BA-Ber复合物纳米晶,并对纳米晶进行表征和在体肠吸收评价,考察纳米晶对中药难溶性成分口服吸收的影响。
1 材料 1.1 仪器万分之一天平(F124,天津亿诺科学仪器有限公司),超纯水系统(Mill-QII,美国Millipore公司),恒流泵(BT100-1L,保定兰格恒流泵有限公司),十万分之一天平(XP205,瑞士MettlerToledo公司),激光粒径测定仪(Nano-ZS,英国Marlvern公司),场发射扫描电子显微镜(SU8020,日本日立公司),加热磁力搅拌器(RET,德国IKA集团),透皮扩散实验仪(TK-20B,上海锴凯科技贸易有限公司),高速搅拌仪(RW20,德国IKA集团),高压均质机(AH100D,奥地利ATS公司)。
1.2 试药二甲基亚砜(DMSO,天津市津科精细化工研究所),BA对照品(含量≥95.4%,中国食品药品检定研究院),Ber对照品(含量≥98%,上海源叶生物科技有限公司),黄芩素(BE)对照品(含量≥98%,上海源叶生物科技有限公司),BA-Ber复合物(自制),泊洛沙姆188(P188,德国BASF股份公司)。维生素C、氯化钾(KCl)、无水氯化钠(NaCl)、七水硫酸镁(MgSO4·7H2O)、十二水磷酸二氢钠(Na2HPO4·12H2O)、碳酸氢钠(NaHCO3)、磷酸二氢钾(KH2PO4)、盐酸(HCl)、氢氧化钠(NaOH)、葡萄糖均为分析纯。
1.3 动物健康SD大鼠(200~250 g),雌雄各半,购自北京维通利华实验动物技术有限公司,合格证号: SCXK-(京)2016-0006,相关研究遵循动物实验原则。
2 实验方法 2.1 BA-Ber复合物及纳米晶的制备 2.1.1 BA-Ber复合物的制备参照文献[6]并优化其反应条件,以摩尔比1:1比例精密称取BA、Ber原料药,置于圆底烧杯中加入适量水,于60 ℃热回流反应2 h。沉淀物抽滤,滤饼用甲醇溶解,旋蒸,静置挥发溶剂,干燥后即得复合物。
2.1.2 BA-Ber复合物纳米晶的制备用DMSO配制1 mg/mL的BA-Ber复合物溶液,缓慢注入含有0.25% P188的水溶液中,以900 r/min搅拌30 min,转入高压均质机900 bar循环20次即得。
2.2 BA-Ber复合物纳米晶的表征 2.2.1 形态考察取少量BA-Ber复合物和纳米晶,真空干燥后表面喷金置电子显微镜下于不同倍率观察所得粒子的表面形态。
2.2.2 粒径、多分散系数及Zeta电位采用激光粒度测定仪测定BA-Ber复合物纳米晶的粒径、多分散系数(PDI)及Zeta电位。
2.3 溶液配制 2.3.1 Hank平衡盐溶液缓冲液(HBSS缓冲液)的配制分别称取NaCl 8.00 g、KCl 0.40 g、CaCl2 0.14 g、MgSO4·7H2O 0.20 g、Na2HPO4·12H2O 0.06 g、NaHCO3 0.35 g、葡萄糖1.00 g、KH2PO4 0.06 g,加适量超纯水溶解,并定容至1 L,用HCl/NaOH调节pH至6.8~7.4,加入2.00 g维生素C并充分溶解,制得HBSS缓冲液,4 ℃冰箱保存备用[7]。
2.3.2 空白灌流液的制备取禁食12 h(自由饮水)的SD大鼠,腹腔注射10%水合氯醛溶液麻醉(1.0 g/kg),固定,沿其腹中线剪开,在其十二指肠的上端和回肠的下端切口,于切口处插管结扎,用预热至37 ℃的HBSS缓冲液将肠内容物冲洗干净,再用空白HBSS缓冲液以2 mL/min的流速灌流。待肠段内全部充满液体并稳定10 min后开始接收灌流液,收集10~120 min内的灌流流出液作为空白灌流液。收集到的灌流液以12 000 r/min离心10 min(离心半径16.8 cm),取上清液合并,4 ℃冷藏备用。
2.3.3 肠灌流供试液的制备精密称取BA-Ber复合物纳米晶适量,以HBSS缓冲液稀释,得纳米晶肠灌流供试液,其中BA、Ber的浓度均约为40 μg/mL。
2.3.4 对照品溶液的制备精密称取BA、Ber、BE对照品适量,分别加甲醇溶解,制备对照品贮备溶液。取上述对照品贮备溶液各1 mL,以HBSS缓冲液定容于10 mL容量瓶,制得BA、Ber、BE浓度分别为208.4、215.2、212.0 μg/mL混合对照品溶液。
2.4 分析方法的建立 2.4.1 色谱条件色谱柱: InertsilODS C18柱(150 mm×4.6 mm,5 μm);流动相: 0.2%甲酸水溶液(A)-乙腈(B);浓度梯度: 0~5 min,B: 20%~40%;5~10 min,B: 40%~60%;10~12 min,B: 60%~40%;12~15 min,B: 40%~20%;15~20 min,B: 20%~20%;20~25 min,B: 20%;流速: 1.0 mL/min;检测波长: 280 nm;柱温: 25 ℃;进样量: 20 μL。
2.4.2 专属性考察分别取空白肠灌流液、对照品溶液和肠灌流样品溶液按照“2.4.1”项下色谱条件进行检测。考察空白肠灌流液对BA、Ber和BE的测定是否有干扰。
2.4.3 线性关系考察精密吸取一定量“2.3.4”项下对照品溶液,加入HBSS缓冲液稀释成系列浓度的混合对照品溶液,按照“2.4.1”项下色谱条件测定色谱峰面积,以待测物峰面积为纵坐标,待测物浓度为横坐标,进行线性回归,计算相关系数。
2.4.4 精密度实验按照“2.3.3”项下方法制备不同浓度的肠灌流供试液(10、40、80 μg/mL),依“2.4.1”项下色谱条件连续进样6次,测定BA、Ber、BE的含量。
2.4.5 加样回收率精密称取已知含量的BA-Ber复合物纳米晶各3份,每份分别约为0.5、2.0、4.0 mg,分别置于10 mL容量瓶中,再分别精密加入混合对照品溶液0.5、2、4 mL(混合对照品浓度: 每1 mL溶液含BA 208.4 μg和Ber 215.2 μg),按照“2.4.1”项下色谱条件测定含量,计算BA和Ber的平均回收率。
2.4.6 稳定性实验按照“2.3.3”项下方法制备不同浓度的肠灌流供试液(10、40、80 μg/mL),按照“2.4.1”项下色谱条件,分别于制备后0、2、4、8、10、12 h进样检测,测定BA、Ber、BE的含量。
2.5 大鼠在体单向肠灌流实验 2.5.1 大鼠在体单向肠灌流实验方法取禁食12 h(自由饮水)的SD大鼠10只,随机分成两组,分别以BA-Ber复合物和其纳米晶作为灌流液。腹腔注射10%水合氯醛溶液麻醉(1.0 g/kg),分离出4个待考察肠段[8](十二指肠段自幽门1 cm处开始,空肠段自幽门15 cm处开始,回肠段自盲肠上行20 cm处开始,结肠段紧临回盲端下行),各个肠段分别取约10 cm于两端切口,用预热至37 ℃的HBSS缓冲液将肠内容物冲洗干净,于切口处插管结扎。进口处用已知质量并装有供试液的西林瓶进行灌流,流速0.2 mL/min,每间隔15 min在出口处用另一已知质量的离心管收集1次,同时迅速更换下一个供试液西林瓶和接收液离心管,称取更换下来的供试液西林瓶和接收液离心管的质量,接收液涡旋混合3 min,于12 000 r/min、4 ℃离心10 min(离心半径16.8 cm),吸取上清液100 μL,加100 μL甲醇复溶,12 000 r/min、4 ℃离心10 min(离心半径16.8 cm),取上清液进样,测定药物浓度。实验持续105 min,实验结束后处死大鼠,剪下被灌流的肠段,测量其长度和内径。
2.5.2 数据处理采用质量法,按下列公式计算药物有效渗透系数(Peff)[9]。

|
Vin和Vout分别为肠道进出口接收液的体积(mL);Cin和Cout分别为肠道进口灌流液和出口接收液的浓度(mg/mL);L为被灌流肠段的长度(cm);r为切面半径(cm);Q为灌流速度(mL/min)。
2.6 统计学方法数据采用SPSS 22.0软件进行统计分析,计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验,以P < 0.05表示差异有统计学意义。
3 实验结果 3.1 形态考察结果表明,BA-Ber复合物为长杆状,表面光滑平整且排列整齐。制成纳米晶为圆柱状,分布均匀。BA-Ber复合物、BA-Ber复合物纳米晶的表面形态见图 1。

|
| 注:A.BA-Ber复合物;B. BA-Ber复合物纳米晶。 图 1 BA-Ber复合物、BA-Ber复合物纳米晶的扫描电镜图 |
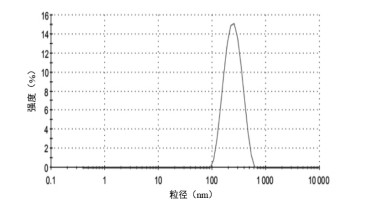
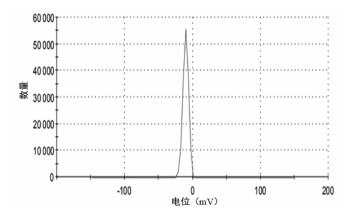
采用激光粒度测定仪测定BA-Ber复合物纳米晶的粒径、PDI及Zeta电位,结果显示BA-Ber复合物纳米晶粒径为(225.10±9.12) nm,PDI为(0.27±0.04),Zeta电位为(-10.10±0.70) mV。结果表明,BA-Ber复合物纳米晶粒径小且分布均一,体系稳定性较好。粒径测定结果见图 2,Zeta电位测定结果见图 3。
|
| 图 2 BA-Ber复合物纳米晶粒径分布图 |
|
| 图 3 BA-Ber复合物纳米晶电位分布图 |
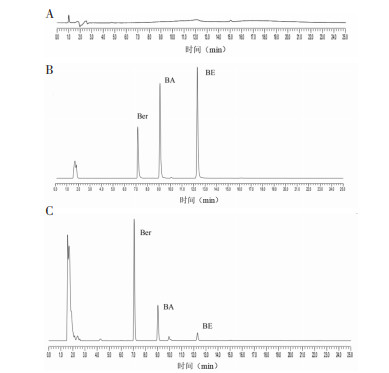
空白肠灌流液在以上色谱条件下对BA、Ber、BE 3种成分的测定无干扰。空白肠灌流液、混合对照品和肠灌流样品溶液的色谱图见图 4。
|
| 注:A.空白肠灌流液;B.混合对照品溶液;C.肠灌流样品溶液。 图 4 空白肠灌流液、混合对照品和肠灌流样品溶液色谱图 |
以待测物峰面积为纵坐标,待测物浓度为横坐标,进行线性回归,得到BA、Ber、BE在HBSS缓冲液中的标准曲线,线性方程和回归系数见表 1,线性关系良好。
计算得低浓度供试品溶液RSD为0.29%~1.85%(n=6),中浓度供试品溶液RSD为0.22%~1.23%(n=6),高浓度供试品溶液RSD为0.13%~1.40%(n=6),表明仪器精密度良好。
3.3.4 加样回收率计算BA、Ber的加样回收率,结果见表 2,表明该方法加样回收实验结果良好。
计算得低浓度供试品溶液RSD为0.02%~1.98%(n=6),中浓度供试品溶液RSD为0.20%~0.92%(n=6),高浓度供试品溶液RSD为0.66%~1.73%(n=6),表明供试品溶液在12 h内基本稳定。
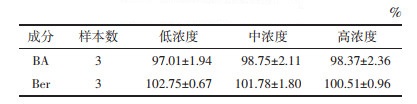
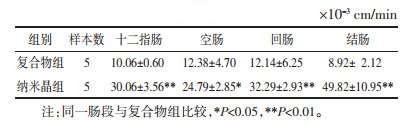
3.4 BA-Ber复合物纳米晶大鼠在体单向肠灌流实验结果采用在体单向肠灌流,对BA-Ber复合物纳米晶中BA和Ber在肠道中的吸收情况进行了考察,通过计算得其Peff值。结果显示,BA-Ber复合物在各个肠段均有吸收,制成纳米晶后,BA在结肠吸收最好,Peff为(49.82±10.95)×10-3 cm/min。在十二指肠、空肠、回肠、结肠4个肠段中,纳米晶组BA的Peff分别是复合物组的2.99、2.00、2.66、5.58倍,与复合物组比较,差异均具有统计学意义(P<0.05或P<0.01)。纳米晶组Ber在空肠吸收最好,Peff为(16.69±2.45)×10-3 cm/min。纳米晶组Ber的Peff分别是复合物组的1.25、1.18、1.53、1.80倍,两组在十二指肠、结肠的Peff比较,差异具有统计学意义(P<0.05或P<0.01)。研究结果表明,BA-Ber复合物制成纳米晶后在各个肠段吸收均有所增加。BA-Ber复合物纳米晶能够显著增加BA、Ber在大鼠肠道的吸收。见表 3、表 4。
对药物进行纳米化的目的是提高其溶解速度和生物利用度。药物的粒径减小,粒子表面积增大,药物溶出速率也会随之提高[10]。因此,粒径及粒径分布是评估纳米晶的重要属性之一。此外,药物纳米颗粒的不同形态对于口服吸收效果也有一定影响[11]。因此,本实验对BA-Ber复合物纳米晶进行形态、粒径、粒径分布及Zeta电位的表征研究与数值测定,结果提示复合物纳米晶外观呈光圆平整的短棒状,粒径在200~300 nm且分布均匀,其尺寸和形貌符合纳米晶粒子的一般属性,为后续开展体内外评价研究提供了前提条件。
4.2 单向肠灌流模型和Peff研究药物肠道吸收的实验方法有很多种,体内(药物浓度法)、在体(在体灌流法等)、离体(外翻肠环法、肠囊外翻模型等)及人结肠癌上皮细胞(Caco-2)细胞模型法应用较为广泛[12]。在体肠灌流模型具有操作方便、准确性高、未切断肠道神经、比离体法更接近机体内的真实吸收状态并保证了血液及淋巴液的正常供应,且测得的吸收速率等指标与体内法相近等优势[13]。灌流方式主要分为振动灌流、循环灌流和单向灌流,而单向灌流因有较低的流速(0.2~0.3 mL/min)并对肠壁黏膜损伤较轻,且更接近药物口服给药后的肠道环境,吸收速率更稳定,故与人体有较好的相关性,因此本实验选用0.2 mL/min作为灌注流速。同时,小肠在吸收过程中不但吸收药物而且吸收水分,肠腔内的水分改变会影响药物浓度。因此,可以采用质量法对水分进行校正。
在体肠灌流模型通过测定灌流前后药物浓度的变化来评价药物在小肠的吸收(吸收速率及吸收量等),并计算Peff等吸收动力学参数。药物吸收性能按Peff分为3类: Peff<0.18×10-3 cm/min为吸收差,Peff>1.2×10-3 cm/min为吸收完全,介于两者之间的为中等吸收。本实验结果显示,BA-Ber复合物灌流后,BA、Ber在大鼠各个肠段Peff均大于1.2×10-3 cm/min,提示吸收良好;制备纳米晶后,BA、Ber的肠吸收进一步增加。
4.3 BA及黄芩素药理作用及体内转化BA的体内吸收常表现出双峰效应。BA经十二指肠快速吸收后,进入空肠呈现为游离态,随时间延长肠道内微生物将游离态BA代谢为苷元BE[14]。BE具有较大疏水性,易通过被动扩散方式进入小肠壁上皮细胞。进入肠壁上皮细胞后,BE经尿苷二磷酸(UDP)-葡萄糖醛酸转移酶)作用又代谢为BA,随后部分BA经多药耐药相关蛋白3(MRP3)转运入血,由肠系膜静脉进入肝脏,在肝脏进一步被代谢;另有部分BA则被多药耐药相关蛋白2(MRP2)重新泵回肠道中,这就是BE的肠道首过代谢作用[15]。
考虑到BA的肠道转化,故本研究在进行含量测定时,建立了同时测定BA、BE含量的分析方法,并测定BA、BE含量,将BE含量转化为等摩尔BA,用以校正因BA转化、浓度降低造成的“假吸收”现象。此外,为了提高药物稳定性、防止BA分解,添加了维生素C并适当调节了溶液pH制备肠灌注液。
4.4 纳米晶对中药难溶性成分BA和Ber在肠道中的吸收促进作用本实验结果显示,纳米晶显著提高了BA-Ber复合物的肠吸收,其可能的原因是形成纳米晶后,粒径减小,表面积增大,提高了药物溶解速率和渗透性。其机制还与药物在胃肠道的主动运输、被动扩散以及多种蛋白介导的内吞途径有关。药物粒径减小,表面能增大,增强了药物在细胞表面的被动吸附作用以及靶向细胞膜特异性受体与配体之间的相互识别,进而引发细胞的内吞作用[16]。
因此,将药物制成纳米晶,可以提高药物在体内的溶解度和渗透性,使药物更易被肠黏膜摄取和转运,从而增加了药物在肠道中的吸收,提高了生物利用度。
| [1] |
田学浩, 张昊, 李桐, 等. 中药配伍理论科学内涵的外在表象: 复方水煎自沉淀[J]. 中草药, 2017, 48(22): 4778-4783. TIAN X H, ZHANG H, LI T, et al. New strategy on scientific connotation of Chinese materia medica compatibility enlightened by precipitation from Chinese materia medica formula decoction[J]. Chinese Traditional and Herbal Drugs, 2017, 48(22): 4778-4783. DOI:10.7501/j.issn.0253-2670.2017.22.029 |
| [2] |
YI L, XU X. Study on the precipitation reaction between baicalin and berberine by HPLC[J]. Journal of Chromatography B, 2004, 810(1): 165-168. DOI:10.1016/S1570-0232(04)00579-3 |
| [3] |
房康, 吴高荣, 王辉, 等. 黄连解毒汤自沉淀化学成分及其抗PC12细胞损伤研究[J]. 中草药, 2017, 48(18): 3714-3719. FANG K, WU G R, WANG H, et al. Study on chemical constituents of self-settling from Huanglian Jiedu Decoction and effects on PC12 induced by CoCl2[J]. Chinese Traditional and Herbal Drugs, 2017, 48(18): 3714-3719. DOI:10.7501/j.issn.0253-2670.2017.18.008 |
| [4] |
OKOSHI K, UEKUSA Y, NARUKAWA Y, et al. Solubility enhancement of berberine-baicalin complex by the constituents of Gardenia Fruit[J]. Journal of Natural Medicines, 2021, 75(1): 76-83. DOI:10.1007/s11418-020-01446-1 |
| [5] |
孙磊, 冯军, 雷艳丽, 等. 黄芩苷-盐酸小檗碱复合物的溶解度与油水分配系数测定[J]. 中国实验方剂学杂志, 2017, 23(21): 35-38. SUN L, FENG J, LEI Y L, et al. Determination of equilibrium solubility and oil-water partition coefficient of baicalin-berberine hydrochloride complex[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(21): 35-38. |
| [6] |
雷艳丽, 孙磊, 隋宏, 等. 黄芩苷-小檗碱复合物的形成规律[J]. 中成药, 2018, 40(3): 577-582. LEI Y L, SUN L, SUI H, et al. Formation rules of baicalin-berberine complex[J]. Chinese Traditional Patent Medicine, 2018, 40(3): 577-582. DOI:10.3969/j.issn.1001-1528.2018.03.013 |
| [7] |
吴安国, 曾宝, 王春玲, 等. 厚朴酚在Hank's平衡盐溶液的溶解性和稳定性[J]. 广东药学院学报, 2010, 26(6): 568-571. WU A G, ZENG B, WANG C L, et al. Study on solubility and stability of magnolol in Hank's balanced salt solution[J]. Journal of Guangdong Pharmaceutical College, 2010, 26(6): 568-571. DOI:10.3969/j.issn.1006-8783.2010.06.005 |
| [8] |
邓少东, 张鹏, 林励, 等. 单向灌流法研究巴戟天低聚糖的大鼠肠吸收特性[J]. 中国中药杂志, 2015, 40(1): 134-140. DENG S D, ZHANG P, LIN L, et al. Study on intestinal absorption features of oligosaccharides in Morinda officinalis How. with sigle-pass perfusion[J]. China Journal of Chinese Materia Medica, 2015, 40(1): 134-140. |
| [9] |
LI H W, DONG L, LIU Y, et al. Comparison of two approaches of intestinal absorption by puerarin[J]. Journal of Pharmacological and Toxicological Methods, 2014, 70(1): 6-11. DOI:10.1016/j.vascn.2014.03.170 |
| [10] |
王廉卿, 戎欣玉, 刘魁, 等. 纳米药物晶体的制备技术及其应用[J]. 河北科技大学学报, 2014, 35(4): 339-348. WANG L Q, RONG X Y, LIU K, et al. Preparation technologies and applications of drug nanocrystals[J]. Journal of Hebei University of Science and Technology, 2014, 35(4): 339-348. |
| [11] |
李思佳, 王森怡, 李凌晖, 等. 基于聚合物无定形固体分散体技术的难溶性药物口服固体制剂开发[J]. 中国药学杂志, 2020, 55(3): 169-176. LI S J, WANG S Y, LI L H, et al. Development of oral solid formulation for insoluble drugs based on PASD technology[J]. Chinese Pharmaceutical Journal, 2020, 55(3): 169-176. |
| [12] |
ELSHEIKH M A, ELNAGGAR Y S R, OTIFY D Y, et al. Bioactive-chylomicrons for oral lymphatic targeting of berberine chloride: novel flow-blockage assay in tissue-based and caco-2 cell line models[J]. Pharmaceutical Research, 2018, 35(1): 18. DOI:10.1007/s11095-017-2307-z |
| [13] |
KUANG G J, YI H, ZHU M J, et al. Study of absorption characteristics of the total saponins from Radix ilicis pubescentis in an in situ single-pass intestinal perfusion (SPIP) rat model by using ultra performance liquid chromatography (UPLC)[J]. Molecules (Basel, Switzerland), 2017, 22(11): 1867. DOI:10.3390/molecules22111867 |
| [14] |
苟缙, 田乙岚, 杨丁雨, 等. 黄芩汤中黄芩苷大鼠药代动力学特征研究[J]. 中药与临床, 2020, 11(1): 42-44. GOU J, TIAN Y L, YANG D Y, et al. Study on pharmacokinetics of baicalin of Huangqin Decoction in rats[J]. Pharmacy and Clinics of Chinese Materia Medica, 2020, 11(1): 42-44. |
| [15] |
许伯慧, 严菲. 黄芩苷及其苷元黄芩素体内过程的研究进展[J]. 南通大学学报(医学版), 2010, 30(3): 220-223. XU B H, YAN F. Research progress of baicalin and its aglycone baicalein in vivo[J]. Journal of Nantong University (Medical Sciences), 2010, 30(3): 220-223. DOI:10.3969/j.issn.1674-7887.2010.03.027 |
| [16] |
刘倩. 纳米晶技术增加难溶性药物的透膜性和跨膜转运的机理研究[D]. 北京: 军事科学院, 2019. LIU Q. Study on the mechanism of nanocrystal technology to increase the permeability and transmembrane transport of insoluble drugs[D]. Beijing: Academy of Military Sciences PLA China, 2019. |
 2022, Vol. 41
2022, Vol. 41