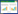文章信息
- 袁茵, 周天, 张妍妍, 鞠爱霞, 肖洪彬, 韩玉生
- YUAN Yin, ZHOU Tian, ZHANG Yanyan, JU Aixia, XIAO Hongbin, HAN Yusheng
- 何首乌提取物二苯乙烯苷对血管性痴呆模型大鼠内质网应激相关蛋白的影响
- Effect of tetrahydroxystilbene glucoside from Polygonum multiflorum on endoplasmic reticulum stress related proteins in vascular dementia model rats
- 天津中医药大学学报, 2022, 41(1): 118-123
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(1): 118-123
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.01.22
-
文章历史
收稿日期: 2021-10-17
2. 黑龙江省龙科种业集团有限公司, 哈尔滨 150040
2. Heilongjiang Longke Seed Industry Group Co. Ltd., Harbin 150040, China
血管性痴呆(VD)是由各种脑血管疾病或长期慢性脑低灌注引起的神经功能异常综合征,临床上早期主要表现为血管性认知功能障碍,并逐渐向痴呆转化[1]。研究发现,VD发病机制与内质网(ER)应激(ERS)关系密切,通过引起神经元过度自噬和凋亡,进而引起认知功能障碍[2-3],因此调节神经细胞的自噬水平以及抑制其凋亡是防治VD的重要途径之一[4]。现代药理研究表明,中药何首乌提取物二苯乙烯苷(TSG)对神经系统疾病具有良好的治疗作用[5]。TSG能够通过减少淀粉样前体蛋白生成、抑制β淀粉样蛋白的神经毒性、调节凋亡相关蛋白表达,从而抑制神经元凋亡[6],还可以通过抑制环磷酸腺苷依赖性蛋白激酶A活化,减少细胞内的钙离子(Ca2+),从而提高VD大鼠的学习记忆能力[7]。但目前对于TSG的研究主要集中在阿尔兹海默病(AD)的治疗,而对于VD的研究较少,且作用机制尚不十分明确。本研究采用改良的双侧颈总动脉结扎(BCCAO)法制备VD模型大鼠,通过给予不同剂量TSG进行干预,从ERS角度探讨何首乌提取物TSG对VD大鼠的保护作用及相关机制。
1 材料与方法 1.1 实验动物SPF级SD大鼠,雄性,体质量(200±20) g,由青岛市实验动物和动物实验中心提供,合格证号: SCXK(鲁)2016-0002。适应性饲养1周,经Morris水迷宫筛选合格的大鼠纳入实验。
1.2 主要试剂TSG购自中国药品生物制品鉴定所,纯度 > 95%。兔抗GRP78(bs-1219R)、转录因子CCAAT/增强子结合蛋白(C/EBP)同源蛋白(CHOP,bs-1361R)、磷酸化蛋白激酶R样ER激酶(p-PERK,bs-3330R)、磷酸化真核细胞起始因子2α(p-eIF2α,bs-3488R)、激活转录因子4(ATF4,bs-1531R)、B淋巴细胞瘤-2(Bcl-2,bs-20352R)、Bcl-2相关X蛋白(Bax,bs-0127R)和半胱氨酸天冬氨酸蛋白酶-3(Caspase-3,bs-0081R)一抗由北京博奥森生物公司提供;二抗Anti-mouse IgG及二抗Anti-rabbit IgG由碧云天生物技术有限公司提供;PV二步法试剂盒由北京中杉生物公司提供。
1.3 模型制备和分组给药采用BCCAO法制备VD模型大鼠[8]。大鼠腹腔注射10%的水合氯醛(35 mg/kg)进行麻醉,仰卧固定,颈部正中备皮后常规消毒。沿颈部正中切口,钝性剥离出左右侧颈总动脉,用动脉夹闭血管20 min,然后恢复血流10 min,再次夹闭血管20 min,如此重复3次。第3次血流恢复后结扎两侧颈总动脉,清理并缝合伤口,局部注射庆大霉素0.2万单位。
术后7 d进行Morris水迷宫筛选,将合格的大鼠随机分为模型组(Model组)、TSG干预组,另设假手术组(Sham组)。TSG组在大鼠模型制备成功4周后分别按30 mg/kg和60 mg/kg剂量灌胃给药,每日1次,连续给药4周。同时Sham组和Model组大鼠分别灌胃给予等体积的生理盐水。Sham组大鼠除不夹闭和结扎两侧颈总动脉外,余下处理方法同Model组大鼠。
1.4 Morris水迷宫行为学检测各组大鼠分别在术后第4、8周采用Morris水迷宫进行定位航行实验和空间探索实验。
1.4.1 定位航行实验将大鼠面对池壁缓慢地从某一象限中点放入池中,使大鼠每日进行4次训练,连续训练5 d,记录大鼠在90 s内找到隐藏平台的时间。如果大鼠不能在90 s内找到隐藏平台,则由研究人员引导大鼠至平台处,并允许大鼠在平台停留15 s,以第5天的逃避潜伏期评价大鼠的空间学习能力。
1.4.2 空间探索实验在实验第6天撤除隐藏平台,将各组大鼠面对池壁缓慢放入水池后,记录120 s内大鼠跨越平台次数,以此评价大鼠的空间记忆能力。
1.5 苏木素-伊红(HE)染色对各组大鼠脑组织进行染色观察,在术后第8周时处死大鼠并迅速取出脑组织,经4%多聚甲醛固定后,脱水、透明、浸蜡和包埋,制备成5 μm切片后进行HE染色,显微镜下观察海马组织病理形态学变化。
1.6 免疫组化(IHC)染色各组大鼠在术后第8周时处死并取脑组织,4%多聚甲醛固定24 h后石蜡包埋,制备成5 μm切片,免疫组化PV二步法检测海马组织中Bcl-2、Bax和Caspase-3蛋白表达,每例选择3个200倍视野,采用Image-pro plus 6.0病理图像分析系统对阳性表达进行分析,取其平均值,以积分光密度(IOD值)代表蛋白相对表达量。
1.7 蛋白免疫印迹(Western Blot)法检测取大鼠海马组织加入预冷的RIPA裂解液中,超声粉碎后经4 ℃离心机12 000 r/min离心10 min(离心半径10 cm),取上清液,用二喹啉甲酸(BCA)法测定并调整蛋白浓度。上样量为50 μg,经过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行凝胶电泳、转膜、封闭和洗膜后,加入一抗(稀释比例1:1 000),4 ℃孵育过夜;洗膜后加入二抗辣根过氧化物酶标记免疫球蛋白G单克隆抗体(IgG-HRP,稀释比例1:5 000)室温孵育1 h;洗膜后使用电化学发光(ECL)法检测并拍照。以β-actin为内参,使用ImageJ分析软件计算各组海马组织中葡萄糖调节蛋白78(GRP78)、CHOP、p-PERK、p-eIF2α和ATF4蛋白表达。
1.8 统计学方法实验数据采用SPSS 22.0统计学软件进行分析,结果以均数±标准差(x±s)表示,符合正态分布且方差齐时采用单因素方差分析,不符合时采用非参数检验。P<0.05表示差异有统计学意义。
2 结果 2.1 TSG对VD大鼠学习记忆障碍的改善作用Morris水迷宫实验显示,在术后第4周时,Model组、TSG30组和TSG60组大鼠的逃避潜伏期比Sham组明显延长,穿越平台次数明显减少(P<0.05)。在术后第8周时,Model组大鼠的逃避潜伏期比Sham组明显延长,穿越平台次数明显减少,经TSG干预治疗后,TSG30组和TSG60组大鼠的逃避潜伏期比Model组明显缩短,穿越平台次数明显增加,尤以TSG60组改善更加明显(P<0.05)。见表 1及图 1。
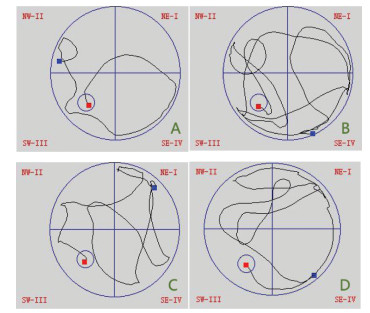
|
| 注:A.Sham组;B.Model组;C.TSG30组;D.TSG60组。 图 1 各组大鼠Morris水迷宫 |
HE染色结果显示,Sham组大鼠海马区神经细胞的形态比较规整,细胞质与细胞核界限清晰,染色均匀,神经元排列紧密,无组织充血、水肿和炎性细胞浸润。与Sham组比较,Model组大鼠海马区神经细胞排列紊乱,部分神经元细胞核固缩或细胞质深染,海马区脑组织毛细血管扩张,结构疏松,可见小胶质细胞明显增多和炎性细胞浸润。与Model组比较,TSG30组和TSG60组大鼠海马区病理表现有不同程度改善,表现为神经元形态明显改善,毛细血管扩张和水肿减轻,小胶质细胞和炎性细胞数量明显减少,以TSG60组改善更为明显。见图 2。
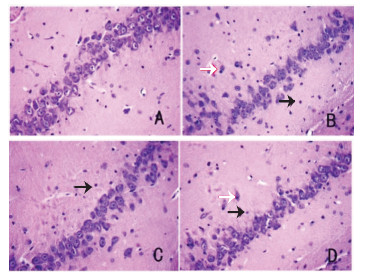
|
| 注:A.Sham组;B.Model组;C.TSG30组;D.TSG60组;黑色箭头表示炎性细胞;白色箭头表示细胞核固缩。 图 2 各组大鼠海马CA1区脑组织病理情况(HE,×400) |
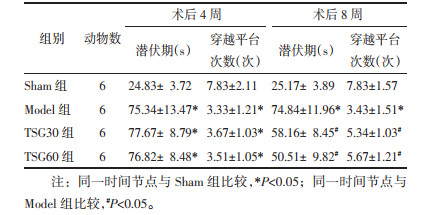
IHC法检测结果显示,与Sham组比较,Model组大鼠海马组织中Caspase-3和Bax蛋白表达明显增加,Bcl-2蛋白表达明显减少(P<0.05)。与Model组比较,TSG30组和TSG60组大鼠海马组织中Caspase-3和Bax蛋白表达明显降低,Bcl-2蛋白表达明显增加(P<0.05)。见表 2及图 3-5。
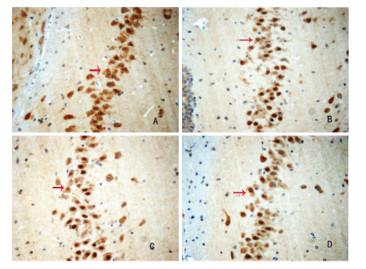
|
| 注:A.Sham组;B.Model组;C.TSG30组;D.TSG60组;箭头表示阳性表达细胞。 图 3 各组大鼠海马CA1区Bcl-2蛋白表达情况(IHC,×400) |
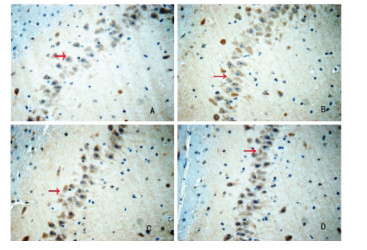
|
| 注:A.Sham组;B.Model组;C.TSG30组;D.TSG60组;箭头表示阳性表达细胞。 图 4 各组大鼠海马CA1区Bax蛋白表达情况(IHC,×400) |
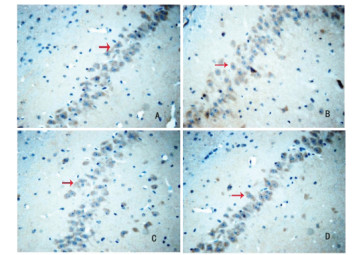
|
| 注:A.Sham组;B.Model组;C.TSG30组;D.TSG60组;箭头表示阳性表达细胞。 图 5 各组大鼠海马CA1区Caspase-3蛋白表达情况(IHC,×400) |
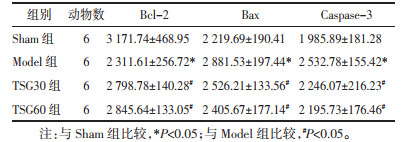
Western Blot法检测结果显示,与Sham组比较,Model组大鼠海马组织中GRP78、CHOP、p-PERK、p-eIF2α和ATF4蛋白表达明显增加(P<0.05)。与Model组比较,TSG30组和TSG60组大鼠海马组织中GRP78、CHOP、p-PERK、p-eIF2α和ATF4蛋白表达明显降低(P<0.05)。见表 3及图 6。
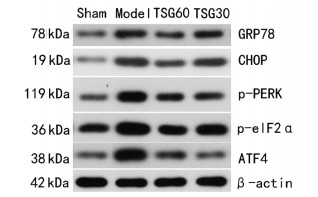
|
| 图 6 TSG对VD大鼠海马组织中GRP78、CHOP、p-PERK、p-eIF2α和ATF4蛋白表达的影响 |
研究表明,除AD外,VD是痴呆的第2大常见类型,其由脑部缺血、出血及缺氧等多种脑血管因素诱导,进而形成以认知功能障碍为主的综合征[9]。VD病理机制尚不十分明确,同时临床上缺乏有效的治疗药物,因此如何有效地控制VD的发生发展已成为众多研究者关注的焦点。中药何首乌是蓼科植物何首乌Polygonummultiflorum Thunb.的干燥块根,药性苦、甘、涩,微温,归肝、心、肾经,具有补肝肾、益精血、乌须发、强筋骨、化浊降脂之功。何首乌的主要有效成分包括蒽醌类、TSG类、黄酮类和类酚类等。其中,TSG是何首乌中具有良好药理活性的水溶性有效成分。现代药理研究表明,TSG对神经细胞具有明显的保护作用[10],其机制与清除自由基、提高海马组织微循环再灌注、促进脑室下区(SVZ)神经细胞增殖、调节5-羟色胺(5-HT)受体等方面有关,从而改善大鼠的学习记忆能力,发挥治疗VD的作用[11-13]。本实验研究结果表明,TSG能够明显缩短VD大鼠逃避潜伏期,增加穿越平台次数,对VD大鼠学习记忆能力具有明显的改善作用。同时TSG能够减轻VD模型大鼠海马组织病理损伤,起到神经保护的作用。
VD的发病机制复杂且尚不明确,ERS参与了认知功能的损害,对VD发生与发展发挥着重要的作用。研究表明VD模型中的学习记忆障碍与长期持续性的ERS呈高度相关[14-15]。ER是真核细胞中一种重要的细胞器,可以通过对蛋白质修饰、脂类合成和Ca2+转运来维持细胞内环境的稳定。蛋白质的修饰过程主要有蛋白质折叠、糖基化以及二硫键的生成等[16]。研究表明ERS参与了细胞凋亡的发生发展[17],其中未折叠蛋白反应(UPR)起着十分重要的作用。当一些外界刺激引起细胞的营养缺乏、DNA损伤、能量紊乱和氧化应激等时,打破细胞的内环境稳态,从而引起ERS[18]。在早期一定程度的ERS可以激活细胞的自身保护性适应机制,过强或持续性的ERS将导致ER内环境稳态无法修复,继而导致UPR的爆发,最终引起细胞凋亡的发生[19-20]。
UPR主要通过ER跨膜蛋白肌醇需求酶1α(IRE1α)、蛋白激酶R样ER激酶(PERK)和激活转录因子6(ATF6)3种ER跨膜蛋白来发挥作用。GRP78是ERS发生的标志性蛋白,在未发生ERS时,GRP78与IRE1α、PERK、ATF6蛋白在ER内结合,这时处于无活性状态。当发生ERS时,GRP78与3种跨膜蛋白分离,与错误折叠蛋白结合,从而使3种跨膜蛋白进入活化状态,减弱致病因素对细胞的刺激[21]。当发生ERS时,通过被激活的IRE1α、PERK和ATF6途径均可使CHOP的表达大量增加,其中PERK-eIF2α-ATF4途径起主导作用,CHOP是ATF4的直接作用靶点。PERK与GRP78分离后活化,使eIF2α磷酸化,抑制eIF2β的活性,下调蛋白质合成,从而减轻ER的负荷[22-23]。同时p-eIF2α使ATF4合成增加,促进CHOP表达,进而使Bax、Caspase-3蛋白表达增加,Bcl-2蛋白表达减少,最终导致细胞死亡[23]。
本实验结果显示,Model组大鼠海马组织中Caspase-3和Bax蛋白表达明显增加,Bcl-2蛋白表达明显减少,说明VD大鼠海马组织神经细胞发生了凋亡。经过TSG干预后,大鼠海马组织中Caspase-3和Bax蛋白表达明显降低,Bcl-2蛋白表达明显增加,表明TSG对VD大鼠海马组织中神经细胞凋亡具有抑制作用。Model组大鼠海马组织中GRP78、CHOP、p-PERK、p-eIF2α和ATF4蛋白表达明显增加,表明在VD的发生发展过程中有ERS发生。经过TSG干预后,海马组织中GRP78、CHOP、p-PERK、p-eIF2α和ATF4蛋白表达明显降低,表明TSG对VD模型ERS相关蛋白具有一定的调控作用。综上所述,ERS参与了VD发生发展过程,何首乌提取物TSG可能通过调控ERS相关蛋白表达,抑制神经细胞凋亡,从而改善VD大鼠学习记忆障碍。
| [1] |
ZONG W J, ZENG X C, CHEN S Y, et al. Ginsenoside compound Kattenuates cognitive deficits in vascular dementia rats by reducing the Aβ deposition[J]. Journal of Pharmacological Sciences, 2019, 139(3): 223-230. DOI:10.1016/j.jphs.2019.01.013 |
| [2] |
牛小莉, 楚宝, 谢小华, 等. 丁苯酞对血管性痴呆大鼠内质网应激相关蛋白的影响[J]. 中国新药杂志, 2021, 30(8): 747-753. NIU X L, CHU B, XIE X H, et al. Butylphthalide regulates the expressions of markers related to ERS in hippocampus of rats with vascular dementia[J]. Chinese Journal of New Drugs, 2021, 30(8): 747-753. DOI:10.3969/j.issn.1003-3734.2021.08.012 |
| [3] |
GENEREUX J C, QU S, ZHOU M, et al. Unfolded protein response induc-ed ER-dj3 secretion links ER stress to extracellular proteostasis[J]. The EMBO Journal, 2015, 34(1): 4-19. DOI:10.15252/embj.201488896 |
| [4] |
LIU S, HE Y, SHI J, et al. Allicin attenuates myocardial ischemia reperfusion injury in rats by inhibition of inflammation and oxidative stress[J]. Transplantation Proceedings, 2019, 51(6): 2060-2065. DOI:10.1016/j.transproceed.2019.04.039 |
| [5] |
王宏杨, 迟继铭, 姜雪, 等. 何首乌提取物二苯乙烯苷药理及临床研究进展[J]. 中华中医药学刊, 2019, 37(10): 2464-2469. WANG H Y, CHI J M, JIANG X, et al. Research progress on pharmacological effects and clinical application of Tetrahy droxystilbene Glucoside[J]. Chinese Archives of Traditional Chinese Medicine, 2019, 37(10): 2464-2469. |
| [6] |
刘宁, 寥艳花, 赖术, 等. 二苯乙烯苷对淀粉样前体蛋白/早老蛋白-1双转基因小鼠脑组织半胱氨酸天冬氨酸蛋白酶3和淀粉样前体蛋白表达的影响[J]. 中国全科医学, 2017, 20(15): 1854-1859. LIU N, LIAO Y H, LAI S, et al. Effect of TSG on the expressions of caspase-3 and APP in brain tissues of APP/PS1 double transgenic mouse model of Alzheimer's disease[J]. Chinese General Practice, 2017, 20(15): 1854-1859. DOI:10.3969/j.issn.1007-9572.2017.15.014 |
| [7] |
罗红波, 石向群, 张志强, 等. Aβ诱发细胞钙失衡中蛋白激酶A的表达变化及二苯乙烯苷的影响[J]. 中国现代医学杂志, 2014, 24(1): 20-24. LUO H B, SHI X Q, ZHANG Z Q, et al. Effects of tetrahydroxy stilbene glucoside on calcium homeostasis and expression of PKA in pyramidal neurons of the rat hippocampus induced by β-amyloid[J]. China Journal of Modern Medicine, 2014, 24(1): 20-24. DOI:10.3969/j.issn.1005-8982.2014.01.005 |
| [8] |
胡跃强, 汪庭龙, 向军军, 等. 血管性痴呆大鼠不同时间点模型的建立与评估[J]. 中国老年学杂志, 2019, 39(7): 1679-1681. HU Y Q, WANG T L, XIANG J J, et al. Establishment and evaluation of vascular dementia rats at different time points[J]. Chinese Journal of Gerontology, 2019, 39(7): 1679-1681. DOI:10.3969/j.issn.1005-9202.2019.07.049 |
| [9] |
O'BRIEN J T, THOMAS A. Vascular dementia[J]. Lancet (London, England), 2015, 386(10004): 1698-1706. DOI:10.1016/S0140-6736(15)00463-8 |
| [10] |
YANG X P, LIU T Y, QIN X Y, et al. Potential protection of 2, 3, 5, 4'-tetrahydroxystilbene-2-O-β-d-glucoside against staurosporine-induced toxicity on cultured rat hippocampus neurons[J]. Neuroscience Letters, 2014, 576(1): 79-83. |
| [11] |
马海涵, 邵阳, 陈力学, 等. 二苯乙烯苷对血管性痴呆大鼠行为学及脑海马自由基代谢的影响[J]. 中国老年学杂志, 2011, 31(3): 438-440. MA H H, SHAO Y, CHEN L X, et al. Effects of stilbene glycoside on behavioral and free radical metabolism in hippocampus of vascular dementia rat[J]. Chinese Journal of Gerontology, 2011, 31(3): 438-440. DOI:10.3969/j.issn.1005-9202.2011.03.030 |
| [12] |
马海涵, 邵志成, 陈力学, 等. 二苯乙烯苷对血管性痴呆大鼠室管膜细胞增殖的影响[J]. 中国老年学杂志, 2017, 37(8): 1862-1863. MA H H, SHAO Z C, CHEN L X, et al. Effects of stilbene glycoside on ependymal cell proliferation in rats with vascular dementia[J]. Chinese Journal of Gerontology, 2017, 37(8): 1862-1863. DOI:10.3969/j.issn.1005-9202.2017.08.017 |
| [13] |
易传安, 汪冶, 胡祥上, 等. 何首乌提取物对血管性痴呆大鼠5-HT受体及生化指标的影响[J]. 中国老年学杂志, 2014, 34(4): 945-947. YI C A, WANG Y, HU X S, et al. Effects of 5-HT receptor and biochemical index Polygonum Multiflorum extract (PME) on learning and memory of vascular dementia rats[J]. Chinese Journal of Gerontology, 2014, 34(4): 945-947. DOI:10.3969/j.issn.1005-9202.2014.04.040 |
| [14] |
XU C, DAI Y X, BAI J, et al. 17β-oestradiol alleviates endoplasmic reticulum stress injury induced by chronic cerebral hypoperfusion through the Haemoglobin/HIF 1α signalling pathway in ovariectomized rats[J]. Neurochemistry International, 2021, 148(5): 105119. |
| [15] |
NIU X L, JIANG X, XU G D, et al. DL-3-n-butylphthalide alleviates vascular cognitive impairment by regulating endoplasmic reticulum stress and the Shh/Ptch1 signaling-pathway in rats[J]. Journal of Cellular Physiology, 2019, 234(8): 12604-12614. DOI:10.1002/jcp.27332 |
| [16] |
IURLARO R, MUÑOZ-PINEDO C. Cell death induced by endoplasmic reticulum stress[J]. The FEBS Journal, 2016, 283(14): 2640-2652. DOI:10.1111/febs.13598 |
| [17] |
ALMANZA A, CARLESSO A, CHINTHA C, et al. Endoplasmic reticulum stress signalling-from basic mechanisms to clinical applications[J]. The FEBS Journal, 2019, 286(2): 241-278. DOI:10.1111/febs.14608 |
| [18] |
GUAN B J, KROKOWSKI D, MAJUMDER M, et al. Translational control during endoplasmic reticulum stress beyond phosphorylation of the translation initiation factor eIF2α[J]. Journal of Biological Chemistry, 2014, 289(18): 12593-12611. DOI:10.1074/jbc.M113.543215 |
| [19] |
SENFT D, RONAI Z A. UPR, autophagy, and mitochondria crosstalk underlies the ER stress response[J]. Trends Biochem Sci, 2015, 40(3): 141-148. DOI:10.1016/j.tibs.2015.01.002 |
| [20] |
MENNERICH D, KELLOKUMPU S, KIETZMANN T. Hypoxia and reactive oxygen species as modulators of endoplasmic reticulum and golgi homeostasis[J]. Antioxidants & Redox Signaling, 2019, 30(1): 113-137. |
| [21] |
OAKES S A, PAPA F R. The role of endoplasmic reticulum stress in human pathology[J]. Annual Review of Pathology, 2015, 10(9): 173-194. |
| [22] |
CHAUDHARI N, TALWAR P, PARIMISETTY A, et al. A molecular web: endoplasmic reticulum stress, inflammation, and oxidative stress[J]. Frontiers in Cellular Neuroscience, 2014, 8(12): 213. |
| [23] |
LUHR M, TORGERSEN M L, SZALAI P, et al. The kinase PERK and the transcription factor ATF4 play distinct and essential roles in autophagy resulting from tunicamycin-induced ER stress[J]. Journal of Biological Chemistry, 2019, 294(20): 8197-8217. DOI:10.1074/jbc.RA118.002829 |
 2022, Vol. 41
2022, Vol. 41