文章信息
- 蔡楠, 李晓璇, 赵利斌, 曹宁宁, 肖学凤, 刘昌孝
- CAI Nan, LI Xiaoxuan, ZHAO Libin, CAO Ningning, XIAO Xuefeng, LIU Changxiao
- 胡黄连苷Ⅱ药理作用研究进展
- Research progress on pharmacological effects of picroside Ⅱ
- 天津中医药大学学报, 2022, 41(1): 124-130
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(1): 124-130
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.01.23
-
文章历史
收稿日期: 2021-11-03
2. 天士力控股集团有限公司研究院现代中药开发中心, 天津 300410;
3. 北京振东光明药物研究院, 北京 100085;
4. 天津药物研究院释药技术与药物代谢动力学国家重点实验室, 天津 300301
2. Traditional Chinese Medicine Research Center, Tasly Holding Group Co. Ltd., Tianjin 300410, China;
3. Zhendong Guangming Pharmaceutical Research Institute, Beijing 100085, China;
4. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300301, China
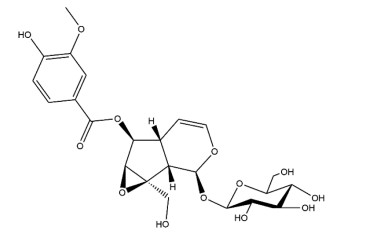
胡黄连是玄参科植物胡黄连Picrorhiza scrophulariiflora Pennell的干燥根茎,始载于《新修本草》,亦称“割孤露泽”。胡黄连味苦,性寒,入肝、胃、大肠经,具有退虚热、除疳热、清湿热的功效。现代药理研究表明,胡黄连具有保肝、抗炎、抗氧化应激及调节免疫等药理作用,临床常用于治疗肝炎、脂肪肝、肝硬化等肝脏疾病[1],对其有效成分进行研究可为开发新型中药提供思路。目前,胡黄连已被分离鉴定出90多个成分,主要为环烯醚萜类、苯乙醇糖苷类、葫芦素类、酚苷类及芳香酸类。其中,胡黄连苷Ⅱ是胡黄连的主要有效成分之一,其含量较高且研究较多,属于环烯醚萜类[2]。胡黄连苷Ⅱ为白色粉末,易溶于甲醇[3],分子式为C23H28O13,分子量为512.46,化学结构见图 1。近年来,随着对胡黄连苷Ⅱ药理作用的深入研究,发现其能够通过影响炎性细胞因子发挥抗炎作用,增加抗氧化酶活性发挥抗氧化应激作用,表明胡黄连苷Ⅱ具有抗炎、抗氧化应激等与胡黄连相同的药理作用,是一种潜在的肝病治疗剂。此外,胡黄连苷Ⅱ还具有抗细胞凋亡、抗肿瘤、抗纤维化等多种药理活性,提示胡黄连苷Ⅱ具有良好的临床应用前景。因此,本文对国内外胡黄连苷Ⅱ的药理作用研究进行综述[4-49],以期为胡黄连苷Ⅱ的进一步研究与临床应用提供参考。见表 1。
|
| 图 1 胡黄连苷Ⅱ化学结构 |
炎症是机体对损伤因子发生的一种防御反应[4],参与多种疾病的发生发展。丝裂原激活蛋白激酶(MAPK)信号通路和核转录因子-κB(NF-κB)信号通路是目前研究较多的经典炎症信号通路。MAPK信号通路中,上调磷酸化MAPK的表达水平可促进白细胞介素-33(IL-33)及干扰素-γ(IFN-γ)的表达;NF-κB信号通路中,上调NF-κB的表达水平可促进白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)的表达。IL-33、IL-1β、IL-6、IFN-γ和TNF-α均属于促炎性细胞因子,可扩大炎症反应[5-6]。因此有效阻断MAPK信号通路和NF-κB信号通路是药物抗炎的有效途径。
大量研究表明胡黄连苷Ⅱ具有抗炎作用,能够减轻炎症引起的各种损伤[7-10]。胡黄连苷Ⅱ可下调蛙皮素诱导的重症胰腺炎模型大鼠胰腺组织NF-κB的表达水平,降低血清IL-1β、IL-6和TNF-α的表达水平,表明胡黄连苷Ⅱ可通过阻断NF-κB信号通路,抑制促炎性细胞因子的表达,改善重症胰腺炎[11]。Shen等[12]研究发现,胡黄连苷Ⅱ不仅能够降低脂多糖(LPS)诱导的A549细胞中NF-κB的表达水平,显著下调IL-1β、IL-6和TNF-α的蛋白及mRNA表达水平,减轻细胞炎症;还可降低LPS诱导的急性肺损伤模型小鼠支气管肺泡灌洗液中IL-1β、IL-6和TNF-α的表达水平,表明胡黄连苷Ⅱ可通过阻断NF-κB信号通路,改善LPS诱导的急性肺损伤。另有文献报道,胡黄连苷Ⅱ干预可减少血清淀粉样蛋白A(SAA)诱导的人气道上皮细胞MAPK的磷酸化,降低IL-33的蛋白及mRNA表达水平,提示胡黄连苷Ⅱ可通过阻断MAPK信号通路抑制IL-33的表达,减轻气道炎症反应[13]。上述研究表明胡黄连苷Ⅱ可通过阻断NF-κB信号通路和MAPK信号通路,抑制促炎性细胞因子的表达,发挥抗炎作用。
2 抗氧化应激氧化应激是指机体受到不良刺激产生大量氧自由基(ROS)导致组织器官受损的一种应激反应[14]。机体内存在ROS生成酶系统和清除ROS的抗氧化酶系统[15-16]。生理状态下,ROS的产生和清除维持动态平衡,从而避免组织器官受ROS损伤。病理状态下,还原型辅酶Ⅱ(NADPH)氧化酶等ROS生成酶活性增强或谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)等抗氧化酶活性减弱,使ROS产生增加或清除速率降低,ROS在体内蓄积,过量的ROS氧化细胞膜上的磷脂产生丙二醛(MDA),ROS和MDA进一步引发蛋白质和核酸变性,最终造成组织器官损伤[17-18]。
研究发现,胡黄连苷Ⅱ具有抗氧化应激作用。胡黄连苷Ⅱ干预能够增加缺氧/复氧肾小管上皮细胞培养液中SOD的活性,并减少MDA含量,减轻缺氧/复氧肾小管上皮细胞氧化应激程度,表明胡黄连苷Ⅱ具有显著的抗氧化应激能力[19]。Wang等[20]研究胡黄连苷Ⅱ对高同型半胱氨酸血症模型小鼠血管内皮损伤的影响,结果显示胡黄连苷Ⅱ可降低模型小鼠主动脉内皮NADPH氧化酶的活性,增加血浆SOD和CAT活性,减少MDA含量,减轻高同型半胱氨酸血症模型小鼠血管氧化应激程度,从而减轻其血管内皮损伤。再如,胡黄连苷Ⅱ干预前脑缺血模型大鼠后,其血清和脑组织的GSH-Px、SOD、CAT活性增加,表明胡黄连苷Ⅱ对前脑缺血模型大鼠脑组织具有抗氧化应激作用[21]。另有研究显示,胡黄连苷Ⅱ处理过氧化氢(H2O2)诱导的氧化损伤L-02肝细胞后,肝细胞内ROS水平显著降低,具有抗氧化作用的核转录因子E2相关因子2(Nrf2)和血红素加氧酶-1(HO-1)的mRNA表达水平显著升高,表明胡黄连苷Ⅱ可改善肝细胞氧化应激[22-23]。
3 抗细胞凋亡细胞凋亡是指机体为维持内环境的稳定,由基因控制的细胞自主地有序地死亡[24]。生理状态下,细胞增殖和细胞凋亡处于平衡状态[25],对维持机体稳态具有重要意义[26]。组织器官受到损伤后,细胞内线粒体损伤,诱导细胞发生凋亡,打破细胞增殖与凋亡的平衡。细胞凋亡过度引起阿尔兹海默症、脑梗死等多种疾病的发生,危害人体健康[27-28]。因此,抑制损伤组织细胞过度凋亡对保持人体健康十分重要。细胞凋亡主要由半胱氨酸天冬氨酸蛋白酶(Caspase)凋亡家族和B淋巴细胞瘤-2(Bcl-2)凋亡家族调节。Caspase-3作为Caspase家族的凋亡执行因子,具有破坏细胞核的作用,是凋亡不可逆的标志[29]。在Bcl-2凋亡家族中,Bcl-2相关的X基因(Bax)是促凋亡蛋白,能够改变线粒体膜通透性,增加线粒体释放细胞色素C(Cyt-C),引起细胞核DNA断裂,导致细胞凋亡;Bcl-2是抗凋亡蛋白,可抑制线粒体释放Cyt-C,抑制细胞凋亡[30-31]。
多项研究表明,胡黄连苷Ⅱ具有抗细胞凋亡的作用。翁小东等[32]建立肾缺血再灌注肾损伤大鼠模型,研究胡黄连Ⅱ对肾细胞凋亡的保护作用,结果表明胡黄连苷Ⅱ通过升高肾细胞Bcl-2的蛋白表达水平,降低Caspase-3和Bax的蛋白表达水平,抑制肾细胞凋亡,发挥肾脏保护作用。再如,胡黄连苷Ⅱ干预大脑中动脉栓塞模型大鼠后,大鼠脑组织神经元Cyt-C和Caspase-3的mRNA表达水平显著降低,提示胡黄连苷Ⅱ可通过抑制脑缺血再灌注后神经细胞凋亡,发挥神经保护作用[33]。
4 抗肿瘤恶性肿瘤是严重威胁人类生命和健康的常见疾病之一,是目前人类病死率上升的重要因素[34]。增殖、侵袭和转移是肿瘤的主要生物学特征[35]。基质金属蛋白酶(MMPs)通过降解细胞外基质、破坏肿瘤侵袭和转移的组织学屏障、增加肿瘤细胞的侵袭和转移促进肿瘤发展[36]。因此,抑制肿瘤细胞增殖或降低MMPs的活性,对遏制肿瘤的发生发展至关重要[37-38]。
研究表明,胡黄连苷Ⅱ具有抗肿瘤作用。Lou等[39]研究胡黄连苷Ⅱ对人乳腺癌细胞(MDA-MB-231)侵袭和迁移的抑制作用,结果显示胡黄连苷Ⅱ以剂量依赖性方式显著下调MDA-MB-231细胞中基质金属蛋白酶-9(MMP-9)的活性,抑制MDA-MB-231细胞的侵袭和转移,提示胡黄连苷Ⅱ在MDA-MB-231细胞中发挥抗肿瘤作用。再有研究发现,胡黄连苷Ⅱ以浓度依赖性方式降低肾癌细胞(ACHN)的增殖率,抑制ACHN细胞增殖,提示胡黄连苷Ⅱ在ACHN细胞中发挥抗肿瘤作用[40]。
5 抗纤维化纤维化是指组织器官在受到持续性损伤后,组织器官内成纤维细胞、肌成纤维细胞增多及胶原蛋白、层粘连蛋白和纤维粘连蛋白(FN)等细胞外基质(ECM)大量沉积的病理过程[41]。纤维化相关因子(包括促/抑纤维化细胞因子)在纤维化过程中发挥重要作用。在转化生长因子-β(TGF-β)、结缔组织生长因子(CTGF)等促纤维化细胞因子的作用下,成纤维细胞增殖并分化为肌成纤维细胞,肌成纤维细胞可过度合成和分泌ECM[42]。骨形态发生蛋白-7(BMP-7)、MMPs等抑纤维化细胞因子抑制成纤维化细胞增殖分化并促进ECM降解[43]。生理状态下,促纤维化细胞因子与抑纤维化细胞因子处于平衡状态,成纤维细胞和肌成纤维细胞数量不变,ECM的合成与降解平衡,组织器官生理功能正常[44]。病理状态下,受损组织中促纤维化细胞因子表达增加,抑纤维化细胞因子表达减少,成纤维细胞和肌成纤维细胞数量增加使得ECM过度沉积导致组织纤维化[45]。
研究发现,胡黄连苷Ⅱ具有抗纤维化作用。李君等[46]使用胡黄连苷Ⅱ干预子宫内膜异位症模型大鼠后,模型大鼠异位内膜中TGF-β的蛋白及mRNA表达水平均显著降低,提示胡黄连苷Ⅱ可抑制模型大鼠子宫内膜纤维化。另有研究显示胡黄连苷Ⅱ干预肾脏缺血再灌注损伤模型大鼠后,可显著上调模型大鼠肾组织中BMP-7的表达水平,下调TGF-β、CTGF和FN的表达水平,表明胡黄连苷Ⅱ通过增加ECM降解,减少ECM合成,减轻模型大鼠肾组织ECM沉积,以发挥抗纤维化作用[47]。
6 其他除上述药理作用外,研究发现胡黄连苷Ⅱ还具有抗抑郁、平喘等药理作用。胡黄连苷Ⅱ不仅可显著降低慢性应激抑郁模型大鼠血浆皮质酮含量和强迫游泳的不动时间,改善抑郁症状[48];还可降低哮喘模型大鼠气道阻力,提高肺动态顺应性,减轻哮喘症状[49]。
7 结语与展望胡黄连苷Ⅱ属于环烯醚萜类成分,是胡黄连的主要特征性成分和有效成分,具有广泛的药理活性。到目前为止,已知胡黄连苷Ⅱ具有抗炎、抗氧化应激、抗细胞凋亡、抗肿瘤、抗纤维化等多种药理作用。胡黄连苷Ⅱ具有较好的应用前景和临床治疗潜力,但胡黄连苷Ⅱ的药理作用研究尚处于细胞实验和动物实验研究阶段,针对胡黄连苷Ⅱ的临床研究十分有限。因此,这些药理作用能否被临床认可仍需进一步研究。此外,除抗炎之外,胡黄连苷Ⅱ的其他药理作用机制尚不明确,需进一步研究与探索。综上,胡黄连苷Ⅱ具有广阔的研究空间,深入研究其作用机制并开展临床研究,有望使胡黄连苷Ⅱ在临床上得到应用。
| [1] |
金诚, 吴飞, 郑晓, 等. 胡黄连的化学成分和质量分析及药理作用研究进展[J]. 中国新药杂志, 2019, 28(3): 292-302. JIN C, WU F, ZHENG X, et al. Research progress on the chemical composition, analytical method and pharmacological action of Rhizoma picrorhizae[J]. Chinese Journal of New Drugs, 2019, 28(3): 292-302. |
| [2] |
GUO N, JIN C, SHEN L, et al. Chemical components, pharmacological actions, and clinical applications of Rhizoma Picrorhizae[J]. Phytotherapy Research, 2020, 34(5): 1071-1082. DOI:10.1002/ptr.6591 |
| [3] |
刘美凤. 复方胡黄连抗肝炎有效部位的化学研究[D]. 哈尔滨: 黑龙江中医药大学, 2001. LIU M F. Chemical study on anti-hepatitis effective part of Picrorhizi Compositae[D]. Harbin: Heilongjiang University of Chinese Medicine, 2001. |
| [4] |
丁绍祥. 动脉粥样硬化的抗炎治疗[J]. 中国老年学杂志, 2020, 40(11): 2454-2458. DING S X. Anti-inflammatory treatment of atherosclerosis[J]. Chinese Journal of Gerontology, 2020, 40(11): 2454-2458. DOI:10.3969/j.issn.1005-9202.2020.11.062 |
| [5] |
王婷婷, 翟丽, 张红艳, 等. 胡黄连苷Ⅱ对脑缺血损伤大鼠ERK1/2信号通路的影响[J]. 中国中西医结合杂志, 2016, 36(4): 437-444. WANG T T, ZHAI L, ZHANG H Y, et al. Effect of picrosideⅡ on ERK1/2 signal pathway in cerebral ischemic injury rats[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2016, 36(4): 437-444. |
| [6] |
WANG L, LIU X H, CHEN H, et al. Picroside Ⅱ protects rat kidney against ischemia/reperfusion-induced oxidative stress and inflammation by the TLR4/NF-κB pathway[J]. Experimental and Therapeutic Medicine, 2015, 9(4): 1253-1258. DOI:10.3892/etm.2015.2225 |
| [7] |
曲景灏, 张绍丹, 孙曹毓, 等. 胡黄连苷Ⅱ在脂多糖诱导大鼠葡萄膜炎模型中抗炎作用[J]. 中国实用眼科杂志, 2015, 33(4): 431-435. QU J H, ZHANG S D, SUN C Y, et al. Anti-inflammation effects of picroside-Ⅱ on lipopolysaccharide-induced uveitis in rats[J]. Chinese Journal of Practical Ophthalmology, 2015, 33(4): 431-435. DOI:10.3760/cma.j.issn.1006-4443.2015.04.027 |
| [8] |
房尚萍. 胡黄连苷Ⅱ对急性脓毒性肝损伤小鼠的保护及机制研究[D]. 上海: 第二军医大学, 2017. FANG S P. The protection and mechanism of picrosideⅡ on acute septic liver injury in mice[D]. Shanghai: Second Military Medical University, 2017. |
| [9] |
刘浩, 刘修恒, 王磊, 等. 胡黄连苷Ⅱ可通过增强自噬抑制炎症和氧化应激减轻大鼠肾缺血再灌注损伤[J]. 武汉大学学报(医学版), 2019, 40(2): 203-207. LIU H, LIU X H, WANG L, et al. Picroside Ⅱ alleviates renal ischemia/reperfusion injury in rats by inhibiting inflammation and oxidative stress via enhancing autophagy[J]. Medical Journal of Wuhan University, 2019, 40(2): 203-207. |
| [10] |
何薇, 林江涛. 胡黄连苷Ⅱ对支气管哮喘大鼠气道炎症和支气管收缩影响的研究[J]. 国际呼吸杂志, 2014, 34(3): 166-169. HE W, LIN J T. Experimental study of picroside Ⅱon airway inflammation and bronchial contraction in a rat asthmatic model[J]. International Journal of Respiration, 2014, 34(3): 166-169. DOI:10.3760/cma.j.issn.1673-436X.2014.03.002 |
| [11] |
PIAO X H, LIU B H, GUO L Y, et al. Picroside Ⅱshows protective functions for severe acute pancreatitis in rats by preventing NF-κB-dependent autophagy[J]. Oxidative Medi- cine and Cellular Longevity, 2017, 20(17): 708-709. |
| [12] |
SHEN B Y, ZHAO C X, CHEN C Z, et al. Picroside Ⅱ protects rat lung and A549 cell against LPS-induced inflammation by the NF-κB pathway[J]. Inflammation, 2017, 40(3): 752-761. DOI:10.1007/s10753-017-0519-3 |
| [13] |
LEE K, CHOI J, CHOI B K, et al. PicrosideⅡisolated from Pseudolysimachion rotundum var. subintegrum inhibits glucocorticoid refractory serum amyloid A (SAA) expression and SAA-induced IL-33 secretion[J]. Molecules (Basel, Switzerland), 2019, 24(10): 2020. DOI:10.3390/molecules24102020 |
| [14] |
刘凌云, 曾勉, 左万里, 等. 哮喘-慢性阻塞性肺疾病重叠综合征患者氧化应激水平及抗氧化治疗效果的研究[J]. 中国医学创新, 2016, 13(21): 9-13. LIU L Y, ZENG M, ZUO W L, et al. Oxidative stress and antioxidant therapy in patients with asthmatic chronic obstructive pulmonary disease overlap syndrome[J]. Medical Innovation of China, 2016, 13(21): 9-13. DOI:10.3969/j.issn.1674-4985.2016.21.003 |
| [15] |
张子琪. 虾青素干预对脂多糖诱导炎症反应小鼠的保护作用[D]. 长春: 吉林农业大学, 2019. ZHANG Z Q. Protective effect of astaxanthin intervention on mice with inflammatory response induced by lipopolysaccharide[D]. Changchun: Jilin Agricultural University, 2019. |
| [16] |
廖鼐, 龙子, 海春旭, 等. ROS在脂肪分化中的作用研究新进展[J]. 现代生物医学进展, 2019, 19(15): 2996-3000. LIAO N, LONG Z, HAI C X, et al. Role of ROS in the regulation of adipocyte differentiation[J]. Progress in Modern Biomedicine, 2019, 19(15): 2996-3000. |
| [17] |
马萍, 程天赋, 郭增旺, 等. 紫花芸豆肽修复H2O2对HepG2细胞的氧化应激损伤[J]. 食品科学, 2020, 41(1): 175-182. MA P, CHENG T F, GUO Z W, et al. Cytoprotective effect of Phaseolus vulgaris peptides against H2O2-induced oxidative damage in HepG2 cells[J]. Food Science, 2020, 41(1): 175-182. |
| [18] |
明建华, 叶金云, 张易祥, 等. 姜黄素对草鱼生长性能、抗氧化应激能力及核因子E2相关因子2/抗氧化反应元件信号通路相关基因表达的影响[J]. 动物营养学报, 2019, 31(2): 809-823. MING J H, YE J Y, ZHANG Y X, et al. Effects of curcumin on growth performance, oxidative stress resistance and expression of nuclear factor erythroid 2-related factor 2/antioxidant responsive element signaling pathway-related genes in grass carp (Ctenopharyngodon idella)[J]. Chinese Journal of Animal Nutrition, 2019, 31(2): 809-823. DOI:10.3969/j.issn.1006-267x.2019.02.037 |
| [19] |
刘洋, 刘修恒, 王磊, 等. 胡黄连苷Ⅱ对大鼠肾小管上皮细胞缺氧/复氧损伤的保护作用[J]. 武汉大学学报(医学版), 2017, 38(3): 381-386. LIU Y, LIU X H, WANG L, et al. Effect of picroside Ⅱ on renal tubular epithelial cells with hypoxia reoxygenation[J]. Medical Journal of Wuhan University, 2017, 38(3): 381-386. |
| [20] |
WANG Y K, HONG Y J, ZHANG C Y, et al. Picroside Ⅱ attenuates hyperhomocysteinemia-induced endothelial injury by reducing inflammation, oxidative stress and cell apoptosis[J]. Journal of Cellular and Molecular Medicine, 2019, 23(1): 464-475. DOI:10.1111/jcmm.13949 |
| [21] |
常翠翠, 纪晓军, 张睿, 等. 胡黄连苷Ⅱ对大鼠脑缺血损伤的抗氧化作用及剂量优化研究[J]. 世界中西医结合杂志, 2013, 8(6): 555-559. CHANG C C, JI X J, ZHANG R, et al. Study of picroside Ⅱ on antioxidation and dose optimization in the rats of cerebral ischemic injury[J]. World Journal of Integrated Traditional and Western Medicine, 2013, 8(6): 555-559. DOI:10.3969/j.issn.1673-6613.2013.06.006 |
| [22] |
李白雪, 张传涛, 冯全生, 等. 胡黄连苷Ⅱ对体外H2O2诱导肝细胞(L-02)损伤Keap1Nrf2(ARE)抗氧化通路mRNA表达的影响[J]. 中华中医药杂志, 2015, 30(3): 682-685. LI B X, ZHANG C T, FENG Q S, et al. Effects of picroside Ⅱ on the m RNA expression of Keap1Nrf2(ARE) antioxidant signal pathway in liver cells damage induced by H2O2 in vitro[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2015, 30(3): 682-685. |
| [23] |
李白雪, 冯全生, 张传涛, 等. 胡黄连苷Ⅱ对过氧化氢诱导急性肝细胞损伤中Ⅱ相代谢酶mRNA表达的影响[J]. 中国中医基础医学杂志, 2014, 20(7): 909-911, 938. LI B X, FENG Q S, ZHANG C T, et al. The effects of Picroside Ⅱ on the mRNA expression of phase Ⅱ metabolic enzymes in the H2O2-induced L-02 cells damage[J]. Chinese Journal of Basic Medicine in Traditional Chinese Medicine, 2014, 20(7): 909-911, 938. |
| [24] |
肖本浩, 张志海, 王吉利, 等. 绝经后骨质疏松症与血清中BCL-2、Bak相关性研究[J]. 辽宁中医药大学学报, 2018, 20(7): 93-97. XIAO B H, ZHANG Z H, WANG J L, et al. Sudy of the correlation between postmenopausal osteoporosis and serum protein bcl-2, bak[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2018, 20(7): 93-97. |
| [25] |
贾旭东. 细胞增殖和细胞凋亡与癌的发生和预防[J]. 国外医学(卫生学分册), 2001, 28(2): 65-68, 74. JIA X D. Cell proliferation, apoptosis with the carcinogenesis and prevention of cancer[J]. Foreign Medical Sciences (Section Hygiene), 2001, 28(2): 65-68, 74. |
| [26] |
朱虹, 罗顺峰, 张万广, 等. 凋亡抑制蛋白Survivin在肝癌中的表达和意义[J]. 肝胆外科杂志, 2002, 10(3): 232-233. ZHU H, LUO S F, ZHANG W G, et al. Expression and implication of inhibitor apoptosis protein of survivin in hepatocellular carcinoma[J]. Journal of Hepatobiliary Surgery, 2002, 10(3): 232-233. DOI:10.3969/j.issn.1006-4761.2002.03.035 |
| [27] |
张玉静, 蒋妮, 柳强, 等. 线粒体损伤在镉诱导肝细胞凋亡和DNA损伤中的作用[J]. 卫生研究, 2020, 49(2): 290-297. ZHANG Y J, JIANG N, LIU Q, et al. Role of mitochondrial damage in cadmium-induced cell apoptosis and DNA damage of hepatocytes[J]. Journal of Hygiene Research, 2020, 49(2): 290-297. |
| [28] |
苗明三. 对细胞凋亡研究的认识: 疾病与细胞凋亡[J]. 河南中医学院学报, 2003, 18(3): 27-31. MIAO M S. Personal conception of the study of cellular ageing—illness and cellular ageing[J]. Journal of Henan College of Traditional Chinese Medicine, 2003, 18(3): 27-31. DOI:10.3969/j.issn.1003-5028.2003.03.022 |
| [29] |
刘迪, 于子翔, 张寒雪, 等. 矢车菊素-3-O-葡萄糖苷干预Caspase级联反应抑制H2O2诱导的细胞凋亡[J]. 营养学报, 2020, 42(4): 369-373. LIU D, YU Z X, ZHANG H X, et al. Cyanidin-3-O-glucoside inhibits H2O2-induced apoptosis by mediating the cascaded reaction of caspase[J]. Acta Nutrimenta Sinica, 2020, 42(4): 369-373. DOI:10.3969/j.issn.0512-7955.2020.04.011 |
| [30] |
王艳杰, 邓雯, 张鹏飞. 细胞色素C与细胞凋亡研究进展[J]. 动物医学进展, 2012, 33(7): 89-92. WANG Y J, DENG W, ZHANG P F. Progress on cytochrome C and cell apoptosis[J]. Progress in Veterinary Medicine, 2012, 33(7): 89-92. DOI:10.3969/j.issn.1007-5038.2012.07.019 |
| [31] |
王丽芳, 赵方毓, 唐鲜娥, 等. 木犀草素通过线粒体凋亡途径诱导SW480结肠癌细胞的凋亡作用研究[J]. 中国临床药理学杂志, 2019, 35(17): 1862-1864, 1875. WANG L F, ZHAO F Y, TANG X E, et al. Effect of the luteolin induces apoptosis in SW480 colon cancer cells via mitochondrial apoptosis pathway[J]. The Chinese Journal of Clinical Pharmacology, 2019, 35(17): 1862-1864, 1875. |
| [32] |
翁小东, 王磊, 刘修恒, 等. 胡黄连苷Ⅱ对大鼠肾缺血再灌注损伤后肾细胞凋亡反应的保护作用[J]. 中国医药导报, 2016, 13(21): 21-24, 193. WENG X D, WANG L, LIU X H, et al. Protective effects of picroside Ⅱ on apoptosis after renal ischemia-reperfusion injury in rats[J]. China Medical Herald, 2016, 13(21): 21-24, 193. |
| [33] |
於永婷, 郭配, 陈红兵. 胡黄连苷Ⅱ对大鼠脑缺血-再灌注损伤后CytC mRNA和Caspase-3mRNA表达的影响[J]. 世界最新医学信息文摘, 2017, 17(79): 5-6. YU Y T, GUO P, CHEN H B. Effect of picroside Ⅱ on expression of CytC mRNA and caspase-3 m RNA after cerebral ischemia-reperfusion injury of rats[J]. World Latest Medicine Information, 2017, 17(79): 5-6. |
| [34] |
王冬梅, 庞瑞, 杨亮亮, 等. 恶性肿瘤合并抑郁患者中医体质类型分析[J]. 现代中西医结合杂志, 2019, 28(3): 238-241, 246. WANG D M, PANG R, YANG L L, et al. Analysis of TCM constitution types in patients with malignant tumor complicated with depression[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2019, 28(3): 238-241, 246. |
| [35] |
宋旭红. 细胞凋亡与抗肿瘤[J]. 新疆医科大学学报, 2003, 26(4): 409-411. SONG X H. Apoptosis and anti-tumor[J]. Journal of Xinjiang Medical University, 2003, 26(4): 409-411. DOI:10.3969/j.issn.1009-5551.2003.04.056 |
| [36] |
刘娜, 张晓林. 己糖激酶与肿瘤的生物学特征[J]. 佛山科学技术学院学报(自然科学版), 2014, 32(5): 75-78. LIU N, ZHANG X L. Hexokinase and biological characteristics of cancer[J]. Journal of Foshan University (Natural Science Edition), 2014, 32(5): 75-78. DOI:10.3969/j.issn.1008-0171.2014.05.019 |
| [37] |
邓路婵, 周黎明. 基质金属蛋白酶与恶性肿瘤转移的关系[J]. 四川生理科学杂志, 2014, 36(2): 80-82. DENG L C, ZHOU L M. Relationship between matrix metalloproteinases and tumor metastasis[J]. Sichuan Journal of Physiological Sciences, 2014, 36(2): 80-82. |
| [38] |
伊日贵, 徐晓艳, 李时荣. 肿瘤侵袭转移机制研究进展[J]. 中华实用诊断与治疗杂志, 2014, 28(10): 937-939. YI R G, XU X Y, LI S R. Research progress on the mechanism of tumor invasion and metastasis[J]. Journal of Chinese Practical Diagnosis and Therapy, 2014, 28(10): 937-939. |
| [39] |
LOU C H, ZHU Z H, XU X T, et al. Picroside Ⅱ, an iridoid glycoside from Picrorhiza kurroa, suppresses tumor migration, invasion, and angiogenesis in vitro and in vivo[J]. Biomedicine & Pharmacotherapy, 2019, 120: 109494. |
| [40] |
张璐, 胡莹. 胡黄连苷Ⅱ通过线粒体途径诱导肾癌细胞凋亡的实验研究[J]. 临床肾脏病杂志, 2020, 20(6): 504-507. ZHANG L, HU Y. An experimental study renal cancer cell apoptosis induced by picroside Ⅱ through mitochondrial pathway[J]. Journal of Clinical Nephrology, 2020, 20(6): 504-507. |
| [41] |
韩颖萍, 黄霞, 刘惠霞, 等. 沙参麦冬汤对肺间质纤维化大鼠氧自由基损伤及细胞外基质代谢的影响[J]. 中华中医药杂志, 2011, 26(9): 2169-2171. HAN Y P, HUANG X, LIU H X, et al. Effect of Shashen Maidong Tang on oxygen free radicals damage and ECM metabolism of pulmonary fibrosis rats[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2011, 26(9): 2169-2171. |
| [42] |
丁茂鹏, 韦凌霞, 王志旺, 等. CTGF激活肌成纤维细胞参与组织器官纤维化及中医药干预作用的研究进展[J]. 时珍国医国药, 2020, 31(11): 2729-2731. DING M P, WEI L X, WANG Z W, et al. Research progress of CTGF activated myofibroblasts participate in tissues and organs fibrosis and intervention of traditional Chinese medicine[J]. Lishizhen Medicine and Materia Medica Research, 2020, 31(11): 2729-2731. |
| [43] |
HENDERSON N C, RIEDER F, WYNN T A. Fibrosis: from mechanisms to medicines[J]. Nature, 2020, 587(7835): 555-566. DOI:10.1038/s41586-020-2938-9 |
| [44] |
孙亭如, 姚源璋. 肾纤维化中西医治疗进展[J]. 中国中西医结合肾病杂志, 2014, 15(12): 1126-1128. SUN T R, YAO Y Z. Progress in traditional Chinese and Western medicine treatment of renal fibrosis[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2014, 15(12): 1126-1128. |
| [45] |
刘岩, 王献华, 周玮玮. 表皮生长因子与器官纤维化[J]. 现代预防医学, 2008, 35(7): 1398-1400. LIU Y, WANG X H, ZHOU W W. Epidermal growth factor and organ fibrosis[J]. Modern Preventive Medicine, 2008, 35(7): 1398-1400. DOI:10.3969/j.issn.1003-8507.2008.07.091 |
| [46] |
李君, 王倩青, 郜智慧, 等. 胡黄连苷Ⅱ降低M2型巨噬细胞的表达及对子宫内膜异位症大鼠盆腔黏连和内膜细胞凋亡的调节作用[J]. 免疫学杂志, 2020, 36(11): 994-1000. LI J, WANG Q Q, GAO Z H, et al. Picroside Ⅱ reduces the expression of M2 macrophages and regulates pelvic adhesion and endometrial cell apoptosis in rats with endometriosis[J]. Immunological Journal, 2020, 36(11): 994-1000. |
| [47] |
刘浩, 刘修恒, 王磊, 等. 胡黄连苷Ⅱ通过抑制调控上皮-间质转化减轻大鼠肾脏缺血再灌注损伤后肾纤维化[J]. 职业与健康, 2019, 35(4): 466-470. LIU H, LIU X H, WANG L, et al. Picroside Ⅱ on reducing renal fibrosis after renal ischemia reperfusion injury in rats by inhibiting epithelial-mesenchymal transition[J]. Occupation and Health, 2019, 35(4): 466-470. |
| [48] |
周俊华, 熊哲. 胡黄连苷Ⅱ对慢性应激抑郁大鼠的治疗作用及其机制[J]. 医药导报, 2011, 30(12): 1549-1551. ZHOU J H, XIONG Z. Effects and mechanism of picrosideⅡ on rats with chronic stress depression[J]. Herald of Medicine, 2011, 30(12): 1549-1551. |
| [49] |
何薇, 林江涛. 胡黄连苷Ⅱ对哮喘大鼠的抗炎平喘作用[J]. 中日友好医院学报, 2005, 19(4): 233-235. HE W, LIN J T. Experimental study of picroside on airway inflammation and bronchial contraction in asthmatic model rats[J]. Journal of China-Japan Friendship Hospital, 2005, 19(4): 233-235. |
 2022, Vol. 41
2022, Vol. 41