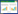文章信息
- 王月儿, 李珠, 冯曼, 李琳, 高杉, 于春泉
- WANG Yue'er, LI Zhu, FENG Man, LI Lin, GAO Shan, YU Chunquan
- 交泰丸对慢性温和不可预知性应激抑郁大鼠肠道菌群的影响
- Effects of Jiaotai Pills on intestinal flora in depression model mice with chronic unpredictable mild stress
- 天津中医药大学学报, 2022, 41(2): 204-211
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(2): 204-211
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.02.18
-
文章历史
收稿日期: 2022-01-20
抑郁症是最常见的精神疾病之一,以情绪低落、兴趣缺乏为主要症状,具有患病率高、复发率高、致残率高的特点。据柳叶刀最近调查发现,全世界每年约有5%的成年人患有抑郁症,患病人数约3.5亿,其中中国的抑郁症的终身患病率为6.9%,人群约有9 500万,且人数还在持续增加[1-2]。抑郁症的病因及发病机制尚不明确,现有抗抑郁药物也不能完全满足抑郁症患者的治疗需求[3]。因此,寻找有效的治疗方法迫在眉睫。近年来,研究发现肠道和大脑之间拥有双向的调节系统,而肠道菌群与大脑之间的关系对抑郁症具有一定的影响[4]。
交泰丸记载于明代《韩氏医通》,由黄连、肉桂(10∶1)配伍组成,方名出自《四科简要方·安神》:生川连五钱,肉桂心五分,研细,白蜜丸,空心淡盐汤下,治心肾不交,怔忡无寐,名交泰丸。黄连味苦性寒,入心经,寒可清火,苦能降泄,故可清降心火;肉桂性辛味甘大热,入肾阳,能温肾水,引火归元,两药一寒一热,一阴一阳,共奏交通心肾,调神定志,临床上常用于治疗失眠,糖尿病等疾病[5-6]。课题组前期研究发现交泰丸可以改善利血平诱导小鼠抑郁模型、慢性温和不可预知性应激大鼠抑郁模型的抑郁行为,并可通过调节cAMP-PKA-CREB-BDNF等细胞信号传导通路达到抗抑郁的目的[7-11]。课题组前期采用CUMS方法成功制备抑郁大鼠模型,并且发现交泰丸通过调节PI3K、AKT、mTOR、4EBP1蛋白表达水平,从而调控大鼠PI3K/AKT/mTOR信号通路,发挥抗抑郁作用[12]。因此在前期研究的基础上,本研究采用16S rDNA高通量测序技术,观察交泰丸对CUMS大鼠肠道菌群组成的调控作用,阐明交泰丸通过调节肠道菌群结构而发挥抗抑郁的作用,为临床上使用交泰丸治疗抑郁症提供科学依据。
1 材料与方法 1.1 实验动物健康Wistar雄性大鼠135只,体质量240~260 g,购于北京维通利华实验动物技术有限公司,合格证号为1100111911013744,动物生产许可证号:SCXK(京)2016-0006,饲养于中国医学科学院放射医学研究所动物房。饲养期间,室温:24~26 ℃,湿度:40%~60%,明暗交替各周期为12 h,分笼饲养,随机分组,普通饲料喂养,自由进食饮水。适应性喂养1周后开始实验。动物实验通过天津中医药大学伦理委员会批准(批准号TCM-LAEC2019066)。
1.2 实验器材PhusionⓇ High-Fidelity PCR Master Mix with GC Buffer(New England Biolabs公司),Bio-rad T100梯度PCR仪,GeneJET胶回收试剂盒(Thermo Scientific公司),TruSeq DNA PCR-Free Library Preparation Kit建库试剂盒(Illumina公司),Magnetic Soil And Stool DNA Kit(版本号为DP180427),Miseq测序仪(美国Illumina公司)等。
1.3 实验药物与制备将黄连、肉桂以10∶1的比例,取黄连400 g,肉桂40 g,制成20目粗粉。黄连加水回流提取3次,加水量依次为10、8、8倍,提取时间分别为170、80、40 min,过滤,2 000 r/min离心20 min,合并上清液,制干粉备用;肉桂与交泰丸分别加水用双提法提取3次,加水量依次为10、8、8倍,提取分别为170、80、40 min,过滤,2 000 r/min离心20 min,合并上清液,制干粉备用;交泰丸加水用双提法提取3次,加水量依次为10、8、8倍,提取分别为170、80、40 min,过滤,2000 r/min离心20 min,合并上清液,将先前分别提取的黄连、肉桂上清液混合,水浴浓缩,制干粉备用。
黄连、肉桂、交泰丸提取液分别进行水浴浓缩,60 ℃烘干,粉碎成干粉,计算出膏率(干粉质量÷饮片质量×100%),4 ℃冰箱保存备用,使用时按所得出膏率用超纯水溶解稀释至溶液或混悬液。
1.4 动物模型的制备及取材将大鼠随机分为9组,分别为空白对照组(C)、模型组(M)、交泰丸高剂量组(3.00 g生药/kg,JTW.H)、交泰丸低剂量组(1.50 g生药/kg,JTW.L)、黄连高剂量组(2.73 g生药/kg,CR.H)、黄连低剂量组(1.36 g生药/kg,CR.L)、肉桂高剂量组(0.27 g生药/kg,CC.H)、肉桂低剂量组(0.14 g生药/kg,CC.L)和氟西汀组(7.5 mg/kg,FLX),每组15只,分笼饲养。
实验前正常供给饲料及饮水,并且进行糖水偏爱实验。模型组与给药组均接受应激刺激,大鼠在刺激21天后按1.0 mL/100 g体质量灌胃给药(空白组和模型组则给予等量的蒸馏水),连续14 d,给药同时继续进行相应刺激。
空白组大鼠正常供给饲料及饮水(蔗糖偏爱实验前禁水24 h除外),不接受任何刺激。CUMS模型主要包括6种刺激因子:冰水游泳、昼夜颠倒、夹尾、振荡、禁食和禁水。每组动物每日随机给予1种应激,保证同一刺激不连续出现,持续35 d。实验结束后,模型组大鼠体质量增长速度缓慢、糖水偏爱率以及旷场实验中水平行走距离与直立次数均明显降低,说明CUMS抑郁大鼠食欲减退、快感缺失、活动量减少、运动迟缓、对对外界的好奇性降低,证明抑郁模型建立成功[12]。在第36天将大鼠麻醉取材,处死大鼠,解剖大鼠直肠,收集新鲜粪便,置微型离心管中,样品于液氮中速冻,保存于-80 ℃冰箱备用待测。
1.5 16S rDNA V3~V4区高通量测序采用CTAB或SDS方法对粪便样本的基因组DNA进行提取,用磁珠法检测DNA浓度及纯度。取适量的样品于离心管中,使用无菌水稀释样品至1 ng/μL。以稀释后的基因组DNA为模板,使用带Barcode的16S rDNA(V3-V4)区域引物:338 F(ACTCCTACGGGAGGCAGCAG)和806 R(GGACTACNNGGGTWTCTAAT)。使用New England Biolabs公司的PhusionⓇ High-Fidelity PCR Master Mix with GC Buffer的酶进行PCR,确保扩增效率和准确性。根据PCR产物浓度进行等浓度混样,充分混匀后使用1×TAE浓度2%的琼脂糖胶电泳纯化PCR产物,选择主带大小在400~450 bp之间的序列,割胶回收目标条带。使用Illumina公司TruSeq DNA PCR-Free Library Preparation Kit建库试剂盒进行文库的构建,构建完成的文库经过Qubit定量和文库检测,合格后,使用NovaSeq 6000进行上机测序。
1.6 生物学信息分析利用Uparse软件[13]对所有样本有效序列进行聚类后,选取OTUs(Operational Taxonomic Units)的代表性序列。使用Mothur方法与SILVA132[14]的SSUrRNA数据库[15]对物种进行门纲目科属的注释。使用Qiime软件(Version 1.9.1)计算Chao1,Simpson,Goods-coverage指数,使用R软件(Version 2.15.3)绘制稀释曲线,Rank abundance曲线,物种累积曲线。使用R软件进行Alpha多样性指数组间差异分析;Alpha多样性指数组间差异分析选用的是Tukey检验。使用R软件的vegan软件包(Version 2.15.3)绘制NMDS图。使用R软件进行β多样性指数组间差异分析,选用的是Tukey检验。LEfSe分析使用LEfSe软件,默认设置LDA Score的筛选值为4。
1.7 统计分析实验数据使用SPSS 24.0软件进行统计分析。结果采用均数±标准差(x±s)表示,若实验结果呈正态性分布且方差齐,采用单因素方差分析;若实验结果呈非正态分布,则采用非参数检验。P < 0.05表示差异有统计学意义。
2 结果 2.1 菌群α多样性分析α多样性常用于衡量群落生态学中物种丰富度和均匀度。为了测试肠道菌群测序的充分性,根据不同测序深度的OTU数构建稀疏曲线、等级聚类曲线和物种累积箱型图(见图 1a、b和c)。实验结果表明,测序数据足以反映样品中微生物种类的大部分信息,各组的丰富度和均匀度较高。
|
| 注: a: 稀疏曲线; b: 等级聚类曲线; c: 物种累积箱形图。C: 空白组; M: 模型组; FLX: 氟西汀组; JTW.H: 交泰丸高剂量组; JTW.L: 交泰丸低剂量组; CR.H: 黄连高剂量组; CR.L: 黄连低剂量组; CC.H: 肉桂高剂量组; CC.L: 肉桂低剂量组。 图 1 各组抑郁症大鼠的物种多样性与丰富性曲线图(n=8) |
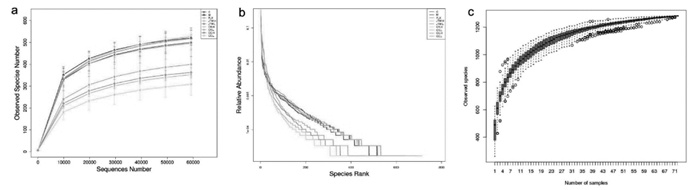
为了观察空白组、模型组、交泰丸高低剂量组、黄连高低剂量组、肉桂高低剂量组的肠道菌群多样性的差异,采用Simpson指数来评估物种多样性,采用Chao1指数和observed species来评估物种丰富度。Simpson指数值越大,则表明菌群多样性越低。Observed species、chao1指数越高,说明菌群的丰富度越高。实验结果表明,模型组Simpson值略低于交泰丸高、低剂量组和黄连高、低剂量组,表明模型组肠道菌群多样性高于交泰丸高、低剂量组和黄连高、低剂量组,且组间比较有显著性差异(P < 0.05)。由Chao1指数和observed species图可知,模型组指数高于交泰丸高低剂量组、黄连高低剂量组,这说明模型组的物种丰富度高于交泰丸高低剂量组、黄连高低剂量组,且组间差异有显著性(P < 0.05)。以上结果表明,给予交泰丸、黄连会使大鼠肠道菌群的α多样性发生明显改变。见图 2。
|
| 注: a: Simpson指数; b: Chao1指数; c: observed species指数。C: 空白组; M: 模型组; FLX: 氟西汀组; JTW.H: 交泰丸高剂量组; JTW.L: 交泰丸低剂量组; CR.H: 黄连高剂量组; CR.L: 黄连低剂量组; CC.H: 肉桂高剂量组; CC.L: 肉桂低剂量组。 图 2 各组抑郁症大鼠肠道菌群Alpha多样性分析图(n=8) |
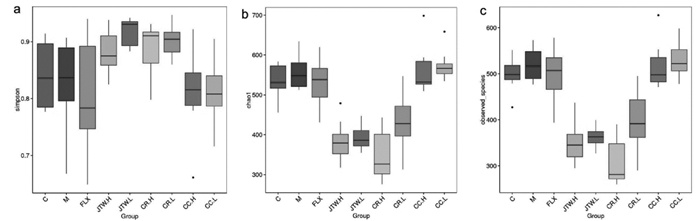
β多样性是对不同样本的微生物群落构成进行比较分析,评估微生物群落差异。无度量多维标定法(NMDS)结果如图所示,交泰丸高剂量组、交泰丸低剂量组、黄连高剂量组、黄连低剂量组、肉桂高剂量组、肉桂低剂量组偏离模型组。表明交泰丸高剂量组、交泰丸低剂量组、黄连高剂量组、黄连低剂量组、肉桂高剂量组、肉桂低剂量组可在一定程度上改变CUMS大鼠肠道菌群结构。见图 3。
|
| 注: C: 空白组; M: 模型组; FLX: 氟西汀组; JTW.H: 交泰丸高剂量组; JTW.L: 交泰丸低剂量组; CR.H: 黄连高剂量组; CR.L: 黄连低剂量组; CC.H: 肉桂高剂量组; CC.L: 肉桂低剂量组。 图 3 各组抑郁症大鼠肠道微生物群落差异的NMDS分析图(n=8) |
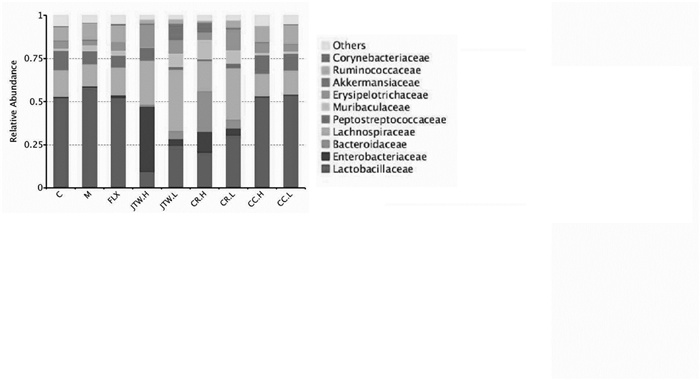
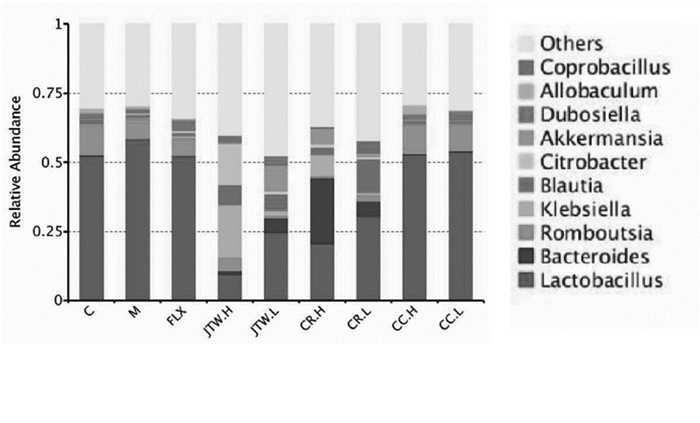
在科水平中,与空白组相比,模型组的毛螺菌科(Lachnospiraceae)相对丰度下降;与模型组相比,交泰丸低剂量组的毛螺菌科(Lachnospiraceae)相对丰度上升(P < 0.05)。与空白组相比,模型组的瘤胃菌科(Ruminococcaceae)相对丰度上升;与模型组相比,交泰丸高低剂量组、黄连高剂量组的瘤胃菌科(Ruminococcaceae)相对丰度降低(P < 0.05)。在属水平中,与空白组相比,模型组的拟杆菌属(Bacteroides)、布劳特氏菌属(Blautia)相对丰度丰度降低;与模型组相比,交泰丸低剂量组的拟杆菌属(Bacteroides)、阿克曼氏菌(Akkermansia)、交泰丸高低剂量组的布劳特氏菌属(Blautia)相对丰度上升(P < 0.05),这说明表明交泰丸可显著调节抑郁大鼠肠道菌群结构及菌落丰度。见图 4和图 5。
|
| 注: C: 空白组; M: 模型组; FLX: 氟西汀组; JTW.H: 交泰丸高剂量组; JTW.L: 交泰丸低剂量组; CR.H: 黄连高剂量组; CR.L: 黄连低剂量组; CC.H: 肉桂高剂量组; CC.L: 肉桂低剂量组。 图 4 各组大鼠肠道菌群在科水平的组成(n=8) |
|
| 注: C: 空白组; M: 模型组; FLX: 氟西汀组; JTW.H: 交泰丸高剂量组; JTW.L: 交泰丸低剂量组; CR.H: 黄连高剂量组; CR.L: 黄连低剂量组; CC.H: 肉桂高剂量组; CC.L: 肉桂低剂量组。 图 5 各组大鼠肠道菌群在属水平的组成(n=8) |
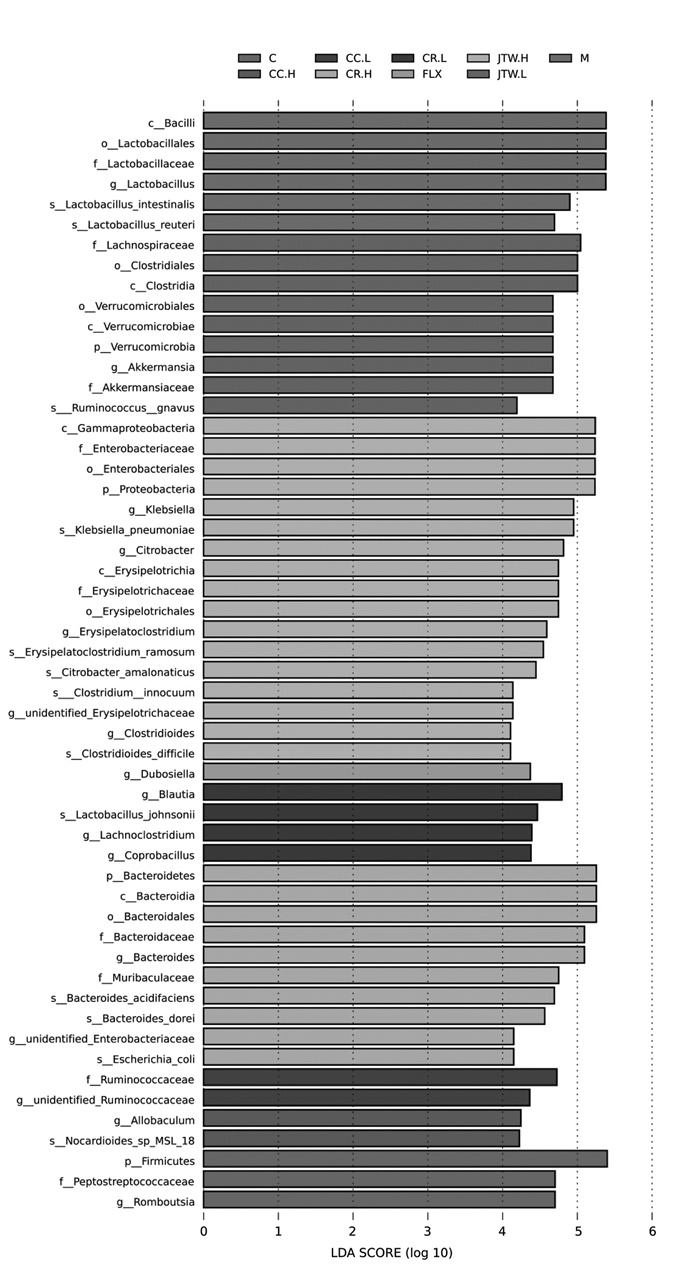
通过LEfSe分析筛选各组的优势菌,结果发现空白组的差异菌群为厚壁菌门(Firmicutes)、消化链球菌科(Peptostreptococcaceae)和罗姆布茨菌属(Romboutsia)。模型组的差异菌群为芽孢杆菌(Bacillus)、乳杆菌目(Lactobacillales)、乳杆菌科(Lactobacillaceae)、乳杆菌属(Lactobacillus)。FLX组的差异菌群为Dubosiella。JTW.H组的差异菌群为变形菌门(Proteobacteria)、克雷伯氏菌(Klebsiella)、柠檬酸杆菌(Citrobacter)、丹毒丝菌纲(Erysipelotrichia)、Clostridioides等。JTW.L组的差异菌群为梭菌纲(Clostridia)、疣微菌纲(Verrucomicrobiae)、毛螺菌科和阿克曼氏菌纲(Akkermansiaceae)等。CR.H组的差异菌群为拟杆菌和Muribaculaceae。CR.L组的差异菌群为布劳特氏菌属、Lachnoclostridium和粪芽孢菌属(Coprobacillus)。CC.H组的差异菌群为Allobaculum。CC.L组的差异菌群为瘤胃菌科(Ruminococcaceae)。见图 6。
|
| 注: C: 空白组; M: 模型组; FLX: 氟西汀组; JTW.H: 交泰丸高剂量组; JTW.L: 交泰丸低剂量组; CR.H: 黄连高剂量组; CR.L: 黄连低剂量组; CC.H: 肉桂高剂量组; CC.L: 肉桂低剂量组。 图 6 各组菌群LEfSe分析(n=8) |
肠道菌群包含上千种细菌,300多万个基因,是人体基因组的150倍,被称为“人体第二基因组”[16]。过去人们大多关注肠道菌群与功能性胃肠疾病、代谢性疾病的关系,如肥胖,糖尿病,高血压等[17]。近年来,人们开始把焦点转移到神经系统疾病,发现肠道菌群可以与大脑相互作用,影响精神性疾病的发生发展,如焦虑、抑郁、精神分裂及神经退行性疾病等[18-19]。研究表明,肠道菌群能通过“微生物-肠-脑轴”影响大脑神经生化,进而影响人们的情绪和行为[20]。
自从发现了肠道菌群和抑郁症的密切关系后,越来越多的研究者开始寻求通过调节肠道菌群来治疗抑郁症的方法。Haghighat等[21]研究发现益生菌可以增加抑郁症患者脑源性神经营养因子(BDNF)的水平,改善患者的抑郁症状。Sun等[22]研究表明益生菌可以通过菌肠脑轴来改善CUMS大鼠的5-羟色胺(5-HT)与BNDF水平来达到抗抑郁的目的。本研究通过分析肠道菌群的多样性与丰富性,揭示CUMS大鼠与给药组大鼠肠道菌群结构的变化,借助相关统计学方法筛选各分类水平中相对丰度发生改变的差异菌群,发现交泰丸对于抑郁症大鼠肠道菌群的影响。
拟杆菌的一些菌株长期以来一直被视为益生菌。拟杆菌在调节肠道菌群动态平衡,增加宿主免疫力等方面具有重要作用[23-24]。Cheng等[25]通过微生物相关基因集富集分析发现拟杆菌与抑郁相关。拟杆菌属物种可能通过肠脑代谢信号差异调节抑郁样行为[26]。在本研究中,交泰丸增加CUMS大鼠的拟杆菌丰度,这与之前的研究一致[27]。交泰丸可能通过增加拟杆菌的含量促进肠道菌群动态平衡的恢复,进而改善大鼠的类似抑郁症状。然而,拟杆菌与抑郁症的机制研究尚不明确,需要进一步的研究证明其与抑郁症的关系。
阿克曼氏菌广泛存在于健康人群的肠道中,具有保护肠道屏障和减轻肠道炎症反应的作用[28-29]。通过将差异丰富的肠道菌群与抑郁指标和代谢物水平联系起来,发现阿克曼氏菌丰度的改变与抑郁症状和炎症细胞因子密切相关[30]。研究发现阿克曼氏菌与5-HT存在正相关的关系,而5-HT的水平与抑郁症的发展密切相关[31-32]。陈拓[33]研究发现阿克曼氏菌可以缓解小鼠的抑郁样行为。这些结果表明,阿克曼氏菌可能是治疗抑郁症的潜在新靶点。
醋酸、丙酸、丁酸等短链脂肪酸(SCFAs)与肠道微生物群密切相关。在抑郁症小鼠中,菌群分类、短链脂肪酸和神经递质之间存在一些显著的相关性,如阿克曼氏菌与乙酸水平呈显著的正相关[31],毛螺菌科是肠道中短链脂肪酸的生产者[34],多酚通过影响肠道微生物群中的拟杆菌门来促进SCFAs的产生[35]。在本研究中,交泰丸增加CUMS大鼠的拟杆菌,阿克曼氏菌,毛螺菌科的丰度。因此,交泰丸可能通过调节肠道微生物的丰度来影响SCFAs的合成,从而产生一些抗抑郁作用。但是,肠道菌群和SCFAs关系在交泰丸治疗抑郁症的作用有待进一步研究。
毛螺菌科和布劳特氏菌属的丰度变化与抑郁症的发展存在一定的相关性[23, 36]。研究发现,抑郁症患者的毛螺菌科和布劳特氏菌属减少,但治疗后增加[37-39],这与本研究的结果一致。还观察到瘤胃菌科丰度的下降。研究发现,瘤胃菌科是对照组和抑郁小鼠之间差异最丰富的分类单元[31]。另一项研究表明氯胺酮显著降低抑郁大鼠瘤胃球菌科丰度[40]。交泰丸的抗抑郁作用可能与毛螺菌科、布劳特氏菌属和瘤胃菌科的变化有关,但还需要更多的研究来更好地证明抑郁症与肠道菌群变化之间的关系。
综上所述,交泰丸可能通过调节肠道菌群的菌落丰度变化来发挥抗抑郁作用。交泰丸改善抑郁症大鼠模型中主要肠道细菌丰度的新结果可能有助于阐明体内抗抑郁药的机制,对交泰丸用于临床治疗抑郁症提供参考依据。然而,交泰丸干预肠道菌群从而影响抑郁症的机制仍需要更进一步的研究。
| [1] |
HERRMAN H, PATEL V, KIELING C, et al. Time for united action on depression: a lancet-world psychiatric association commission[J]. Lancet, 2022, 399(10328): 957-1022. DOI:10.1016/S0140-6736(21)02141-3 |
| [2] |
LU J, XU X F, HUANG Y Q, et al. Prevalence of depressive disorders and treatment in China: A cross-sectional epi-demiological study[J]. The Lancet Psychiatry, 2021, 8(11): 981-990. DOI:10.1016/S2215-0366(21)00251-0 |
| [3] |
李平. 阿戈美拉汀与文拉法辛治疗抑郁症的效果差异分析[J]. 中国现代药物应用, 2021, 15(23): 152-155. LI P. Analysis of the difference between agomelatine and venlafaxine in the treatment of depression[J]. Chinese Jour-nal of Modern Drug Application, 2021, 15(23): 152-155. |
| [4] |
刘保光, 董颖, 谢苗, 等. 基于脑-肠-微生物轴探讨肠道菌群对抑郁症的影响[J]. 中华中医药杂志, 2021, 36(10): 6027-6029. LIU B G, DONG Y, XIE M, et al. Discussion on the effects of intestinal flora on depression based on brain-gut-microorganism axis[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2021, 36(10): 6027-6029. |
| [5] |
赵一璟, 张婧婧, 范尧夫, 等. 交泰丸治疗2型糖尿病伴失眠症58例临床研究[J]. 江苏中医药, 2021, 53(10): 30-33. ZHAO Y J, ZHANG J J, FAN Y F, et al. Clinical study of Jiaotai Pill in the treatment of 58 cases of type 2 diabetes mellitus with insomnia[J]. Jiangsu Journal of Traditional Chinese Medicine, 2021, 53(10): 30-33. |
| [6] |
秦珊, 吴文忠, 刘成勇, 等. 交泰丸穴位贴敷治疗心肾不交型老年失眠症临床疗效及安全性评价[J]. 中华中医药杂志, 2021, 36(8): 5072-5075. QIN S, WU W Z, LIU C Y, et al. Clinical efficacy and safety assessment of acupoint application with Jiaotai Pills in treating senile insomnia caused by imbalance between heart-yang and kidney-yin[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2021, 36(8): 5072-5075. |
| [7] |
杨帅, 潘晔, 宋彦奇, 等. 交泰丸对抑郁大鼠行为学及脑内单胺类神经递质的影响[J]. 中草药, 2016, 47(23): 4218-4223. YANG S, PAN Y, SONG Y Q, et al. Effects of Jiaotai Pill on behavior and monoamine neurotransmitters of depression rat model[J]. Chinese Traditional and Herbal Drugs, 2016, 47(23): 4218-4223. |
| [8] |
梁如, 殷佳, 潘晔, 等. 交泰丸对慢性温和不可预知性应激抑郁模型大鼠炎性细胞因子的影响[J]. 中草药, 2018, 49(5): 1100-1105. LIANG R, YIN J, PAN Y, et al. Effects of Jiaotai Pill on inflammatory cytokines in depression model mice with chronic unpredictable mild stress[J]. Chinese Traditional and Herbal Drugs, 2018, 49(5): 1100-1105. |
| [9] |
雒明池, 梁如, 高树明, 等. 基于cAMP-CREB-BDNF信号通路探讨交泰丸抗抑郁的作用机制[J]. 天津中医药, 2018, 35(5): 365-369. LUO M C, LIANG R, GAO S M, et al. Antidepressant mech-anism of Jiaotai Pill based on cAMP-CREB-BDNF signaling pathway[J]. Tianjin Journal of Traditional Chinese Medicine, 2018, 35(5): 365-369. |
| [10] |
雒明池, 梁如, 高杉, 等. 基于NO-cGMP信号转导通路交泰丸对慢性温和不可预知性应激抑郁大鼠的抗抑郁作用研究[J]. 中草药, 2018, 49(18): 4344-4348. LUO M C, LIANG R, GAO S, et al. Antidepressant effects of Jiaotai Pills based on NO-cGMP signal transduction path-way in chronic mild unpredictable stress depression rats[J]. Chinese Traditional and Herbal Drugs, 2018, 49(18): 4344-4348. DOI:10.7501/j.issn.0253-2670.2018.18.019 |
| [11] |
JIAO Z Y, ZHAO H, HUANG W, et al. An investigation of the antidepressant-like effect of Jiaotai Wan in rats by non-targeted metabolomics based on ultra-high-performance liq-uid chromatography quadrupole time-of-flight mass spec-trometry[J]. Journal of Separation Science, 2021, 44(2): 645-655. DOI:10.1002/jssc.202000576 |
| [12] |
冯曼. 基于PI3K/AKT/mTOR信号通路探讨交泰丸及其拆方抗抑郁的作用机制[D]. 天津: 天津中医药大学, 2020. FENG M. Study on the antidepressant effect mechanism of JiaotaiPill and its separated recipes based on PI3K/AKT/mTOR signaling pathway[D]. Tianjin: Tianjin University of Traditional Chinese Medicine, 2020. |
| [13] |
HAAS B J, GEVERS D, EARL A M, et al. Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons[J]. Genome Research, 2011, 21(3): 494-504. DOI:10.1101/gr.112730.110 |
| [14] |
EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature methods, 2013, 10(10): 996-998. DOI:10.1038/nmeth.2604 |
| [15] |
WANG Q, GARRITY G M, TIEDJE J M, et al. Naive baye-sian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267. DOI:10.1128/AEM.00062-07 |
| [16] |
邓琦蕾, 申元英. 肠道微生物群在脑-肠-微生物轴中作用机制的研究进展[J]. 实用医学杂志, 2017, 33(14): 2404-2407. DENG Q L, SHEN Y Y. Research progress on the role of gut microbiota in the brain-gut-microbe axis[J]. The Journal of Practical Medicine, 2017, 33(14): 2404-2407. DOI:10.3969/j.issn.1006-5725.2017.14.040 |
| [17] |
FORSLUND K, HILDEBRAND F, NIELSEN T, et al. Disen-tangling type 2 diabetes and metformin treatment signatures in the human gut microbiota[J]. Nature, 2015, 528(7581): 262-266. DOI:10.1038/nature15766 |
| [18] |
ZHU S B, JIANG Y F, XU K L, et al. The progress of gut microbiome research related to brain disorders[J]. Journal of Neuroinflammation, 2020, 17(1): 25. DOI:10.1186/s12974-020-1705-z |
| [19] |
WESTFALL S, DINH D M, PASINETTI G M. Investigation of potential brain microbiome in Alzheimer' s disease: implications of study bias[J]. Journal of Alzheimer's Disease: JAD, 2020, 75(2): 559-570. DOI:10.3233/JAD-191328 |
| [20] |
RAIMONDI I, IZZO L, TUNESI M, et al. Organ-on-a-chip in vitro models of the brain and the blood-brain barrier and their value to study the microbiota-gut-brain axis in neu-rodegeneration[J]. Frontiers in Bioengineering and Biotech-nology, 2020, 7: 435. DOI:10.3389/fbioe.2019.00435 |
| [21] |
HAGHIGHAT N, RAJABI S, MOHAMMADSHAHI M. Effect of synbiotic and probiotic supplementation on serum brain-derived neurotrophic factor level, depression and anxiety symptoms in hemodialysis patients: a randomized, double-blinded, clinical trial[J]. Nutritional Neuroscience, 2021, 24(6): 490-499. DOI:10.1080/1028415X.2019.1646975 |
| [22] |
SUN J, WANG F Y, HU X Z, et al. Clostridium butyricum attenuates chronic unpredictable mild stress-induced de-pressive-like behavior in mice via the gut-brain axis[J]. Journal of Agricultural and Food Chemistry, 2018, 66(31): 8415-8421. DOI:10.1021/acs.jafc.8b02462 |
| [23] |
WANG C, XIAO Y, YU L L, et al. Protective effects of dif-ferent bacteroides vulgatus strains against lipopolysaccha-ride-induced acute intestinal injury, and their underlying functional genes[J]. Journal of Advanced Research, 2022, 36(2): 27-37. |
| [24] |
LEE J H, KWON S J, HAN J Y, et al. A mucin-responsive hybrid two-component system controls Bacteroides thetaio-taomicron colonization and gut homeostasis[J]. Journal of Microbiology, 2022, 60(2): 215-223. DOI:10.1007/s12275-022-1649-3 |
| [25] |
CHENG S Q, HAN B, DING M, et al. Identifying psychiatric disorder-associated gut microbiota using microbiota-related gene set enrichment analysis[J]. Briefings in Bioinformatics, 2019, 21(3): 1016-1022. |
| [26] |
ZHANG Y Y, FAN Q L, HOU Y L, et al. Bacteroides species differentially modulate depression-like behavior via gut-brain metabolic signaling[J]. Brain, Behavior, and Im-munity, 2022, 102(5): 11-22. |
| [27] |
XIAO Q F, SHU R N, WU C L, et al. Crocin-I alleviates the depression-like behaviors probably via modulating "micro-biota-gut-brain" axis in mice exposed to chronic restraint stress[J]. Journal of Affective Disorders, 2020, 276: 476-486. DOI:10.1016/j.jad.2020.07.041 |
| [28] |
SWIDSINSKI A, DÖRFFEL Y, LOENINGÖBAUCKE V, et al. Acute appendicitis is characterised by local invasion with fusobacterium nucleatum/necrophorum[J]. Gut, 2011, 60(1): 34-40. DOI:10.1136/gut.2009.191320 |
| [29] |
BELZER C, DE V W M. Microbes inside-from diversity to function: the case of akkermansia[J]. ISME Journal, 2012, 6(8): 1449-1458. DOI:10.1038/ismej.2012.6 |
| [30] |
MA W N, SONG J, WANG H R, et al. Chronic paradoxical sleep deprivation-induced depression like behavior, energy metabolism and microbial changes in rats[J]. Life Sciences, 2019, 225(6): 88-97. |
| [31] |
WU M, TIAN T, MAO Q, et al. Associations between disor-dered gut microbiota and changes of neurotransmitters and short-chain fatty acids in depressed mice[J]. Translational Psychiatry, 2020, 10(1): 350. DOI:10.1038/s41398-020-01038-3 |
| [32] |
WU S J, CHANG C Y, LAI Y T, et al. Increasing γ-aminobutyric acid content in vegetable soybeans via high-pressure processing and efficacy of their antidepressant-like activity in mice[J]. Foods (Basel, Switzerland), 2020, 9(11): 1673. |
| [33] |
陈拓. 交泰丸通过肠道菌群介导的肠粘膜屏障修复缓解心理应激合并结肠炎的研究[D]. 南京: 南京中医药大学, 2020. CHEN T. Jiaotai Wan alleviate gut microbiota-mediated in-testinalmucosal barrier damage in the stress mice following colitis[D]. Nanjing: Nanjing University of Chinese Medicine, 2020. |
| [34] |
ZHUANG P, ZHANG Y, SHOU Q Y, et al. Eicosapen-taenoic and docosahexaenoic acids differentially alter gut microbiome and reverse high-fat diet-induced insulin resis-tance[J]. Molecular Nutrition & Food Research, 2020, 64(10): e1900946. |
| [35] |
ZHOU N, GU X Y, ZHUANG T X, et al. Gut microbiota: a pivotal hub for polyphenols as antidepressants[J]. Journal of Agricultural and Food Chemistry, 2020, 68(22): 6007-6020. DOI:10.1021/acs.jafc.0c01461 |
| [36] |
HUMBEL F, RIEDER J H, FRANC Y, et al. Association of alterations in intestinal microbiota with impaired psychologi-cal function in patients with inflammatory bowel diseases in remission[J]. Clinical Gastroenterology and Hepatology, 2020, 18(9): 2019-2029. DOI:10.1016/j.cgh.2019.09.022 |
| [37] |
GU F, WU Y Y, LIU Y, et al. Lactobacillus casei improves depression-like behavior in chronic unpredictable mild stress-induced rats by the BDNF-TrkB signal pathway and the intestinal microbiota[J]. Food & Function, 2020, 11(7): 6148-6157. |
| [38] |
YANG Q, LUO L, SUN T, et al. Chronic minocycline treat-ment exerts antidepressant effect, inhibits neuroinflamma-tion, and modulates gut microbiota in mice[J]. Psychophar-macology, 2020, 237(10): 3201-3213. DOI:10.1007/s00213-020-05604-x |
| [39] |
WONG M L, INSERRA A, LEWIS M D, et al. Inflamma-some signaling affects anxiety-and depressive-like behavior and gut microbiome composition[J]. Molecular Psychiatry, 2016, 21(6): 797-805. DOI:10.1038/mp.2016.46 |
| [40] |
GETACHEW B, AUBEE J I, SCHOTTENFELD R S, et al. Ketamine interactions with gut-microbiota in rats: relevance to its antidepressant and anti-inflammatory properties[J]. BMC Microbiology, 2018, 18(1): 222. DOI:10.1186/s12866-018-1373-7 |
 2022, Vol. 41
2022, Vol. 41