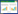文章信息
- 陈莉, 安海燕, 郭晓媛, 张承承
- CHEN Li, AN Haiyan, GUO Xiaoyuan, ZHANG Chengcheng
- 益肾化湿颗粒改善糖尿病小鼠早期肾小管损伤的实验研究
- Experimental study of Yishen Huashi Granule inproving early renal tubular injury in diabetic mice
- 天津中医药大学学报, 2022, 41(2): 212-217
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(2): 212-217
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.02.19
-
文章历史
收稿日期: 2021-12-25
2. 北京中医药大学东方医院肾病科, 北京 100078
2. Dongfang Hospital Affiliated to Beijing University of Chinese Medicine, Beijing 100078, China
糖尿病肾病(DKD)是糖尿病(DM)常见微血管并发症之一,也是导致终末肾脏病(ESRD)的主要原因。近些年来,DM的发病率逐年升高,国际糖尿病联合会根据既往调查研究统计2019年全球DM患病率约9.3%,到2030年估计将上升至10.2%,而至2045年可能将上升至10.9%,由DKD及相关并发症的治疗将给全球医疗保健系统带来沉重的经济负担[1],因此,对于DKD的早期干预与治疗也越加受到重视。既往对DKD早期肾脏病理的认识均以肾小球损伤为主,但近些年来新的观点认为肾小管损伤可能才是DKD早期蛋白尿形成的主要原因[2]。肾小管上皮细胞megalin、cubilin蛋白是重吸收尿蛋白的主要结构,当两者表达减少时可导致蛋白尿加重。尿液中性粒细胞明胶酶相关脂质运载蛋白(NGAL)水平与白蛋白尿正相关,而与肾小球滤过率呈负相关,是肾小管损伤的标记物,并且是监测DKD很有前途的早期指标[3]。肾小管损伤是导致DKD患者肾功能下降的主要原因。目前中医在治疗DKD上的优势越发凸显,其中益肾化湿颗粒为近些年来新研发的中成药,经相关研究证实在改善DKD患者肾功能及并发症上疗效显著[4-5]。本研究主要观察益肾化湿颗粒减轻db/db小鼠早期肾小管损伤,延缓DKD进展的作用,为临床治疗DKD提供科学依据。
1 材料与方法 1.1 实验动物18只SPF级健康雄性db/db小鼠,6~7周龄,体质量(35~45)g;6只SPF级健康雄性db/m小鼠,6~7周龄,体质量(20~25)g,购自常州卡文斯实验动物有限公司,动物生产许可证号:SCXK(苏)2016-0010。所有动物饲养在北京中医药大学东方医院实验中心SPF级实验动物屏障环境,温度21~22 ℃,相对湿度60%~70%,24 h昼夜循环光环境,动物自由进食,自由饮水。饲料为普通清洁级大鼠维持饲料,购于北京科奥协力饲料有限公司。本实验通过北京中医药大学东方医院医学实验动物伦理委员会审查(201924)。
1.2 药物益肾化湿颗粒(广州康臣药业有限公司,批号:国药准字Z20090250);缬沙坦胶囊(北京诺华制药有限公司,批号:国药准字H20040217)。
1.3 试剂及仪器4%多聚甲醛(欧北生物科技有限公司);兔抗megalin多克隆抗体(美国Proteintech Group公司);羊抗cubilin多克隆抗体(美国R&D Systems公司);NGAL酶联免疫吸附测定试剂盒(杭州联科生物技术股份有限公司);尿蛋白(UTP)、肌酐(Scr)、尿素氮(BUN)、尿酸(UA)、甘油三酯(TG)、低密度脂蛋白(LDL)检测试剂(英科新创科技有限公司);PAS染色试剂盒(北京索莱宝科技有限公司)。AU480型全自动生化分析仪(美国贝克曼公司);切片机(上海徕卡仪器有限公司);多功能酶标仪(Thermo);电热恒温培养箱(天津泰斯特DH4000A);MH-1微孔板震荡器(kylin-Bell);洗板机(Thermo);普通光学显微镜(Olympus L340099);成像系统(日本尼康Nikon DS-U3)。
1.4 分组及干预所有小鼠适应性喂养1周后将18只自发型2型糖尿病db/db小鼠随机分为模型组、缬沙坦组、益肾化湿组,每组6只,另设雄性db/m小鼠6只为正常对照组。
缬沙坦胶囊及益肾化湿颗粒均以去离子水充分搅拌混匀,4 ℃冰箱保存药物,灌胃前将药物从冰箱取出置于温水中水浴至药物温度适中后再行灌胃,对照组及模型组予去离子水[10 mL/(kg·d)] 灌胃。缬沙坦组予缬沙坦胶囊[(生药13. 33 mg/(kg·d)]灌胃,益肾化湿组予益肾化湿颗粒[(生药5 g/(kg·d)]灌胃(约等于人体推荐剂量的10倍)[6],连续干预12周。由于灌胃过程操作失误,中药组小鼠死亡1只。
药物干预12周后代谢笼收集24 h尿液并记录尿量,-20 ℃冰箱保存,备用24 h-UTP及NGAL检测。采用1%戊巴比妥钠溶液(50 mg/kg)将小鼠麻醉后取血,备用血液生化检测。取血后处死小鼠,肾组织以4%多聚甲醛固定后备用PAS染色及免疫组化检测。
1.5 指标检测 1.5.1 血清生化指标检测血液标本静置2 h后,4 ℃、3 000 r/min、20 min离心提取血清,-80 ℃冰箱保存,全自动生化分析仪检测Scr、BUN、UA、TG、LDL水平。
1.5.2 24 h-UTP及尿NGAL水平检测采用全自动生化分析仪检测24 h-UTP水平;ELISA法检测尿液NGAL水平,严格按照ELISA试剂盒说明书进行操作。
1.5.3 肾组织PAS染色小鼠肾组织固定后脱水,石蜡切片置于60 ℃烤箱烘片30 min,分别用二甲苯和梯度乙醇脱蜡水化,行PAS染色,400倍镜下拍片。结果判定:采用Image Pro Plus 6.0图像分析系统进行PAS染色分析,每张切片选6个视野,计算肾小球系膜和基底膜相对面积,取平均值。肾小球系膜基质指数=PAS阳性染色面积/肾小球毛细血管袢总面积×100%[7]。
1.5.4 肾组织megalin、cubilin免疫组化染色小鼠肾组织固定后脱水,石蜡切片脱蜡、水化,3%过氧化氢孵育10 min灭活过氧化氢酶,枸橼酸缓冲液修复抗原,5%牛血清白蛋白封闭,分别加入一抗、二抗孵育,DAB显色,苏木素复染,1%盐酸酒精分化,1%氨水返蓝后脱水封片,200倍镜下进行拍片,结果判定:阳性表达部分呈棕黄色颗粒状,用Image Pro Plus 6.0图像分析软件对每张图片选中区域进行IOD(sum)及Area(sum)采集,然后以IOD(sum)/Area(sum)得到每张图片的平均光密度值,每例切片测定5个非重复视野,结果取平均值。
1.6 统计方法采用SPSS 20.0进行数据分析,计量数据以(x±s)表示,多组间比较采用单因素方差分析(One-way ANOVA)分析,方差齐时,各组间两两比较采用LSD检验,方差不齐时,则采用Tamhance’s T2检验,数据不符合正态分布则采用非参数检验,P < 0. 05为差异有统计学意义。
2 结果 2.1 益肾化湿颗粒对小鼠血液生化指标的影响与正常组比较,模型组小鼠血液UA、TG及LDL水平升高,差异具有统计学意义(P < 0.01),BUN、Scr水平无明显变化,差异无统计学意义。与模型组比较,缬沙坦组小鼠LDL水平下降,差异具有统计学意义(P < 0.01),益肾化湿组小鼠UA、LDL水平下降,差异具有统计学意义(P < 0.05),益肾化湿组小鼠血液TG水平有下降趋势,但无统计学意义,见表 1。
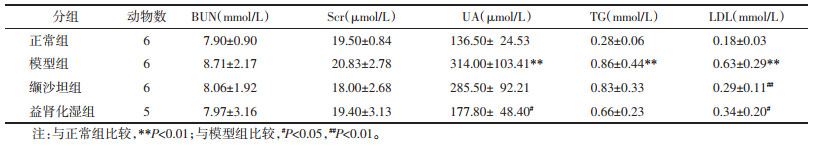
与正常组比较,模型组小鼠24 h-UTP及尿液NGAL水平升高,差异具有统计学意义(P < 0.01)。与模型组比较,缬沙坦组及益肾化湿组小鼠24 h-UTP及尿液NGAL水平有不同程度下降,差异具有统计学意义(P < 0.05,P < 0.01),见表 2。
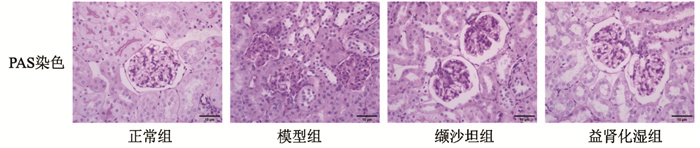
PAS染色提示,正常组小鼠肾小球结构正常,毛细血管清晰,基底膜均匀,未见明显系膜基质增生;模型组小鼠较正常组小鼠肾小囊腔狭窄,肾小球毛细血管腔不明显,系膜区明显增宽,系膜基质增生,肾小管管腔不规则,部分肾小管刷状缘丢失;缬沙坦组小鼠肾小球毛细血管清晰,基底膜稍增厚,局部系膜基质增生,可见紫红色糖原物质沉积,部分肾小管管腔不规则;益肾化湿组小鼠系膜基质增生不明显,肾小球毛细血管腔明显,肾小管排列规整,刷状缘较完整,见图 1。
|
| 图 1 各组小鼠肾组织PAS染色 |
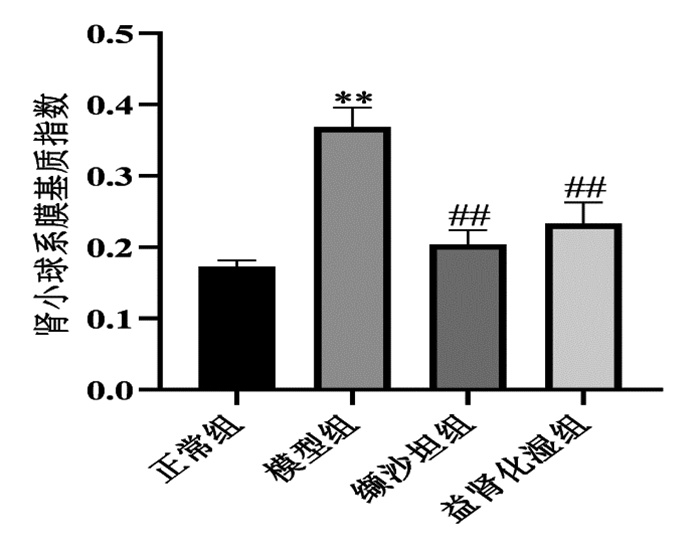
Imagepro Plus 6.0软件统计,与正常组比较,模型组小鼠肾小球系膜基质指数升高,差异具有统计学意义(P < 0.01);与模型组比较,缬沙坦组和益肾化湿组肾小球系膜基质指数下降,差异具有统计学意义(P < 0.01),见图 2。
|
| 注: 与正常组比较, **P<0.01;与模型组比较, ##P<0.01。 图 2 各组小鼠肾小球系膜基质指数分析比较(x±s) |
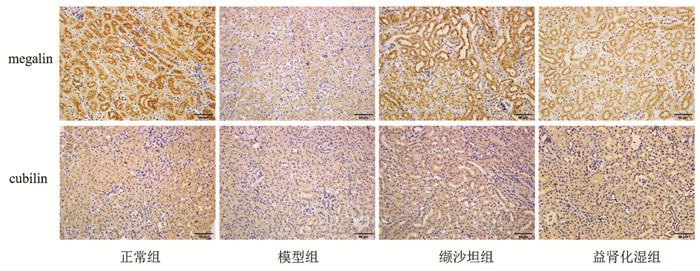
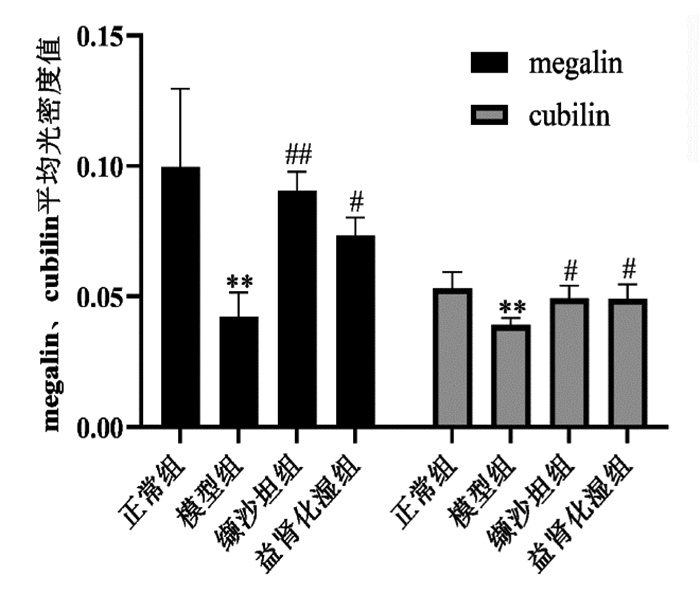
正常组小鼠肾小管上皮细胞megalin、cubilin蛋白均大量表达,主要表达在近端肾小管胞浆内。与正常组比较,模型组小鼠肾组织megalin、cubilin表达下降,Imagepro Plus 6.0软件统计megalin、cubilin平均光密度值下降,差异具有统计学意义(P<0.01);与模型组比较,缬沙坦组及益肾化湿组小鼠肾小管上皮细胞megalin、cubilin表达增加,Imagepro Plus 6.0统计平均光密度值有不同程度升高,差异具有统计学意义(P<0.05,P<0.01),见图 3、图 4。
|
| 图 3 各组小鼠肾小管上皮细胞megalin、cubilin蛋白的表达 |
|
| 注: 与正常组比较, **P<0.01, 与模型组比较, #P<0.05, ##P<0.01。 图 4 各组小鼠肾小管megalin、cubilin表达的平均光密度值分析比较(x±s) |
DKD主要以蛋白尿及肾功能下降导致的相关临床症状为主,中医多将之归于“下消”“尿浊”“浊毒”“水肿”“关格”等范畴。对于DKD的病因病机认识,《灵枢·本脏》曰:“脾脆……善病消渴。”《外台秘要·消渴消中》云:“消渴者,原其发动,此则肾虚所致,每发即小便至甜。”《类证治裁·三消论治》曰:“小水不臭反甜者,此脾气下脱。”可见本病发生发展与脾肾两脏关系密切。肾主藏精,肾虚精失固摄,下泄形成蛋白尿。脾主运化,通过脾升胃降使机体气机升降有序,水液正常输布至全身,若脾胃虚弱则易导致水液停滞,湿邪酿生,脾的生理特性喜燥恶湿,湿邪贯穿于DKD病程始终,湿邪可以反过来困遏脾阳,导致脾气不升,加重水液运化功能障碍,湿性黏滞致病情缠绵难愈,反复发作,故治疗DKD时应当重视健脾益肾,升阳除湿。
益肾化湿颗粒原方出自李东垣《脾胃论》中的名方“升阳益胃汤”,由人参、黄芪、白术、茯苓、陈皮、炙甘草、柴胡、独活、羌活、防风、泽泻、黄连、白芍等16味中药组成,方中人参、白术、茯苓、炙甘草、陈皮、半夏取自六君子汤,为益气健脾、燥湿化痰之代表方;黄芪为补气之圣药,五脏并补,还具有行水消肿的功效;柴胡、独活、羌活、防风为祛风药,味薄气轻而升散之力强,黄连清热燥湿,泽泻祛下焦湿浊,导湿热从小便排出,诸药合用,有补有泻,具有升阳健脾,化湿清热的功效。在此方中并无直接益肾的药物,但却以“益肾”为名,是基于脾肾两脏之间的关系,通过补益脾胃,清化水湿之邪,使后天水谷精微之气化生有源,从而得以不断充盈先天,故能“益肾”。
目前,早期DKD损伤机制和治疗靶点的研究已由以肾小球损伤为中心转移到“糖尿病肾小管病(DT)”研究[8]。因此,肾小管损伤的防治研究具有重要的临床意义。此外,国内外对小鼠进入早期DKD阶段的判断尚无明确标准,但基于对db/db小鼠肾脏病理特点的研究发现该小鼠一般不会发展至肾小球硬化和肾功能进行性下降的阶段,因此广泛用于研究早期DKD病变[9]。本实验中db/db小鼠24 h-UTP水平较正常组小鼠明显升高,系膜基质增生,肾小管刷状缘丢失,伴有血UA及血脂水平的升高,而益肾化湿颗粒干预后可以有效降低24 h-UTP,缓解DKD系膜增生及小管病变,减轻db/db小鼠肾损伤,并且具有降低血UA和LDL水平的作用,提示益肾化湿颗粒可以通过改善DKD并发症起到延缓疾病进展的作用。
NGAL是一种分子质量约25KD的脂质转运蛋白,主要由包括中性粒细胞及肾小管上皮细胞在内的各种上皮细胞释放,其一般在正常人体内保持着极低的水平,但是当近端肾小管损伤时,其水平可显著增加[10-11],相关研究表明在DKD患者中,尿液NGAL水平与肾小管间质损伤程度相关,可以作为肾小管损伤标志物[12]。本实验模型组小鼠尿液NGAL水平水平较正常组小鼠明显升高,提示存在肾小管损伤,经益肾化湿颗粒干预后db/db小鼠尿液NGAL水平明显下降,说明药物可以有效保护肾小管。
Megalin和cubilin同属低密度脂蛋白受体家族成员,在近端肾小管上皮细胞中可见到这两种蛋白受体的大量表达,并通过胞吞作用介导肾小管重吸收尿蛋白的过程,当肾小管上megalin、cubilin缺失时可以导致显著的蛋白尿生成[13]。DKD早期就可以出现megalin、cubilin的表达减少,并且随病程进展,这两种蛋白的表达情况更进一步下降。Peruchetti等[14]利用高糖刺激肾小管上皮细胞,发现培育48 h后megalin表达明显减少,Giraud-Billoud等[15]对糖尿病小鼠进行观察亦发现其肾皮质上megalin、cubilin蛋白表达明显减少,而尿白蛋白水平明显升高,此外,多项实验结果表明这种改变很早就已经发生[16-17]。因此,megalin、cubilin也可以反映DKD进程中的肾小管损伤。本研究发现db/db小鼠较db/m小鼠肾小管上皮细胞megalin、cubilin蛋白表达明显减少并出现明显蛋白尿,提示megalin、cubilin蛋白表达减少可能是db/db小鼠早期蛋白尿形成的主要原因。经益肾化湿颗粒干预后,与模型组比较,db/db小鼠肾小管上皮细胞megalin、cubilin蛋白表达明显增加,说明益肾化湿颗粒可能通过上调megalin、cubilin蛋白的表达从而减少尿蛋白的形成,可以在一定程度上缓解db/db小鼠早期肾小管损伤。
积极防治肾小管损伤对于延缓DKD病情具有重要意义,益肾化湿颗粒可以降低db/db小鼠24 h-UTP,改善肾脏病理损伤,其作用可能与上调肾小管上皮细胞megalin、cubilin蛋白的表达,下调尿液NGAL水平,减轻早期肾小管损伤有关,但是对于其具体作用机制仍需进一步的研究。
| [1] |
SAEEDI P, PETERSOHN I, SALPEA P, et al. Global and regional diabetes prevalence estimates for 2019 and projec-tions for 2030 and 2045:Results from the international dia-betes federation diabetes atlas, 9th edition[J]. Diabetes Re-search and Clinical Practice, 2019, 157(6): 107843. |
| [2] |
DI VINCENZO A, BETTINI S, RUSSO L, et al. Renal struc-ture in type 2 diabetes: Facts and misconceptions[J]. Journal of Nephrology, 2020, 33(5): 901-907. DOI:10.1007/s40620-020-00797-y |
| [3] |
ROTBAIN CUROVIC V, HANSEN T W, EICKHOFF M K, et al. Urinary tubular biomarkers as predictors of kidney function decline, cardiovascular events and mortality in mi-croalbuminuric type 2 diabetic patients[J]. Acta Diabetolog-ica, 2018, 55(11): 1143-1150. DOI:10.1007/s00592-018-1205-0 |
| [4] |
涂元宝, 李传平, 高磊. 益肾化湿颗粒辅助治疗早期糖尿病肾病的疗效及安全性分析[J]. 世界中医药, 2020, 15(7): 1042-1046. TU Y B, LI C P, GAO L. Efficacy and safety analysis of yishen Huashi Granule in the adjuvant treatment of early diabetic nephropathy[J]. World Chinese Medicine, 2020, 15(7): 1042-1046. DOI:10.3969/j.issn.1673-7202.2020.07.016 |
| [5] |
赵毓芳, 董科, 徐湜潺, 等. 糖尿病肾病治疗中益肾化湿颗粒与贝那普利联合应用的价值分析[J]. 辽宁中医杂志, 2016, 43(1): 103-105. ZHAO Y F, DONG K, XU S C, et al. Analysis on application value of benazepril hydrochloridec combined with Yishen Huashi Particles in diabetic nephropathy[J]. Liaoning Journal of Traditional Chinese Medicine, 2016, 43(1): 103-105. |
| [6] |
张正菊, 孟凤仙, 白华, 等. 虎杖苷对糖尿病肾病小鼠AMPKα1/TLR4信号通路的影响[J]. 中国中西医结合杂志, 2019, 39(11): 1378-1384. ZHANG Z J, MENG F X, BAI H, et al. Effects of polydatin on AMPKalpha1/TLR4 signaling pathway in diabetic neph-ropathy mice[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2019, 39(11): 1378-1384. DOI:10.7661/j.cjim.20190928.321 |
| [7] |
TAKIYAMA Y, SERA T, NAKAMURA M, et al. Impacts of diabetes and an SGLT2 inhibitor on the glomerular number and volume in db/db mice, as estimated by synchrotron radiation micro-CT at SPring-8[J]. EBioMedicine, 2018, 36(7): 329-346. |
| [8] |
柒春芳, 陈祖姣, 王文健. 糖尿病肾小管病[J]. 中华肾脏病杂志, 2020, 36(4): 321-326. QI C F, CHEN Z J, WANG W J. Diabetic tubulopathy[J]. Chinese Journal of Nephrology, 2020, 36(4): 321-326. DOI:10.3760/cma.j.cn441217-20190924-00063 |
| [9] |
牛苗苗, 陈华. 糖尿病肾病动物模型研究进展[J]. 实验动物科学, 2018, 35(3): 86-92. NIU M M, CHEN H. Research progress of laboratory animal models of diabetic neuropathy[J]. Laboratory Animal Science, 2018, 35(3): 86-92. DOI:10.3969/j.issn.1006-6179.2018.03.017 |
| [10] |
ABBASI F, MOOSAIE F, KHALOO P, et al. Neutrophil gelatinase-associated lipocalin and retinol-binding protein-4 as biomarkers for diabetic kidney disease[J]. Kidney & Blood Pressure Research, 2020, 45(2): 222-232. |
| [11] |
BUONAFINE M, MARTINEZ -MARTINEZ E, JAISSER F. More than a simple biomarker: The role of NGAL in cardio-vascular and renal diseases[J]. Clinical Science (London, England: 1979), 2018, 132(9): 909-923. DOI:10.1042/CS20171592 |
| [12] |
QUANG T H, NGUYET M P, THAO D P, et al. Evaluation of urinary neutrophil gelatinase associated lipocalin and kidney injury molecule-1 as diagnostic markers for early nephropathy in patients with type 2 diabetes mellitus[J]. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy, 2020, 13(3): 2199-2207. |
| [13] |
DVANAJSCAK Z, MURPHY J D, LARSEN C P, et al. Anti-brush border antibody disease (anti-LRP2 nephropathy)associated with lupus nephritis[J]. Kidney International Reports, 2020, 5(9): 1590-1594. DOI:10.1016/j.ekir.2020.06.025 |
| [14] |
DE BARROS PERUCHETTI D, SILVA-AGUIAR R P, SIQUEIRA G M, et al. High glucose reduces megalin-mediated albumin endocytosis in renal proximal tubule cells through protein kinase B O-GlcNAcylation[J]. Journal of Biological Chemistry, 2018, 293(29): 11388-11400. DOI:10.1074/jbc.RA117.001337 |
| [15] |
GIRAUD BILLOUD M, FADER C, AGÜERO ZIZZI R M, et al. Diabetic nephropathy, autophagy and proximal tubule protein endocytic transport: a potentially harmful relation-ship[J]. BIOCELL, 2018, 42(2): 35. DOI:10.32604/biocell.2018.07010 |
| [16] |
COFFEY S, COSTACOU T, ORCHARD T, et al. Akt links insulin signaling to albumin endocytosis in proximal tubule epithelial cells[J]. PLoS One, 2015, 10(10): e0140417. DOI:10.1371/journal.pone.0140417 |
| [17] |
FIGUEIRA M F, CASTIGLIONE R C, DE LEMOS BAR-BOSA C M, et al. Diabetic rats present higher urinary loss of proteins and lower renal expression of megalin, cubilin, ClC-5, and CFTR[J]. Physiological Reports, 2017, 5(13): e13335. DOI:10.14814/phy2.13335 |
 2022, Vol. 41
2022, Vol. 41