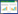文章信息
- 贾贝田, 王丽, 崔换天, 金昱彤, 曹敏, 刘海朝, 边育红
- JIA Beitian, WANG Li, CUI Huantian, JIN Yutong, CAO Min, LIU Haizhao, BIAN Yuhong
- 基于TLR4信号通路黄芪多糖促树突状细胞抗肿瘤作用的研究
- Anti-tumor effect study of Astragalus polysaccharide promotes dendritic cell through TLR4 signal pathway
- 天津中医药大学学报, 2022, 41(2): 218-224
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(2): 218-224
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.02.20
-
文章历史
收稿日期: 2021-12-20
2. 天津市第二人民医院, 天津 300192;
3. 山东大学, 青岛 266237
2. Tianjin Second People' s Hospital, Tianjin 300192, China;
3. Shandong University, Qingdao 266237, China
细胞免疫应答是抗肿瘤免疫的主要方式[1]。有效的抗原递呈是激活CD8+ T细胞并触发细胞毒性T淋巴细胞(CTL)反应的关键。树突状细胞(DCs)作为最强大的抗原呈递细胞(APC), 可以通过识别肿瘤相关抗原, 激活CTL特异性杀灭肿瘤细胞, 在抗肿瘤过程中发挥着重要的作用[2]。临床研究发现, 肿瘤患者的DCs功能缺陷与肿瘤的发生、发展密切相关[3]。患者的肿瘤组织、淋巴结和外周血中成熟DCs的数量显著减少, 抗原呈递和CTL激活的能力低下[4]。因此, 促进DCs成熟, 进而激活CTL已成为国内外研究热点[5]。
黄芪多糖(APS)是扶正中药黄芪的主要活性成分, 已被公认为是一种抗肿瘤免疫调节剂, 并在临床上得到广泛应用[6-7]。研究发现: APS抗肿瘤作用与DCs密切相关[8]。APS可促进DCs表面分子CD80、CD86的表达, 促进DCs成熟, 并激活CTL发挥抗肿瘤作用[9-11]。
Toll样受体4(TLR4)是DCs的核心模式识别受体, 通过TLR4介导的DCs活化是启动CD8+ T细胞反应的重要步骤。研究发现DCs可通过TLR4介导的髓样分化因子(MyD88)依赖的信号转导通路被LPS/中药多糖活化, 分泌肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-12等多种细胞因子[12-13]。TLR4被配体激活后, MyD88蛋白的TIR域与TLR的TIR域结合, 而后通过其死亡区域与IL-1受体相关激酶(IRAKs)的N-末端死亡区域相互作用, 其中IRAK1被IRAK4磷酸化而活化, 超磷酸化的IRAK1与TRAF6结合并使其活化, 激活下游通路进而导致细胞质内核转录因子(NF-κB)活化, 促使NF-κB进入细胞核, 激活相关基因发生转录, 诱导DC成熟, 分泌共刺激分子及相关细胞因子。通过TLR4中和抗体抑制TLR4信号传导或干扰TLR4可以导致细胞炎性因子产生的减少[14]。Priyank等[15]发现TLR4可以通过My D88依赖性途径促进DCs诱导的CTL活化。但是, 尚不清楚TLR4信号通路是否介导APS诱导的DCs活化并发挥抗肿瘤作用。因此, 本实验将以小鼠树突状细胞DC2.4为受试细胞, 研究基于TLR4通路APS对DCs活化及发挥抗肿瘤作用影响。
1 材料与方法 1.1 材料小鼠树突状细胞DCs 2.4购于赛百慷(上海)生物技术股份有限公司; 小鼠结肠癌细胞CT26购于上海北纳创联生物技术有限公司; 雄性BALB/c小鼠购于北京华阜康生物科技股份有限公司; APS粉末购于天津赛诺制药有限公司; 青霉素链霉素混合液、RPMI-1640培养基、FITC标记的CD80抗体、PE标记的CD86抗体、肿瘤坏死因子(TNF)-α、0.25% 胰蛋白酶、细胞总RNA提取试剂盒、cDNA反转试剂盒、Q-PCR扩增试剂盒(SYBR Green)以及ELISA相关试剂盒购于天津贝尔格莱科技有限公司; TLR4通路抑制剂ST2825、TAK-242购于MedChem Express; 胎牛血清购于天津华立科技有限公司。
1.2 方法 1.2.1 细胞培养及分组小鼠树突状细胞DC2.4用DMEM高糖培养基(含10%胎牛血清、100 U/m L青霉素、100 μg/mL链霉素)进行培养; 小鼠结肠癌CT26细胞用RPMI1640培养基(含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素)进行培养。细胞培养箱设置条件: 5% CO2、恒温37℃、饱和湿度, 每2日更换培养液, 观察并记录细胞的生长状态。
取对数生长期的DC2.4细胞, 调整密度为4×105个细胞/mL, 接种于6孔板, 每孔2 mL, 于37℃、5% CO2培养箱中培养, 具体分组如下: 控制(Control)组、APS组、TNF-α组、APS+TNF-α组、TAK-242+TNF-α组、TAK-242+APS+TNF-α组、ST2825+TNF-α组及ST2825+APS+TNF-α组。
1.2.2 APS对DC2.4细胞成熟及活化的影响各分组细胞培养72 h后, 分别收集细胞及上清, 细胞流式技术检测DC2.4细胞表面标记CD80、CD86的表达水平, ELISA试剂盒检测上清中细胞因子IL-12p-70的分泌情况。
1.2.3 APS干预的DC2.4对T细胞活化及杀伤肿瘤的影响1) 小鼠脾脏淋巴细胞分离及染色: 颈椎脱臼处死健康的BALB/c小鼠, 75%的乙醇浸泡消毒, 无菌取小鼠脾脏, 研磨脾脏, 用200目细胞筛过滤除去组织块, 收集脾脏细胞, 用D-Hanks平衡盐溶液清洗2次, 加入红细胞裂解液处理5 min, 2 000 r/min离心20 min(离心半径为17.3 cm, 下同), 用1 mL完全培养基重悬, 接种于T25培养瓶中。12 h后, 收集非贴壁细胞即为脾脏淋巴细胞, 1 500 rmp离心5 min, 弃上清, 用PBS溶液洗两次, 每次1 500 rmp离心5 min, 弃上清, 加入已配好的CTG染液, 37℃避光孵育30 min。1 500 rmp离心5 min, 弃上清, 用PBS溶液清洗一次, 1 500 rmp离心5 min, 弃上清, 用1 mL完全培养液重悬沉淀细胞, 细胞计数板进行计数, 调细胞浓度为5×105个/mL。
2) 肿瘤抗原致敏DCs: 将小鼠结肠癌细胞CT26反复冻融, 制备成肿瘤抗原。加入到已加药培养72 h的各分组的DCs中(上清液已取出), 使DCs和肿瘤抗原的比例为1:10。
3) ELISA法检测APS干预的DCs对T细胞分泌细胞因子的影响: 加抗原致敏的DCs于5% CO2, 37℃培养24 h后, 每孔加入5×105个/mL T细胞100 μL, 使DCs和脾脏淋巴细胞的比为1:10。培养24 h后, 收集各组上清液, 按试剂盒操作说明操作检测IL-2的含量。
4) 脾脏淋巴细胞增殖检测: 小鼠DC与脾脏淋巴细胞共培养24 h后用全视野细胞成像分析仪检测脾脏淋巴细胞增殖情况。
5) APS促DCs活化CTL发挥抗肿瘤作用的研究: 将各组致敏DCs与T细胞按1:10比例共同培养, 2 d后收集悬浮细胞, 进行细胞计数, 调整T细胞浓度为1×106个/mL, 制成CTL细胞悬液。取对数生长期肿瘤细胞, 调整细胞浓度分别为1×105。取96孔板, 加入CTL细胞和肿瘤细胞各100 μL, 使其效靶比分别为10:1。96孔板置于5%CO2、37℃培养箱培养24 h后, 吸出培养基, 吖啶橙(AO)和碘化丙啶(PI)双荧光染色, 通过全视野细胞成像分析, 观察死亡率。
2 统计分析采用SPSS 22对实验数据进行统计分析, 首先进行正态性检验和方差齐性检验, 若总体均满足正态性和方差齐性, 计量资料用均数±标准差(x±s)表示, 两组数据比较采用独立样本t检验, P < 0.05表示差异具有统计学意义。
3 结果 3.1 APS对DC2.4细胞成熟及活化的影响为了研究APS对DC2.4成熟的影响, 课题组检测了APS对DC2.4表面标记物CD80和CD86表达的影响。由图 1A-B所示, 与Control组比较, APS组和TNF-α组均可上调DCs表面标记分子CD80和CD86的表达, 且两者合用时效果最优, 差异有统计学意义(P < 0.01)。该实验说明了APS和TNF-α合用可显著促进DCs的成熟。
|
| 注: 与Control组比较, * P<0.05, ** P<0.01。 图 1 APS对DC2.4细胞成熟及活化的影响 |
DC成熟后分泌的细胞因子IL-12p-70是诱导T细胞应答的必要条件, 故本实验检测了APS对DC分泌细胞因IL-12p-70的影响。由图 1C所示, 与Control组比较, APS和TNF-α均可促进DC分泌细胞因子IL-12p-70, 且两者合用时效果最优, 差异有统计学意义(P < 0.01)。该实验进一步说明了APS和TNF-α合用可显著促进DCs的成熟和活化。
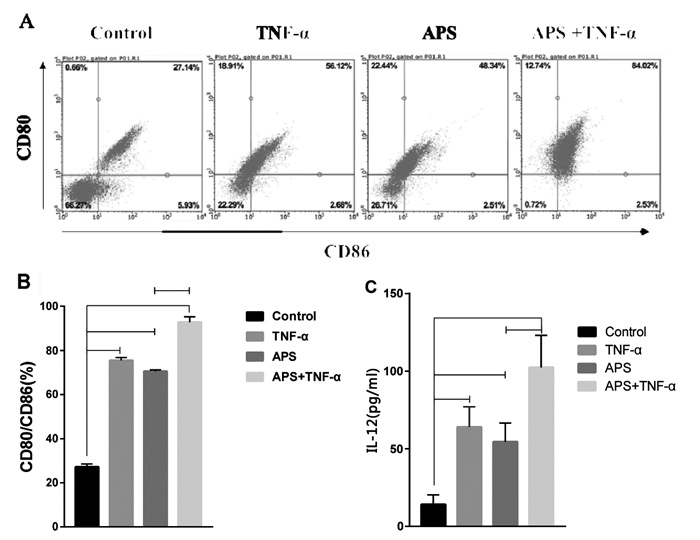
3.2 APS干预的DC2.4细胞对T细胞活化及杀伤肿瘤的影响T细胞介导的免疫杀伤是机体对肿瘤的重要免疫应答, 因此该实验首先检测了APS干预后的DC对T细胞活化的影响。如图 2A-B所示, 与Control组相比, 各加药组对T细胞增殖及分泌IL-2的水平均显著提高, 差异有统计学意义(P < 0.05), 且与APS组相比, APS+TNF-α组DCs对T细胞增殖及分泌IL-2水平的促进作用最强(P < 0.05)。该实验说明APS干预后的DC2.4细胞促进了T细胞的活化, 且与TNF-α合用时效果最优。
|
| 注: A: Control组; B: APS组; C: TNF-α组; D: APS+TNF-α组(×200);与Control组比较, * P<0.05, ** P<0.01。 图 2 APS干预的DC2.4对T细胞活化及杀伤肿瘤的影响 |
本实验将APS干预的DC刺激后的T细胞与CT26细胞共培养, 检测APS干预的DC对T细胞杀伤肿瘤的影响。如图 2C-D所示, 与Control组相比, TNF-α组、APS组以及APS+TNF-α组肿瘤细胞的杀伤率均显著增高, 分别为56.79、57.92和69.56%, 差异均有统计学意义(P < 0.01), 其中APS+TNF-α组肿瘤细胞死亡率最高。该实验表明APS干预后的DC2.4细胞增强了T细胞对肿瘤的杀伤。
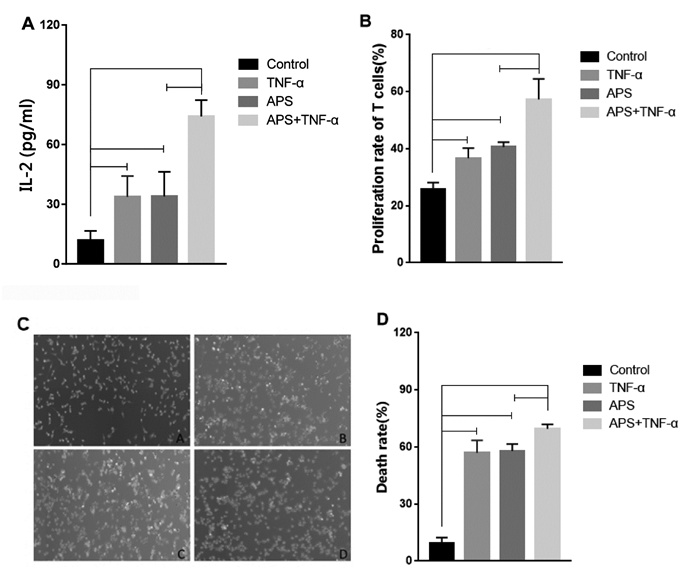
3.3 基于TLR4通路APS对DC2.4细胞成熟及活化的影响为了进一步明确APS促DC2.4细胞成熟及活化的机制, 本实验使用TAK-242(TLR4抑制剂)和ST2825(MyD88抑制剂)阻断TLR4介导的MyD88通路, 观察APS对DC2.4成熟及活化的影响。
如图 3所示, 与TNF-α组相比, 加入TLR4通路阻断剂TAK-242或ST2825后, TNF-α组CD80/CD86的表达以及IL-12p-70的分泌均无显著差异, 说明阻断剂TAK-242和ST2825对TNF-α作用效果无影响, 差异无统计学意义(P > 0.05);与TNF-α组相比, 加入TLR4通路阻断剂TAK-242或ST2825后, APS+TNF-α组DC2.4细胞表面分子CD80/CD86的表达以及IL-12p-70的分泌水平也均无显著差异(P > 0.05)。本实验说明加入TLR4通路阻断剂TAK-242或ST2825后, APS不能诱导DC2.4的成熟及活化, 初步证明APS可能是通过TLR4介导的MyD88通路促DC2.4成熟及活化的。
|
| 注: 与Control组比较, ** P<0.01。 图 3 基于TLR4通路APS对DC2.4成熟及活化的影响 |
阻断TLR4介导的MyD88通路后, 本实验检测了APS干预的DC2.4是否对T细胞的活化及杀伤肿瘤产生影响。如图 4所示, 与TNF-α组相比, 加入TLR4通路阻断剂TAK-242和ST2825抑制剂后, 各组T细胞增殖及分泌的IL-2水平差异均无统计学意义(P > 0.05), 对肿瘤细胞CT26的杀伤水平也均无明显差异(P > 0.05)。说明阻断TLR4介导的MyD88通路后, APS干预的DC2.4细胞无法诱导T细胞产生应答并发挥杀伤肿瘤的作用。
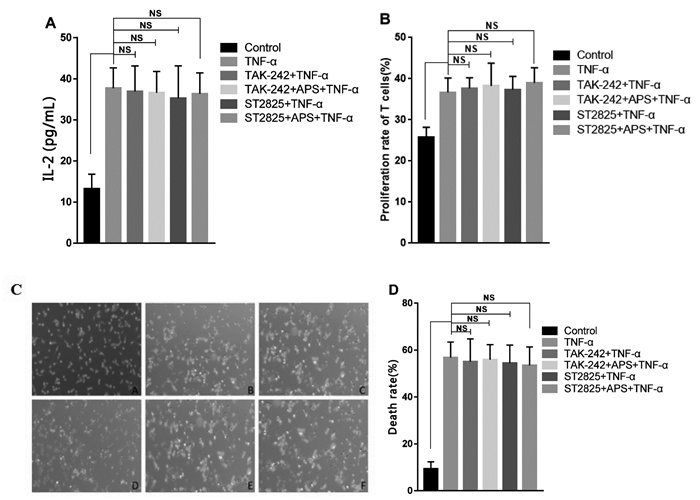
|
| 注: A: Control组; B: TNF-α组; C: TAK-242+TNF-α; D: TAK-242+TNF-α+APS; E: ST2825+TNF-α; F: ST2825+APS+TNF-α(×200);与Control组比较, * P<0.05, ** P<0.01。 图 4 基于TLR4通路APS干预的DC2.4细胞对T细胞活化及杀伤肿瘤的影响 |
正常情况下, DCs在维持机体免疫平衡中起着重大的调节作用。但是在肿瘤微环境中存在着大量细胞因子抑制DCs功能, 如PGE-2、IL-10和TGF-β等, 从而导致肿瘤逃逸[16-17]。研究表明APS能增强人体免疫功能, 提高免疫细胞的免疫活性, 是理想的机体免疫增强剂[18]。如APS可增强巨噬细胞的吞噬作用[19]。CD80和CD86属于免疫球蛋白超家族, 其配体均是CD28和CD152, 主要表达于活化的DCs表面, 是DCs成熟的主要标志, 也是DCs活化T细胞启动机体免疫应答的重要信号[20-22]。TNF-α可促进DCs成熟, 增强DCs对初始T细胞的刺激。因此本课题加入了TNF-α刺激DC, 并考察APS与TNF-α合用对DC功能的影响。本研究发现DCs经APS刺激后, CD80、CD86的表达均增高, 提示APS诱导DCs的成熟, 且与细胞因子TNF-α协同使用时效果最好。IL-12p-70是IL-12的活化状态, 具有促进Th0细胞向Th1细胞的分化, 诱导T细胞活化, 并增强IL-2、TNF-α的分泌等功能。本研究发现APS可促进DCs分泌IL-12p-70, 说明APS可提高DCs的免疫活性, 且与细胞因子TNF-α协同使用时效果最优。
T细胞介导的免疫杀伤是机体抗肿瘤的重要免疫应答, IL-2是T细胞活化的标志。本实验将APS活化的DCs与T细胞共培养, 发现细胞上清中IL-2分泌水平增高, 且活化的CTL细胞对肿瘤细胞的杀伤作用增强, 说明APS可促进DCs活化T细胞, 从而发挥抗肿瘤的作用。尽管这些研究结果揭示了APS具有提高DCs免疫功能, 促进T细胞对肿瘤的杀伤, 但其分子生物学机制有待阐明。
研究发现TLR4一旦识别了病原体中特定的分子结构, 就会激活细胞内TLR下游一系列的信号通路, 活化免疫细胞产生细胞因子。TLR4可通过MYD88通路, 活化IKK2-TRAF6复合物, 激活NF-κB, 促进促炎因子的转录。为验证APS是否通过TLR4信号通路影响DCs, 本实验加入TLR4关键节点抑制剂TAK-242和ST2825抑制剂, 结果显示经TAK-242和ST2825阻断通路后, 与TNF-α组比较, 抑制剂组对DCs表面分子CD80、CD86的表达、细胞因子IL-12 p-70的分泌以及对T细胞活化杀伤肿瘤作用均无显著差异。本研究通过体外实验初步阐明了APS通过TLR4信号通路促进DCs发挥抗肿瘤作用的机制。
综上所述, 本课题说明了基于TLR4通路, APS可促进DCs表面分子CD80、CD86的表达及细胞因子IL-12 p-70的分泌, 进而活化T细胞, 分泌IL-2, 发挥抗肿瘤的作用, 且与细胞因子TNF-α协同使用时效果最优, 为APS在临床的应用提供理论基础, 为新药的研制和开发提供新的视角。
| [1] |
WANG F, ZHANG X, WANG H H, et al. Effects of dezocine and sufentanyl for postoperative analgesia on activity of NK, CD4+ and CD8+ cells in patients with breast cancer[J]. Oncology Letters, 2019, 17(3): 3392-3398. |
| [2] |
MARTÍN-VILCHEZ S, MOLINA-JIMÉNEZ F, ALONSO-LEBRERO J L, et al. AM3, a natural glycoconjugate, in-duces the functional maturation of human dendritic cells[J]. British Journal of Pharmacology, 2008, 154(3): 698-708. DOI:10.1038/bjp.2008.87 |
| [3] |
ROLINSKI J, HUS I. Dendritic-cell tumor vaccines[J]. Transplantation Proceedings, 2010, 42(8): 3306-3308. DOI:10.1016/j.transproceed.2010.07.033 |
| [4] |
LEGITIMO A, CONSOLINI R, FAILLI A, et al. Dendritic cell defects in the colorectal cancer[J]. Human Vaccines & Immunotherapeutics, 2014, 10(11): 3224-3235. |
| [5] |
SONG Y C, HUANG H C, CHANG C Y Y, et al. A potential herbal adjuvant combined with a peptide-based vaccine acts against HPV-related tumors through enhancing effector and memory T-cell immune responses[J]. Frontiers in Immunol-ogy, 2020, 11(2): 62. |
| [6] |
GUO L, BAI S P, ZHAO L, et al. Astragalus polysaccharide injection integrated with vinorelbine and cisplatin for pa-tients with advanced non-small cell lung cancer: Effects on quality of life and survival[J]. Medical Oncology (Northwood, London, England), 2012, 29(3): 1656-1662. DOI:10.1007/s12032-011-0068-9 |
| [7] |
LI K, CUI L J, CAO Y X, et al. UHPLC Q-exactive MS-based serum metabolomics to explore the effect mechanisms of immunological activity of Astragalus polysaccharides with different molecular weights[J]. Frontiers in Pharmacology, 2020, 11(2): 595692. |
| [8] |
高林林, 吴晓英. 中药多糖抗肿瘤作用与树突状细胞关系研究进展[J]. 云南中医中药杂志, 2009, 30(5): 69-70. GAO L L, WU X Y. Research progress on the relationship between Dendritic cells and anti-tumor effect of Polysaccha-rides from traditional Chinese medicines[J]. Yunnan Journal of Traditional Chinese Medicine and Materia Medica, 2009, 30(5): 69-70. DOI:10.3969/j.issn.1007-2349.2009.05.054 |
| [9] |
邓旻, 窦晓兵, 史亦谦, 等. 黄芪多糖定向诱生脐血来源树突状细胞及其对T细胞增殖作用的研究[J]. 中国免疫学杂志, 2007, 23(6): 539-544, 550. DENG M, DOU X B, SHI Y Q, et al. Astragalus polysaccha-rides(APS) induces the cord blood monocytes into mature dendritic cells(DCs) directly and its impact on T cells prolif-eration[J]. Chinese Journal of Immunology, 2007, 23(6): 539-544, 550. DOI:10.3321/j.issn:1000-484X.2007.06.015 |
| [10] |
邵鹏, 赵鲁杭. 黄芪多糖对树突状细胞表型及功能成熟的影响[J]. 中华微生物学和免疫学杂志, 2006, 26(7): 637-640. SHAO P, ZHAO L H. Regulation on phenotypic and func-tional maturation of dendritic cells by Astragalus mongholi-cus polysaccharides[J]. Chinese Journal of Microbiology and Immunology, 2006, 26(7): 637-640. DOI:10.3760/j:issn:0254-5101.2006.07.016 |
| [11] |
荆雪宁, 邱波, 王金凤, 等. 黄芪多糖诱导成熟的树突状细胞肿瘤疫苗体外抗肿瘤作用的实验研究[J]. 中国中西医结合杂志, 2014, 34(9): 1103-1107. JING X N, QIU B, WANG J F, et al. In vitro anti-tumor ef-fect of human dendritic cells vaccine induced by astragalus polysacharin: an experimental study[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2014, 34(9): 1103-1107. DOI:10.7661/CJIM.2014.09.1103 |
| [12] |
HITTLE L E, JONES J W, HAJJAR A M, et al. Bordetella parapertussis PagP mediates the addition of two palmitates to the lipopolysaccharide lipid A[J]. Journal of Bacteriology, 2015, 197(3): 572-580. DOI:10.1128/JB.02236-14 |
| [13] |
HU L L, YANG H X, AI M, et al. Inhibition of TLR4 alleviates the inflammation and apoptosis of retinal ganglion cells in high glucose[J]. Graefe' s Archive for Clinical and Experimental Ophthalmology, 2017, 255(11): 2199-2210. DOI:10.1007/s00417-017-3772-0 |
| [14] |
GARIBOTTO G, CARTA A, PICCIOTTO D, et al. Toll-like receptor-4 signaling mediates inflammation and tissue injury in diabetic nephropathy[J]. Journal of Nephrology, 2017, 30(6): 719-727. DOI:10.1007/s40620-017-0432-8 |
| [15] |
NAIR-GUPTA P, BACCARINI A, TUNG N, et al. TLR sig-nals induce phagosomal MHC-I delivery from the endosomal recycling compartment to allow cross-presentation[J]. Cell, 2014, 158(3): 506-521. DOI:10.1016/j.cell.2014.04.054 |
| [16] |
李娟, 金风. 树突状细胞肿瘤免疫基础及临床研究进展[J]. 现代肿瘤医学, 2018, 26(7): 1112-1117. LI J, JIN F. The immune foundation of dendritic cell and the research prograss[J]. Journal of Modern Oncology, 2018, 26(7): 1112-1117. DOI:10.3969/j.issn.1672-4992.2018.07.033 |
| [17] |
HU Z Q, XUE H, LONG J H, et al. Biophysical properties and motility of human mature dendritic cells deteriorated by vascular endothelial growth factor through cytoskeleton remodeling[J]. International Journal of Molecular Sciences, 2016, 17(11): 1756. DOI:10.3390/ijms17111756 |
| [18] |
CHANG F L, TSAI K C, LIN T Y, et al. Astragalus mem-branaceus-derived anti-programmed death-1 monoclonal antibodies with immunomodulatory therapeutic effects against tumors[J]. BioMed Research International, 2020, 2020: 3415471. |
| [19] |
XU H D, YOU C G, ZHANG R L, et al. Effects of Astragalus polysaccharides and astragalosides on the phagocytosis of Mycobacterium tuberculosis by macrophages[J]. The Journal of International Medical Research, 2007, 35(1): 84-90. DOI:10.1177/147323000703500108 |
| [20] |
王丽祥, 方琦. 共刺激分子CD80、CD86及抗原递呈细胞DC在鼻咽疾病的应用研究[J]. 微创医学, 2017, 12(2): 230-232. WANG L X, FANG Q. Study on the application of costimu-latory molecules CD80 and CD86 and antigen presenting cell-DC in nasopharyngeal diseases[J]. Journal of Minimally Invasive Medicine, 2017, 12(2): 230-232. |
| [21] |
RADFORD K J, TULLETT K M, LAHOUD M H. Dendritic cells and cancer immunotherapy[J]. Current Opinion in Im-munology, 2014, 27: 26-32. DOI:10.1016/j.coi.2014.01.005 |
| [22] |
杨勇, 杨宏新. 共同培养的树突状细胞与CIK细胞对乳腺癌细胞杀伤活性的研究[J]. 内蒙古医学杂志, 2012, 44(3): 257-259. YANG Y, YANG H X. Antitumor effects of cocultured dendritic cells and cytokine-induced killer cells on breast cancer[J]. Inner Mongolia Medical Journal, 2012, 44(3): 257-259. DOI:10.3969/j.issn.1004-0951.2012.03.001 |
 2022, Vol. 41
2022, Vol. 41