文章信息
- 成丽媛, 霍香香, 杨莉, 张玥, 周昆
- CHENG Liyuan, HUO Xiangxiang, YANG Li, ZHANG Yue, ZHOU Kun
- UPLC法测定不同基源淫羊藿中11种有效成分的含量
- Determination of 11 effective components in Epimedium from different primordium by UPLC
- 天津中医药大学学报, 2022, 41(2): 237-242
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(2): 237-242
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.02.23
-
文章历史
收稿日期: 2021-12-20
2. 天津市中药药理学重点实验室, 天津 301617
2. State Key Laboratory of Component-based Chinese Medicine, Tianjin 301617, China
淫羊藿为小檗科植物淫羊藿Epimedium brevicomu Maxim.、箭叶淫羊藿Epimedium sagittatum(Sieb.etZucc.)Maxim.、柔毛淫羊藿Epimedium pubescens Maxim.或朝鲜淫羊藿Epimedium koreanum Nakai的干燥叶,巫山淫羊藿为《中国药典》单列出的源自淫羊藿属的中药,为小檗科植物巫山淫羊藿Epimedium wushanense T.S. Ying的干燥叶,两者均具有补肾阳、强筋骨、祛风湿的功效,可用于治疗肾阳虚衰、筋骨痿软、风湿痹痛等症。其化学成分主要包括淫羊藿总黄酮类、木质素、多糖类成分及生物碱类成分等[1-2]。现代临床可用于治疗骨质疏松、更年期综合征、乳房肿块、高血压、早产儿卵巢功能不全等疾病[3-5]。中药淫羊藿在全国各地用药差异大,且存在伪品、混淆品问题[6]。
本研究用超高效液相色谱(UPLC)法对不同基源、共计23批次的淫羊藿和巫山淫羊藿中所含11种主要成分(包括新绿原酸、绿原酸、隐绿原酸、木兰花碱、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、箭藿苷A、箭藿苷B、宝藿苷I)进行含量测定,并使用主成分分析(PCA)对3种基源的淫羊藿和巫山淫羊藿进行成分含量的对比分析,为区分和鉴别药典收载的不同品种淫羊藿与巫山淫羊藿药材提供参考和依据。
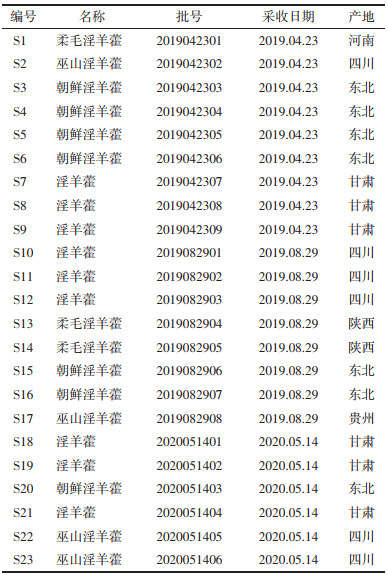
1 仪器与材料 1.1 受试药23批次药材,来自东北、甘肃、四川等地,其中包括柔毛淫羊藿、朝鲜淫羊藿、淫羊藿共19批,以及巫山淫羊藿4批。经天津中医药大学李天祥教授鉴定为小檗科淫羊藿属植物淫羊藿Epimedium brevicomu Maxim.、柔毛淫羊藿Epimedium pubescens Maxim.、朝鲜淫羊藿Epimedium koreanum Nakai和巫山淫羊藿Epimedium wushanense T.S. Ying的干燥叶。采收原药材经自然干燥、粉碎、过筛后,置自封袋中,室温密封保存备用。药材详细信息见表 1。
LC30超高效液相仪(日本岛津公司);Micro 17离心机(赛默飞世尔科技公司);VORTEX-GENIE 2涡旋混合器(美国Scientific Industries公司);Concentrator plus离心浓缩仪(德国Eppendorf公司);Milli-Q型纯水机(美国Millipore公司)。
1.3 试剂甲醇、乙腈(色谱纯,Fisher公司),甲酸(天津市北方天医化学试剂厂)。
箭藿苷A,批号:18011905;箭藿苷B,批号:18011907;淫羊藿苷,批号:18012906;绿原酸,批号:18071907;新绿原酸,批号:19042305;隐绿原酸,批号:19042402;木兰花碱,批号:18111302;宝藿苷Ⅰ,批号:18111903;朝藿定A,批号:17022003,以上标准品均购自成都普菲德生物技术有限公司。
朝藿定B,批号:MUST-16071403;朝藿定C,批号:MUST-16070705,以上标准品购自成都曼思特生物科技有限公司。
2 方法与结果 2.1 色谱条件LC30超高效液相仪(日本岛津公司),色谱柱:Shim-pack GISS C18色谱柱(100 mm×2.1 mm,1.9 μm),流动相:0.1%甲酸(A)-乙腈(B),流速:0.3 mL/min,柱温:40 ℃,进样体积5 μL,检测波长270 nm。洗脱梯度:0~4 min,2%~5% B;4~12 min,5% B;12~15 min,5%~25.2% B;15~23 min,25.2% B;23~25 min,25.2%~30% B;25~28 min,30%~40% B。28~32 min,40%~60% B;32~33 min,60%~2% B,33~45 min,2% B。
2.2 溶液的制备 2.2.1 对照品溶液的制备分别精密称取朝藿定A、朝藿定B、朝藿定C、宝藿苷I、箭藿苷A、箭藿苷B、绿原酸、新绿原酸、隐绿原酸、淫羊藿苷、木兰花碱约1 mg,加甲醇,涡旋振荡,配制成浓度为1 mg/mL的对照品母液。精确吸取各对照品母液适量,加甲醇配置成含绿原酸、新绿原酸、隐绿原酸、木兰花碱、朝藿定A 10 μg/mL,含朝藿定B、箭藿苷A、箭藿苷B、宝藿苷I 20 μg/mL,含朝藿定C、淫羊藿苷50 μg/mL的混合对照品溶液,4 ℃冰箱存储备用。
2.2.2 供试品溶液的制备精密称取淫羊藿粗粉0.2 g于锥形瓶中,加70%乙醇20 mL,称质量,超声提取30 min,放至室温,补足失重,摇匀,取上清液经0.45 μm微孔滤膜过滤,稀释5倍,4 ℃冰箱存储备用。
2.3 多指标成分含量测定的方法学考察 2.3.1 特异性考察11种对照品溶液和淫羊藿样品UPLC色谱图见图 1。通过与对照品保留时间对比,确定淫羊藿样品色谱图中1~11号色谱峰分别为:新绿原酸、绿原酸、隐绿原酸、木兰花碱、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、箭藿苷A、箭藿苷B、宝藿苷I。
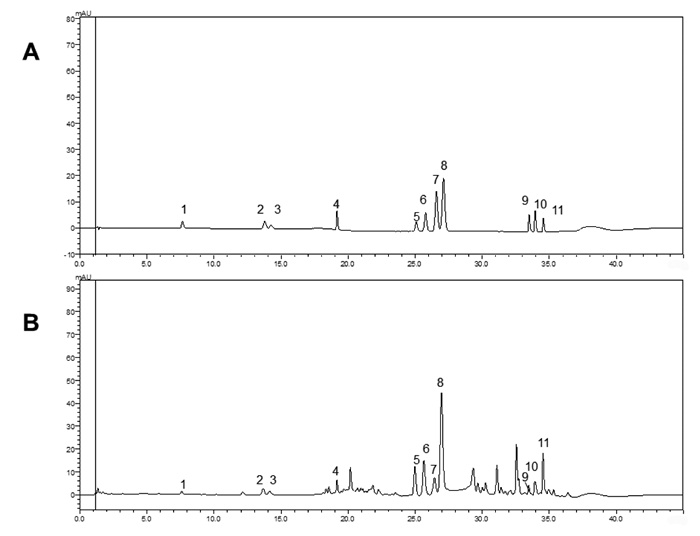
|
| 注: A.11种对照品; B.淫羊藿样品; 1.新绿原酸; 2.绿原酸; 3.隐绿原酸; 4.木兰花碱; 5.朝藿定A; 6.朝藿定B; 7.朝藿定C; 8.淫羊藿苷; 9.箭藿苷A; 10.箭藿苷B; 11.宝藿苷I。 图 1 对照品和淫羊藿样品色谱图 |
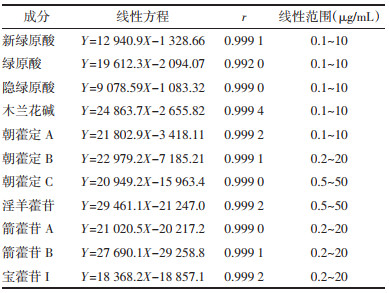
精密吸取“2.2.1”项下配制的混合对照品溶液,加甲醇稀释2、5、10、25、50、100倍得7个不同浓度的混合对照品溶液,按照“2.1”色谱条件分析,以峰面积为纵坐标(Y),对照品浓度为横坐标(X),计算各成分标准曲线方程。11种化合物线性方程见表 2,11种成分的相关系数r均大于0.999,此结果表明11种成分在相应的范围内线性关系良好。
精密吸取混合对照品溶液,在“2.1”色谱条件下连续进样6次,计算各成分峰面积的RSD值。结果显示,新绿原酸、绿原酸、隐绿原酸、木兰花碱、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、箭藿苷A、箭藿苷B、宝藿苷I的RSD值分别为2.54%,1.44%,4.01%,0.25%,0.25%,0.13%,0.19%,0.18%,1.91%,0.60%,0.93%,表明该方法精密度良好。
2.3.4 稳定性实验取同一供试品溶液,在“2.1”项的色谱条件下,分别在0、3、6、9、12、24、48 h进样,计算各成分峰面积的RSD值。新绿原酸、绿原酸、隐绿原酸、木兰花碱、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、箭藿苷A、箭藿苷B、宝藿苷I的RSD值分别为0.47%,0.51%,1.36%,4.52%,0.48%,0.09%,0.69%,0.18%,1.55%,3.22%,1.65%,表明供试品溶液在48 h稳定性良好。
2.3.5 重复性实验取同一供试品溶液6份,在“2.1”项的色谱条件下进行测定,计算各成分峰面积的RSD值。实验结果为溶液中新绿原酸、绿原酸、隐绿原酸、木兰花碱、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、箭藿苷A、箭藿苷B、宝藿苷I的RSD值分别为2.88%,2.79%,3.44%,2.93%,3.13%,3.14%,3.04%,3.28%,4.85%,1.86%,3.64%,表明该方法重复性良好。
2.3.6 回收率实验精密吸取已知各成分含量的同一供试品溶液1 mL,加入等量各成分与样品浓度相等的混合对照品溶液,平行配制6份,在“2.1”色谱条件进行测定,计算各成分的加样回收率和RSD值。结果新绿原酸、绿原酸、隐绿原酸、木兰花碱、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、箭藿苷A、箭藿苷B、宝藿苷I的平均加样回收率分别为99.97%、88.67%、98.37%、103.78%、91.99%、104.46%、97.84%、101.90%、102.67%、95.97%、102.59%;RSD值分别为8.34%、9.44%、8.19%、15.23%、8.21%、6.50%、5.24%、6.62%、2.47%、4.18%、7.25%。
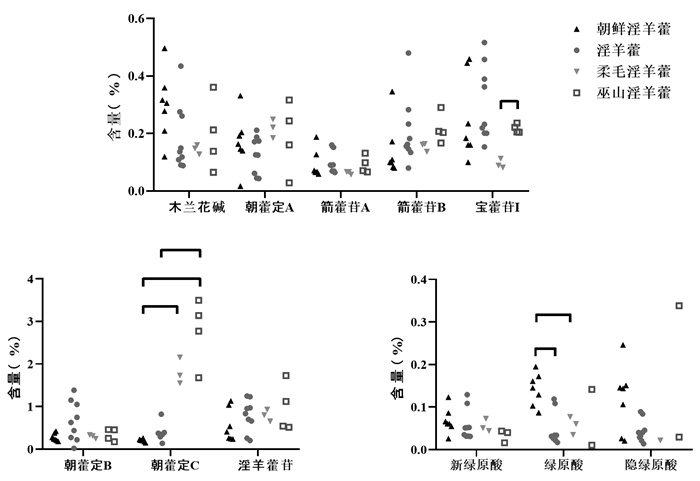
2.4 淫羊藿样品多指标成分含量测定3种基源的淫羊藿和巫山淫羊藿、共计23个批次样品中新绿原酸、绿原酸、隐绿原酸、木兰花碱、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、箭藿苷A、箭藿苷B、宝藿苷I成分各百分含量结果见图 2。使用GraphPad Prism 8.0软件对23批次淫羊藿样品各成分含量结果进行统计学分析,采用单因素方差分析进行检验,分析结果见图 2。
|
| 注: *P < 0.05, **P < 0.01。 图 2 23个批次淫羊藿和巫山淫羊藿中11种成分的百分含量 |
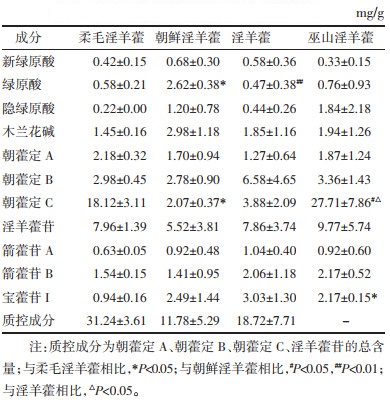
在不同基源样品的11个成分中,绿原酸含量在朝鲜淫羊藿与柔毛淫羊藿中有显著性差异(P < 0.05),与淫羊藿相比有亦显著性差异(P < 0.01);朝藿定C在巫山淫羊藿中含量最高,在朝鲜淫羊藿中朝藿定C含量最低,其次为淫羊藿、柔毛淫羊藿,朝鲜淫羊藿和淫羊藿与巫山淫羊藿相比均有显著差异(P < 0.05),柔毛淫羊藿与朝鲜淫羊藿相比亦有显著性差异(P < 0.05);宝藿苷I在柔毛淫羊藿与巫山淫羊藿相比存在显著性差异(P < 0.05)。
此外,朝藿定C在巫山淫羊藿和柔毛淫羊藿中的含量普遍高于淫羊藿苷含量,与淫羊藿和朝鲜淫羊藿恰好相反。不同基源的淫羊藿样品中以上11种主要成分含量详细见表 3。
|
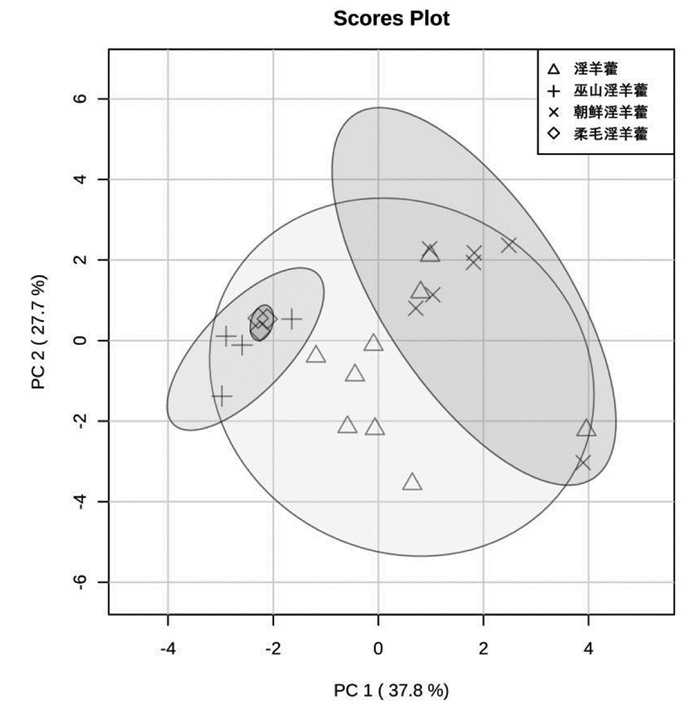
| 图 3 4种基源淫羊藿的主成分分析图 |
9批淫羊藿中朝藿定A、朝藿定B、朝藿定C和淫羊藿苷的总量为0.27~2.84%,3批柔毛淫羊藿中的质控成分总量为2.91~3.54%;7批朝鲜淫羊藿中的质控成分总量为0.65~2.05%。
2.5 样品的主成分分析对23批淫羊藿药材11个成分含量采用主成分分析(PCA)进行降维处理,第一组主成分PC1的贡献率为37.8%,第2组主成分PC2的贡献率为27.7%,两者累计贡献率为65.5%,可作为不同基源淫羊藿之间对比分析指标。PCA分析显示,巫山淫羊藿与柔毛淫羊藿相似度较高,仅从目前检测的成分来说难以区分,而这两者与朝鲜淫羊藿差异明显,可以进行区分;淫羊藿则正好居于其他3种之间。
3 讨论淫羊藿含有的淫羊藿苷、朝藿定A、朝藿定B、朝藿定C等成分具有骨保护作用、心血管系统保护作用和生殖系统保护作用等,临床多用于治疗骨质疏松等症[7-12],绿原酸类成分主要具有抗菌、抗病毒及抗炎、抗氧化等作用[13-14]。目前药典中收载的淫羊藿药材有不同基源,而淫羊藿药材真伪混用现象使得用药剂量与药效关系成为一个问题,若临床用药剂量一致,而主要药效成分的含量明显不同,必定会造成疗效的差异。因此,有必要进一步合理规范淫羊藿药材的分类及用量与用途的关系,以保证其临床疗效。
本文针对目前存在的不同基源淫羊藿的分类问题,采用PCA法对19批淫羊藿和4批巫山淫羊藿中11种成分的含量进行对比分析,通过分析比较,不同批次、不同基源的淫羊藿的有效成分存在差异。巫山淫羊藿与柔毛淫羊藿较为相似,但与朝鲜淫羊藿有明显差异,淫羊藿则与其他3种基源淫羊藿之间均产生交叉,不易区分。这一结果可一定程度反应药典将几个基源的淫羊藿药材归属变化的内在道理。
研究结果显示,朝鲜淫羊藿药材中朝藿定A、朝藿定B、朝藿定C和淫羊藿苷的总量为0.65~2.05%,含量较其他基源的淫羊藿药材较低,这与2020版《中国药典》规定一致,同时PCA分析结果也显示,朝鲜淫羊藿药材与其他基源药材存在明显差异。另外,柔毛淫羊藿药材中朝藿定C含量为1.55~2.16%,远高于淫羊藿中朝藿定C的0.14~0.82%,和朝鲜淫羊藿药材中朝藿定C的0.15~0.26%。且PCA分析结果显示柔毛淫羊藿与淫羊藿、朝鲜淫羊藿差异较大,与巫山淫羊藿相似度较高。根据此次结果,建议单独为柔毛淫羊藿制定质控指标,当然,这还需要更多药学、药理学和临床研究的支持证明。此外,此次实验结果显示,淫羊藿和巫山淫羊藿药材中朝藿定C、宝藿苷I和绿原酸等含量差异较大,对这些差异性成分进行质量标定可进一步合理规范淫羊藿药材的品种筛选,完善淫羊藿药材的质量标准。
通过上述分析比较得出,不同批次、不同基源淫羊藿的有效成分存在一定差异,针对淫羊藿存在混用现象,且质量控制难的问题,应对不同基源的淫羊藿进行更加系统的质量分析,完善不同基源淫羊藿的质量评价方法。本研究可以为淫羊藿药材的合理分类和质量控制提供一定的参考。
| [1] |
SU X D, LI W, MA J Y, et al. Chemical constituents from Epimedium koreanum Nakai and their chemotaxonomic sig- nificance[J]. Natural Product Research, 2018, 32(19): 2347-2351. DOI:10.1080/14786419.2017.1405412 |
| [2] |
CHEN X J, TANG Z H, LI X W, et al. Chemical con- stituents, quality control, and bioactivity of epimedii folium (Yinyanghuo)[J]. The American Journal of Chinese Medicine, 2015, 43(5): 783-834. DOI:10.1142/S0192415X15500494 |
| [3] |
罗露, 袁志鹰, 黄惠勇, 等. 淫羊藿化学成分及药理研究进展[J]. 亚太传统医药, 2019, 15(6): 190-194. LUO L, YUAN Z Y, HUANG H Y, et al. Advances in the chemical constituents and pharmacological studies of Epimedium[J]. Asia-Pacific Traditional Medicine, 2019, 15(6): 190-194. |
| [4] |
ZHAO H S, SHAN Y H, MA Z, et al. A network pharmacol- ogy approach to explore active compounds and pharmaco- logical mechanisms of Epimedium for treatment of prema- ture ovarian insufficiency[J]. Drug Design, Development and Therapy, 2019, 13: 2997-3007. DOI:10.2147/DDDT.S207823 |
| [5] |
ZHAI Y K, GUO X, PAN Y L, et al. A systematic review of the efficacy and pharmacological profile of Herba Epimedii in osteoporosis therapy[J]. Die Pharmazie, 2013, 68(9): 713-722. |
| [6] |
焦美钰, 王佳豪, 许亮, 等. 淫羊藿本草考证与中国淫羊藿属植物分类研究[J]. 中国中医药现代远程教育, 2017, 15(14): 157-160. JIAO M Y, WANG J H, XU L, et al. Herbal textual of epimedii folium and taxonomic study on the Epimedium adans in China[J]. Chinese Medicine Modern Distance Edu- cation of China, 2017, 15(14): 157-160. DOI:10.3969/j.issn.1672-2779.2017.14.068 |
| [7] |
LI C R, LI Q, MEI Q B, et al. Pharmacological effects and pharmacokinetic properties of icariin, the major bioactive component in Herba Epimedii[J]. Life Sciences, 2015, 126: 57-68. DOI:10.1016/j.lfs.2015.01.006 |
| [8] |
LIU Y, HUANG L, HAO B, et al. Use of an osteoblast overload damage model to probe the effect of icariin on the proliferation, differentiation and mineralization of MC3T3- E1 cells through the Wnt/β-catenin signalling pathway[J]. Cellular Physiology and Biochemistry, 2017, 41(4): 1605-1615. DOI:10.1159/000470896 |
| [9] |
LI X A, HO Y S, CHEN L, et al. The protective effects of icariin against the homocysteine -induced neurotoxicity in the primary embryonic cultures of rat cortical neurons[J]. Molecules (Basel, Switzerland), 2016, 21(11): 1557. DOI:10.3390/molecules21111557 |
| [10] |
DING J, TANG Y, TANG Z, et al. Icariin improves the sexual function of male mice through the PI3K/AKT/ENOS/ NO signalling pathway[J]. Andrologia, 2018, 50(1). |
| [11] |
HUANG X W, WANG X P, ZHANG Y, et al. Absorption and utilisation of epimedin C and icariin from Epimedii herba, and the regulatory mechanism via the BMP2/Runx2 signalling pathway[J]. Biomedicine & Pharmacotherapy, 2019, 118: 109345. |
| [12] |
王焕珍, 柴艺汇, 陈云志, 等. 淫羊藿化学成分与药理作用研究进展[J]. 亚太传统医药, 2016, 12(7): 63-65. WANG H Z, CHAI Y H, CHEN Y Z, et al. Research progress on chemical constituents and pharmacological effects of Epimedium Herba[J]. Asia-Pacific Traditional Medicine, 2016, 12(7): 63-65. |
| [13] |
BAGDAS D, GUL Z, MEADE J A, et al. Pharmacologic overview of chlorogenic acid and its metabolites in chronic pain and inflammation[J]. Current Neuropharmacology, 2020, 18(3): 216-228. DOI:10.2174/1570159X17666191021111809 |
| [14] |
LIANG N J, KITTS D D. Chlorogenic acid isomers alleviate interleukin 8 production in caco-2 cells by decreasing phos- phorylation of p38 and increasing cell integrity[J]. Interna- tional Journal of Molecular Sciences, 2018, 19(12): 3873. DOI:10.3390/ijms19123873 |
 2022, Vol. 41
2022, Vol. 41