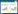文章信息
- 董彬, 于斌, 孙闵, 刘志华, 王乐荣, 王祥生
- DONG Bin, YU Bin, SUN Min, LIU Zhihua, WANG Lerong, WANG Xiangsheng
- 二黄益肾汤调控TGF-β1/Smad信号通路治疗慢性肾功能衰竭研究
- Mechanism of Erhuang Yishen Decoction in treating chronic renal failure via inactivation of the TGF-β1/Smad signal pathway
- 天津中医药大学学报, 2022, 41(3): 336-341
- Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(3): 336-341
- http://dx.doi.org/10.11656/j.issn.1673-9043.2022.03.14
-
文章历史
收稿日期: 2022-02-22
2. 济宁医学院中西医结合学院, 济宁 272067
2. College of Integrative Medicine, Jining Medical College, Jining 272067, China
慢性肾功能衰竭(CRF)作为不可逆性疾病,呈慢性进展,最终发展为终末期肾病,需肾脏替代治疗,临床治疗颇为棘手。其主要表现为全身代谢功能紊乱、多系统衰竭,预后一般较差。一般认为,本病的发病与肾间质纤维化密切相关,是导致肾脏结构和功能障碍的主要原因。中国CRF患者数量高达1.2亿,造成严重的经济与社会负担。本病的主要病因与外感、内伤有关,病机以本虚标实、标本兼夹为主,本虚表现为气血阴阳的不足,标实主要以湿热瘀毒痰为主,病变部位在肾,涉及脾、胃、心、肝、肺及三焦、膀胱等,以脾肾亏虚为主[1]。随着中医药治疗慢性病优势的凸显,中医药不仅能够改善CRF患者的临床症状及相关检测指标,延缓CRF的快速进展,更能改善患者远期病死率,提升远期存活率。
二黄益肾汤主要由黄芪、淫羊藿、大黄、白术、白花蛇舌草、六月雪、莪术、石韦、丹参、砂仁等药物组成,具有补肾健脾、活血通络、清热泄浊之功效,可降低内生肌酐(Scr)和尿素氮(BUN)水平,是济宁市中医院用于气虚湿瘀型CRF患者治疗的协定处方[2-3]。转化生长因子(TGF)-β1是TGF家族成员,是较强的促纤维化因子,Smad是TGF-β家族的信号传导分子,TGF-β1活化后与Smad3相互识别,TGF-β1/Smad信号通路在组织纤维化的形成过程中发挥重要作用[4]。然而对于二黄益肾汤治疗CRF肾纤维化的机制与TGF-β1/Smad信号通路的相关性研究较少,本项目通过5/6肾切除建立CRF动物模型,并采用二黄益肾汤进行治疗,分析其对TGF-β1/Smad信号通路的影响,试阐述其作用机制。
1 材料与方法 1.1 主要实验试剂和仪器尿毒清颗粒(广州康臣药业有限公司生产),规格为5 g/袋。TGF-β1、Smad3、Smad4、Smad7购自Abcam公司,引物购自上海生物工程公司,实时定量-聚合酶链反应(RT-PCR)试剂盒购自天根生化科技有限公司。5424型小型高速离心机(德国Eppendorf公司),BioRad CFX96荧光定量聚合酶链反应(PCR)检测系统(美国BioRad公司)。
1.2 实验动物SPF级SD大鼠40只(实验动物许可证号:SCXK鲁20140007),购自山东朋悦实验动物中心。
1.3 动物模型建立及筛选选取10只大鼠作为正常组,不进行干预。其余30只大鼠参考文献方法[5-6],采用5/6肾切除方法建立CRF动物模型。术前常规消毒,2%戊巴比妥钠腹腔注射麻醉大鼠,在左侧肋弓下0.5 cm、脊柱向左旁开1 cm处切开一垂直于脊柱、长约2.5 cm的切口。暴露左侧肾脏,结扎左侧肾动脉的2/3分支后缝合,7 d后予同法摘除右侧肾脏。术后4周眼眶后静脉丛采血,进行血清BUN、Scr测定,以BUN、Scr数值大于健康大鼠2倍确立模型建立成功。后将模型动物依据Scr数值随机分为模型组、二黄益肾汤组及尿毒清组,每组10只。
1.4 干预方案模型筛选后进行药物干预,根据人与大鼠体表面积换算公式计算,二黄益肾汤临床等效剂量为18.93 g/kg,尿毒清临床等效剂量为2.25 g/kg。二黄益肾汤组成:黄芪15 g,大黄10 g,炒白术15 g,白花蛇舌草20 g,淫羊藿15 g,六月雪30 g,莪术15 g,石韦40 g,丹参40 g,砂仁12 g,药材购自济宁市中医院药房。干预方式为灌胃治疗,干预时间为12周。
1.5 检测指标 1.5.1 血清Scr、BUN水平检测实验结束后,采用戊巴比妥钠进行动物麻醉,腹主动脉采血,全自动生化分析仪检测血清Scr、BUN水平。
1.5.2 病理学检测肾组织经4%多聚甲醛固定,梯度乙醇脱水、二甲苯透明处理、石蜡包埋、切片(厚度为4~5 μm)后常规苏木精-伊红(HE)染色,OLMPUS显微镜观察各组肾组织病理变化并拍照。
1.5.3 肾脏组织TGF-β1、Smad3、Smad4和Smad7 mRNA表达量检测肾脏组织经TRIzol提取总RNA后,进行反转录,之后进行RT-PCR检测。检测指标为TGF-β1、Smad3、Smad4和Smad7。β-actin为内参,用2-ΔΔCt法计算各基因的相对表达量。引物序列见表 1。
组织经裂解后进行蛋白提取和定量,之后进行SDS-PAGE电泳,抗体孵育及发光显色后,进行应用凝胶成像系统扫描,采用Image J图像分析软件进行灰度值分析,TGF-β1、Smad3、Smad4和Smad7蛋白相对表达量以目的蛋白与内参β-actin的灰度值的比值表示。
1.6 统计学处理应用SPSS 22.0软件包进行统计学分析。计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD法;计数资料以百分比或率表示,组间比较采用卡方检验。P < 0.05为差异有统计学意义。
2 结果 2.1 模型动物筛选及一般情况观察模型建立4周后,分析BUN和Scr水平。结果显示,模型组BUN、Scr水平与正常组相比呈现增高趋势,差异具有统计学意义(P < 0.01),说明CRF肾纤维化动物模型建立成功,见表 2。正常组大鼠精神状态、生长速度、进食和排便均正常,反应灵敏。模型组动物精神状态萎靡,增长较慢,体毛稀疏,饮水量增加,体质量减轻,被毛无光泽,活动减少,应激反应较差。
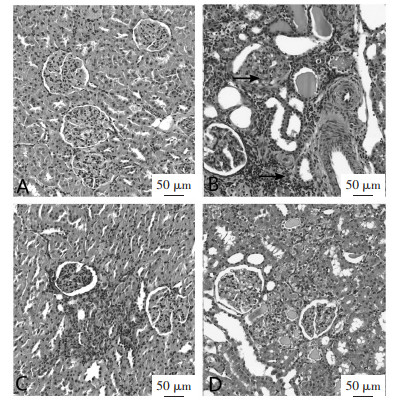
正常组大鼠肾组织染色均匀,肾小管大小、形态正常,肾间质未见明显病理改变。模型组大鼠表现出广泛的肾结构损伤和形态改变,肾小管上皮萎缩,肾小管管腔扩张,间质炎性细胞浸润和肾小管坏死。二黄益肾汤组和尿毒清组肾间质内有少量炎性细胞浸润及纤维组织增生,肾小管扩张程度较轻,肾小囊扩张,但纤维化的面积较模型组小,仍保留部分正常肾小管结构。病理结果显示,二黄益肾汤和尿毒清治疗后能够改善CRF肾纤维化病变程度。见图 1。
|
| 注:A.正常组;B.模型组;C.尿毒清组;D.二黄益肾汤组;→表示淋巴细胞和单核细胞炎性浸润。 图 1 各组大鼠HE染色结果(×200) |
结果显示,模型组大鼠BUN、Scr含量高于正常组,差异具有统计学意义(P < 0.01);与模型组比较,二黄益肾汤组和尿毒清组BUN、Scr含量呈现降低趋势,差异具有统计学意义(P < 0.01)。二黄益肾汤组BUN、Scr降低趋势较尿毒清组明显。见表 3。
RT-PCR结果显示,与正常组相比,模型组TGF-β1、Smad3和Smad4 mRNA表达升高,Smad7 mRNA表达降低,各指标差异具有统计学意义(P < 0.05)。与模型组相比,二黄益肾汤组和尿毒清组TGF-β1、Smad3、Smad4 mRNA的表达量呈现降低趋势,而Smad7 mRNA的表达量呈现升高趋势,差异具有统计学意义(P < 0.05)。见表 4。
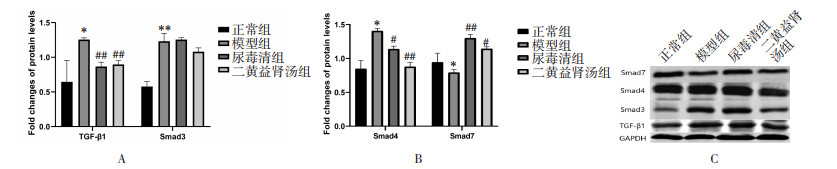
Western Blot检测结果显示,与正常组相比,模型组TGF-β1、Smad3和Smad4的蛋白表达量升高,而Smad7的蛋白表达量降低,差异具有统计学意义(P < 0.05)。与模型组相比,二黄益肾汤组和尿毒清组TGF-β1、Smad3、Smad4的蛋白表达量降低,而Smad7蛋白的表达水平升高,差异具有统计学意义(P < 0.05)。见图 2。
|
| 注:与正常组比较,*P < 0.05,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01。 图 2 TGF-β1、Smad3、Smad4和Smad7的蛋白表达量(x±s,n=10) |
CRF属于中医“关格”“癃闭”“虚劳”等范畴,多为其他慢性疾病或并发症迁延不愈发展而来,常见于水肿、淋证、消渴、尿血、眩晕等疾病后期。其基本病机为脾肾亏虚,湿浊内蕴,病变部位主要在脾、肾,并与肠相关。本病的发病主要与湿、浊、瘀、毒相关,是病情演变及加重的主要因素,且贯穿于本病的始终。因而一些医家主张补脾益肾治其本,化湿泄浊治其标[7]。
二黄益肾汤方中黄芪、淫羊藿为君药,主要用于补肾健脾、利水消肿,针对脾肾亏虚起到补养作用。砂仁化湿行气,白术益气健脾、燥湿利水,兼助黄芪补气,两药针对湿浊起到化湿泄浊的效果。莪术破血行气消积,丹参活血祛瘀止痛,两药主要用于活血化瘀通络,合用针对湿、浊、瘀、毒起到治疗效果,共为臣药。大黄通腑泄浊,配伍丹参又可活血逐瘀;白花蛇舌草清热利湿解毒;六月雪清热利湿、舒筋活络,加用石韦共助湿浊从小便而解,上述4味共为佐药,使邪有出路。大黄兼为使药,引药入血络,使久病顽疾邪去正安。全方共奏补肾健脾、利湿泄浊、活血化瘀之效,标本兼治。
CRF的发病主要与自身免疫反应、感染、药物应用、遗传因素、环境和饮食因素等相关,并与肾小管间质和肾小球纤维化有关[8]。研究发现,TGF-β1是参与肾间质纤维化的主要细胞因子,而Smads信号通路是TGF-β1促纤维化的中心调控环节,TGF-β1可刺激纤维细胞增殖并促使其产生胶原蛋白,抑制细胞外基质降解,Smads是TGF-β1的下游调控因子。TGF-β1与细胞膜上的受体结合后,激活细胞内Smad2、Smad3并促使其磷酸化活化,促进TGF-β1信号转入细胞核,发挥其促纤维化作用。Smad6可以抑制Smads,并阻断TGF-β1信号转导[5]。
黄芪是治疗CRF的常用有效中药之一,研究表明黄芪通过抑制TGF-β1信号通路的激活对CRF具有一定的抗纤维化和抗炎作用,并且能够降低BUN、Scr水平[9],与本研究结果一致。研究发现淫羊藿可以降低CRF患者可溶性白细胞介素(IL)-2受体、IL-6和干扰素-α(IFN-α)含量,并且淫羊藿单体能够抑制活化的成纤维细胞和系膜细胞增殖以及TGF-β1表达,从而发挥防治肾纤维化作用[10]。研究认为砂仁的乙酸乙酯层提取物具有较强的抗氧化作用,砂仁多糖具有很强的清除自由基的活性作用,可能与其抗纤维化机制相关[11]。白术内酯Ⅰ和白术内酯Ⅲ具有明显的促进促炎性巨噬细胞因子的表达作用,具有一定的抗炎活性,另有研究证实,白术具有一定的抗氧化能力[12]。Cohly等[13]研究发现莪术发挥抗氧化作用体现在其中的姜黄素成分能够抑制脂质的过氧化,降解细胞凋亡基因Fas-L、Fas表达并溶解细胞来保护受损的肾细胞[14]。刘迟等[15]检测研究莪术降低单侧输尿管梗阻大鼠肾间质纤维化中TGF-β1、核转录因子-κB(NF-κB)、Ⅳ型胶原等相关纤维化指标的表达。丹参主要成分是丹参酮ⅡA,具有改善微循环、抗纤维化的作用。陆海英等[16]发现丹参酚酸B抑制肾组织基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶抑制剂-2(TIMP-2)的表达,改善大鼠纤维化水平。另有研究发现丹参能够抑制促炎性细胞因子的释放和氧化应激反应,抑制肾小管间质转化,主要机制与其能够拮抗TGF-β1的纤维化作用相关[17]。大黄酸和大黄素是大黄的主要活性成分,研究发现大黄酸能够抑制肾间质纤维化,改善肾脏微循环,大黄素可以抑制肾小球纤维化,大黄提取物能够抑制TGF-β1/Smad3的信号活化,增加Smad7含量,从而通过调控TGF-β/Smad信号通路发挥抗纤维化作用[18]。另有研究证实大黄酸可以抑制TGF-β1、结缔组织生长因子(CTGF)的基因表达,从基因水平抑制细胞外基质(ECM)积聚[5]。研究证实,白花蛇舌草的水提液具有肾脏保护作用,能够降低肾脏肿瘤坏死因子-α(TNF-α)、IL-6和IL-10等炎性因子的表达,白花蛇舌草具有较好的抗纤维化作用,网络药理学研究发现其作用机制可能与TGF-β信号通路、肾细胞癌信号通路和Janus激酶信号转导与转录激活因子(JAK-STAT)信号通路相关[19]。六月雪系茜草科白马骨属植物,临床常用于治疗肾脏疾病,大量应用可以降低蛋白尿与BUN、Scr含量,作用机制可能与其能够降低氧化应激反应、抑制肾间质纤维化相关[20]。石韦具有较好的抗炎利尿及抗氧化作用[21]。
本研究采用5/6肾切除方法建立CRF肾纤维化动物模型,病理结果显示CRF肾纤维化存在炎性细胞浸润、肾小球萎缩、肾间质增宽的情况,生化检测显示Scr和BUN呈现升高趋势,结合其他文献的研究结果,能够确定CRF动物模型建立成功。中医药干预治疗能够改善模型动物CRF肾纤维化的病理结构,减轻炎性细胞浸润和纤维组织增生情况,降低Scr和BUN含量。
通过RT-PCR和Western Blot分析TGF-β1/Smad通路相关指标的含量变化,结果显示CRF的发病与TGF-β1、Smad3和Smad4的激活以及Smad7基因、蛋白含量的下调相关。二黄益肾汤能够抑制TGF-β1、Smad3和Smad4的激活,进而提高Smad7含量,通过调控TGF-β1/Smad信号通路发挥相关的治疗作用。
综上所述,二黄益肾汤能够保护肾脏,抑制肾脏纤维化进程,作用机制与其对TGF-β1/Smad信号通路的调控相关,进而为健脾补肾、化湿泄浊法治疗CRF提供基础研究支持。
| [1] |
李丽容, 黄雪霞, 韦婷婷, 等. 中医外治法治疗慢性肾衰竭研究进展[J]. 广西中医药大学学报, 2020, 23(4): 51-54. LI L R, HUANG X X, WEI T T, et al. Research progress of external treatment of traditional Chinese medicine in the treatment of chronic renal failure[J]. Journal of Guangxi University of Chinese Medicine, 2020, 23(4): 51-54. |
| [2] |
李冬冬, 田雪芬, 王静, 等. 二黄益肾汤质量标准的建立[J]. 中国民族民间医药, 2020, 29(21): 50-54. LI D D, TIAN X F, WANG J, et al. Study on the quality standard of Erhuang Yishen Decoction[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2020, 29(21): 50-54. |
| [3] |
田雪芬, 郭文厂, 李冬冬, 等. 二黄益肾汤质量标准研究[J]. 中国药业, 2020, 29(11): 48-52. TIAN X F, GUO W C, LI D D, et al. Quality standard of Erhuang Yishen Decoction[J]. China Pharmaceuticals, 2020, 29(11): 48-52. |
| [4] |
谭丽萍, 吴美丽, 任婧婧, 等. 丹白颗粒对宫腔粘连大鼠TGF-β/Smad信号通路及内膜纤维化的影响[J]. 河北医学, 2021, 27(7): 1057-1062. TAN L P, WU M L, REN J J, et al. Effects of danbai granule on TGF-β/smad signaling pathway and endometrial fibrosis in rats with intrauterine adhesions[J]. Hebei Medicine, 2021, 27(7): 1057-1062. DOI:10.3969/j.issn.1006-6233.2021.07.001 |
| [5] |
高洁, 刘益涛, 董华, 等. 三七总皂甙通过Smads信号通路减缓慢性肾衰竭大鼠肾间质纤维化进程的作用研究[J]. 中药新药与临床药理, 2021, 32(6): 799-805. GAO J, LIU Y T, DONG H, et al. Panax notoginseng saponins reduce renal interstitial fibrosis in chronic renal failure rats through smads pathway[J]. Traditional Chinese Drug Research and Clinical Pharmacology, 2021, 32(6): 799-805. |
| [6] |
邹涵, 黄志敏, 唐宇, 等. 三七注射液对慢性肾衰竭大鼠肠道失调信号通路及肠道菌群结构的影响[J]. 时珍国医国药, 2021, 32(2): 269-272. ZOU H, HUANG Z M, TANG Y, et al. Effects of Panax Notoginseng Injection on intestinal dysregulation signal pathway and intestinal flora structure in rats with chronic renal failure[J]. Lishizhen Medicine and Materia Medica Research, 2021, 32(2): 269-272. DOI:10.3969/j.issn.1008-0805.2021.02.04 |
| [7] |
刘晓静, 孟令栋, 黄萍, 等. 慢性肾衰竭的中医研究进展[J]. 实用临床医药杂志, 2019, 23(1): 129-132. LIU X J, MENG L D, HUANG P, et al. Research advance on traditonal Chinese Medical treatment for chronic renal failure[J]. Journal of Clinical Medicine in Practice, 2019, 23(1): 129-132. |
| [8] |
任倩倩, 向少伟, 许雯雯, 等. 中医药治疗慢性肾衰竭的研究进展[J]. 实用中医内科杂志, 2021, 35(2): 49-51. REN Q Q, XIANG S W, XU W W, et al. Research progress of traditional Chinese medicine treatment of chronic renal failure[J]. Journal of Practical Traditional Chinese Internal Medicine, 2021, 35(2): 49-51. |
| [9] |
李志萃, 牛婧, 王亿平. 中医药治疗慢性肾衰竭的研究进展[J]. 中国中西医结合肾病杂志, 2009, 10(11): 1027-1029. LI Z C, NIU J, WANG Y P. Research progress of traditional Chinese medicine in the treatment of chronic renal failure[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2009, 10(11): 1027-1029. |
| [10] |
王东, 张江, 吴同茹, 等. 淫羊藿有效单体对活化的肾成纤维细胞株和系膜细胞株的影响[J]. 中国中西医结合肾病杂志, 2012, 13(11): 956-959. WANG D, ZHANG J, WU T R, et al. The effect of utility monomer in Epimedium to the renal fibroblast cell line and mesangial cell line[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2012, 13(11): 956-959. |
| [11] |
黄崇才. 砂仁的化学成分、药理作用及临床应用的研究进展[J]. 内蒙古中医药, 2017, 36(S1): 210-212. HUANG C C. The research progress on chemical constituents, pharmacological action and clinical application of of Amomum villosum[J]. Inner Mongolia Journal of Traditional Chinese Medicine, 2017, 36(S1): 210-212. |
| [12] |
FENG Y Y, JI H Y, DONG X D, et al. An alcohol-soluble polysaccharide from Atractylodes macrocephala Koidz. induces apoptosis of Eca-109 cells[J]. Carbohydrate Polymers, 2019, 22(6): 115-136. |
| [13] |
COHLY H H P, TAYLOR A, ANGEL M F, et al. Effect of turmeric, turmerin and curcumin on H2O2-induced renal epithelial (LLC-PK1) cell injury[J]. Free Radical Biology and Medicine, 1998, 24(1): 49-54. |
| [14] |
李泽宇, 曹瑞, 郝二伟, 等. 广西莪术化学成分和药理作用的研究进展及其质量标志物(Q-Marker)预测分析[J]. 中草药, 2021, 52(15): 4687-4699. LI Z Y, CAO R, HAO E W, et al. Research progress on chemical constituents and pharmacological effects of Curcuma kwangsiensis and prediction of its quality marker(Q-Marker)[J]. Chinese Traditional and Herbal Drugs, 2021, 52(15): 4687-4699. |
| [15] |
刘迟, 郭刚, 胡仲仪. 莪术对单侧输尿管梗阻大鼠肾间质纤维化的影响[J]. 上海中医药杂志, 2006, 40(12): 71-73. LIU C, GUO G, HU Z Y. Effect of Curcuma phaeocaulis valeton on renal interstitial fibrosis after unilateral ureteral obstruction in rats[J]. Shanghai Journal of Traditional Chinese Medicine, 2006, 40(12): 71-73. |
| [16] |
陆海英, 张悦, 刘煜敏, 等. 丹参酚酸B对肾纤维化大鼠肾组织MMP-2表达的影响[J]. 上海中医药大学学报, 2009, 23(2): 55-58. LU H Y, ZHANG Y, LIU Y M, et al. Influence of salvianolic acid B on expression of MMP-2 in renal fibrosis rats[J]. Journal of Shanghai University of Traditional Chinese Medi- cine, 2009, 23(2): 55-58. |
| [17] |
XU L H, SHEN P Q, BI Y L, et al. Danshen Injection ameliorates STZ-induced diabetic nephropathy in association with suppression of oxidative stress, pro-inflammatory factors and fibrosis[J]. International Immunopharmacology, 2016, 38(4): 385-394. |
| [18] |
ZHANG Z H, LI M H, LIU D, et al. Rhubarb protect against tubulointerstitial fibrosis by inhibiting TGF-β/smad pathway and improving abnormal metabolome in chronic kidney disease[J]. Frontiers in Pharmacology, 2018, 9(1): 1029-1035. |
| [19] |
董雅倩, 张佳幸, 龚琳娜, 等. 白花蛇舌草环烯醚萜的鉴定及基于网络药理学的抗肾纤维化作用的机制研究[J]. 药学学报, 2020, 55(12): 2934-2941. DONG Y Q, ZHANG J X, GONG L N, et al. Identification of the iridoids of Hedyotis diffusa Willd and its mechanism on renal fibrosis based on network pharmacology[J]. Acta Pharmaceutica Sinica, 2020, 55(12): 2934-2941. |
| [20] |
孙响波, 于妮娜. 六月雪治疗肾脏疾病探源[J]. 中医药导报, 2013, 19(10): 127-128. SUN X B, YU N N. Exploring the source of June Xue's treatment of kidney diseases[J]. Guiding Journal of Traditional Chinese Medicine and Pharmacy, 2013, 19(10): 127-128. |
| [21] |
亓雪, 李兰, 张颖颖. 有柄石韦的化学及药理研究进展[J]. 山东化工, 2018, 47(16): 64-65, 68. QI X, LI L, ZHANG Y Y. Research advance in chemical and pharmacological on Pyrrosia petiolosa (Christ) Ching[J]. Shandong Chemical Industry, 2018, 47(16): 64-65, 68. |
 2022, Vol. 41
2022, Vol. 41